腰痹通胶囊由三七、川芎、延胡索、白芍、牛膝、狗脊、熟大黄、独活八味中药制成[1], 在治疗腰椎间盘突出症上疗效显著, 能明显减少患者疼痛[2]。三七为腰痹通胶囊方中君药, 其主要活性部位为皂苷类成分, 具有散瘀止血、消肿定痛[3, 4]的药效。腰痹通胶囊收录于2020版《中国药典》 (一部), 仅以人参皂苷Rg1和人参皂苷Rb1作为质量评价指标。目前已有文献研究采用一测多评法[5]、指纹图谱法[6]等建立腰痹通胶囊多指标含量测定方法, 但多采用紫外检测器进行检测。皂苷类成分由于仅有紫外末端吸收, 在用紫外检测器检测时, 常出现基线波动大、重现性差等问题, 严重影响腰痹通胶囊质量检测的稳定性, 而且样品前处理繁琐。
电雾式检测器(charged aerosol detector, CAD)作为一种新型的检测器, 灵敏度高, 通用性强, 尤其适用于无紫外吸收或弱紫外吸收的物质检测, 已逐渐被用于中药成分分析[7-10]。为更全面控制腰痹通胶囊质量, 优化检测方法, 本文采用HPLC-CAD同时测定腰痹通胶囊中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd等5种皂苷类成分含量, 同时考察了CAD的参数设置对检测结果的影响, 以期为中药皂苷类等无紫外吸收成分的分析提供参考。
材料与方法仪器 Thermo Scientific UltiMate 3000高效液相色谱仪(美国Thermo Fisher公司), 配有GPG-3600SD双三元梯度泵, WPS-3000自动进样器, TCC-3x00 (RS)柱温箱, VWD-3x00 (RS)检测器, Corona Veo电雾式检测器; XS105十万分之一电子分析天平[梅特勒-托利多仪器(上海)有限公司]; FA2004B万分之一电子分析天平(上海越平科学仪器有限公司); Milli-Q超纯水仪(美国Millipore公司)。
试药、试剂与样品 三七皂苷R1对照品(批号MUST-18121705, 纯度99.98%)、人参皂苷Rg1对照品(批号MUST-19022811, 纯度99.16%)、人参皂苷Re对照品(批号MUST-19072510, 纯度98.72%)、人参皂苷Rb1 (批号MUST-19060116, 纯度98.58%)和人参皂苷Rd (批号MUST-19060116, 纯度98.55%), 均购自成都曼思特生物技术有限公司。乙腈和甲醇(HPLC级, 北京百灵威科技有限公司); 实验用水为超纯水, 其余试剂均为分析纯。22批(190505-1、190505-2、190506-1、190506-2、190507-1、190507-2、190508-1、190508-2、190509-1、190509-2、190510-1、190510-2、190511-1、190511-2、190512-1、190512-2、190513-1、190513-2、190514-1、190514-2、190515-1、190515-2)腰痹通胶囊成品由江苏康缘药业股份有限公司提供。
对照品溶液制备 取适量三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1和人参皂苷Rd对照品, 精密称定, 置25 mL量瓶中, 用甲醇溶解并定容至刻度, 摇匀, 制成质量浓度分别为0.339 2、1.089 2、0.219 2、1.030 0和0.318 8 mg·mL-1的混合对照品储备液。
供试品溶液制备 取腰痹通胶囊内容物, 研细后取0.5 g, 精密称定, 置于250 mL锥形瓶中, 用移液管精密加入甲醇50 mL, 称定重量, 加热回流30 min, 放冷, 用甲醇补足减失的重量, 以4 000 r·min-1的转速离心5 min后用0.22 μm的滤膜过滤, 即得供试品溶液。
色谱条件 色谱柱: Waters XBridge Phenol (150 mm×4.6 mm, 3.5 μm); 流动相:乙腈(A)-水(B), 梯度洗脱程序如下: 0~18 min, 15% A→21% A; 18~30 min, 21% A→23% A; 30~50 min, 23% A→32% A; 50~60 min, 32% A→34% A; 60~65 min, 34% A→60% A。柱温: 30 ℃, 流速: 1.0 mL·min-1, 进样量: 10 μL。CAD雾化温度: 35 ℃; 气压: 60.2 psi (1 psi ≈ 6.9 kPa); 滤波: 3.6 s; 采集频率: 5 Hz。
方法学验证
专属性 取空白溶剂、混合对照品溶液和供试品溶液, 在上述色谱条件下进样分析, 比较空白溶剂、混合对照品和供试品的色谱图。
线性关系 精密移取0.50、1.00、2.00、3.00、4.00、5.00和6.00 mL混合对照品储备液, 用甲醇稀释至10 mL, 制成一系列浓度混合对照品溶液, 在上述色谱条件下进样分析, 记录色谱图。以对照品浓度为横坐标(X), 峰面积为纵坐标(Y), 分别计算5种皂苷的线性回归方程和相关系数。
精密度 取腰痹通胶囊(批号: 190508-1), 按“供试品溶液制备”方法制得供试品溶液, 在上述色谱条件下连续进样6针, 分别记录5种皂苷成分的峰面积, 计算RSD值。
重复性 取同一批腰痹通胶囊内容物(批号: 190508-1) 6份, 按“供试品溶液制备”方法平行制备6份供试品溶液, 在上述色谱条件下进样分析, 测定5种皂苷成分含量, 计算RSD值。
加样回收率 取同一批已知含量的腰痹通胶囊内容物(批号: 190508-1) 6份, 按5种皂苷成分含量的100%水平加入对照品, 按“供试品溶液制备”方法制备供试品溶液, 在上述色谱条件下进样分析, 测定5种皂苷成分含量, 计算平均加样回收率和RSD。
稳定性 取腰痹通胶囊(批号: 190508-1), 按“供试品溶液制备”方法制得供试品溶液, 分别置于室温0、4、8、12、16、20和24 h时后, 在上述色谱条件下进样分析, 记录5种皂苷成分的峰面积, 计算RSD。
含量测定 分别取22批腰痹通胶囊按“供试品溶液制备”方法制得供试品溶液, 在上述色谱条件下进样分析, 测定5种皂苷成分的含量, 计算含量平均值和RSD。
结果 1 方法学验证 1.1 专属性空白溶剂、混合对照品和供试品溶液的液相色谱图如图 1所示。从图中可知, 样品中其他成分及空白溶剂对测定指标成分无影响, 且结果表明, 5种指标成分的理论塔板数均大于40 000, 色谱峰分离度均大于1.5, 峰形对称。
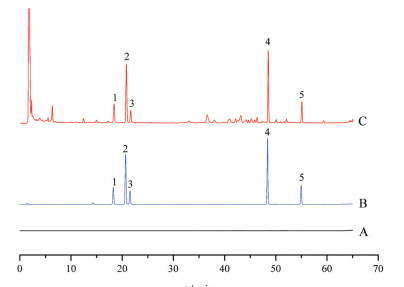
|
Figure 1 HPLC chromatograms of blank methanol (A) and mixed reference solution (B) and sample solution (C). 1: Notoginsenoside R1; 2: Ginsenoside Rg1; 3: Ginsenoside Re; 4: Ginsenoside Rb1; 5: Ginsenoside Rd |
三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1和人参皂苷Rd分别在16.96~203.5、54.46~653.5、10.96~131.5、51.5~618.0和15.94~191.3 μg·mL-1内呈良好线性关系, R2均在0.999 0以上, 结果见表 1。
| Table 1 Regressive equations, correlation coefficients and linear ranges |
5种皂苷成分峰面积RSD分别为1.31%、1.15%、1.20%、1.98%和0.14%, 表明仪器的精密度良好。
1.4 重复性5种皂苷成分含量RSD分别为1.69%、1.88%、1.98%、1.45%和1.84%, 表明该方法重复性良好。
1.5 加样回收率5种皂苷成分的加样回收率分别为98.96%、100.8%、94.76%、100.1%和103.1%, RSD分别为0.87%、1.46%、1.85%、2.06%和0.96%, 结果见表 2。
| Table 2 Results of recovery tests (n = 6) |
按上述方法, 测得22批腰痹通胶囊中5种皂苷的含量平均值分别为0.5915%、2.386%、0.3159%、1.856%和0.4788%, RSD分别为3.83%、4.30%、2.73%、3.29%和3.83%。将5种皂苷含量相加得到三七总皂苷(Panax notoginseng saponins, PNS), 计算平均含量为5.628%, RSD为2.56%, 结果见表 3, 表明腰痹通胶囊批次间皂苷类成分含量无显著差异, 批次间一致性较好, 工艺稳定。
| Table 3 Results of content determination of Yaobitong capsules (%). PNS: Panax notoginseng saponins |
2020版《中华人民共和国药典》采用加热回流萃取法测定腰痹通胶囊中人参皂苷Rg1与人参皂苷Rb1含量, 该法操作繁琐复杂, 萃取过程易造成有效成分损失。实验首先比较了加热回流、加热回流萃取两种处理方法对含量测定的影响, 结果表明, 萃取过程仅除去一部分大极性杂质, 对主要成分影响不大, 且萃取过程消耗大量饱和正丁醇, 耗时较长, 故选择加热回流法; 其次比较了两种提取方式(超声提取、加热回流提取)的提取效果, 结果发现加热回流提取效果更佳; 在此基础上, 分别对提取溶剂(50%甲醇、水、纯甲醇、纯乙醇)和提取时间(0.5、1和1.5 h)进行了考察, 结果表明纯甲醇提取0.5 h即可提取完全。
比较了CORTECS C18柱(150 mm×4.6 mm, 2.7 μm)、XSelect CSH TM C18柱(150 mm×4.6 mm, 3.5 μm)、XBridge Phenol柱(150 mm×4.6 mm, 3.5 μm), 三种型号的色谱柱均能满足各色谱峰基线分离的要求, 其中XBridge Phenol柱的分离效果、各色谱峰理论塔板数及对称因子均最佳, 故选用此色谱柱。还考察了不同流速(0.8、0.9、1.0和1.1 mL·min-1)和不同柱温(30、35和40 ℃)对色谱峰分离效果的影响, 结果表明柱温为30 ℃时, 分离效果最佳, 且低温有利于保护色谱柱。随着流速的加快, 出峰时间前移, 但均能满足各色谱峰分离度 > 1.5的要求。故选用了较低的柱温30 ℃和最常用的流速1.0 mL·min-1。
研究过程中串联了紫外检测器和电雾式检测器, 将紫外检测图谱与CAD图谱进行比较, 结果发现紫外检测图谱易出现基线漂移, CAD图谱基线更平稳, 重现性更好, 对三萜皂苷类成分的测定具有明显优势。本实验还对CAD的检测参数进行了优化, 分别设定雾化温度为35和50 ℃进样分析, 结果表明, 雾化温度对各成分的分离效果无影响, 雾化温度为50 ℃时各成分响应明显减小, 故设定雾化温度为35 ℃, 与柱温相近, 不易产生因温差带来的波动。幂律因子(power function value, PFV)是影响CAD测定含量的重要参数之一, 有文献[11]提出幂律因子对方法的线性与加样回收率均有一定影响。实验比较了幂律因子在1.00、1.20、1.25、1.30、1.35和1.40时的线性, 结果表明, R2随着幂律因子的增加先升高后又有所下降。在此基础上, 考察了幂律因子对加样回收率的影响, 结果表明, 幂律因子的改变对加样回收率的影响不大, 均能达到回收率的要求。综合幂律因子对线性和加样回收率的影响, 三七皂苷R1、人参皂苷Re可选择的幂律因子为1.20、1.25、1.30、1.35和1.40, 人参皂苷Rg1和Rb1可选择的幂律因子为1.35和1.40, 人参皂苷Rd可选择的幂律因子为1.25、1.30、1.35和1.40。本实验5种皂苷成分最终选择的幂律因子分别为1.20、1.25、1.35、1.25和1.35。
本研究以腰痹通胶囊为研究对象, 首次建立了HPLC-CAD同时测定腰痹通胶囊中5种皂苷成分的方法, 同时对提取条件、色谱条件、CAD雾化温度和幂律因子等参数进行了优化。方法学验证表明, 所建立的含量测定方法满足定量要求, 且简单易行, 为腰痹通胶囊的多指标质量控制提供了方法基础, 同时也为CAD用于其他含三七药材制剂质量研究提供了参考。
作者贡献: 斯乐婷为第一作者, 负责实验设计、液相条件的摸索和稿件编写, 倪鸿飞和李倩分别负责液相数据分析、文献的研究和整理, 栾连军、陈勇、刘雪松提出实验思路, 负责指导实验设计, 通讯作者吴永江全面负责实验设计、稿件撰写与修改等。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 1. Beijing: China Medical Science Press, 2020: 1805-1807.
|
| [2] |
Ma HL. Therapeutic effect of Yaobitong capsules on prolapse of lumbar intervertebral disc and its influence on IL-6 and IL-8[J]. Med J Air Force (空军医学杂志), 2018, 34: 199-201. |
| [3] |
Chen HY, Chen A, Lu FG, et al. Advances in pharmacological of Panax notoginseng saponins[J]. Hunan J Tradit Chin Med (湖南中医杂志), 2019, 35: 154-157. |
| [4] |
Guo XF, Wang CM, Gu YQ, et al. The progress of pharmacological study of Panax notoginseng saponins in preventing deep venous thrombosis[J]. Jiangsu J Tradit Chin Med (江苏中医药), 2019, 51: 90-93. |
| [5] |
Dai BD, Sun LQ, Li YJ, et al. Simultaneous determination of five saponins in Yao-Bi-Tong capsules by QAMS[J]. Mod Tradit Chin Med Mater Med-World Sci Technol (世界科学技术-中医药现代化), 2014, 16: 2227-2232. |
| [6] |
Li XH, Deng MF, Xiao W, et al. Study on HPLC fingerprint of Yaobitong capsules[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2020, 37: 429-432. |
| [7] |
Liao Y, Liu M, Wang HY. Determination of the contents of saikosaponin a, b2 and d in Bupleurum Chinense from different habitats by HPLC-CAD[J]. J Sichuan Tradit Chin Med (四川中医), 2020, 38: 62-66. |
| [8] |
Yan L, Wu Y, Gao H. Determination of four kinds of saponnins in Rhizoma Anemarrhenae before and after processing by HPLC-CAD[J]. Res Pract Chin Med (现代中药研究与实践), 2019, 33: 46-49. |
| [9] |
Long SK, Zhao L. Determination of terpene lactones in Gingko tablets by high performance liquid chromatography-charged aerosol detector[J]. Cent South Pharm (中南药学), 2020, 18: 105-107. |
| [10] |
Xing YZ, Song SJ. Simultaneous determination of seven active constituents in Qianbai Biyan Tablets by HPLC-CAD[J]. China Pharm (中国药师), 2020, 23: 1216-1219. |
| [11] |
Wang Y, Liu YX, Yue HS, et al. Comparison between the charged aerosol detector and evaporative light scattering detector for the analysis of sugar in Zhusheyong Yiqifumai and the study on the accuracy of methods[J]. China J Chin Mater Med (中国中药杂志), 2020. DOI:10.19540/j.cnki.cjcmm.20200221.306 |
 2020, Vol. 55
2020, Vol. 55


