β-内酰胺类抗生素易在药品的生产、运输、贮藏过程中产生聚合物杂质从而诱发过敏反应, 因此聚合物杂质是影响抗生素药品质量和安全的关键因素之一, 应进行严格质控[1-4]。
随着分离技术的快速发展, 聚合物杂质的分析方法也逐渐得到发展升级, 主流的分析方法包括葡聚糖凝胶G10色谱法(Sephadex G10)、高效凝胶色谱法(HPSEC)、反相高效液相色谱法(RP-HPLC)、高效毛细管电泳法(HPCE)、阴离子交换色谱法等[5-8]。目前, 精准控制指针式聚合物杂质已经逐渐成为聚合物杂质新的质控理念[9]。
头孢克肟为半合成第3代头孢菌素, 临床主要用于治疗敏感菌所致的呼吸、泌尿和胆道等部位的感染等。《中国药典》2015年版、USP42版和EP10.0版中, 均未对头孢克肟原料及制剂进行聚合物控制[10-12]。有文献报道采用G10凝胶色谱法测定了头孢克肟原料的聚合物杂质[13]和头孢克肟缓释微丸胶囊的聚合物杂质[14]; 也有采用高效凝胶色谱法测定头孢克肟颗粒和干混悬剂中的高分子杂质的报道[15, 16]。但是, G10凝胶系统和高效凝胶色谱法分析聚合物杂质时, 聚合物色谱峰易受到极性较大的小分子杂质的干扰, 从而影响聚合物杂质的定量准确性。作者已对部分β-内酰胺类抗生素的聚合物杂质做过研究, 证明RP-HPLC方法可对指针性聚合物杂质进行精准控制[17-23], 本研究分别建立HPSEC法和RP-HPLC法, 对头孢克肟原料及制剂中的聚合物杂质进行研究, 建立头孢克肟聚合物的分析方法。
材料与方法仪器 柱切换-LC-MSn系统由Thermo HPLC色谱系统(U3000四元低压梯度泵、自动进样器、柱温箱、切换阀和四波长检测器)和Q Exactive Focus型MS/MS质谱仪(美国Thermo公司)组成, 工作站为Xcalibur1.0版。
样品与试剂 头孢克肟原料(批号: 1811-2015)、头孢克肟分散片(批号: 938203)由中国食品药品检定研究院提供。乙腈(色谱纯)购自美国Fisher公司, 其他化学试剂(分析纯), 均购自国药集团化学试剂公司, 水为实验室自制双蒸水。
高效凝胶排阻色谱(HPSEC)法 色谱柱TSK-gel G2000SWxl (填料:刚性、球形、亲水硅胶; 30 cm×7.8 mm ID, 5 μm); 流动相: A相为0.005 mol·L-1磷酸盐缓冲液(pH 7.0) [0.005 mol·L-1磷酸氢二钠溶液-0.005 mol·L-1磷酸二氢钠溶液(61:39)]; B相为乙腈; A:B=85:15。流速: 0.7 mL·min-1; 检测波长: 254 nm; 柱温: 30 ℃; 进样量: 20 μL (色谱系统Ⅰ)。样品溶解与稀释溶剂: 0.1 mol·L-1磷酸盐缓冲液(pH 7.0) [0.1 mol·L-1磷酸氢二钠溶液-0.1 mol·L-1磷酸二氢钠溶液(61:39), 用磷酸调节至pH 7.0], 用于溶解供试品; 流动相A作为稀释剂。样品浓度: 3.0 mg·mL-1。
RP-HPLC法 色谱柱Phenomenex Gemini-C18 (250 mm×4.6 mm ID, 5 μm); 流动相:甲酸水溶液(0.5:100) (A)-甲酸乙腈溶液(0.5:100) (B)。梯度洗脱: 0.0~5.0 min, 2.0% B; 5.0~10.0 min, 2.0%~15.0% B; 10.0~30.0 min, 15.0%~30.0% B; 30.0~33.0 min, 30.0%~50.0% B; 33.0~34.0 min, 50.0%~70.0% B; 34.0~35.0 min, 70.0% B; 35.0~35.5 min, 2.0% B; 35.5~50.0 min, 2.0% B。流速: 1.0 mL·min-1; 柱温: 30 ℃; 检测波长: 270 nm (色谱系统Ⅱ)。用于分析头孢克肟原料及制剂的指针性聚合物杂质。
柱切换-LC-MSn法 一维色谱系统:同色谱系统Ⅰ, 进样体积增加至50 μL, 用于弱保留值杂质的分离。二维色谱系统:色谱柱: Agilent, SB-C18 (150 mm×4.6 mm ID, 5 μm)。流动相:甲酸水溶液(0.5:100) (A)-甲酸乙腈溶液(0.5:100) (B); 梯度洗脱: 0~10.0 min, 0 B (脱盐处理); 10.0~27.0 min, 0~90.0% B; 27.0~37.0 min, 90.0% B; 37.0~38.0 min, 90.0%~0 B; 38.0~40.0 min, 0 B。柱温:室温; 流速: 0.7 mL·min-1。切换阀:六通阀A和B; 用于对HPSEC法分离的聚合物杂质进行脱盐处理、质谱定性研究。
LC-MSn法 色谱系统:同色谱系统Ⅱ, 进样体积增加至40 μL, 用于对RP-HPLC色谱系统分离的聚合物杂质进行质谱研究。
质谱条件 柱切换-LC-MSn, LC-MSn的质谱方法:扫描电压(+) 3 000.0 V, 毛细管温度(+) 350.0 ℃, 鞘气(+) 35 L·h-1, 辅助气(+) 10.00 L·h-1, 最大喷雾电流(+) 100.00, 探针加热器温度(+) 350.00 ℃, S-棱镜RF水平50.00, 离子源为HESI; 一级质谱方法:正离子模式, 分辨率70 000, 扫描范围m/z 200~2 000;二级质谱方法:分辨率17 500, 分离窗口m/z 3.0, (N) CE 13 V, 缺省电荷状态1。
溶液配制
头孢克肟降解溶液 取头孢克肟原料约250 mg, 置于10 mL量瓶中, 加0.1 mol·L-1磷酸盐缓冲液(pH 8.0) [0.1 mol·L-1磷酸氢二钠溶液-0.1 mol·L-1磷酸二氢钠溶液(61:39), 用0.1 mol·L-1氢氧化钠溶液调节至pH 8.0] 10 mL溶解, 制成浓度约为25 mg·mL-1的溶液(以头孢克肟计), 在室温下放置3天后, 作为降解储备溶液。量取1.4 mL上述溶液置于10 mL量瓶中, 加0.005 mol·L-1磷酸盐缓冲液(pH 7.0)稀释至刻度, 制成浓度约为3 mg·mL-1的溶液, 作为降解溶液。
头孢克肟原料及制剂溶液 取头孢克肟原料或制剂适量(相当于30 mg头孢克肟), 置于10 mL量瓶中, 加0.1 mol·L-1磷酸盐缓冲液(pH 7.0) 4 mL溶解, 然后加0.005 mol·L-1磷酸盐缓冲液(pH 7.0)稀释至刻度, 摇匀, 过滤, 制成浓度约为3 mg·mL-1的溶液。
方法学验证用溶液 同头孢克肟降解溶液。
酸降解溶液 取头孢克肟原料约30 mg, 置于10 mL量瓶中, 加0.1 mol·L-1磷酸盐缓冲液(pH 7.0) 4 mL溶解, 然后加0.1 mol·L-1盐酸溶液4 mL, 在70 ℃水浴中放置30 min, 取出后放到室温, 用0.1 mol·L-1磷酸盐缓冲液(pH 7.0)稀释到刻度, 摇匀备用。
碱降解溶液 取头孢克肟原料约30 mg, 置于10 mL量瓶中, 加0.1 mol·L-1磷酸盐缓冲液(pH 7.0) 4 mL溶解, 然后加0.1 mol·L-1氢氧化钠溶液4 mL, 在室温条件下放置15 min, 取出后加入0.1 mol·L-1盐酸2 mL, 摇匀备用。
氧化降解溶液 取头孢克肟原料约30 mg, 置于10 mL量瓶中, 加0.1 mol·L-1磷酸盐缓冲液(pH 7.0) 4 mL溶解, 然后加10%双氧水溶液2 mL, 在室温条件下放置15 min, 摇匀备用。
紫外降解溶液 取头孢克肟原料约30 mg, 置于10 mL量瓶中, 加0.1 mol·L-1磷酸盐缓冲液(pH 7.0)溶解并稀释至刻度。在UV灯下照射12 h, 备用。
水浴降解溶液 取头孢克肟原料约30 mg, 置于10 mL量瓶中, 加0.1 mol·L-1磷酸盐缓冲液(pH 7.0)溶解并稀释至刻度。在70 ℃水浴中放置60 min, 取出后放到室温, 备用。
方法学验证
检测限与定量限 精密量取方法学验证溶液, 用RP-HPLC法的流动相A进行倍比稀释, 得到不同浓度的系列溶液, 量取20 μL注入液相色谱仪。以头孢克肟对照品为外标, 得到方法的最低定量限(LOQ)和最低检测限(LOD)。
精密度 精密量取方法学验证溶液20 μL, 注入液相色谱仪, 连续进样3针, 计算主要二聚体杂质的峰面积, 以相对标准偏差RSD%表示。
重复性 制备6份质量浓度为3 mg·mL-1的头孢克肟原料溶液, 进样分析, 以主成分自身对照法计算头孢克肟二聚体的含量, 以相对标准偏差RSD%表示。
耐用性 精密量取方法学验证溶液20 μL, 注入液相色谱仪, 在柱温为38、40和42 ℃时, 流速为0.9、1.0和1.1 mL·min-1, 以及色谱柱(C18, 250 mm×4.6 mm, 5 μm)为Phenomenex Gemini、Kromasil、CAPCELL PAK和Thermo Hypersil BDS时, 考察聚合物杂质的分离情况。
结果与讨论 1 HPSEC法分析头孢克肟弱保留值杂质参照《中国药典》2015年版二部中头孢米诺钠的有关物质Ⅱ的方法, 对流动相的pH、缓冲盐的浓度、强溶剂比例与检测波长等因素进行了优化, 最后建立了HPSEC法。然后采用该方法对头孢克肟降解溶液、头孢克肟原料和头孢克肟分散片进行了分析。结果显示, 在头孢克肟降解溶液中检出4个弱保留值杂质HPSEC-1~4, 其中弱保留值杂质HPSEC-1~3在头孢克肟主峰之前, HPSEC-4在主峰之后。按主成分自身对照法计算, 在头孢克肟原料和分散片中均检出HPSEC-2~4, 含量分别为0.5%和1.5%。
2 柱切换-LC-MSn法推定头孢克肟聚合物的化学结构以头孢克肟降解溶液为供试品, 采用柱切换-LC-MSn法推定弱保留值杂质HPSEC-1~4的化学结构, 杂质结构式见图 1。
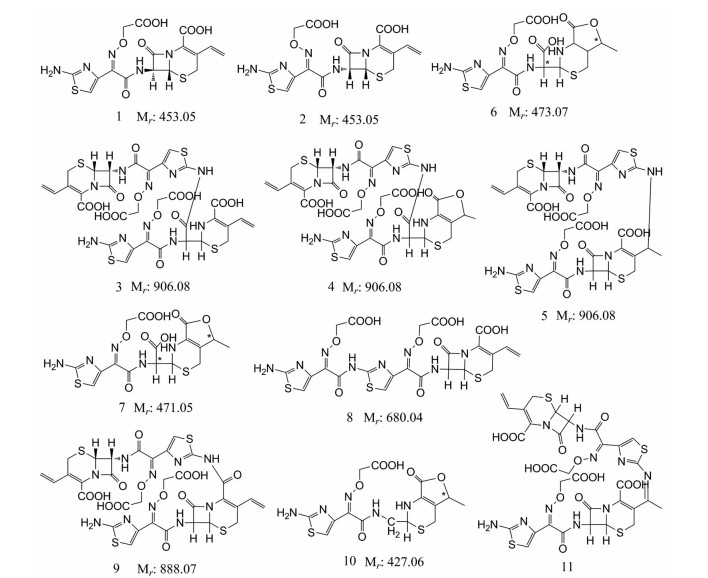
|
Figure 1 Chemical structures of impurities in cefixime degradation solution. 1, 2: HPSEC-1a, 2a, 2b; 3-5: HPSEC-2c, 2d; 6: HPSEC-3a; 7: HPSEC-3b, 3c, 3d; 8: HPSEC-3f, 3g; 9: HPSEC-3h; 10: HPSEC-4a; 11: Unk-6, 7 |
在弱保留值杂质HPSEC-1中检出1个杂质峰, 命名为HPSEC-1a, 质谱数据见表 1。在HPSEC-1a的全扫描质谱图中均存在m/z 454.05 (z = 1)的加合离子峰, 为[M+H]+峰, 因此HPSEC-1a的相对分子质量为453, 与头孢克肟的相对分子质量相同, 初步推定为头孢克肟异构体, 不属于聚合物杂质。二级质谱显示A裂解产生的特征性子离子m/z 285、B裂解产生的特征性子离子m/z 329, 说明该杂质为头孢克肟异构体, 确切的异构化位点仅通过质谱无法确定, 还需要采用NMR等技术进行进一步研究。HPSEC-1a的化学结构式见图 1。
| Table 1 Mass spectra data of polymer impurities in cefixime degradation solution |
在弱保留值杂质HPSEC-2中检出了4个杂质峰, 命名为HPSEC-2a~2d, 质谱数据见表 1。
在HPSEC-2a、2b的全扫描质谱图中均存在m/z 454.05 (z = 1)的加合离子峰, 为[M+H]+峰, 因此HPSEC- 2a、2b的相对分子质量为453, 与头孢克肟的相对分子质量相同, 初步推定为头孢克肟同分异构体, 化学结构式见图 1, 为小分子杂质, 不属于聚合物杂质。
在HPSEC-2c、2d的全扫描质谱图中均存在m/z 907.09 (z = 1)、m/z 454.05 (z = 2)的加合离子峰, 分别为[M+H]+、[M+2H]++峰, 因此HPSEC-2c、2d的相对分子质量为906, 是头孢克肟相对分子质量的2倍, 初步推定为头孢克肟二聚体, 属于聚合物杂质。在HPSEC- 2c、2d的二级质谱图中均存在中性丢失CO2产生的子离子m/z 863 [m/z 907-44], 四元内酰胺环A裂解产生的子离子m/z 738 [m/z 907-169]以及其中性丢失CO2产生的子离子m/z 694 [m/z 738-44]、聚合物位点开裂产生的子离子m/z 454。这些二级质谱特征性子离子进一步表明HPSEC-2c为头孢克肟二聚体。HPSEC-2c、2d的化学结构式见图 1。
2.3 弱保留值杂质HPSEC-3在弱保留值杂质HPSEC-3中检出了9个杂质峰, 按照色谱出峰顺序, 分别命名为HPSEC-3a~3i, 质谱数据见表 1。
在HPSEC-3a的全扫描质谱图中存在m/z 474.04 (z = 1)的加合离子峰, 分别为[M+H]+峰, 因此HPSEC-3a的相对分子质量为473, 比头孢克肟的相对分子质量多20, 初步推定为头孢克肟开环水解产物, 不属于聚合物杂质, 化学结构式见图 1。
在HPSEC-3b~3d的全扫描质谱图中均存在m/z 472.06 (z = 1)的加合离子峰, 为[M+H]+峰, 因此推测HPSEC-3b~3d的相对分子质量为471, 比头孢克肟的相对分子质量多18, 初步推断为头孢克肟开环水解物, 属于小分子杂质, 三者互为同分异构体。参考EP10.0中收载的杂质结构, 推定出该3个杂质的化学结构式, 见图 1。
在HPSEC-3e的全扫描质谱图中存在m/z 454.05 (z = 1)的加合离子峰, 为[M+H]+峰, 因此推测HPSEC-3e的相对分子质量为453, 与头孢克肟的相对分子质量相同, 推定为头孢克肟同分异构体, 化学结构式见图 1。
在HPSEC-3f、3g的全扫描质谱图中均存在m/z 681.05 (z = 1)的加合离子峰, 为[M+H]+峰, 因此推测HPSEC-3f、3g的相对分子质量为680, 比头孢克肟的相对分子质量大227。降解实验表明该杂质不是降解杂质, 属于工艺杂质。根据头孢克肟的合成反应原理, 推断该杂质为头孢克肟分子中多取代了1个7位侧链的反应副产物。二级质谱图中存在四元内酰胺环发生A裂解产生的子离子m/z 170和m/z512, 说明取代位点在头孢克肟的7位侧链上。基于上述分析, 推定该杂质为头孢克肟上多取代了一分子7位侧链, 化学结构式见图 1, 确切的化学结构还需要采用NMR等方法进行进一步确证。
在HPSEC-3h的全扫描质谱图中存在m/z 889.08 (z = 1)的加合离子峰, 为[M+H]+峰, 因此推测HPSEC-3h的相对分子质量为888, 比头孢克肟二聚体的相对分子质量小18。初步推定为头孢克肟脱水二聚体。二级质谱图中存在四元内酰胺环发生A裂解产生的特征性子离子m/z 720和m/z 692, 以及发生B裂解产生的特征性子离子m/z 764, 说明该杂质分子中具有一个完整的母核结构, m/z 454的子离子提示聚合位点易于发生裂解产生一个头孢克肟子离子, 表明两分子头孢克肟之间只有一个连接位点, 降解实验表明该杂质不是降解杂质, 属于工艺杂质, 说明该杂质不是头孢克肟首先形成二聚体, 然后再脱水产生。因此推定该杂质为一分子头孢克肟的7位氨噻肟游离氨基与另一分子头孢克肟的羧基反应, 脱水生成酰胺键的产物, 推定的化学结构式见图 1。确切的化学结构还需要采用NMR等方法进行进一步确证。
在HPSEC-3i的全扫描质谱图中存在m/z 798.08 (z = 1)的加合离子峰, 为[M+H]+峰, 因此推测HPSEC-3i的相对分子质量为797, 比头孢克肟二聚体的相对分子质量小109, 初步推定为头孢克肟二聚体降解物。具体的化学结构有待于进一步研究。
2.4 弱保留值杂质HPSEC-4在HPSEC-4中检出了1个杂质峰, 质谱数据显示该杂质的相对分子质量为427, 属于小分子杂质, 不属于聚合物杂质, 比头孢克肟的相对分子质量少26, 初步推断为头孢克肟开环脱羧物, 即EP10.0收载的头孢克肟杂质B, 不属于聚合物杂质, 其化学结构见图 1。
3 HPSEC法分析聚合物杂质专属性分析在头孢克肟主峰前的2个弱保留值杂质峰HPSEC- 2、3中检出了头孢克肟二聚体、头孢克肟脱水聚体以及头孢克肟二聚体降解物。在HPSEC-1~4中均检出其他小分子杂质。HPSEC法分析聚合物时, 能够检出聚合物杂质, 但是受到小分子杂质的共出峰干扰, 导致方法专属性较差, 定量不准确, 因此不适合用于头孢克肟原料与制剂的聚合物质控。因此本文建立了RP-HPLC法, 并采用LC-MSn法对RP-HPLC法的专属性进行了研究。
3.1 RP-HPLC法分析头孢克肟的聚合物杂质本研究首先比较了《中国药典》2015年版、EP10.0版、USP42版收载的头孢克肟有关物质分析方法, 结果显示, 3种方法均采用离子对试剂四丁基氢氧化铵作为流动相, 不利于聚合物杂质的质谱分析, 给聚合物杂质的定位带来困难, 因此选择了乙腈-甲酸水梯度洗脱方法作为聚合物分析的初始方法[24], 并在此基础上进行方法优化, 最终建立了RP-HPLC法。优化后的RP-HPLC法分析头孢克肟降解浓溶液的典型色谱图见图 2, 采用优化后方法可以分离出unk-1~11等11个未知杂质峰。
3.2 RP-HPLC法分离聚合物杂质的方法学验证 3.2.1 专属性采用LC-MSn法对优化后RP-HPLC系统分离的unk-1~11等11个疑似聚合物杂质进行了质谱分析, 从而实现对聚合物杂质进行精确定位, 质谱数据见表 2, 质谱TIC图见图 2。结果表明, 5个杂质为头孢克肟聚合物杂质及其衍生物, 包括unk-6、7、9~11。杂质unk-9~11含量较高, 分别推定为头孢克肟二聚体异构体、头孢克肟脱水二聚体和头孢克肟二聚体, 可作为质量控制的指针性聚合物杂质。聚合物杂质unk-6、7含量较低, 推定为头孢克肟二聚体衍生物。上述聚合物杂质的化学结构为初步推测结构, 因为存在多个聚合位点和取代位点, 导致聚合物杂质存在多种异构体, 仅通过质谱法无法确证其化学结构, 需要进一步通过NMR法加以确证, 但是质谱法提供的分子量信息能够确定这些杂质均是头孢克肟聚合物杂质。另外, 本文对头孢克肟的酸降解溶液、碱降解溶液、UV降解溶液、氧化降解溶液和水浴降解溶液进行了分析, 结果表明在聚合物出峰位置没有干扰色谱峰。总之, RP-HPLC法能够检出头孢克肟二聚体及其异构体、脱水二聚体、二聚体衍生物, 各个杂质分离度良好, 方法专属性良好。
| Table 2 Cefixime impurities separated by RP-HPLC |
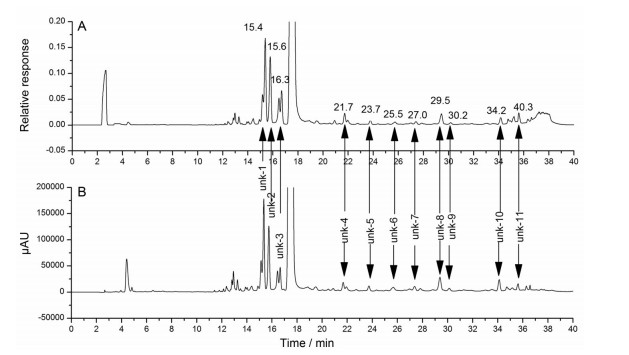
|
Figure 2 Typical mass TIC and UV chromatograms of cefixime degradation solution by optimized method. A: Mass TIC; B: UV chromatogram 270 nm |
头孢克肟二聚体的LOQ为7.87×10-4 μg; LOD为3.66×10-4 μg; 头孢克肟脱水二聚体的LOQ为1.27×10-3 μg; LOD为6.09×10-4 μg。
3.2.3 精密度头孢克肟二聚体异构体、脱水二聚体和二聚体的3次重复进样的RSD分别为0.59%、0.04%和0.38%。
3.2.4 重复性6份样品中头孢克肟二聚体异构体、脱水二聚体和二聚体的含量的RSD分别为1.31%、1.15%和1.38%。
3.2.5 耐用性当流速、柱温改变时, RP-HPLC法均可有效分离样品中的头孢克肟聚合物杂质。不同型号的色谱柱对聚合物杂质的分离能力不尽相同, Phenomenex Gemini色谱柱的分离效果较好。
3.3 聚合物分析结果比较采用RP-HPLC法对头孢克肟原料和头孢克肟分散片进行聚合物分析, 见图 3。结果显示, 头孢克肟原料和制剂中检出头孢克肟脱水二聚体、头孢克肟二聚体及其异构体, 原料中聚合物总含量为0.05%、制剂中聚合物总含量为0.1%。RP-HPLC法测得的聚合物含量明显低于HPSEC法, 进一步说明RP-HPLC法准确和专属性良好。
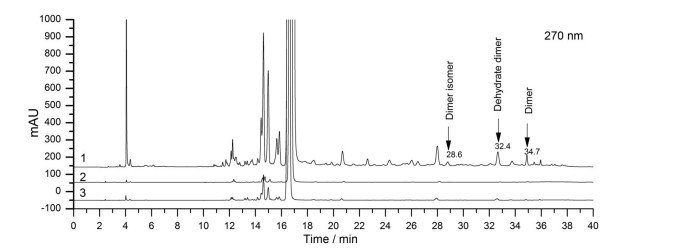
|
Figure 3 Typical chromatograms of cefixime degradation solution, raw material and product by RP-HPLC. 1: Degradation solution; 2: Raw material; 3: Product |
本文综合运用高效凝胶色谱法(HPSEC)、柱切换-LC-MSn法等现代色谱分析技术, 证明了HPSEC法分析头孢克肟中聚合物杂质的方法专属性差, 新建立的RP-HPLC法分析头孢克肟中聚合物杂质的灵敏度高、专属性强, 可用于头孢克肟原料和制剂的聚合物质控; 头孢克肟降解溶液可作为头孢克肟聚合物分析的系统适用性溶液。
作者贡献: 李进完成了实验和论文撰写, 姚尚辰和尹利辉协助完成, 通讯作者许明哲为本文修改和指导, 胡昌勤提出实验思路与理念并进行指导。
利益冲突: 无任何利益冲突。
| [1] |
Jin SH. Research progress on cephalosporin allergic reaction[J]. World Notes Antibiot (国外药学:抗生素分册), 1984, 5: 191-197. |
| [2] |
Jin SH. Allergic reaction of antibiotics-Ⅰ allergic reaction of beta-lactam antibiotics[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 1986, 2: 251-257. |
| [3] |
Jin SH, Hu CQ. Study on allergic reactions to beta-lactam antibiotics[J]. Bull Med Res (医学研究杂志), 2002, 31: 22-23. |
| [4] |
Jin SH. A review on relationship between quality of β-lactam antibiotics and allergic reactions[J]. Chin J Antibiot (中国抗生素杂志), 1988, 13: 65-71. |
| [5] |
Hu CQ, Jin SH. Research progress of polymer impurities in β-lactam antibiotics and their analytical technology[J]. World Notes Antibiot (国外药学:抗生素分册), 1996, 17: 336-343. |
| [6] |
Wang YY, Chen Y, Hong LY. Review on progresses of isolation and test methods for high-molecular weight polymer impurities in β-lactam antibiotics[J]. Chin Pharm Aff (中国药事), 2015, 29: 608-612. |
| [7] |
Zhang Q, Yama MB, Aki HM, et al. Polymerization of cephalosporins in aqueous solution[J]. Acta Pharm Sin (药学学报), 1996, 31: 306-312. |
| [8] |
Niu CQ, Zhu SQ. Separation and determination of ampicillin polymers by high performance capillary electrophoresis[J]. Acta Pharm Sin (药学学报), 1997, 32: 207-209. |
| [9] |
Hu CQ. Developments on analysis of polymers of β-lactam antibiotics[J]. Chin J New Drugs (中国新药杂志), 2008, 17: 2098-2102. |
| [10] |
State Pharmacopoeia Commission. Pharmacopoeia of the people's Republic of China (中华人民共和国药典)[S]. 2015 Ed. Vol 2. Beijing: China Medical Science Press, 2015: 255-258.
|
| [11] |
United States Pharmacopeial Convention Inc. The United States Pharmacopeia[S]. 42 Ed. Roehville MD: the United States Pharmacopeial Convention Inc, 2019: 818-819.
|
| [12] |
European Directorate for the Quality of Medicines. Europeon Pharmacopeia 10.0[S]. Strasbourg: European Directorate for the Quality of Medicines, 2020: 2119-2120.
|
| [13] |
Zhao XD, Fu R, Lu J, et al. Determination of polymers in cefixime by molecular-exclusion chromatography method[J]. China Pharm (中国药师), 2011, 14: 61-63. |
| [14] |
Li JX, Xiang L, Chen SH, et al. Determination of polymer in cefixime sustained release pellet capsules by gel filtration chromatography[J]. Cent South Pharm (中南药学), 2014, 12: 1228-1230. |
| [15] |
Su YQ, Cai GW, Gao L. Determination of polymer impurities in cefixime granules by molecular exclusion chromatography method[J]. Cent South Pharm (中南药学), 2019, 17: 1949-1952. |
| [16] |
Shi HY, Chen XY, Wang JH. Determination of high molecular mass impurities in cefi xime for suspension by molecular-exclusion chromatography method[J]. Chin J Antibiot (中国抗生素杂志), 2016, 41: 122-124. |
| [17] |
Li J, Zhang PP, Chong XM, et al. Analysis of polymer impurities in co-amoxicillin and potassium clavulanate preparations[J]. Chin J Pharm Anal (药物分析杂志), 2017, 37: 1430-1440. |
| [18] |
Yang MQ, Jin SH, Hu CQ. Analysis of polymer impurities in related substances of benzylpenicillin sodium by HPLC-column-switching[J]. Chin J Pharm Anal (药物分析杂志), 2009, 29: 1615-1620. |
| [19] |
Li J, Zhang PP, Yao SC, et al. Analysis of polymer impurities in cefradine raw materials and preparations[J]. Chin J Antibiot (中国抗生素杂志), 2019, 44: 362-369. |
| [20] |
Li J, Zhang PP, Yao SC, et al. Analysis of polymer impurities in piperacillin sodium and tazobactam sodium for injection[J]. Chin J Pharm Anal (药物分析杂志), 2019, 39: 1279-1294. |
| [21] |
Li J, Yao SC, Yin LH, et al. Analysis of polymer impurities in ceftazidime raw material and preparation[J]. Acta Pharm Sin (药学学报), 2020, 55: 1889-1896. |
| [22] |
Li J, Yao SC, Yin LH, et al. Analysis of polymer impurities in cefdinir raw materials and preparations[J]. Chin J Antibiot (中国抗生素杂志), 2020. https://kns.cnki.net/kcms/detail/51.1126.R.20200617.0856.006.html. DOI: 10.13461/j.cnki.cja.006969.
|
| [23] |
Li J, Yao SC, Yin LH, et al. Analysis of polymer impurities in cefotaxime raw materials and preparations[J]. Chin J Antibiot (中国抗生素杂志), 2020. https://kns.cnki.net/kcms/detail/51.1126.R.20200617.0856.004.html. DOI: 10.13461/j.cnki.cja.006968.
|
| [24] |
Zahra T, Hakimeh P, Hasan R, et al. Determination of cefixime by a validated stability-indicating HPLC method and identification of its related substances by LC-MS/MS studies[J]. Sci Pharm, 2013, 81: 493-503. DOI:10.3797/scipharm.1301-15 |
 2020, Vol. 55
2020, Vol. 55


