2. 上海市食品药品检验所, 国家药品监督管理局治疗类单抗质量控制重点实验室, 上海 201203
2. Shanghai Institute for Food and Drug Control, NMPA Key Laboratory for Quality Control of Therapeutic Monoclonal Antibodies, Shanghai 201203, China
胸腺法新(thymalfasin)是由10种L-氨基酸组成的合成二十八肽, 其制剂注射用胸腺法新在临床上主要用于免疫缺陷, 病毒感染以及肿瘤的治疗, 并且在缺少新冠肺炎特效药的背景下作为免疫增强药物被广泛使用, 因此该多肽药物的质量控制显得至关重要。除中国药典(ChP2015)外, 其他各国药典均未收载胸腺法新及其制剂。ChP2015中胸腺法新及其有关物质的分析多采用基于杂质对照品的HPLC法[1-3]。消旋肽为多肽链中含一个或多个非预期手性构型的氨基酸残基所形成的肽链[4], 由于该类杂质与主成分的结构差异小、色谱分离困难且合成杂质对照品的成本较高, 因此HPLC法无法对潜在的所有消旋肽进行全面控制。目前该类杂质的最新质控思路是将合成多肽完全水解成游离氨基酸, 通过分离及计算D/L氨基酸的相对含量来对消旋肽杂质进行间接控制[5]。美国药典(USP42)[6]就是采用GC-MS方法对水解后艾塞那肽中D-His和L-His响应值的相对比例进行测定, 以控制D-His1消旋肽杂质含量。该方法具有无需合成多肽杂质对照品, 且不要求消旋肽在色谱上完全分离等优势。目前USP42的方法仅对艾塞那肽中D-His进行控制, 但GC-MS良好的分辨率和灵敏度[7, 8]有望从氨基酸角度全面监控多肽中所有氨基酸发生消旋化的可能性。因此, 本文旨在建立基于GC-MS的常见氨基酸分析方法并应用于胸腺法新的质量控制。
为了测定氨基酸需要先将多肽进行水解, 而水解过程不可避免会引起少量手性氨基酸消旋化。因此, 本文采用氘代盐酸/重水溶液(deuterium chloride/deuterium oxide, DCl/D2O)水解胸腺法新, 该方法可以使在水解过程中发生外消旋的氨基酸手性碳(α-碳)标记上一个氘(分子量增加1 Da), 进一步通过高分辨质谱即可区分水解产生的D-氨基酸和原始的D-氨基酸。由于氨基酸为极性物质, 需要先对其进行非手性衍生化以提高挥发性才能用GC分析。主要的衍生化方法有:酯化、酰化和硅烷化等。其中, 硅烷化反应要求无水环境, 反应条件苛刻, 且极易影响反应效率。氯甲酸酯[9]作为酰化试剂的一种, 具有反应快速和副产物少等优点, 但其无法对氨基酸(如Thr和Ser)侧链上的脂肪族羟基衍生化, 因此导致这些极性较大的化合物难以从色谱柱上洗脱下来。相比之下, 全氟酸酐不仅能使氨基酸α-碳上的氨基酰化, 还能衍生化氨基酸侧链的羟基或氨基, 大大增加其挥发性。目前文献[9]报道中, 利用异丙醇(isopropanol, IPA)与三氟乙酸酐(trifluoroacetic anhydride, TFAA)分别进行酯化和酰化的两步衍生化方法具有较好的对映体分离度和灵敏度, 在Chirasil-L-Val柱上最多可成功分离15对D/L-氨基酸的N(O, S)-三氟乙酰基异丙酯衍生物, 因此是本文的主要衍生化试剂组合候选对象。
由于合成多肽药物中含有不同氨基酸, 各氨基酸的侧链结构不同, 其化学性质也具有较大差异, 因此针对常见氨基酸建立GC-MS分析方法具有较大难度。目前该方法待改进之处在于: ① Trp、Arg和His等具有较高分子量和极性的氨基酸可能在柱上无限期地保留[10]; ② Asp、Glu、Ser、Thr和Tyr等氨基酸侧链中含有羟基, 可能影响其衍生化效率和衍生产物的稳定性[9]; ③现有文献中GC-MS定量方法未曾应用于氘代水解的氨基酸产物, 其定量离子和方法专属性有待研究。本文采用的基于IPA和TFAA衍生化的氨基酸测定方法是对文献[9, 11-14]方法的改进(氨基酸衍生化反应通式如图 1所示), 通过正交设计优化多步衍生化反应中的试剂用量、反应温度和时间等条件提高氨基酸衍生产物的衍生化效率和稳定性; 通过增加第三步操作使氯甲酸异丁酯(isobutyl chloroformate, IBCF)与His侧链上的咪唑环衍生化, 减弱其极性而得以分析, 最终该方法可以在较短时间(29 min)内同时测定17种氨基酸(除Asn、Gln和Arg)。采用氘代盐酸对胸腺法新进行水解, 对文献[10, 15]报道的定量离子方法进行调整和优化。由于胸腺法新中含有的Asn会在酸水解和衍生化过程中转化为Asp, 因此对胸腺法新中其他9种氨基酸(Ala、Asp、Glu、Ile、Leu、Lys、Thr、Val、Ser)进行分析, Asn以Asp结构计算。由于胸腺法新不含His, 因此对氘代酸水解得到的氨基酸进行IPA和TFAA两步衍生化处理, 建立胸腺法新中D-氨基酸的定量方法, 并对方法进行了方法学验证。采用已优化及验证的GC-MS方法对6家企业生产的胸腺法新原料药中D-氨基酸含量进行准确测定。本实验从氨基酸层面反映对映体纯度, 为胸腺法新的质量控制提供新的方法, 有望为合成多肽药物全面控制消旋肽杂质提供参考。
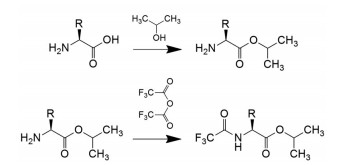
|
Figure 1 Mechanism of two-step derivatization of amino acids by isopropanol and trifluoroacetic anhydride |
仪器与材料 7890A/5975C气相质谱联用仪(美国Agilent公司); 离心机(美国Eppendorf公司); MS-204S电子天平(瑞士Mettler Toledo公司); Milli-Q型超纯水仪(美国Millipore公司); 烘箱(德国Memmert公司)。
氨基酸对照品: D-亮氨酸和D-赖氨酸对照品(上海阿拉丁生化科技股份有限公司, 中国); D-异亮氨酸对照品(上海麦克林生化科技有限公司, 中国); L-半胱氨酸对照品购自国药集团化学试剂有限公司; 其他L-氨基酸对照品和D-氨基酸对照品(Merch KGaA, Darmstadt, 德国), 氨基酸批号信息见表 1; DCl (35%, 批号: MBBC4507)、D2O (批号: MKCG0822)、TFAA (批号: BCBZ4625)、三氟乙酸乙酯(ethyl trifluoroacetate, TFAEt) (批号: MKCC4812)和十二烷酸甲酯(99.95%, 批号: BCBF7114V)均购自Merch KGaA (Darmstadt, 德国); 盐酸(HCl)、IBCF (批号: 80025282)购自国药集团化学试剂股份有限公司; 色谱纯二氯甲烷(CH2Cl2) (Thermo Fisher Scientific, 美国); 色谱纯IPA (Anaqua Chemicals Supply, 美国)。6批胸腺法新原料药含量均为100%, 自编号1~6分别对应企业A (批号: 171001)、企业B (批号: S00620171201)、企业C (批号: 1711012)、企业D (批号: THSA141101-R)、企业E (批号: 0281711001)和企业F (批号: C109-A-6180101)。
| Table 1 Information of reference amino acids |
色谱和质谱条件 CP-Chirasil-L-Val: N-丙酰基-L-缬氨酸-叔丁基酰胺聚硅氧烷WCOT熔融石英毛细管柱(25 m×0.25 mm ID, 涂膜厚度0.12 μm, 美国Agilent公司); 载气:高纯氦气; 分流比1:50;流速1.0 mL·min-1; 进样量1.0 μL; 进样口温度: 200 ℃; 柱温:程序升温, 初始温度98 ℃, 维持8 min, 以8 ℃·min-1升温至170 ℃, 维持0 min, 以10 ℃·min-1升温至190 ℃, 维持10 min。离子源:电子轰击源(EI); 电子能量70 eV; 离子源温度: 230 ℃; 四极杆温度: 150 ℃。采集方式:选择离子扫描(SIM), 定量离子见表 2。
| Table 2 The MS parameters of amino acids for quantification and confirmation |
数据处理 通过GC-MS Advanced software (美国Agilent公司)获得各氨基酸衍生产物的提取离子流图(EIC), 并对各待测化合物的峰响应值进行记录, 采用公式(1)进行定量分析。
| $ {\rm{Content}} = \frac{{{A_D}}}{{{A_L} + {A_D} + {A_{D{\rm{*}}}}}} \times 100{\rm{\% }} $ | (1) |
式(1)中AD为样品溶液中各D-氨基酸的峰值响应, AL为样品溶液中对应L-氨基酸的峰值响应, AD*为水解中由L-氨基酸外消旋化产生的D-氨基酸的峰值响应。
氨基酸对照品溶液制备 精密称取各氨基酸对照品约10 mg于50 mL量瓶, 加水溶解并定容至刻度, 即得。内标溶液:适量称取十二烷酸甲酯, 用CH2Cl2配成2 mg·mL-1溶液
供试品溶液制备 氘代盐酸溶液:精密量取35% DCl与D2O以1:1 (v/v)混合即得, 随配随用。取胸腺法新原料药约1 mg加入氘代盐酸溶液350 μL溶解, 充氮, 密封, 置110 ℃烘箱放置20 h, 放冷, 用氮气流吹干过量试剂, 进行衍生化反应。
衍生化反应方法 取1~2 mg供试品水解物或氨基酸对照品, 加DCl/IPA溶液(1:5, v/v) 250 μL, 置于110 ℃酯化反应50 min。冷却后开盖, 用氮气流吹干过量试剂。加TFAA/TFAEt溶液(1:1, v/v) 250 μL溶解产物, 置于130 ℃酰化反应20 min。冷却后用氮气流吹干过量试剂。His需要进行第三步衍生化, 即加IBCF 100 μL溶解产物, 置于120 ℃酰化反应20 min。冷却后用氮气流吹干过量试剂, 用适量CH2Cl2复溶最终产物, 转移至进样小瓶, 进样。
衍生化条件的优化 正交设计考察DCl/IPA酯化试剂中不同用量比例[250 μL (1:5, v/v)、250 μL (1:2, v/v)、400 μL (1:2, v/v)]、酯化反应温度(90、100、110 ℃)、酯化反应时间(20、30、50 min)、TFAA/TFAEt酰化试剂用量(80:160、100:200、125:125 μL)、酸酐酰化反应温度(100、110、130 ℃)、酸酐酰化反应时间(10、20、30 min)、第三步酰化反应试剂及用量(IBCF 50 μL、IBCF与CH2Cl2各50 μL、IBCF 100 μL)、IBCF酰化反应温度(100、110、120 ℃)和IBCF酰化反应时间(10、15、20 min)对衍生化效率的影响。
供试品复溶试剂体积的优化 参照胸腺法新中各L-氨基酸的摩尔比关系, 分别配制L-氨基酸储备液(L-Ser、L-Glu、L-Thr、L-Ala、L-Val、L-Ile、L-Leu、L-Lys和L-Asp浓度分别为7.11、14.20、7.08、7.09、7.09、2.37、2.40、9.45和9.47 mmol·L-1)和D-氨基酸储备液(D-Ser、D-Glu、D-Thr、D-Ala、D-Val、D-Ile、D-Leu、D-Lys和D-Asp浓度分别为1.41、2.84、1.42、1.42、1.42、0.48、0.47、1.89和1.90 mmol·L-1)。取D-氨基酸溶液适量, 加入到L-氨基酸溶液中, 分别配成各D-氨基酸浓度为0.25%、0.50%、1.00%和2.00%的混合氨基酸对照品溶液, 每个样品平行制备3份衍生物, 以D-氨基酸的平均回收率为指标, 单因素考察复溶样品的溶剂(CH2Cl2)体积(1、2、5、10、20、30 mL)对各氨基酸衍生物平均回收率的影响。
方法学考察
系统适用性 将混合氨基酸对照品溶液, 按上述方法操作, 制备衍生产物, 加入内标溶液50 μL, 连续重复进样6次, 记录各氨基酸衍生物和内标物的响应值比值Aaa/AIS, 并计算RSD。
线性关系和定量限 将混合氨基酸对照品的衍生产物稀释成一系列梯度溶液以衍生物峰的响应值(Y)及相应的浓度(X)进行线性回归。以各化合物的信噪比为3计算检测限(LOD), 以信噪比为10计算定量限(LOQ)。
精密度 取胸腺法新原料药按上述方法操作制备供试品衍生产物, 平行6份, 其中一份连续进样6次, 按上述方法测定, 记录各衍生物峰响应值, 按公式(1)计算D-氨基酸含量及其RSD。
准确度 按“供试品复溶试剂体积的优化”操作配成CD/(CD+CL)浓度比为0.25%、0.50%、1.00%和2.00%的氨基酸对照品溶液, 按上述方法操作制备混合对照品衍生产物, 按上述方法测定, 每个浓度平行3份, 计算对照品平均回收率。
加标回收率 取胸腺法新原料药氘代盐酸水解产物加入混合氨基酸对照品, 使各待测D-氨基酸的最终含量为0.50%~1.00%, 按上述方法操作制备供试品衍生产物, 平行6份, 按上述方法测定, 计算平均加标回收率。
结果 1 衍生化条件优化综合极差分析结果和单因变量的多因素方差分析结果, 得到适用于17种氨基酸衍生化反应的整体最优因素水平分别是:第一步酯化反应试剂为250 μL DCl/IPA (1:5, v/v)、酯化反应温度为110 ℃、酯化反应时间为50 min; 第二步酰化反应试剂为250 μL TFAA/TFAEt溶液(1:1, v/v)、酰化反应温度为130 ℃、酰化反应时间为20 min; 仅针对His的第三步酰化反应试剂为100 μL IBCF溶液、酰化反应温度为120 ℃、酰化反应时间为20 min。
2 供试品复溶试剂体积的优化结果表明, 各氨基酸衍生物的平均回收率随着复溶样品的溶剂体积的变化而变化, 且每种浓度的样品得到的测定结果RSD (n = 3)均小于10.42%。其中, D-Ala、D-Ile和D-Ser在CH2Cl2体积为1 mL时, 可以得到最佳的平均回收率范围为80.78%~128.18%; D-Val、D-Leu和D-Glu在CH2Cl2体积为2 mL时可以得到最佳的平均回收率范围为77.75%~125.48%; D-Thr在CH2Cl2体积为5 mL时可以得到最佳的平均回收率范围为81.88%~99.93%; D-Asp在CH2Cl2体积为10 mL时可以得到最佳的平均回收率范围为76.69%~105.01%; D-Lys在CH2Cl2体积为30 mL时可以得到最佳的平均回收率范围为80.65%~96.32%。这是因为多步衍生化的最后一步氮气吹干后, 复溶样品所用的CH2Cl2体积决定了样品中L-氨基酸的进样浓度, 而数据处理的公式(1)不仅与D-氨基酸含量有关, 还与L-氨基酸终浓度有密切的联系, 因此为准确测定胸腺法新中不同D-氨基酸含量, L-Ala、L-Ile、L-Ser、L-Val、L-Glu、L-Leu、L-Thr、L-Asp和L-Lys最佳的进样浓度分别为1 011.25、335.96、1 009.17、507.01、1 006.97、171.2、201.3、133.96和44.71 μmol·L-1。
3 方法学验证 3.1 专属性在上述色谱和质谱条件下, 16对D/L-氨基酸和Gly在29 min内实现基线分离。由于Chirasil-L-Val色谱柱的手性材料中L-缬氨酸的空间构型使与其手性中心相连的二酰基结构和待测L-氨基酸上的羰基形成更强的分子内氢键, 从而导致L-氨基酸衍生物在色谱柱中的保留时间延长, 因此D-氨基酸衍生物在相应的L-对映体之前出峰[16, 17], 见图 2。系统适应性实验结果显示各氨基酸衍生物的相对标准偏差RSD < 6.97%, 表明方法的系统适用性良好。各氨基酸衍生物的分子质量、保留时间、定量离子和定性离子信息见表 2。由于Gln和Asn在衍生和水解反应中会完全水解成Glu和Asp, 而Arg侧链上胍基的氮无法全部被TFAA或IBCF酰化, 分子极性大且沸点高, 因此无法检测Gln、Asn和Arg衍生产物。
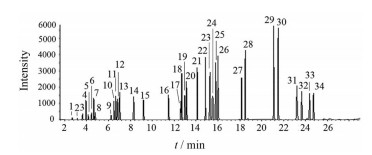
|
Figure 2 TIC of amino acids derivatives. 1: D-Alanine; 2: L-Alanine; 3: D-Valine; 4: D-Threonine; 5: L-Valine; 6: Glycine; 7: L-Threonine; 8: D-Isoleucine; 9: L-Isoleucine; 10: D-Proline; 11: L-Proline; 12: D-Leucine; 13: D-Serine; 14: L-Serine; 15: L-Leucine; 16: Methyl dodecanoate (internal standard); 17: D-Cysteine; 18: D-Aspartic; 19: L-Aspartic; 20: L-Cysteine; 21: D-Methionine; 22: L-Methionine; 23: D-Phenylalanine; 24: D-Glutamate; 25: L-Phenylalanine; 26: L-Glutamate; 27: D-Tyrosin; 28: L-Tyrosin; 29: D-Lysine; 30: L-Lysine; 31: D-Tryptophan; 32: L-Tryptophan; 33: D-Histidine; 34: L-Histidine |
结果显示, 在设计的进样浓度范围内各化合物线性关系良好, r2均大于0.992 3。各氨基酸衍生物的检测限和定量限范围分别为0.05~1.40 μmol·L-1和0.09~2.79 μmol·L-1, 表明该方法灵敏度良好。结果见表 3。
| Table 3 Regression data, limit of quantification (LOQ) and limit of detection (LOD) of nine amino acids derivatives in thymalfasin. Y: Peak response; X: Concentration of compound (μmol·L-1) |
实验表明, 6份供试品溶液中9种D-氨基酸峰测定结果的RSD均小于10.90%, 连续重复进样6针的结果RSD均小于10.43%, 表明方法的精密度良好。
3.4 准确性和加标回收率对照品准确性实验结果表明, 各氨基酸得到的平均回收率为76.69%~128.18%, 且每种浓度的样品测得结果的RSD (n = 3)均小于10.42%。其中, Ala、Ile、Val、Leu、Thr和Glu适用的D-氨基酸浓度范围为0.50%~2.00%; Ser适用的D-氨基酸浓度范围为1.00%~2.00%;而Asp和Lys由于定量限较低, 因此可准确检测的D-氨基酸浓度低至0.25%, 综上说明大多数D-氨基酸在0.50%~2.00%浓度内的回收率良好。加标回收实验结果表明, 胸腺法新原料药中9种D-氨基酸的平均加标回收率为70.41%~125.39%, RSD在2.15%~10.91%之间, 说明该方法在0.50%~1.00%浓度范围内测定的准确度良好。
4 样品测定检测6批不同厂家的胸腺法新原料药, D-Asp和D-Glu含量较高, 分别为0.41%~0.49%和0.25%~0.33%, 其他D-氨基酸响应值比值均小于0.25%, 结果见表 4。
| Table 4 Contents of D-Asp and D-Glu in thymalfasin. Contents of other D-amino acids were low than 0.25% |
本文建立了多步衍生化GC-MS法测定胸腺法新中9种D-氨基酸含量的方法, 具有如下优点: ①衍生化效率较高且衍生产物稳定, 极大缩短分析时间, 在29 min内16对D/L-氨基酸和Gly实现基线分离; ②氨基酸对映体测定种类增加至17种; ③可用于胸腺法新中D-氨基酸含量测定, 且重复性、精密度及回收率等良好, 相比HPLC法, 该方法无需合成消旋肽杂质对照品, 能快速反映胸腺法新中非预期氨基酸对映体含量。
多步衍生化反应条件优化是手性氨基酸定量分析的关键因素。本实验以17种氨基酸衍生产物与内标的峰值响应比值为指标, 对多步衍生化反应的反应试剂用量、反应温度和反应时间等进行正交设计实验考察, 得到整体最优的衍生化反应条件。当氨基酸个别因素的最佳水平不完全与预选方法组合相同时, 进一步通过方差分析验证了在该预选方法组合条件下, 所有显著性影响(P < 0.05)各氨基酸衍生效率的关键因素均处于最佳水平, 而个别氨基酸未满足最佳水平的影响因素恰好为非关键因素(P > 0.05), 对衍生化效率影响不明显, 因此该整体最优反应条件组合适用于17种氨基酸衍生化。通过对色谱和质谱条件优化, 在29 min内实现了各氨基酸对映体的有效分离; 为了实现原始存在和水解过程产生D-氨基酸的区分, 本实验采用了氘代盐酸水解并基于定量离子结构式包含α-碳及其上氢离子的原则调整了17种氨基酸的定量离子; 同时对胸腺法新供试品复溶体积进行优化, 对已优化的方法进行线性、定量限、精密度、准确性和加标回收率等方法学考察, 验证了定量方法准确可靠。
本方法成功应用于对胸腺法新中9种D型氨基酸的定性和定量测定, 发现各厂家产品的D型氨基酸含量趋势一致, 其中D-Asp和D-Glu含量较高。虽然ChP2015仅列出常见的[D-Ser1-胸腺法新]杂质结构, 但实验结果表明胸腺法新原料药还可能存在含其他D-氨基酸的消旋肽杂质。该结果提示, 厂家在生产过程中应关注以上D-氨基酸存在的原因, 进一步考察氨基酸原料药纯度或合成工艺的影响因素。
作者贡献: 林梅、陈钢和邵泓提供了研究思路, 所有作者参与了这项研究的设计, 林洁虹收集和分析了大部分数据并撰写了论文, 林洁虹和尹红锐讨论了研究结果并修订了论文。
利益冲突: 本文里研究内容无任何利益冲突。
| [1] |
Tian NN. Study on Quality of Thymalfasin (胸腺法新的质量分析研究)[D]. Lanzhou: Lanzhou University, 2015.
|
| [2] |
Chen JX, Wang SL, Zhang HY, et al. Content determination of the related substances in thymalfasin for injection by RP-HPLC[J]. Mod Med Heal (现代医药卫生), 2014, 30: 3390-3392. |
| [3] |
Cheng L, Tang YM, Yin G, et al. HPLC determination of impurities of thymalfasin and thymalfasin for injection[J]. Chin J Pharm Anal (药物分析杂志), 2013, 33: 1942-1947. |
| [4] |
Hu YX, Jiang Y, Han TJ, et al. Quality control and related substances of synthetic peptide drugs[J]. Chin J New Drug (中国新药杂志), 2018, 502-508. |
| [5] |
Lin JH, Wang H, Shao H, et al. Advances in research on mass spectrometry based chiral amino acid analysis for quality control of racemic peptide impurities[J]. Acta Pharm Sin (药学学报), 2019, 54: 1958-1964. |
| [6] |
The United States Pharmacopeial Commission. The United States Pharmacopeia 42-National Formulary 37[S]. Rockville: The United States Pharmacopeial Convention, 2019: 1667-1670.
|
| [7] |
Wang GZ, Hao X, Liu L, et al. GC-MS separation and determination of 20 amino acids in biological samples based on ethyl chloroformate second derivation[J]. Acta Pharm Sin (药学学报), 2017, 52: 113-117. |
| [8] |
Song GS, Xu YM, Zhou L, et al. Simultaneous quantification of 7 coumarins in common cnidium fruit by GC-MS[J]. Acta Pharm Sin (药学学报), 2016, 51: 626-630. |
| [9] |
Waldhier MC, Dettmer K, Gruber MA, et al. Comparison of derivatization and chromatographic methods for GC-MS analysis of amino acid enantiomers in physiological samples[J]. J Chromatogr B, 2010, 878: 1103-1112. DOI:10.1016/j.jchromb.2010.03.021 |
| [10] |
Zampolli M, Meunier D, Sternberg R, et al. GC-MS analysis of amino acid enantiomers as their N(O, S)-perfluoroacyl perfluoroalkyl esters:application to space analysis[J]. Chirality, 2006, 18: 279-295. DOI:10.1002/chir.20241 |
| [11] |
Lorenzo MP, Dudzik D, Varas E, et al. Optimization and validation of a chiral GC-MS method for the determination of free d-amino acids ratio in human urine:application to a Gestational Diabetes Mellitus study[J]. J Pharm Biomed Anal, 2015, 107: 480-487. DOI:10.1016/j.jpba.2015.01.015 |
| [12] |
Pietrogrande MC, Basaglia G. Enantiomeric resolution of biomarkers in space analysis:chemical derivatization and signal processing for gas chromatography-mass spectrometry analysis of chiral amino acids[J]. J Chromatogr A, 2010, 1217: 1126-1133. DOI:10.1016/j.chroma.2009.09.055 |
| [13] |
Fuchs SA, de Sain-van der Velden MGM, De Barse MMJ, et al. Two mass-spectrometric techniques for quantifying serine enantiomers and glycine in cerebrospinal fluid:potential confounders and age-dependent ranges[J]. Clin Chem, 2008, 54: 1443-1450. DOI:10.1373/clinchem.2007.100412 |
| [14] |
Ermer J, Gerhardt J, Siewert M. Quality control of peptide drugs. Chiral amino acid analysis versus standard for icatibant acetate[J]. Arch Pharm (Weinheim), 1995, 328: 635-639. DOI:10.1002/ardp.19953280902 |
| [15] |
Bertrand M, Chabin A, Brack A, et al. Separation of amino acid enantiomers via chiral derivatization and non-chiral gas chromatography[J]. J Chromatogr A, 2008, 1180: 131-137. DOI:10.1016/j.chroma.2007.12.004 |
| [16] |
Morrison C. Chromatographic separations and analysis: chiral gas chromatography[M]//Carreira EM, Yamamoto H.Comprehensive Chirality.Elsevier Science & Technology, 2012: 335.
|
| [17] |
Allenmark S, Schurig V. Chromatography on chiral stationary phases[J]. J Mater Chem, 1997, 7: 1955-1963. DOI:10.1039/a702403g |
 2020, Vol. 55
2020, Vol. 55


