随着Bemcentinib+帕博利珠单抗(pembrolizumab, 商品名: Keytruda®)等化学药和生物药的联用、度伐利尤单抗(durvalumab, 商品名: Imfinzi®)+Tremelimumab等生物药的联用日渐增加, 联合用药不仅引领免疫治疗的方向, 在化学药复方制剂的应用中同样获得广泛的关注, 索非布韦(sofosbuvir, 商品名: Sovaldi®)作为吉利德公司研发的首个获批的用于治疗慢性丙型肝炎感染的药物, 具有治愈率高、疗程短和全基因型等优点。随着“吉二代” (Harvani®) —索非布韦+雷迪帕韦(ledipasvir)复方、“吉三代” (Epclusa®) —索非布韦+韦帕他韦(velpatasvir)复方、“吉四代” (Vosevi®) —索非布韦+韦帕他韦+伏西瑞韦(voxilaprevir)复方等不断推出, 从2015~2019年, 四代产品累计销售额高达808.99亿美元(数据来源: IMS数据库, 检索日期: 2020年3月10日), 商业价值巨大。
复方药物是由两种或多种活性药物成分(active pharmaceutical ingredients, APIs)组成的物理混合(图 1), 相比于单一药物, 在治疗包括感染性疾病、HIV/AIDS、癌症、糖尿病、心血管疾病等多种复杂疾病时, 具有很多优势, 但也存在一些问题, 具体包括:①APIs的质量控制标准问题。虽然复方药物的两种或多种APIs是按一定比例进行物理混合的, 但其含量标准的重现性较差, 不同化合物对X-射线粉末衍射(powder X-ray diffraction, PXRD)的响应存在差异, 因此无法建立晶型标准; ②制剂过程中APIs的比例和分散性问题。由于每单位剂量的药物产品仅含毫克/微克级别APIs, 在制剂过程中, 控制APIs的比例和分散性存在困难; ③原料药的储存问题。相较于单一API, 物理混合后APIs的稳定性更低。而将两种或多种APIs通过弱相互作用结合在同一晶格中, 制备成药物-药物共晶的超分子复合物, 能很好地应对复方药物存在的上述问题, 且新型药物-药物共晶等复合物可能比物理混合具有更高的溶出速率和生物利用度。
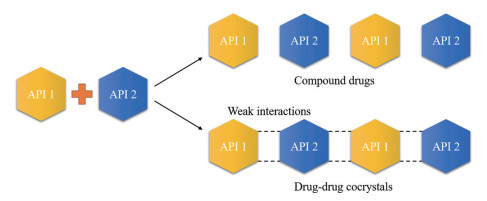
|
Figure 1 The difference of API between compound drugs and drug-drug cocrystals |
基于超分子化学理念, 运用晶体工程设计, 可将不同种药物分子在不改变化学结构的情况下, 结合在同一晶格中, 形成新的固态药物复合物, 且药物-药物复合物可以多种晶型存在, 进而实现从分子水平上调控APIs的构型、组成、剂型、物理化学性质和药理学性质等[1-6]。基于晶体工程设计的药物-药物共晶/盐等药物-药物复合物的研究, 不仅对具有水溶性差、生物利用度低、压片性能差、物理/化学不稳定等特点的APIs的溶解度[7]、溶出速率[8]、机械性能[9]、稳定性[10]等物理化学性质改善具有重要意义, 还能克服与传统固定剂量组合(fixed-dose combinations, FDCs)相关的一些问题, 在实现联合用药中发挥重要作用[11]。药物共晶已在美国食品药品监督管理局(US FDA)的监管指南中被引入, 在药物盐难以获得的情况下, 成为潜在的可替代形式和有希望的新型药物开发技术[12]。
本文综述了近年来基于晶体工程设计原理合成的多种药物-药物共晶/盐等药物-药物复合物的研究现状, 包括设计、合成、表征、物理化学性质变化、药理学性质变化、多晶型现象、研发管线等, 为进一步开发新型固态组合药物提供理论支持和启发。
1 基于晶体工程设计的药物-药物共晶研究两种API之间的非共价连接方式可包括:鸡尾酒疗法(使用两种可用的药物)、FDCs、药物-药物共晶(API-API cocrystals)等(图 2)[13]。根据FDA于2018年2月发布的药物共晶分类指南, 药物共晶可被看作是一种特殊的溶剂合物/水合物, 但共晶配体(co-crystal formers or coformers, CCFs)不是溶剂(包括水), 而是难挥发性物质。当CCF为另一种药物分子时, 形成药物-药物共晶。APIs与CCFs在同一晶格中具有明确的化学计量比, 以非共价键、非离子化形式连接, 分子间相互作用方式包括氢键、π-π相互作用、C/N-H…π键相互作用、卤键、范德华力等, 进而形成新的药物复合物[14, 15], 药物-药物共晶还可以多种晶型存在。
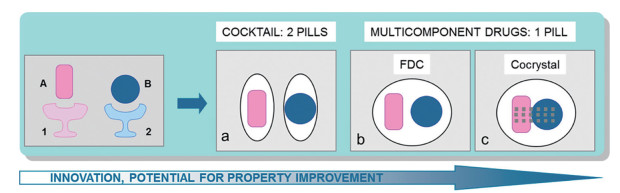
|
Figure 2 Noncovalent linking approaches to polypharmacology, combining the action of two drugs, A and B, which bind to their respective targets, 1 and 2. (a) Cocktails involve the use of two available drugs. Multicomponent drugs are composed of two active pharmaceutical ingredients (APIs) that can either be in the form of (b) a fixed-dose combination (FDC) or (c) an API-API cocrystal[13] |
随着共结晶技术的应用范围日益扩大,药物共晶为工程化的药物固体形态提供了新机遇, 很多性质超越传统固体形态的APIs[16]。药物共晶还为传统的联合治疗中常见的药物间溶解度、稳定性差异、化学相互作用等局限性提供了潜在的解决方案。两种或以上原料药的共结晶可用于提供组合药物,以更好、更有效地应用于现有很多单一疗法不能提供预期治疗效果的复杂疾病[17]。
1.1 药物-药物共晶的设计、合成与表征药物-药物共晶的设计通常是基于药物的化学结构特征、物理化学性质差异、不同种药物之间的药理学协同增效等多种因素的综合考虑, 设计合成新的药物-药物共晶。经典的超分子合成子包括羧酸二聚、酸-吡啶基、苯酚-吡啶基、苯酚-羧酸等[18]。有机晶体中, 氢键相互作用和合成子竞争分析可通过查询剑桥晶体学数据库(Cambridge Structural Database, CSD)实现[19]。
药物-药物共晶的合成方法有很多种, 主要包括溶剂挥发结晶、冷却结晶、研磨/溶剂辅助研磨结晶、反应结晶、热熔挤出结晶、熔融结晶、声波结晶等固态化学实验方法。Bhatt等[20]系统研究了抗艾滋病药物拉米夫定和齐多夫定形成的共晶:2, 4, 6-三氨基嘧啶-齐多夫定(1:2)共晶是基于反向合成分析和合成子预测成功获得; 拉米夫定-齐多夫定(1:1)一水合物共晶的设计基于两点二聚体, 但实际获得的一水合物使得共晶结构中的合成子因水分子的存在而发生轻微改变; 拉米夫定-拉米夫定-3, 5-二硝基水杨酸盐(1:1)一水合物共晶的实际结构与合成子理论预测得到的结果相差很大, 预测部分拉米夫定质子化较为困难; 拉米夫定-糖精(1:1)盐的形成和完全质子化预测较易; 拉米夫定-4-喹啉酮共晶则并不是通过反向合成分析获得, 而是通过共晶筛选获得。通过对5种晶体结构进行对比分析发现, 基于超分子合成子概念提出的反向合成法和共晶筛选的方法相结合是获得药物-药物共晶的理想策略。
药物-药物共晶的表征技术采用多种方法联用(图 3)[21], X-射线单晶衍射(single-crystal X-ray diffraction, SCXRD)是确定晶体结构必不可少的手段, 能够直接给出药物共晶的结合方式的高分辨图像; 对于未得到单晶结构的药物共晶, PXRD及粉末模拟单晶等方法可进一步确定其结构、结晶度等; 傅里叶变换红外光谱(FTIR)[22]和拉曼光谱(Raman)[23]等振动光谱可用于定性分析特定官能团的变化, 反映药物-药物共晶的分子堆叠方式、分子间相互作用以及构象的差异; 固体核磁共振(ssNMR)可用于确定分子间相互作用, 结合PXRD阐明结构; 热失重分析(TGA)和差示扫描量热分析(DSC)对于确定药物-药物共晶的熔点、纯度、分解温度、是否为溶剂合物、是否存在转晶等提供帮助; 动态水蒸气吸附(DVS)实验对于确定药物-药物共晶的吸附动力学, 是否存在水合物/无水合物相互转变等发挥重要作用。
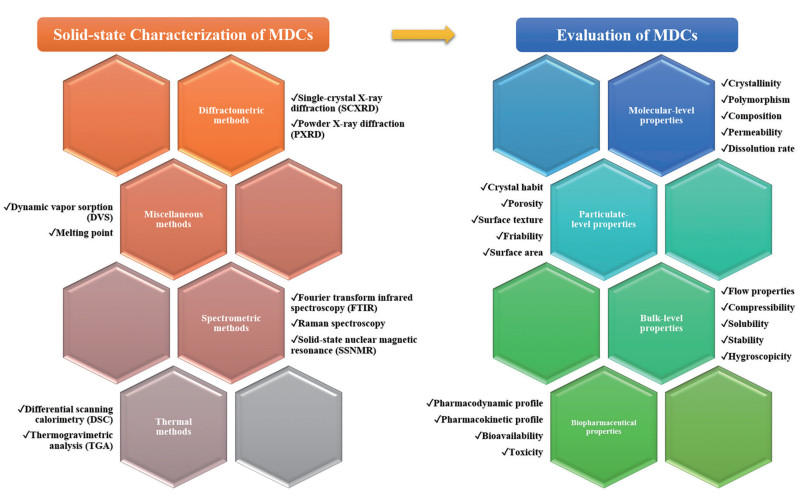
|
Figure 3 Overview of various solid-state characterization methods and evaluation of parameters available for multidrug co-crystals (MDCs) evaluation[21] |
药物共晶能有效改善固态药物的溶解度[24-26]、溶出速率[27, 28]、渗透性[29-31]、吸湿性[32, 33]、体内生物利用度[34, 35]、稳定性[36]、机械性能[28, 37]、熔点[38]、颜色[39-41]等物理化学性质, 且很多药物共晶兼具多种优于APIs的物理化学性质[42, 43]。Chandel等[44]制备了乙酰氯芬酸-扑热息痛(1:1)共晶, 两种药物的溶解度均较药物单体有提高; Jiang等[45]获得了氨苯酚与磺胺、黄酮、木犀草素、咖啡因以等摩尔比形成的药物-药物共晶, 以及氨苯酚与咖啡因、2-羟基苯并噻唑以摩尔比为1:2形成的药物-药物共晶, 6种共晶中, 氨苯酚-咖啡因(1:1)在pH 4.6和pH 6.8的缓冲液中的平衡溶解度是氨苯酚的1.8倍, 在1% tween溶液中的固有溶出速率(intrinsic dissolution rate, IDR)是氨苯酚的1.2倍; Žegarac等[46]合成了西地那非-乙酰水杨酸(1:1)共晶, 其IDR相比于枸橼酸西地那非(重磅药物Viagra®的活性成分)提高了75%; Surov等[47]制备得到双氟尼酸-茶碱(1:1)和双氯芬酸-茶碱(1:1)共晶, 相较于原料药, 两种共晶的表观溶解度均有所提高, 在不同的相对湿度下储存时表现出更优物理稳定性。双氯芬酸-茶碱(1:1)共晶的IDR比双氯芬酸高约1.3倍, 双氟尼酸-茶碱(1:1)共晶的IDR与双氟尼酸相当; Bommaka等[25]研究发现, 作为生物药剂学分类系统(biopharmaceutics classification system, BCS)的IV类药, 恩他卡朋具有水溶性差、渗透率低等特点, 可与乙酰胺、烟酰胺、异烟酰胺、吡嗪酰胺、异烟肼以等摩尔比形成共晶, 与茶碱以等摩尔比形成共晶的一水合物。其中, 恩他卡朋-茶碱的一水合物和恩他卡朋-吡嗪酰胺在pH 7.0的磷酸盐缓冲溶液中溶解度、溶解速率和稳定性相比于恩他卡朋本身均有提高。Franz细胞扩散速率测定结果进一步显示, 恩他卡朋-茶碱一水合物的渗透性较好, 成为物理化学性质稳定、优良的新型固体形态; Kaur等[48]制备了拉莫三嗪与苯巴比妥以等摩尔比形成的药物-药物共晶, 在pH 7.2的磷酸盐缓冲溶液和不含胃蛋白酶的模拟胃液中测定其溶解度和IDR, 结果均为:苯巴比妥 > 拉莫三嗪 > 苯巴比妥-拉莫三嗪共晶, 药物-药物共晶中异二聚体结合力较强, 而母体药物中同二聚体结合力较弱。因此, 苯巴比妥-拉莫三嗪共晶中药物单体的溶解度和溶出速率较母体药物减小, 对于实现药物共晶以低浓度持续释放进而达到控释、缓释等目的具有潜在的应用价值; Li等[7]获得了盐酸小檗碱与杨梅素、二氢杨梅素分别以等摩尔比形成的两种低吸湿性的药物-药物共晶, 盐酸小檗碱-杨梅素共晶中杨梅素在水中溶解度增强, 盐酸小檗碱-杨梅素、盐酸小檗碱-二氢杨梅素中, 两种母体药物对HT-29细胞均具有协同抗癌作用; Li等[10]制备了由吡罗昔康和氯联新组成的8种药物-药物共晶的溶剂合物, 并研究了药学上可接受的乙酸乙酯溶剂合物, 其物理稳定性优良, 可有效应对无水吡罗昔康在高湿条件下易于形成水合物的问题; Haneef等[49]研究发现, 替米沙坦-阿替洛尔共晶在盐诱导的动物模型中, 其溶解度和溶出速率均增加, 致使抗高血压活性更好。
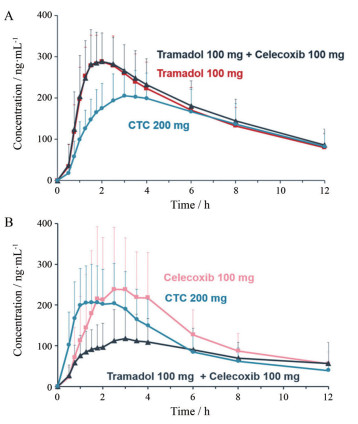
1.3 药物-药物共晶的药代动力学性质研究药物-药物共晶对药物体内吸收动力学[50]等药代动力学性质有改善作用。药物-药物共晶的设计通常会考虑不同种药物的药理学性质, 对作用机制相近或互补的药物进行共结晶设计, 实现协同增效, 具有重要意义。Almansa等[13]报道了由曲马多盐酸盐和塞来昔布以摩尔比为1:1的形式结合形成的药物-药物共晶, 塞来昔布是环氧合酶-2 (cyclo-oxygenase-2, COX-2)的优先抑制剂, 也是一种非甾体抗炎药(nonsteroidal anti-inflammatory drug, NSAID)。曲马多是一种合成的μ-opioid受体激动剂, 用于治疗中/重度疼痛。过饱和研究表明, 该药物-药物共晶中, 难溶的塞来昔布的饱和效应比物理混合中塞来昔布单体的浓度更高(图 4A)。IDR研究表明, 共晶中曲马多的释放速度更慢(图 4B), 而塞来昔布释放速度更快(图 4C), 进而表明该药物-药物共晶的药代动力学行为将得到改善。临床试验数据显示(数据来源:PharmaPendium数据库, 检索日期:2020年5月10日), 与单独使用曲马多或与塞来昔布联用相比, 药物-药物共晶对曲马多的吸收速度和其活性M1代谢物(O-去甲基-曲马多)的形成速度更慢, 最大血浆浓度(Cmax)较低, 且可延长至最大浓度(tmax) (图 5A)。更慢的吸收速率使得药物-药物共晶具有良好的药代动力学性质, 相较于单独使用100mg曲马多或与塞来昔布联用的耐受性更好; 与单独使用塞来昔布相比, 塞来昔布和曲马多联合用药在用药后6h内显著降低了塞来昔布的吸收速率, 药物-药物共晶则具有更快的吸收速度, 且并未观察到对塞来昔布吸收的负干扰, 因此, 该药物-药物共晶消除了与曲马多联用时观察到的塞来昔布的干扰(图 5B)。综上所述, 该药物-药物共晶可有效应对成人急性疼痛严重到需要阿片类镇痛药而其他治疗方法不足的问题, 对治疗疼痛的临床发展具有潜在的应用价值, 且目前该药物-药物共晶已经处于临床Ⅱ期研究阶段; Évora等[51]首次合成了吡嗪酰胺和二氟尼柳以等摩尔比形成的药物-药物共晶, 吡嗪酰胺的使用易使患者产生非多关节痛等不良反应, 吡嗪酰胺-二氟尼柳共晶可作为潜在的联合用药替代疗法; Cheney等[52]制备了美洛昔康-阿司匹林(1:1)共晶, 在pH 7.4的磷酸盐缓冲溶液中, 共晶的溶解度是美洛昔康的44倍, 显示出良好的动态溶解性。药代动力学研究显示, Cmax是美洛昔康的4倍, 与母体药物美洛昔康相比, 达到人体治疗浓度所需时间显著降低。
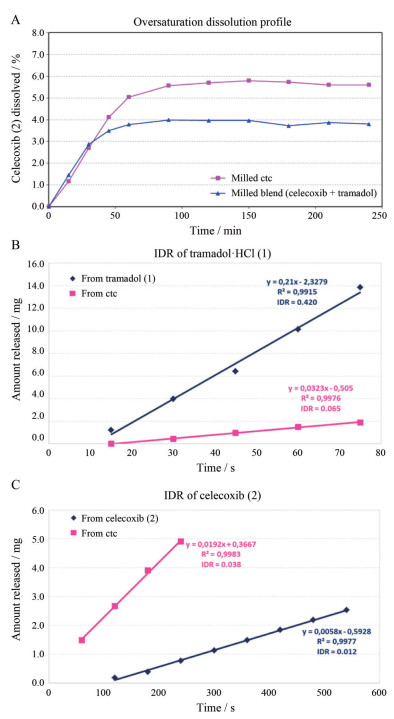
|
Figure 4 Dissolution of celecoxib from tramadol hydrochloride-celecoxib in water at 37 ℃ in comparison to the dissolution from a blend of celecoxib and tramadol·HCl (A), release (amount versus time) of tramadol hydrochloride-celecoxib in water at 37 ℃ in comparison to tramadol·HCl (B) and celecoxib (C) from a pellet with a surface of 0.5 cm2, and calculated IDR in mg/(s×cm2)[13] |
|
Figure 5 Tramadol (A) and celecoxib (B) plasma concentration-time curves in study 101. CTC (Co-crystal of tramadol and celecoxib) 200 mg dose contains 88 mg tramadol and 112 mg celecoxib |
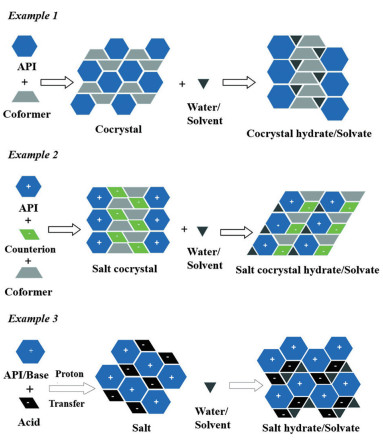
多晶型现象不仅存在于单个API中[53], 也存在于药物-药物共晶复合物中[54, 55], 且可以药物共晶、盐共晶和药物盐, 及其各自的溶剂/水合物等多种形式存在(图 6)[15]。不同晶型的药物-药物共晶, 其结构和性质都具有多样性。作者[36]成功制备了由维生素D2和维生素D3组成的药物-药物共晶, 存在Form A和Form B两种晶型, 室温下, Form A的稳定性优于Form B; He等[55]成功获得了3个等摩尔比的氨苯酚-黄酮共晶(Form A、B、C)和1个摩尔比为1:2的氨苯砜-黄酮共晶(Form D), 其平衡溶解度和IDR存在明显差异, 在pH = 6.8的缓冲溶液中, Form A的IDR约为Form C的8倍; Aitipamula等[56]研究发现, 多晶型现象存在于乙水杨胺和龙胆酸共晶中, 且相较于纯乙水杨胺, 乙水杨胺-龙胆酸共晶的溶出性质提高; Stepanovs等[57]获得了呋塞米-己酮可可碱以等摩尔比形成共晶、共晶一水合物以及共晶丙酮合物等3种不同晶型的共晶, 其氢键网络各异, 呋塞米均作为氢键供体参与氢键形成。
|
Figure 6 Possible multicomponent systems: cocrystals, salt cocrystals, and salts along with their respective solvate/hydrate forms[15] |
根据成盐规则, 当含有碱性基团的药物与含有酸性基团的药物满足△pKa = pKa (碱)-pKa (酸) > 2时, 两种药物结合成盐; 当含有碱性基团的药物与含有酸性基团的药物满足△pKa = pKa (碱)-pKa (酸) < 2时, 两种药物结合成共晶[58-60]。很多药物-药物共晶中, 单药以离子化的形式存在, Vitorino等[61]制备了环丙沙星和诺氟沙星以等摩尔比组成的药物-药物共晶的多水合物, 两种药物均是以离子化状态存在。因此, 基于晶体工程设计的药物-药物复合物的形态常以药物-药物共晶或药物-药物盐的形式存在。当APIs以离子的形式与带有相反电荷的酸或碱离子结合在同一晶格中, 形成新的药物-药物盐。
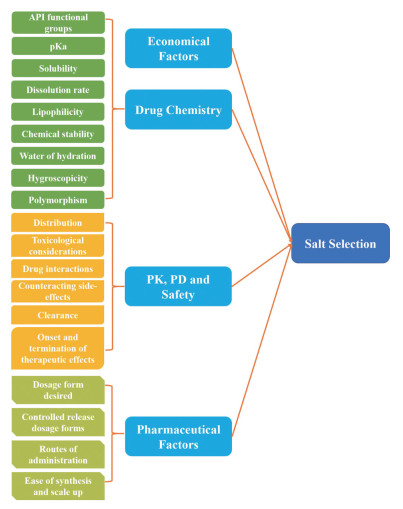
2.1 药物-药物盐的设计、合成与表征药物-药物盐的设计与成盐规则、药物化学结构、药物是否存在联用、PK、PD、安全性等多种因素密切相关[62] (图 7)。药物-药物盐的合成也基于固态化学的方法, 与药物-药物共晶的合成方法相似。
|
Figure 7 Various factors affecting the salt selection[62] |
药物-药物盐的表征同药物-药物共晶一样, 均是采用多种方法表征和综合分析, 其中, 振动光谱仍然发挥重要作用, 红外光谱结合同位素标记策略可有效区分药物盐/共晶[63], 拉曼光谱可根据药物成盐后的特征谱带有效区分药物盐[64]。
2.2 药物-药物盐的物理化学性质研究药物-药物盐不仅对原料无定形的化合物获得更为理想的物理形态发挥重要作用, 还对难溶性APIs的溶解度[64]、溶出性质[65]、体外生物学性质[66]、吸湿性[32]等多种物理化学性质改善发挥重要作用。作者[64]利用成盐的方法, 针对氨苯蝶啶这一用于治疗充血性心力衰竭、肝硬化腹水、肾病综合征等水肿性疾病的利尿剂, 具有水溶性差、生物利用度低且个体差异性显著等特点, 获得了结晶度高、吸湿性低的氨苯喋啶-烟酸、氨苯喋啶-苯甲酸、氨苯喋啶-异烟酸、氨苯喋啶-对甲苯磺酸等多种盐, 在pH 2.0的模拟胃液中, 氨苯喋啶-烟酸等多种盐在水中平衡溶解度和IDR较氨苯喋啶均提高; Putra等[32]研究得到了一种盐型的多组分晶体, 由格列齐特和二甲双胍组成, 格列齐特-二甲双胍盐的水溶性高于格列齐特, 吸湿性低于二甲双胍, 物理化学性质得到改善; Wang等[67]设计合成了甲灭酸/托灭酸与哌嗪分别以摩尔比为2:1和1:1形成的4种低吸湿性药物-药物盐, 其溶解度和溶出性质均优于甲灭酸、托灭酸, 甲灭酸-哌嗪(1:1)盐在水和乙醇混合液中的表观平衡溶解度较甲灭酸提高了约130倍。哌嗪的引入破坏了原甲灭酸/托灭酸晶体中的二聚体形式, 并通过新的离子氢键形成了盐, 哌嗪更易与溶剂分子发生相互作用, 加速药物-药物盐的溶解; Jia等[68]获得了甲布他胺和二甲双胍形成的药物-药物盐的无水晶型, 其吸湿性和加速稳定性均优于二甲双胍, 其溶解度和溶出速率均大于甲布他胺, 这些性质的改变与药物-药物盐的晶体堆叠特征和潜在的氢键位点相关。
2.3 药物-药物盐的药理学性质研究药物-药物盐不仅对于设计多组分药物材料, 改善固态药物的物理化学性质发挥重要作用; 同时对于开发具有联合用药基础的潜在新药提供线索。作者[65]利用成盐的方法, 基于氨苯喋啶[69]、呋塞米[70]均是用于治疗充血性心力衰竭和水肿的袢利尿药, 呋塞米能被用于阻止人体吸收过量的盐, 氨苯蝶啶能被用于保持钾的水平, 两者药理学机制互补, 且剂量相近, 制备得到以等摩尔比结合的氨苯蝶啶-呋塞米盐, 在pH 2.0模拟胃液中, 氨苯蝶啶-呋塞米盐的表观平衡溶解度相较于呋塞米或氨苯喋啶和呋塞米以等摩尔比组成的物理混合分别提高15.3和12.2倍, 固有溶出速率较呋塞米提高9.5倍; Gopi等[8]获得了由抑菌剂诺氟沙星和磺胺噻唑组成的药物-药物盐, 在不同pH缓冲液中溶解度增加, 与药物母体相比, 药物-药物盐的扩散、释放和抑菌能力增强, 药物-药物盐水合物的体外生物学特性增强; Aitipamula等[71]制备得到由奥沙普秦与沙丁胺醇组成的盐, 其溶解速度慢于沙丁胺醇, 为现有的沙丁胺醇制剂具有半衰期短、需频繁给药等问题提出了解决方案, 可作为开发沙丁胺醇控释制剂的潜在选择。
2.4 药物-药物盐的多晶型研究药物-药物盐同样存在多晶型现象。Zhou等[72]获得了由二甲双胍和阿司匹林组成的药物-药物盐, 具有无水和半水合物两种晶型, IDR实验表明, 该药物-药物盐可通过延长二甲双胍的释放时间, 协同增强阿司匹林的溶出速率, 改变单药的溶出性能, 有望为临床用药带来有益的药理作用; Thorat等[73]获得了吉非替尼与呋塞米以等摩尔比形成的药物-药物盐的一水合物, 在140 ℃时, 其一水合物从晶格中释放出水分子, 进而产生新的无水盐, 其溶解度和溶解速率均优于一水合物; Grobelny等[74]制备得到了治疗肺结核药物异烟肼和4-氨基水杨酸以等摩尔比形成的药物-药物共晶, 以及吡嗪酰胺和4-氨基水杨酸以等摩尔比形成的一水合物, 但吡嗪酰胺-4-氨基水杨酸一水合物中, 部分质子发生氢键转移, 且转移程度取决于温度, 更像是一种药物-药物盐。
3 基于晶体工程设计的已上市/在研药物-药物复合物管线研究近年来, 随着药物-药物共晶/盐等药物复合物的研究日渐深入, 多种基于晶体工程设计的药物复合物以共晶的形式上市, 并有很多药物复合物仍处于临床研究阶段, 代表性药物共晶的药物名称、商品名称、原研公司、适应症、最高研发阶段、靶点等细节信息见表 1所示(数据来源:科睿唯安Cortellis数据库和药渡数据库等, 检索日期: 2020年3月12日)。
| Table 1 The overview of the R & D for representative drug cocrystals |
如表 1所示, 已上市共晶药物有5个。其中, 沙库比曲(sacubitril)-缬沙坦(valsartan)共晶, 商品名为Entresto®, 也称LCZ696, 是一种由诺华研发的血管紧张素II受体拮抗剂和中性内肽酶抑制剂, 于2015年在美国首次获批上市, 用于治疗心衰, 于2017年7月获得国家食品药品监督管理局(CFDA)批准上市, 具有降血压和降低心肌内冠状动脉中膜厚和腔径比等多种优点, 各项性能优于水溶性差、生物利用度低的缬沙坦; 依格列净(ipragliflozin)-左旋脯氨酸(L-proline)共晶, 商品名为Suglat®, 原研公司为日本Kotobuki制药有限公司, 是一种葡萄糖钠协同转运蛋白-2 (sodium-glucose cotransporter 2, SGLT-2)抑制剂, 用于治疗胰岛素依赖型/非依赖型糖尿病, 于2014年在日本首次获批; 磷酸西格列汀一水合物(sitagliptin phosphate monohydrate)/伊格列净左旋脯氨酸盐(ipragliflozin L-proline)共晶, 商品名为Sujanu®, 原研公司为安斯泰来, 是一种二肽基肽酶IV (dipeptidyl peptidase IV, DPP-4)抑制剂和SGLT-2抑制剂, 用于治疗非胰岛素依赖型糖尿病, 于2018年在日本首次获批; Ertugliflozin共晶, 商品名为Steglatro®, 由辉瑞公司研发, 是一种SGLT-2抑制剂, 用于治疗非胰岛素依赖型糖尿病, 于2018年在美国首次获批; Caffeine Citrate共晶, 商品名为Cafcit®, 原研公司为勃林格殷格翰, 是一种用于治疗呼吸暂停的药物, 于2003年在美国首次获批。
3.2 在研/终止药物-药物共晶在研的药物共晶也有很多, 具有代表性的为塞来昔布/曲马多盐酸盐, 目前处于临床II期研究阶段, 由YooYoung制药公司研发, 用于治疗疼痛, 是一种环氧合酶2抑制剂/阿片受体激动剂; S-086是由深圳信立泰研发的用于治疗心衰的药物共晶, 目前处于临床I期, 属于血管紧张素受体激动剂/中性内肽酶抑制剂; 沙库比曲/缬沙坦钙钠由苑东生物原研, 用于治疗心衰, 处于临床阶段, 属于血管紧张素II受体拮抗剂/中性内肽酶抑制剂。
终止研发的药物包括由武田制药公司研发的用于治疗类风湿性关节炎的TAK-020, 属于BTK酪氨酸激酶抑制剂。
4 总结与展望近年来, 基于晶体工程设计的新型固态组合药物的开发, 获得了广泛的关注和积极的临床应用。基于晶体工程设计的药物-药物共晶/盐等药物-药物复合物的获得, 对单一API的剂型、物理化学性质、药理学性质、产品质量、临床性能等改善发挥重要作用; 基于协同增效机制, 药物-药物复合物在实现联合用药中具有潜在的优势。同时, 药物-药物复合物的研发也面临挑战, 治疗领域、药物间溶解度差异、药物-药物相互作用等因素仍在设计初期需要重点考虑, 从已有的FDCs药物中选择药物-药物复合物组合或成为可选择的方法之一。
未来, 基于多种疾病领域的化学药、具有多种生物学活性的营养素、无机盐的结构和性质, 设计和开发符合晶体工程设计原理的新型药物-药物、药物-营养素和药物-无机盐复合物, 进而为开发新的组合药物提供实验和理论支持, 新型药学性质改善的药物复合物, 结合纳米技术可制备成纳米级别的药物复合物晶体, 先进的药物递送策略也对新型固态药物复合物的吸收利用提供帮助, 进而在多种疾病的治疗过程中获得更好的治疗效果, 具有重要的意义和广泛的应用前景, 值得更多的研发投入。
作者贡献:王建荣对综述进行了构思、数据分析及文章修改; 彭浡负责了数据库检索, 文献查阅及文章撰写
利益冲突:无利益冲突
| [1] |
Qiao N, Li MZ, Schlindwein W, et al. Pharmaceutical cocrystals:an overview[J]. Int J Pharm, 2011, 419: 1-11. DOI:10.1016/j.ijpharm.2011.07.037 |
| [2] |
Sokal A, Pindelska E. Pharmaceutical cocrystals as an opportunity to modify drug properties:from the idea to application:a review[J]. Curr Pharm Design, 2018, 24: 1357-1365. DOI:10.2174/1381612824666171226130828 |
| [3] |
Aitipamula S, Banerjee R, Bansal AK, et al. Polymorphs, salts, and cocrystals:what's in a name?[J]. Cryst Growth Des, 2012, 12: 2147-2152. DOI:10.1021/cg3002948 |
| [4] |
Steed JW. The role of co-crystals in pharmaceutical design[J]. Trends Pharmacol Sci, 2013, 34: 185-193. DOI:10.1016/j.tips.2012.12.003 |
| [5] |
Miroshnyk I, Mirza S, Sandler N. Pharmaceutical co-crystals-an opportunity for drug product enhancement[J]. Expert Opin Drug Del, 2009, 6: 333-341. DOI:10.1517/17425240902828304 |
| [6] |
Thakuria R, Delori A, Jones W, et al. Pharmaceutical cocrystals and poorly soluble drugs[J]. Int J Pharm, 2013, 453: 101-125. DOI:10.1016/j.ijpharm.2012.10.043 |
| [7] |
Li PZ, Ramaiah T, Zhang M, et al. Two cocrystals of berberine chloride with myricetin and dihydromyricetin:crystal structures, characterization, and antitumor activities[J]. Cryst Growth Des, 2020, 20: 157-166. DOI:10.1021/acs.cgd.9b00939 |
| [8] |
Gopi SP, Ganguly S, Desiraju GR. A drug-drug salt hydrate of norfloxacin and sulfathiazole:enhancement of in vitro biological properties via improved physicochemical properties[J]. Mol Pharm, 2016, 13: 3590-3594. DOI:10.1021/acs.molpharmaceut.6b00320 |
| [9] |
Lin RZ, Sun PJ, Tao Q, et al. Mechanism study on stability enhancement of adefovir dipivoxil by cocrystallization:degradation kinetics and structure-stability correlation[J]. Eur J Pharm Sci, 2016, 85: 141-148. DOI:10.1016/j.ejps.2015.10.006 |
| [10] |
Li DX, Li J, Deng ZW, et al. Piroxicam-clonixin drug-drug cocrystal solvates with enhanced hydration stability[J]. CrystEngComm, 2019, 21: 4145-4149. DOI:10.1039/C9CE00666D |
| [11] |
Edward RTT, Julio ZS, Srinivasulu A, et al. Multi-component crystals[M]. Berlin, Boston: De Gruyter Press, 2018: 24-25.
|
| [12] |
Thakuria R, Sarma B. Drug-drug and drug-nutraceutical cocrystal/salt as alternative medicine for combination therapy:a crystal engineering approach[J]. Crystals, 2018, 8: 1-39. |
| [13] |
Almansa C, Mercè R, Tesson N, et al. Co-crystal of tramadol hydrochloride-celecoxib (ctc):a novel api-api co-crystal for the treatment of pain[J]. Cryst Growth Des, 2017, 17: 1884-1892. DOI:10.1021/acs.cgd.6b01848 |
| [14] |
Bond AD. What is a co-crystal?[J]. CrystEngComm, 2007, 9: 833-834. DOI:10.1039/b708112j |
| [15] |
Schultheiss N, Newman A. Pharmaceutical cocrystals and their physicochemical properties[J]. Cryst Growth Des, 2009, 9: 2950-2967. DOI:10.1021/cg900129f |
| [16] |
Shah K, Parmar VK. Application of cocrystallization approach in drug development:recent patents review[J]. Recent Pat Nanotech, 2018, 12: 143-154. DOI:10.2174/1872210512666180221153312 |
| [17] |
Srivastava D, Fatima Z, Kaur CD. Multicomponent pharmaceutical cocrystals:a novel approach for combination therapy[J]. Mini Rev Med Chem, 2018, 18: 1160-1167. DOI:10.2174/1389557518666180305163613 |
| [18] |
Desiraju GR. Supramolecular synthons in crystal engineering-a new organic synthesis[J]. Angew Chem Int Edit, 1995, 34: 2311-2327. DOI:10.1002/anie.199523111 |
| [19] |
Khan M, Enkelmann V, Brunklaus G. O-H···N heterosynthon:a robust supramolecular unit for crystal engineering[J]. Cryst Growth Des, 2009, 9: 2354-2362. DOI:10.1021/cg801249b |
| [20] |
Bhatt PM, Azim Y, Thakur TS, et al. Co-crystals of the anti-hiv drugs lamivudine and zidovudine[J]. Cryst Growth Des, 2009, 9: 951-957. DOI:10.1021/cg8007359 |
| [21] |
Thipparaboina R, Kumar D, Chavan RB, et al. Multidrug co-crystals:towards the development of effective therapeutic hybrids[J]. Drug Discov Today, 2016, 21: 481-490. DOI:10.1016/j.drudis.2016.02.001 |
| [22] |
Saha S, Desiraju GR. Acid···amide supramolecular synthon in cocrystals:from spectroscopic detection to property engineering[J]. J Am Chem Soc, 2018, 140: 6361-6373. DOI:10.1021/jacs.8b02435 |
| [23] |
Peng B, He HY, Li MQ, et al. Comparison of the crystal structures and physicochemical properties of novel resveratrol cocrystals[J]. Acta Crystallogr B, 2019, 75: 1186-1196. DOI:10.1107/S2052520619013477 |
| [24] |
Kuminek G, Cao F, da Rocha ABD, et al. Cocrystals to facilitate delivery of poorly soluble compounds beyond-rule-of-5[J]. Adv Drug Deliv Rev, 2016, 101: 143-166. DOI:10.1016/j.addr.2016.04.022 |
| [25] |
Bommaka MK, Mannava MKC, Suresh K, et al. Entacapone:improving aqueous solubility, diffusion permeability, and cocrystal stability with theophylline[J]. Cryst Growth Des, 2018, 18: 6061-6069. DOI:10.1021/acs.cgd.8b00921 |
| [26] |
Goud NR, Gangavaram S, Suresh K, et al. Novel furosemide cocrystals and selection of high solubility drug forms[J]. J Pharm Sci, 2012, 101: 664-680. DOI:10.1002/jps.22805 |
| [27] |
Arafa MF, El-Gizawy SA, Osman MA, et al. Co-crystallization for enhanced dissolution rate of nateglinide:in vitro and in vivo evaluation[J]. J Drug Deliv Sci Tec, 2017, 38: 9-17. DOI:10.1016/j.jddst.2017.01.005 |
| [28] |
He HY, Zhang Q, Li MQ, et al. Modulating the dissolution and mechanical properties of resveratrol by cocrystallization[J]. Cryst Growth Des, 2017, 17: 3989-3996. DOI:10.1021/acs.cgd.7b00637 |
| [29] |
Rosa J, Machado TC, da Silva AK, et al. Isoniazid-resveratrol cocrystal:a novel alternative for topical treatment of cutaneous tuberculosis[J]. Cryst Growth Des, 2019, 19: 5029-5036. DOI:10.1021/acs.cgd.9b00313 |
| [30] |
Sanphui P, Devi VK, Clara D, et al. Cocrystals of hydrochlorothiazide:solubility and diffusion/permeability enhancements through drug-coformer interactions[J]. Mol Pharm, 2015, 12: 1615-1622. DOI:10.1021/acs.molpharmaceut.5b00020 |
| [31] |
Seo JW, Hwang KM, Lee SH, et al. Preparation and characterization of adefovir dipivoxil-stearic acid cocrystal with enhanced physicochemical properties[J]. Pharm Dev Technol, 2018, 23: 890-899. DOI:10.1080/10837450.2017.1334664 |
| [32] |
Putra OD, Furuishi T, Yonemochi E, et al. Drug-drug multicomponent crystals as an effective technique to overcome weaknesses in parent drugs[J]. Cryst Growth Des, 2016, 16: 3577-3581. DOI:10.1021/acs.cgd.6b00639 |
| [33] |
Lu J, Rohani S. Synthesis and preliminary characterization of sulfamethazine-theophylline co-crystal[J]. J Pharm Sci, 2010, 99: 4042-4047. DOI:10.1002/jps.22142 |
| [34] |
Zhu BQ, Zhang Q, Wang JR, et al. Cocrystals of baicalein with higher solubility and enhanced bioavailability[J]. Cryst Growth Des, 2017, 17: 1893-1901. DOI:10.1021/acs.cgd.6b01863 |
| [35] |
Chen Y, Li L, Yao J, et al. Improving the solubility and bioavailability of apixaban via apixaban-oxalic acid cocrystal[J]. Cryst Growth Des, 2016, 16: 2923-2930. DOI:10.1021/acs.cgd.6b00266 |
| [36] |
Wang JR, Yu QH, Dai WJ, et al. Drug-drug co-crystallization presents a new opportunity for the development of stable vitamins[J]. Chem Commun, 2016, 52: 3572-3575. DOI:10.1039/C5CC10297A |
| [37] |
Friscic T, Jones W. Benefits of cocrystallisation in pharmaceutical materials science:an update[J]. J Pharm Pharmacol, 2010, 62: 1547-1559. DOI:10.1111/j.2042-7158.2010.01133.x |
| [38] |
Aaker y CB, Forbes S, Desper J. Using cocrystals to systematically modulate aqueous solubility and melting behavior of an anticancer drug[J]. J Am Chem Soc, 2009, 131: 17048-17049. DOI:10.1021/ja907674c |
| [39] |
Li MQ, Li Z, Zhang Q, et al. Fine-tuning the colors of natural pigment emodin with superior stability through cocrystal engineering[J]. Cryst Growth Des, 2018, 18: 6123-6132. DOI:10.1021/acs.cgd.8b01002 |
| [40] |
Sangtani E, Mandal SK, Sreelakshmi AS, et al. Salts and cocrystals of furosemide with pyridines:differences in π-stacking and color polymorphism[J]. Cryst Growth Des, 2017, 17: 3071-3087. DOI:10.1021/acs.cgd.6b01868 |
| [41] |
Sangtani E, Sahu SK, Thorat SH, et al. Furosemide cocrystals with pyridines:an interesting case of color cocrystal polymorphism[J]. Cryst Growth Des, 2015, 15: 5858-5872. DOI:10.1021/acs.cgd.5b01240 |
| [42] |
Wang N, Xie C, Lu HJ, et al. Cocrystal and its application in the field of active pharmaceutical ingredients and food ingredients[J]. Curr Pharm Design, 2018, 24: 2339-2348. DOI:10.2174/1381612824666180522102732 |
| [43] |
Xia YM, Chen H, Ye TJ, et al. Investigations of solid states for flavonoids from traditional chinese medicine[J]. Acta Pharm Sin, 2019, 54: 1190-1199. |
| [44] |
Chandel N, Gupta V, Pandey A, et al. Co-crystalization of aceclofenac and paracetamol and their characterization[J]. Int J Pharm Life Sci, 2011, 2: 1020-1028. |
| [45] |
Jiang LL, Huang Y, Zhang Q, et al. Preparation and solid-state characterization of dapsone drug-drug co-crystals[J]. Cryst Growth Des, 2014, 14: 4562-4573. DOI:10.1021/cg500668a |
| [46] |
Žegarac M, Lekšić E, Šket P, et al. A sildenafil cocrystal based on acetylsalicylic acid exhibits an enhanced intrinsic dissolution rate[J]. CrystEngComm, 2014, 16: 32-35. DOI:10.1039/C3CE42013B |
| [47] |
Surov AO, Voronin AP, Manin AN, et al. Pharmaceutical cocrystals of diflunisal and diclofenac with theophylline[J]. Mol Pharm, 2014, 11: 3707-3715. DOI:10.1021/mp5004652 |
| [48] |
Kaur R, Cavanagh KL, Rodriguez-Hornedo N, et al. Multidrug cocrystal of anticonvulsants:influence of strong intermolecular interactions on physiochemical properties[J]. Cryst Growth Des, 2017, 17: 5012-5016. DOI:10.1021/acs.cgd.7b00741 |
| [49] |
Haneef J, Chadha R. Drug-drug multicomponent solid forms:cocrystal, coamorphous and eutectic of three poorly soluble antihypertensive drugs using mechanochemical approach[J]. AAPS PharmSciTech, 2017, 18: 2279-2290. DOI:10.1208/s12249-016-0701-1 |
| [50] |
Weyna DR, Cheney ML, Shan N, et al. Improving solubility and pharmacokinetics of meloxicam via multiple-component crystal formation[J]. Mol Pharm, 2012, 9: 2094-2102. DOI:10.1021/mp300169c |
| [51] |
vora AOL, Castro RAE, Maria TMR, et al. Pyrazinamide-diflunisal:a new dual-drug co-crystal[J]. Cryst Growth Des, 2011, 11: 4780-4788. DOI:10.1021/cg200288b |
| [52] |
Cheney ML, Weyna DR, Shan N, et al. Coformer selection in pharmaceutical cocrystal development:a case study of a meloxicam aspirin cocrystal that exhibits enhanced solubility and pharmacokinetics[J]. J Pharm Sci, 2011, 100: 2172-2181. DOI:10.1002/jps.22434 |
| [53] |
Cherukuvada S, Nangia A. Eutectics as improved pharmaceutical materials:design, properties and characterization[J]. Chem Commun, 2014, 50: 906-923. DOI:10.1039/C3CC47521B |
| [54] |
Swapna B, Maddileti D, Nangia A. Cocrystals of the tuberculosis drug isoniazid:polymorphism, isostructurality, and stability[J]. Cryst Growth Des, 2014, 14: 5991-6005. DOI:10.1021/cg501182t |
| [55] |
He HY, Jiang LL, Zhang Q, et al. Polymorphism observed in dapsone-flavone cocrystals that present pronounced differences in solubility and stability[J]. CrystEngComm, 2015, 17: 6566-6574. DOI:10.1039/C5CE01208B |
| [56] |
Aitipamula S, Chow PS, Tan RBH. Trimorphs of a pharmaceutical cocrystal involving two active pharmaceutical ingredients:potential relevance to combination drugs[J]. CrystEngComm, 2009, 11: 1823-1827. DOI:10.1039/B904616J |
| [57] |
Stepanovs D, Mishnev A. Multicomponent pharmaceutical cocrystals:furosemide and pentoxifylline[J]. Acta Crystallogr C, 2012, 68. |
| [58] |
Cruz-Cabeza AJ. Acid-base crystalline complexes and the pKa rule[J]. CrystEngComm, 2012, 14: 6362-6365. DOI:10.1039/c2ce26055g |
| [59] |
Childs SL, Stahly GP, Park A. The salt-cocrystal continuum: the influence of crystal structure on ionization state[J]. Mol Pharm, 2007, 4: 323-338. DOI:10.1021/mp0601345 |
| [60] |
Kumar SS, Thakuria R, Nangia A. Pharmaceutical cocrystals and a nitrate salt of voriconazole[J]. CrystEngComm, 2014, 16: 4722-4731. DOI:10.1039/C3CE42324G |
| [61] |
Pinto Vitorino G, Sperandeo NR, Caira MR, et al. A supramolecular assembly formed by heteroassociation of ciprofloxacin and norfloxacin in the solid state:co-crystal synthesis and characterization[J]. Cryst Growth Des, 2013, 13: 1050-1058. DOI:10.1021/cg301299e |
| [62] |
Gupta D, Bhatia D, Dave V, et al. Salts of therapeutic agents:chemical, physicochemical, and biological considerations[J]. Molecules, 2018, 23. |
| [63] |
Iwata K, Karashima M, Ikeda Y. Isotope-edited infrared spectroscopy for efficient discrimination between pharmaceutical salts and cocrystals[J]. Mol Pharm, 2017, 14: 2350-2358. DOI:10.1021/acs.molpharmaceut.7b00226 |
| [64] |
Peng B, Zhang ZY, Wang JR, et al. Confocal raman micro-spectral evidence and physicochemical evaluation of triamterene salts[J]. Analyst, 2019, 144: 530-535. DOI:10.1039/C8AN01579A |
| [65] |
Peng B, Wang JR, Mei XF. Triamterene-furosemide salt:structural aspects and physicochemical evaluation[J]. Acta Crystallogr B, 2018, 74: 738-741. DOI:10.1107/S2052520618013185 |
| [66] |
Gopi SP, Ganguly S, Desiraju GR. A drug-drug salt hydrate of norfloxacin and sulfathiazole:enhancement of in vitro biological properties via improved physicochemical properties[J]. Mol Pharm, 2016, 13: 3590-3594. DOI:10.1021/acs.molpharmaceut.6b00320 |
| [67] |
Wang XY, Xu SJ, Jia LN, et al. Drug-drug salts of mefenamic acid\tolfenamic acid and piperazine to improve physicochemical properties for potential veterinary use[J]. CrystEngComm, 2019, 21: 5284-5291. DOI:10.1039/C9CE00781D |
| [68] |
Jia LN, Wu SG, Gong JB. A tolbutamide-metformin salt based on antidiabetic drug combinations:synthesis, crystal structure analysis and pharmaceutical properties[J]. Acta Crystallogr C, 2019, 75: 1250-1258. DOI:10.1107/S2053229619010647 |
| [69] |
Li AY, Xu LL, Chen JM, et al. Solubility and dissolution rate enhancement of triamterene by a cocrystallization method[J]. Cryst Growth Des, 2015, 15: 3785-3791. DOI:10.1021/acs.cgd.5b00439 |
| [70] |
Murugan PS, Selvam GS. Furosemide and potassium chloride-induced alteration in protein profile of left ventricle and its associated risk for sudden cardiac death[J]. Toxicol Int, 2014, 21: 1-7. DOI:10.4103/0971-6580.128781 |
| [71] |
Aitipamula S, Wong ABH, Chow PS, et al. Novel solid forms of oxaprozin:cocrystals and an extended release drug-drug salt of salbutamol[J]. Rsc Adv, 2016, 6: 34110-34119. DOI:10.1039/C6RA01802E |
| [72] |
Zhou WX, Zhao HW, Chen HH, et al. Characterization of drug-drug salt forms of metformin and aspirin with improved physicochemical properties[J]. CrystEngComm, 2019, 21: 3770-3773. DOI:10.1039/C9CE00377K |
| [73] |
Thorat SH, Sahu SK, Patwadkar MV, et al. Drug-drug molecular salt hydrate of an anticancer drug gefitinib and a loop diuretic drug furosemide:an alternative for multidrug treatment[J]. J Pharm Sci, 2015, 104: 4207-4216. DOI:10.1002/jps.24651 |
| [74] |
Grobelny P, Mukherjee A, Desiraju GR. Drug-drug co-crystals:temperature-dependent proton mobility in the molecular complex of isoniazid with 4-aminosalicylic acid[J]. CrystEngComm, 2011, 13: 4358-4364. DOI:10.1039/c0ce00842g |
 2020, Vol. 55
2020, Vol. 55


