2. 江苏省中药药效与安全性重点实验室, 江苏 南京 210023;
3. 江苏省中医药防治肿瘤协同创新中心, 江苏 南京 210023
2. Jiangsu Provincial Key Laboratory of Efficacy and Safety of Traditional Chinese Medicine, Nanjing 210023, China;
3. Jiangsu Collaborative Innovation Center for Traditional Chinese Medicine Prevention and Treatment of Cancer, Nanjing 210023, China
如今人们快节奏的生活和不健康的生活习惯使得恶性肿瘤患者逐渐趋于年轻化, 癌症的发病率和死亡率逐年攀升, 已经成为严峻的社会负担[1]。肿瘤分子靶向治疗与免疫治疗、放疗以及化疗共同构成了现代肿瘤药物治疗的主要手段[2]。众所周知, 经典的广谱类抗癌药物以及放疗对肿瘤细胞有一定杀伤力, 但其损害机体正常细胞, 不良反应大且容易耐药。与此相比, 多肽类分子由于不良反应轻、分子质量小和靶向性强等特点逐渐成为抗肿瘤新药、诊断探针及靶向递送研究的重要方向[3], 其相关研究方式和方法备受学者关注。本文综述了基于传统色谱分离、肽组学、噬菌体展示、生物表型以及人工智能等技术的抗癌肽筛选策略和方法(部分肽药的临床研究见表 1), 以期为更多新型高效肿瘤靶向肽的发现提供方法学依据和参考。
| Table 1 Several peptides through different screening approaches in preclinical phase study. mAb: Monoclonal antibody |
基于抗肿瘤多肽在分子质量、生物相容性以及靶向性方面的独特优势, 抗肿瘤多肽一直是抗肿瘤领域研究的热点[4]。众所周知, 动物进化出复杂的天然防御系统以抵御外来微生物入侵和环境捕食者。两栖及爬行动物外在防御依赖于腺体分泌的毒液, 这些毒液中含有丰富的天然活性多肽, 作用于G蛋白偶联受体[5]或离子通道[6], 表现出抗肿瘤活性。短尾地鼠(Blarina brevicauda)含有的山梨素麻痹肽(SOR-C13)是瞬时阳离子亚家族V6通道(transient receptor potential cation channel, subfamily V member 6, TRPV6)的高亲和力拮抗剂, 能在低浓度下抑制TRPV6, 在卵巢癌和乳腺癌的移植模型中抑制肿瘤增殖[7]。体内荧光标记实验显示SOR-C13肽可以快速被卵巢移植瘤摄取, 20~30 min时可以看到信号值, 约1 h达到最大值, 并且至少保持72 h[8]。在23名上皮癌患者的Ⅰ期临床试验中[9], SOR-C13肽可有效减缓解疾病进程, 展现出抗肿瘤活性。在滑尾蝎(Leiurus quinquestriatus hebraeus)的毒液中含有一种氯离子通道阻断肽[6], 已报道其可以作为癌症诊断探针以及化疗时的治疗性递送肽[10]。
由Esperance Pharmaceuticals公司开发的EP-100是一种合成的裂解肽, 靶向癌细胞上的促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)受体。这种合成肽由GnRH天然配体与带有18个氨基酸的阳离子α-螺旋裂解肽连接而成。阳离子肽与带负电荷的肿瘤细胞膜相互作用, 并且在几分钟内裂解细胞膜使细胞死亡[11]。在原位癌小鼠模型中, EP-100促使卵巢癌细胞数量显著下降, 减缓移植肿瘤模型中的肿瘤生长速度, 并解决了L-氨基酸肽在体内降解的问题, 为实体肿瘤的治疗提供了安全可行的替代方案[12]。
近年来, 肽体类药物也备受关注。肽体(peptibodies)是将具有生物活性的多肽与抗体免疫球蛋白G (immunoglobulin G, IgG)的铰链区和Fc段进行基因重组而表达的融合蛋白。肽体呈现出所融合多肽的生物活性和靶标亲和性, 而且还具有IgG Fc段的功能特点[13], 能够显著延长其血浆半衰期以及结合、活化巨噬细胞和自然杀伤细胞, 从而提高对肿瘤的免疫杀伤效应。此外, 肽体的分子质量是单克隆抗体的1/3, 对实体肿瘤组织有一定的渗透性。Torchia等[14]通过噬菌体展示技术筛选得到靶向淋巴瘤的特异性肽, 与抗体Fc融合的肽体可以刺激巨噬细胞吞噬肿瘤, 并在鼠移植瘤模型中有效清除人淋巴瘤。
多肽偶联药物(peptide drug conjugate, PDC)是另外一种新颖的肽药改造形式。通过在小分子药物的特定位点上偶联靶向性多肽以增强药物肿瘤靶向性, 或是在小分子上偶联具有治疗作用的多肽, 在稳定小分子药物的同时增强治疗效果。一种肿瘤穿透肽iRGD (CRGDK/RGPD/EC)与特异性表达在肿瘤血管内皮上的αv整合素结合, iRGD肽进入肿瘤后被水解成CRGDK/R, C端暴露后进一步与NRP-1 (neuropilin-1)亲和, 触发组织穿透, iRGD偶联多种化疗药物(如多柔比星)后展现出比单独化疗药更优的抗肿瘤效果[15]。有报道抗αvβ3整合素肽模拟物C (anti-αvβ3 integrin peptidomimetic, AmpRGD)与酪氨酸激酶抑制剂舒尼替尼共价结合形成的C-AmpRGD-舒尼替尼缀合物, 可通过内吞作用被人黑色素瘤细胞选择性内化, 比舒尼替尼更有效地减少癌细胞的增殖、迁移和侵袭, 在等摩尔剂量的条件下, 多肽偶联物可更有效地减少小鼠异种移植的黑色素瘤生长[16]。
2 天然抗肿瘤肽的提取分离和鉴定方法 2.1 活性导向的生化及色谱分离方法多肽本质上属于低分子蛋白, 根据其理化性质(电荷、等电点、亲疏水性和分子质量大小等), 常用的提取方法有化学萃取法、酶解法、超滤法和层析法等; 分离方法有离子交换、分子排阻、反相、亲和色谱法以及电泳法; 序列鉴定多采用基因测序和质谱法等。
对于来自于大分子的多肽, 常采用酶解法制备多肽组分。例如, 通过酶解和凝胶层析法分离纯化出蜈蚣总蛋白中的小分子抗肿瘤多肽, 该肽能诱导细胞凋亡并停滞于G2/M期, 减少有丝分裂, 从而抑制肿瘤生长。也有报道采用正交实验设计, 以青蛤酶解液对前列腺癌PC-3细胞的增殖抑制率为指标, 探究提取多肽的最佳酶解温度、料液比、酶解时间以及加酶量, 经凝胶层析和噻唑蓝指示剂(thiazolyl blue tetrazolium bromide, MTT)法分析体外筛选得到青蛤抗肿瘤多肽。
根据多肽的分子质量和脂溶性, 常采用凝胶过滤和反色谱的方式进行分离纯化。Zhang等[17]采用有机溶剂沉淀法提取蛇毒肽, 经过Sephadex G-50色谱和十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)分离得到Saxis肽, 对HeLa、SMMC-7721和SGC-7901等多种肿瘤细胞具有抑制活性, 其半数抑制率(50% inhibitory concentration, IC50)为54~66 μg·mL-1。对于蜂毒肽, 其在蜂毒溶液中以四聚体的形式存在, 与磷脂酶A2分子质量大小相近, 单一色谱分离纯化困难, 但是通过多维色谱的方式, 如Sephadex凝胶偶联反相色谱, 能够获得高纯度抗肿瘤蜂毒肽。
靶点辅助鉴定技术能够实现高通量的定量鉴定, 显著提高天然产物靶点鉴定的效率和准确性, 常用方法包括氨基酸稳定同位素标记(stable isotope labeling by amino acids in cell culture, SILC)、同位素标签相对与绝对定量(isobaric tags for relative and absolute quantification, ITRAQ)、串联质量标记(tandem mass tag, TMT)以及小分子药物靶标识别技术(drug affinity responsive target stability, DARTS)等, 为鉴定“多成分、多靶点”的中药复杂体系的靶标提供了新的思路。
2.2 基于高分辨质谱和转录组测序的天然多肽组鉴定近年来高分辨质谱技术和基因测序技术快速发展和应用, 极大地拓宽了天然多肽研究的广度和深度(图 1)[18, 19]。多肽组学方法源于鸟枪法(shot-gun)蛋白组学, 但样本前处理方面(多肽的提取和纯化)存在差异。在反相色谱-质谱分析方面, 其着重使用纳升液相和高分辨质谱(linear ion trap quadrupole-mass spectrometry, LTQ-MS)、QE-orbitrap (quadrupole exactive orbitrap)和MALDI-TOF (matrix assisted laser desorption/ionization-time of flight mass spectrometry)串联平台。当前多采用Q-Exactive质谱作为肽组分分析首选质谱平台, 但对于少量分子质量较大的毒肽, 电喷雾质谱(electron spray ionization-mass spectrometer, ESI-MS)可能存在漏检现象, 也需采用MALDI-TOF质谱平台进行补充分析。Ma等[20]采用NanoLC-orbitrap-LTQ技术对中华大蟾蜍分泌毒液进行分析, 鉴定了1 035个蟾酥毒肽序列, 分子质量在700~5 000 Da之间, 其中2 000 Da左右的多肽含量最高, 结合活性评价从蟾毒中筛选抗肿瘤多肽。由于中华大蟾蜍的基因序列尚不清楚, 研究者使用了转录组测序的技术建立了蛋白序列库(coding sequence, CDS), 与常规两栖动物基因序列库相比, 能够鉴定出更多的蟾毒多肽。Dutertre等[21]将转录组测序与高分辨质谱串联, 共鉴定出13个基因超家族的上千条芋螺肽序列, 还发现了N端和C端发生变化以及磷酸化修饰的芋螺毒肽, 为高通量筛选抗肿瘤肽提供了一种新思路。
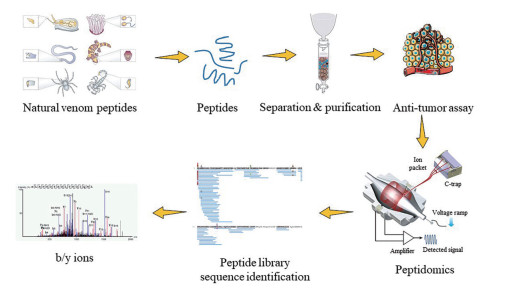
|
Figure 1 Screening anti-tumor peptides through peptidomics. Secretion of several species (cone snail, sea anemone, snake, gila monster, spider, and sorption) which was separated and purified have revealed anti-tumor activity. A strategy that combines liquid chromatography-mass spectrometry, RNA sequencing, and bioinformation analysis was applied to unravel the peptides in the natural venom secretions. b/y ions: In the secondary spectrum, the parent ion collides with inert gas, breaking the peptide bond in the peptide chain, forming a series of product ions, namely N-terminal fragment ions (b series) and C-terminal fragment ions (y series) |
1985年, Smith等[22]通过基因工程将一段外源的肽序列展示在丝状噬菌体的表面, 1988年又将合成的随机序列的寡核苷酸片段克隆到丝状噬菌体上, 表达后每个噬菌体粒子的表面展示一种肽段, 所有这些展示不同肽段的噬菌体构成了噬菌体展示肽库, 从中筛选得到了与特定蛋白结合的结合肽(图 2)。由于噬菌体表达肽与编码基因直接相关, 扩增和克隆后很容易得到DNA序列, 由此建立了噬菌体表面展示的随机肽库[23, 24]。该技术广泛应用于抗肿瘤多肽的筛选研究[25, 26]。
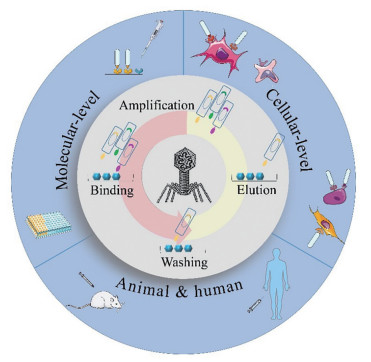
|
Figure 2 Approaches in capturing high affinity peptide through display screening. Molecular-level screening: Homogenous in situ screening requires only the specific target to be coated on a 96-well; Cellular-level screening: In vitro cell screening offers high-throughput approach for identifying multiple peptides that bind specifically to a single cell (i.e., cell lines or primary cells) can be performed on adherent cells (live or fixed); Animal & human screening: By performing biopanning and selection in a living animal, organ-specific peptides could be isolated |
原位筛选是将特定的靶标蛋白包被在96孔板上, 因仅接触单一靶标, 多肽筛选过程不易受到非特异性因素干扰。Kim等[27]受亮氨酸拉链结构的启发, 设计了一种高亲和力多肽APTEDB (aptides modified by extradomain B), Kd为65 nmol·L-1, 该肽包含1个稳定支架结构(色氨酸拉链)和2个靶结合区域。通过噬菌体原位展示技术, 获得高结合亲和力的多肽配体。
3.2 细胞水平筛选该研究策略以正常细胞为对照, 筛选出与癌细胞高亲和的活性多肽。这些多肽往往结合于肿瘤细胞高表达的组分或表面受体[28-30], 从而具有一定的肿瘤靶向性。Qin等[31]利用噬菌体展示技术, 将荷瘤小鼠Gr-1和CD11b标记的脾细胞与肽噬菌体展示文库于4 ℃孵育1 h后洗脱扩增, 发现新型治疗性骨髓来源的抑制性细胞(myeloid-derived suppressor cell, MDSC)特异性结合肽, 该肽在多种肿瘤模型中具有清除MDSC细胞并提高抗肿瘤免疫的作用。
3.3 整体水平筛选通过静脉注射将肽噬菌体文库打入动物体内, 从皮下肿瘤组织提取噬菌体并扩增。经过3~5轮反复生物淘选后, 与肿瘤组织特异性结合的噬菌体显著增加, 富集后得到靶向肽。通过这种方法已经筛选出多种与肿瘤结合的多肽(如表 2中带有RGD和NGR序列的抗肿瘤肽)。为了减少小鼠和人类之间物种差异的相容性, Arap等[32]进行了人体噬菌体展示肽筛选, 发现SMSIARL肽可以特异性地结合于前列腺脉管系统中, 其对前列腺的特异性是其他器官的10~15倍, 初步表明在人体可以进行噬菌体展示肽筛选研究。
| Table 2 Anti-tumor peptides targeting tumor microenvironment through phage display screening. LC50: Lethal concentration 50%; Kd: Dissociation constant; MC: Mander coefficient; MMP: Matrix metalloproteinase; FN: Fibronectin |
肿瘤微环境包括肿瘤及其周围的间质细胞和细胞外基质, 肿瘤细胞与微环境的关系犹如“种子”和“土壤”, 开发肿瘤微环境相关药物是控制肿瘤转移与侵袭的关键[33]。
4.1 基于肿瘤血管的多肽筛选血管靶向肽的经典例子就是RGD肽, 它是一种含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)的三肽序列, 可被整合素特异性识别, 并激活传导通路, 在细胞黏附、侵袭、增殖、存活和凋亡等过程中执行关键的调控功能。Rouslahti等[34]通过体内噬菌体展示技术分离出了环状肽CDCRGDCFC, 该肽选择性地结合αvβ3和αvβ5整合素, 归巢于肿瘤血管系统(表 2)。还有报道通过M13肽噬菌体展示文库[25], 在体内筛选出BCP肽(blood circulation-prolonging peptides, BCP), 鉴定出其含有RGD序列, RGD与血小板的特异性结合提高了BCP肽的血液滞留率。将BCP肽制成包载多柔比星的纳米粒, 可改善多柔比星的药代动力学特性, 增强了多柔比星诱导的氧化应激、线粒体膜去极化和肿瘤细胞凋亡。AS16肽是一种由血管内皮细胞生长因子VEGF受体2 (vascular endothelial growth factor receptor 2, VEGFR2)的拮抗剂ATWLPPR和内皮细胞酪氨酸激酶Tie2 (tyrosine kinase of endothelial 2, Tie2)的拮抗剂NLLMAAS通过柔性连接而成的多肽, 对VEGFR2和促血管生成素2 (angiotensin 2, Ang-2)具有双重抑制性[35], 能够减少肿瘤的生长以及肿瘤中微血管的数量[36]。有研究者为了延长AS16的体内半衰期, 设计了一种包含AS16肽和IgG Fc片段的肽体, 可以有效抑制M2巨噬细胞浸润和血管生成, 且其作用远远超过单独使用AS16肽。Martina等[37]的研究中证明了对VEGF/Ang-2的双重抑制可以使血管正常化, 并通过巨噬细胞发挥抗肿瘤作用。
4.2 基于肿瘤转移的多肽筛选基质金属蛋白酶(matrix metallopeptidases, MMPs)是肿瘤微环境中上调的分子之一, 参与肿瘤细胞的运动和侵袭。通过传统生化分离法筛选得到的抗肿瘤蜂毒肽, 通过阻断NF-κB (nuclear factor kappa-B)和PI3K/Akt/mTOR (phosphatidylinositide 3-kinases/protein kinase B/mammalian target of rapamycin)通路介导的MMP-9表达, 抑制乳腺癌细胞侵袭。大部分针对MMPs的多肽都是由噬菌体展示技术淘选得到。例如, Ndinguri等[38]使用丝状噬菌体肽测试对MMP-2和MMP-9的抑制活性, 最后得到共同含有HWGF序列的2条多肽: CTTHWGFTLC和CRRHWGFEFC。其中, CTTHWGFTLC对MMP-2的IC50值为10 μmol·L-1。
4.3 基于肿瘤免疫的多肽筛选程序性死亡受体PD-1 (programmed cell death protein-1)是一种抑制T细胞炎性活动的表面受体, 阻断PD-1与程序性死亡配体PD-L1 (programmed cell death-ligand 1)的相互作用可增强肿瘤免疫反应[39]。有研究报道AUNP-12多肽结合PD-L1/L2可抑制原发肿瘤的生长和转移, 并至少维持24 h的抗肿瘤免疫活性。Li等[40]使用噬菌体展示筛选了一种靶向PD-L1的多肽抑制剂TPP-1, 并通过磁性激活细胞分选(magnetic activated cell sorting, MACS)和荧光激活细胞分选(fluorescence activated cell sorting, FACS)方法进一步富集了与PD-L1结合的肽。从MACS循环后最初的5×106肽库开始到FACS的8个循环后, 分选肽从2.1% (40 nmol·L-1 PD-L1)增加到54.1% (10 nmol·L-1 PD-L1), 得到9个不同的肽, 其共有序列为CWCWR, 亲和力Kd约95 nmol·L-1。此外, 也有研究者从目鱼豹鳎(Pardachirus marmoratus)中通过传统生化分离法鉴定发现抗癌肽GE33可以作为疫苗佐剂提升灭活膀胱癌细胞(MBT-2)的免疫原性, 在小鼠体内显著提高了杀伤性T细胞(cytotoxic T lymphocyte, CTL)和自然杀伤细胞的数量以及特异性抗体水平等, 证明了抗癌肽的免疫调节潜能。
5 基于生物表型的多肽筛选传统表型筛选是在细胞或动物模型上筛选能够改变生物表型的化合物, 再深入探究化合物发挥药理作用的靶点和作用机制[41], 这种策略被称为“正向药物筛选策略”或“表型药物发现” (phenotypic drug discovery, PDD)。
采用模式生物进行抗肿瘤多肽筛选。对于肿瘤而言, 破坏S期激酶关联蛋白2 (S-phase kinase-associated protein 2, Skp2)和CyclinA之间的相互作用, 可选择性地杀伤肿瘤细胞。已经有研究者通过酵母双杂交技术筛选出与Skp2特异性结合的肽适配体, 并将其构建到真核表达体系中, 以转染的方法最终筛选3个有效抑制肿瘤生长的多肽[42]。但是酵母双杂交技术鉴定的蛋白互作定位于细胞核内, 而许多蛋白质间的作用依赖于翻译后加工, 此过程主要在胞浆内完成, 且“假阳性”发生频繁, 存在一定局限性。斑马鱼是另外一种常用模式动物, 因胚胎透明度高、生长周期短且饲养成本低, 成为研究肿瘤细胞异种移植的良好模型[43], Gallardo等[44]使用带有荧光标记的转基因斑马鱼筛选出一种癌基因抑制肽SU6656, 其能抑制高侵袭性乳腺肿瘤细胞的转移。
除了模式生物外, 细胞高内涵成像也是一种重要的基于表型特征的药物筛选方法。高内涵成像是在保持细胞结构和功能完整性的前提下, 同时检测被筛样品对细胞形态、生长、分化、迁移、凋亡、代谢途径及信号转导各个环节的影响[45], 获取大量相关基因、蛋白及细胞成分的数据信息[46], 以确定其生物活性、潜在毒性及相关生物表型[47]。例如, Graml等[48]将三维共聚焦显微镜与多参数图像分析方法相结合, 研究了裂解酵母基因组的3个关键过程, 最终解释了单个基因对多个生物过程的影响以及这些过程在功能上的联系。
细胞热迁移技术(cellular thermal shift assay, CETSA)是基于分子等温-剂量反应表型的药物筛选方法, 其原理是蛋白内多个肽键平面通过氨基酸的α-C原子旋转而紧密盘曲的稳定结构热变性时转变为不规则疏松构象, 在结合配体后, 其熔化温度(temperature, T)的改变反映了蛋白质与配体分子的亲和力[49], 也可用于探究药物的分子转运、靶点激活过程等问题。例如, 研究者在细胞水平上采用CETSA方法筛选并评估了不同多肽对肿瘤细胞的穿透性和对Mdm2/Mdm4-p53 (murine double minute 2/murine double minute 4-protein 53)靶点的结合性[50]。最近, Massey等[51]将高内涵筛选技术与CETSA相结合, 在细胞水平上获得更多生物数据参数。
6 其他筛选方式 6.1 人工智能虚拟筛选是利用计算机分子对接软件对目标靶点与候选药物之间的相互作用进行模拟, 计算两者之间亲和力大小, 预测其结合模式及结合自由能, 以便在研发早期能快速发现活性多肽候选分子。Kadioglu等[52]利用生物信息学、分子对接技术和体外验证筛选出了针对翻译控制肿瘤蛋白(translationally controlled tumor protein, TCTP)的高亲和力肽WGQWPYHC, 其能够诱导白血病细胞(MOLT-4)的TCTP和细胞周期相关蛋白CDK2 (cyclin dependent kinases 2)、CDK 6和Cyclin D3的表达下调。Li等[53]利用人工智能预测肽的自组装行为, 对不同氨基酸残基突变肽序列进行分子动力学模拟和自组装预测。
人工智能的策略降低了多肽筛选的研究周期, 提升命中率, 是抗肿瘤肽高通量设计和评估的一种重要技术手段。但是, 人工智能技术还面临着诸多挑战[54]:多肽和蛋白质构象变化(即灵活性问题); 从众多生成模型中选择最优结构(即评分问题); 以及如何将实验数据与虚拟计算预测整合到蛋白质和多肽的对接方案中(即综合建模问题)。
6.2 冷冻电镜(cryo-electron microscopy, cryo-EM)冷冻电镜方法使样品在接近于生理环境的玻璃态冰中, 捕获大分子-多肽复合物及结合中间态的三维立体结构[55]。例如研究者使用cryo-EM技术鉴定并解析了激活状态鲑降钙素、G蛋白和人降钙素受体(B类G蛋白偶联受体, G protein coupled receptors, GPCR)的异源三聚体结构[56], 以及胰高血糖素样肽1 (glucagon-like peptide1, GLP1) 4.1 Å的cryo-EM结构。采用这种方式, 一些蜘蛛毒肽与阳离子TRPV1通道(transient receptor potential vanilloid1, TRPV1)的结合模式也被鉴定[57]。由于cryo-EM技术在鉴定配体与靶点间结合位点和结合模式方面的天然优势, 作者预测未来一些重要抗肿瘤多肽与靶点结合的分子机制将被阐明。
7 总结与展望综上, 本文对近年来抗肿瘤多肽研究的热点方法进行了总结和介绍, 重点分析了传统色谱分离、肽组学、噬菌体展示、生物表型以及人工智能等技术原理、方法过程和在抗肿瘤肽筛选、鉴定、设计中的应用。随着这些技术的进步, 越来越多针对不同生物靶点的抗肿瘤肽被发现和优化, 以往难以鉴定的生物界来源复杂天然多肽及修饰物研究也迈上了新的台阶。当然每种技术都有各自的优缺点, 相信多种技术的有机结合和串联使用, 将极大加快多肽药物的发现和研发进程。
作者贡献:沈莉莉负责稿件全文的撰写; 王姣姣负责文献的查找; 陈吴越参与了表格的整理及插图的绘制; 周婧和马宏跃审阅了全文并润色语言; 许惠琴、程海波、陆茵和段金廒指导全文并提供了行文思路。
利益冲突:本文所有作者声明无任何利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Sanmamed MF, Chen L. A paradigm shift in cancer immunotherapy:from enhancement to normalization[J]. Cell, 2018, 175: 313-326. DOI:10.1016/j.cell.2018.09.035 |
| [3] |
Lewis RJ, Garcia ML. Therapeutic potential of venom peptides[J]. Nat Rev Drug Discov, 2003, 2: 790-802. DOI:10.1038/nrd1197 |
| [4] |
Pan X, Xu J, Jia X. Research progress evaluating the function and mechanism of anti-tumor peptides[J]. Cancer Manag Res, 2020, 12: 397-409. DOI:10.2147/CMAR.S232708 |
| [5] |
Fosgerau K, Hoffmann T. Peptide therapeutics:current status and future directions[J]. Drug Discov Today, 2015, 20: 122-128. DOI:10.1016/j.drudis.2014.10.003 |
| [6] |
Wulff H, Christophersen P, Colussi P, et al. Antibodies and venom peptides:new modalities for ion channels[J]. Nat Rev Drug Discov, 2019, 18: 339-357. DOI:10.1038/s41573-019-0013-8 |
| [7] |
Pennington MW, Czerwinski A, Norton RS. Peptide therapeutics from venom:current status and potential[J]. Bioorg Med Chem, 2018, 26: 2738-2758. DOI:10.1016/j.bmc.2017.09.029 |
| [8] |
Bowen CV, Debay D, Ewart HS, et al. In vivo detection of human TRPV6-rich tumors with anti-cancer peptides derived from soricidin[J]. PLoS One, 2013, 8: e58866. DOI:10.1371/journal.pone.0058866 |
| [9] |
Fu S, Hirte H, Welch S, et al. First-in-human phase I study of SOR-C13, a TRPV6 calcium channel inhibitor, in patients with advanced solid tumors[J]. Invest New Drugs, 2017, 35: 324-333. DOI:10.1007/s10637-017-0438-z |
| [10] |
Deshane J, Garner CC, Sontheimer H. Chlorotoxin inhibits glioma cell invasion via matrix metalloproteinase-2[J]. J Biol Chem, 2003, 278: 4135-4144. DOI:10.1074/jbc.M205662200 |
| [11] |
Zhao H, Qin X, Yang D, et al. The development of activatable lytic peptides for targeting triple negative breast cancer[J]. Cell Death Dis, 2017, 3. |
| [12] |
Ma S, Pradeep S, Villar-Prados A, et al. GnRH-R-targeted lytic peptide sensitizes BRCA wild-type ovarian cancer to PARP inhibition[J]. Mol Cancer Ther, 2019, 18: 969-979. DOI:10.1158/1535-7163.MCT-18-0770 |
| [13] |
Berguig GY, Convertine AJ, Frayo S, et al. Intracellular delivery system for antibody-peptide drug conjugates[J]. Mol Ther, 2015, 23: 907-917. DOI:10.1038/mt.2015.22 |
| [14] |
Torchia J, Weiskopf K, Levy R. Targeting lymphoma with precision using semisynthetic anti-idiotype peptibodies[J]. Proc Natl Acad Sci U S A, 2016, 113: 5376-5381. DOI:10.1073/pnas.1603335113 |
| [15] |
Sugahara KN, Teesalu T, Karmali PP, et al. Coadministration of a tumor-penetrating peptide enhances the efficacy of cancer drugs[J]. Science, 2010, 328: 1031-1035. DOI:10.1126/science.1183057 |
| [16] |
Bianchini F, Portioli E, Ferlenghi F, et al. Cell-targeted c (AmpRGD)-sunitinib molecular conjugates impair tumor growth of melanoma[J]. Cancer Lett, 2019, 446: 25-37. DOI:10.1016/j.canlet.2018.12.021 |
| [17] |
Zhang JL, Wen HM, Sun DJ. Purification and anti-tumor effects of a small peptide from snake venom of Gloydius saxatilis[J]. J Biol Pharm (中国生化药物杂志), 2009, 30: 217-225. |
| [18] |
Bian Y, Zheng R, Bayer FP, et al. Robust, reproducible and quantitative analysis of thousands of proteomes by micro-flow LC-MS/MS[J]. Nat Commun, 2020, 11: 157. DOI:10.1038/s41467-019-13973-x |
| [19] |
Schenone M, Dancik V, Wagner BK, et al. Target identification and mechanism of action in chemical biology and drug discovery[J]. Nat Chem Biol, 2013, 9: 232-240. DOI:10.1038/nchembio.1199 |
| [20] |
Ma H, Zhou J, Guo H, et al. A strategy for the metabolomics-based screening of active constituents and quality consistency control for natural medicinal substance toad venom[J]. Anal Chim Acta, 2018, 1031: 108-118. DOI:10.1016/j.aca.2018.05.054 |
| [21] |
Dutertre S, Jin AH, Kaas Q, et al. Deep venomics reveals the mechanism for expanded peptide diversity in cone snail venom[J]. Mol Cell Proteomics, 2013, 12: 312-329. DOI:10.1074/mcp.M112.021469 |
| [22] |
Smith GP. Filamentous fusion phage:novel expression vectors that display cloned antigens on the virion surface[J]. Science, 1985, 228: 1315-1317. DOI:10.1126/science.4001944 |
| [23] |
Peter TB. Bacteriophages as scaffolds for bipartite display:designing swiss army knives on a nanoscale[J]. Bioconjug Chem, 2015, 26: 367-378. DOI:10.1021/acs.bioconjchem.5b00034 |
| [24] |
Martins IM, Reis RL, Azevedo HS. Phage display technology in biomaterials engineering:progress and opportunities for applications in regenerative medicine[J]. ACS Chem Biol, 2016, 11: 2962-2980. DOI:10.1021/acschembio.5b00717 |
| [25] |
Jin P, Sha R, Zhang Y, et al. Blood circulation-prolonging peptides for engineered nanoparticles identified via phage display[J]. Nano Lett, 2019, 19: 1467-1478. DOI:10.1021/acs.nanolett.8b04007 |
| [26] |
Saw PE, Song EW. Phage display screening of therapeutic peptide for cancer targeting and therapy[J]. Protein Cell, 2019, 10: 787-807. DOI:10.1007/s13238-019-0639-7 |
| [27] |
Kim S, Kim D, Jung HH, et al. Bio-inspired design and potential biomedical applications of a novel class of high-affinity peptides[J]. Angew Chem Int Ed Engl, 2012, 51: 1890-1894. DOI:10.1002/anie.201107894 |
| [28] |
Zhao P, Grabinski T, Gao C, et al. Identification of a met-binding peptide from a phage display library[J]. Clin Cancer Res, 2007, 13: 6049-6055. DOI:10.1158/1078-0432.CCR-07-0035 |
| [29] |
Sun J, Zhang C, Liu G, et al. A novel mouse CD133 binding-peptide screened by phage display inhibits cancer cell motility in vitro[J]. Clin Exp Metastasis, 2012, 29: 185-196. DOI:10.1007/s10585-011-9440-6 |
| [30] |
Wu CH, Liu IJ, Lu RM, et al. Advancement and applications of peptide phage display technology in biomedical science[J]. J Biomed Sci, 2016, 23: 8. DOI:10.1186/s12929-016-0223-x |
| [31] |
Qin H, Lerman B, Sakamaki I, et al. Generation of a new therapeutic peptide that depletes myeloid-derived suppressor cells in tumor-bearing mice[J]. Nat Med, 2014, 20: 676-681. DOI:10.1038/nm.3560 |
| [32] |
Arap W, Kolonin MG, Trepel M, et al. Steps toward mapping the human vasculature by phage display[J]. Nat Med, 2002, 8: 121-127. DOI:10.1038/nm0202-121 |
| [33] |
Liu JY, Ren LW, Li S, et al. Research progress of tumor immune and tumor metabolic drug targets[J]. Acta Pham Sin (药学学报), 2019, 54: 1718-1727. |
| [34] |
Ruoslahti E. Vascular zip codes in angiogenesis and metastasis[J]. Biochem Soc Trans, 2004, 32: 397-402. DOI:10.1042/bst0320397 |
| [35] |
Zhu X, Yang J, Gao Y, et al. The dual effects of a novel peptibody on angiogenesis inhibition and M2 macrophage polarization on sarcoma[J]. Cancer Lett, 2018, 416: 1-10. DOI:10.1016/j.canlet.2017.10.043 |
| [36] |
An N, Chen ZQ, Huang M. Research advancement in vascular endothelial cell metabolism and tumor angiogenesis[J]. Acta Pham Sin (药学学报), 2020, 55: 1373-1381. |
| [37] |
Martina S, Nicolò R, Ece K, et al. Dual angiopoietin-2 and VEGFA inhibition elicits antitumor immunity that is enhanced by PD-1 checkpoint blockade[J]. Sci Transl Med, 2017, 9: 1-14. |
| [38] |
Ndinguri MW, Bhowmick M, Tokmina RD, et al. Peptide-based selective inhibitors of matrix metalloproteinase-mediated activities[J]. Molecules, 2012, 17: 14230-14248. DOI:10.3390/molecules171214230 |
| [39] |
Yan SJ, Sun L, Wan GH. The mechanism and research progress of drug resistance of PD-1/PD-L1 immunotherapy in tumors[J]. Acta Pham Sin (药学学报), 2019, 54: 1728-1734. |
| [40] |
Li C, Zhang N, Zhou J, et al. Peptide blocking of PD-1/PD-L1 interaction for cancer immunotherapy[J]. Cancer Immunol Res, 2018, 6: 178-188. DOI:10.1158/2326-6066.CIR-17-0035 |
| [41] |
Fabien V, Paula L, Marko P, et al. Developing predictive assays:the phenotypic screening "rule of 3"[J]. Sci Transl Med, 2015, 7: 293ps15. DOI:10.1126/scitranslmed.aab1201 |
| [42] |
Zhao FF. Screening of Anticancer Peptides Based on Targeting Skp2 Protein (基于Skp2为靶点的抗肿瘤多肽药物的筛选)[D]. Nanchang: Nanchang University, 2015.
|
| [43] |
Deveau AP, Bentley VL, Berman JN. Using zebrafish models of leukemia to streamline drug screening and discovery[J]. Exp Hematol, 2017, 45: 1-9. DOI:10.1016/j.exphem.2016.09.012 |
| [44] |
Gallardo VE, Varshney GK, Lee M, et al. Phenotype-driven chemical screening in zebrafish for compounds that inhibit collective cell migration identifies multiple pathways potentially involved in metastatic invasion[J]. Dis Model Mech, 2015, 8: 565-576. DOI:10.1242/dmm.018689 |
| [45] |
Mattiazzi M, Usaj EB, Styles AJ, et al. High-content screening for quantitative cell biology[J]. Trends Cell Biol, 2016, 26: 598-611. DOI:10.1016/j.tcb.2016.03.008 |
| [46] |
Singh S, Carpenter AE, Genovesio. Increasing the content of high-content screening:an overview[J]. Biomol Screen, 2014, 19: 640-650. DOI:10.1177/1087057114528537 |
| [47] |
Fabian Z, James BL, Link W. High content screening:seeing is believing[J]. Trends Biotechnol, 2010, 28: 237-245. DOI:10.1016/j.tibtech.2010.02.005 |
| [48] |
Graml V, Studera X, Lawson JD, et al. A genomic multiprocess survey of machineries that control and link cell shape, microtubule organization, and cell-cycle progression[J]. Dev Cell, 2014, 31: 227-239. DOI:10.1016/j.devcel.2014.09.005 |
| [49] |
Kranz JK, Schalk-Hihi C. Protein thermal shifts to identify low molecular weight fragments[J]. Methods Enzymol, 2011, 493: 277-298. DOI:10.1016/B978-0-12-381274-2.00011-X |
| [50] |
Tan BX, Brown CJ, Ferrer FJ, et al. Assessing the efficacy of Mdm2/Mdm4-inhibiting stapled peptides using cellular thermal shift assays[J]. Sci Rep, 2015, 5: 12116. DOI:10.1038/srep12116 |
| [51] |
Massey AJ. A high content, high throughput cellular thermal stability assay for measuring drug-target engagement in living cells[J]. PLoS One, 2018, 13: e0195050. DOI:10.1371/journal.pone.0195050 |
| [52] |
Kadioglu O, Efferth T. Peptide aptamer identified by molecular docking targeting translationally controlled tumor protein in leukemia cells[J]. Invest New Drugs, 2016, 34: 515-521. DOI:10.1007/s10637-016-0339-6 |
| [53] |
Li F, Han J, Cao T, et al. Design of self-assembly dipeptide hydrogels and machine learning via their chemical features[J]. Proc Natl Acad Sci U S A, 2019, 116: 11259-11264. DOI:10.1073/pnas.1903376116 |
| [54] |
Ciemny M, Kurcinski M, Kamel K, et al. Protein-peptide docking:opportunities and challenges[J]. Drug Discov Today, 2018, 23: 1530-1537. DOI:10.1016/j.drudis.2018.05.006 |
| [55] |
Renaud JP, Chari A, Ciferri C, et al. Cryo-EM in drug discovery:achievements, limitations and prospects[J]. Nat Rev Drug Discov, 2018, 17: 471-492. DOI:10.1038/nrd.2018.77 |
| [56] |
Liang YL, Khoshouei M, Radjainia M, et al. Phase-plate cryo-EM structure of a class B GPCR-G-protein complex[J]. Nature, 2017, 546: 118-123. DOI:10.1038/nature22327 |
| [57] |
Gao Y, Cao E, Julius D, et al. TRPV1 structures in nanodiscs reveal mechanisms of ligand and lipid action[J]. Nature, 2016, 534: 347-351. DOI:10.1038/nature17964 |
 2020, Vol. 55
2020, Vol. 55


