2. 河南大学药物研究所, 河南 开封 475001;
3. 中国药科大学新药研究中心, 江苏 南京 210009
2. Institute of Drugs, Henan University, Kaifeng 475001, China;
3. Center of Drug Discovery, China Pharmaceutical University, Nanjing 210009, China
新药研发是一项高投入、高风险、高耗时的复杂智力创新过程, 而基于结构片段药物设计原理, 利用现有药物的优势药效团进行拼合或生物等排或骨架迁越等药物化学技术构建结构多样的化合物库, 并通过活性筛选发现苗头化合物是新药研发最经济有效的策略[1-3]。其中, 最具优势特色的α, β-不饱和酮骨架不仅作为重要的活性有机合成子参与构建结构多样的功能有机化合物, 同时也是天然有效成分查尔酮[4, 5]和黄酮类[6]及甾体激素如雄性激素[7]、孕激素[8]、肾上腺皮质激素类[9]及利尿药依他尼酸[10]和靶向酪氨酸激酶抑制剂舒尼替尼[11]等临床药物的特征药效团骨架。除此外, 因α, β-不饱和酮片段可与大分子配体发生络合效应及迈克尔加成反应而产生广泛的药理活性已成为多种蛋白激酶类药物的重要共价修饰基备受关注[12, 13]。另外, 在众多的药物作用靶点中, 拓扑异构酶(topo)不仅是氟喹诺酮药物的抗菌作用靶点[14], 也是抗肿瘤药物的重要作用靶标, 且有多个拓扑异构酶抑制剂有效应用于肿瘤临床治疗[15]。然而, 临床拓扑异构酶抑制剂因存在水溶性差和体内代谢不稳定而导致其生物利用度低及选择性低而导致不良反应大等亟待要克服的局限性, 为此, 基于氟喹诺酮的结构特征及作用机制, 试图通过药物化学结构修饰方法将氟喹诺酮的抗菌活性转为抗肿瘤活性, 进一步拓展拓扑异构酶抑制剂及氟喹诺酮研究的新领域[16]。研究发现, C-3羧基杂环等排体用α, β-不饱和酮骨架作为修饰基而构建的C-3稠杂环α, β-不饱和酮类(图 1A)[17]、绕丹宁不饱和酮酰胺类(图 1B)[18]及噻唑不饱和酮类(图 1C)[19]可显著改善其抗肿瘤活性, 由此推测α, β-不饱和酮结构可能是发挥抗肿瘤活性的重要药效团片段。受α, β-不饱和酮骨架在构建药理活性分子重要性的启发, 本文试图保留已知化合物A、B、C的C-3取代基相同的α, β-不饱和酮结构片段, 即将芳苄叉基部分进行迁越至氟喹诺酮骨架3-位, 并与C-4羰基共同构建新的α, β-不饱和酮结构, 进而设计了氟喹诺酮C-3芳苄叉基不饱和酮类目标化合物(4) (图 1)。

|
Figure 1 From the known compounds (A, B, C) to the target compounds 4 |
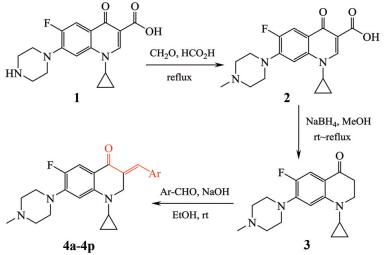
目标化合物(4a~4p)的制备见合成路线1所示。市售环丙沙星(1)经Eschweiler-Clarke甲基化反应生成N-甲基环丙沙星(2), 在甲醇中与硼氢化钠发生还原和脱羧反应得到2, 3-二氢喹啉-4(1H)-酮中间体(3), 然后与芳香醛发生Claisen-Schmidt缩合反应形成C-3芳苄叉基而构建氟喹诺酮不饱和酮衍生物(4a~4p)。
|
Scheme 1 Synthetic route of the target compounds 4a-4p from ciprofloxacin 1 Ar: C6H5 (a); 4-MeO-C6H4 (b); 2-MeO-C6H4 (c); 4-Me-C6H4 (d); 3-Me-C6H4 (e); 3, 4-OCH2O-C6H3 (f); 3, 4, 5-(MeO)3-C6H2 (g); 4-F-C6H4 (h); 3-F-C6H4 (i); 4-Cl-C6H4 (j); 3-Cl-C6H4 (k); 4-Br-C6H4 (l); 3-Br-C6H4 (m); 2-furyl (n); 3-pyridyl (o); 4-pyridyl (p). |
氟喹诺酮2骨架中的2, 3-双键受其3-羧基和4-羰基吸电子效应的影响而表现出高度的缺电子性, 易与硼氢化钠释放出的活性氢负离子(H-)发生加成反应而被还原为易脱羧基的β-酮酸型结构, 接着发生脱羧基反应到中间体3。实验中发现, 如果加大硼氢化钠的用量, 会导致C-4羰基进一步被还原到四氢喹啉-4-醇副产物的生成。同时, 如果长时间回流反应, 副产物四氢喹啉-4-醇的羟基将发生消去反应转化为1, 2-二氢喹啉新副产物。因此, 硼氢化钠的用量、反应温度和反应时间等因素的控制对3的产率及纯度极为重要。中间体3与芳香醛在碱性催化下易发生经典的Claisen-Schmidt缩合反应形成C-3芳苄叉基。中间体3的1H NMR仅在低场δ 7.20和6.20处出现对应C-5和C-8的2个单质子双峰、高场δ 3.50和2.50处出现对应C-2和C-3的2个双质子多峰, 而在更低场δ 9.0、15.0处均未出现2所对应的C-2和3-COOH单质子单峰, 表明3不存在2的2, 3-双键, 而2被还原脱羧生成了预期产物3。目标物4与3的1H NMR相比较, 4在低场δ 3.60处出现双质子单峰化学位移, 而未出现3的δ 2.50处双质子多峰化学位移峰, 同时4除典型的芳基化学位移峰外, 而在δ 8.0处出现特征单质子单峰可归属3-叉基(=CH)质子, 表明化合物4中出现3-芳苄叉基, 同时C-5和C-8的相应的单质子双峰向低场移动约0.50 ppm。另外, 虽然元素分析值及MS测定值也与目标化合物4的结构组成相一致, 但所得到产物的3-叉基双键是否移位到环内形成3-苄基-喹啉-4-酮结构仍需要进一步确证。中间体3和目标化合物4的结构经1H NMR、MS及元素分析确证, 其收率、物理常数及波谱数据见表 1、2。
| Table 1 Physical constants and spectral data of intermediates 3 and target compounds (4a-4p) |
| Table 2 1H NMR data of intermediates 3 and target compounds (4a-4p) |
初步的体外抗肿瘤实验结果(表 3)表明, 合成的16个新目标化合物(4a~4p)对Hep-3B、Capan-1及HL60三种实验癌细胞的IC50 < 40.0 μmol·L-1, 而母体环丙沙星1的IC50 > 100 μmol·L-1, 表明目标物的抗肿瘤活性强于母体, 提示C-3羧基并非是抗肿瘤活性所必需的药效团结构, 而用芳苄叉基替代C-3羧基构建的3-芳苄叉基-喹啉-4-酮类有利于提高抗肿瘤活性。然而, 目标物的IC50均大于对照多柔比星, 但与前期研究工作的C-3杂环不饱和酮类化合物的IC50相比较, 所对应芳苄叉基相同的化合物其IC50并没有显著的差异, 为此, 进一步表明芳苄叉基杂环酮替代C-3羧基并非必要, 仅用芳苄叉基部分替代C-3羧基也可提高氟喹诺酮的抗肿瘤活性, 由此推测α, β-不饱和酮结构片段作为C-3羧基的取代基将对其抗肿瘤活性产生积极的影响。与此同时, 初步的构效关系表明, 参与构建芳苄叉基的芳基为供电子的甲氧基苯基时, 随着甲氧基个数的增加或体积的增大而导致IC50增大, 不利于提高抗肿瘤活性, 如三甲氧基化合物(4g)对3种实验癌细胞的IC50均最大, 表现出较低的活性; 同时, 虽然F、Cl、Br原子半径及电负性有迥然差异, 而卤苯基或芳香杂环类的活性均强于其他取代基化合物, 尤其是氯苯基化合物(4j、4k)对Capan-1的活性与抗肿瘤药多柔比星相当。总之, 芳苄叉基的空间效应、电效应对活性的影响是综合性因素所决定的, 选择适当的芳基取代基进一步提高氟喹诺酮不饱和酮的抗肿瘤活性仍值得探索和发现。
|
Table 3 The in vitro antitumor activity of the target compounds 4a‒4p against the tested cancer cells (n = 3, |
基于氟喹诺酮的作用机制及其结构特征, 用芳苄叉基替代C-3羧基所构建的新氟喹诺酮不饱和酮衍生物以及已知C-3芳苄叉杂环酮类化合物的抗肿瘤活性高于母体环丙沙星, 表明氟喹诺酮的C-3羧基及其杂环不饱和酮等排体并非是抗肿瘤活性所必需的药效团结构, 而以α, β-不饱酮结构片段作为C-3羧基的等排体构建新型的抗肿瘤氟喹诺酮不饱和酮类化合物值得关注。
实验部分熔点用WK-1B数字熔点仪(上海精密科学仪器厂), 毛细管法, 温度未校正; AM-400型核磁共振仪(德国Bruker公司), DMSO-d6为溶剂; Esquire LC型质谱仪(德国Bruker公司); 2400-Ⅱ元素分析仪(美国PE公司)。所用环丙沙星1为商品, N-甲基环丙沙星按文献[20]的方法制备, 其他试剂均为分析纯。
1 化学合成 1.1 1-环丙基-6-氟-7-(4-甲基-哌嗪-基)-2, 3-二氢-喹啉-4(1H)-酮(3)的合成N-甲基环丙沙星2 (20.0 g, 58.0 mmol)悬浮于无水甲醇(1 000 mL)中, 水浴常温搅拌下分批慢慢加入新购买的硼氢化钠粉末(3.8 g, 100.0 mmol) (特别谨防冲料发生!)。待物料溶解后水浴加热至回流, 搅拌反应2 h。减压蒸除溶剂, 加入饱和食盐水(500 mL), 充分振荡至黏稠物完全分散, 转入烧杯中放置固化。过滤, 用水洗至中性, 干燥。粗品悬浮于蒸馏水(200 mL)中, 慢慢滴加浓盐酸至粗品溶解, 加入活性炭2.0 g, 搅拌脱色1 h。滤液用浓氨水碱化至pH 9.0, 放置析出固体。过滤, 用水洗至中性, 自然干燥。用正己烷重结晶, 干燥, 得淡黄色针状结晶物2。
1.2 1-环丙基-6-氟-7-(4-甲基-哌嗪-1-基)-3-芳苄叉基-2, 3-二氢喹啉-4(1H)-酮(4a~4p)的合成通法中间体3 (2.0 g, 6.6 mmol)和新的芳香醛(10.0 mmol)依次溶于无水乙醇(30 mL)与氢氧化钠(1.0 g, 13.0 mmol)的醇钠溶液中, 常温磁力搅拌反应至原料3消失。减压蒸除溶剂, 剩余物加入饱和食盐水(50 mL), 用浓盐酸调pH 2.0, 用乙酸乙酯(3×30 mL)提取除去过量的醛。水相用浓氨水碱化至pH 10.0, 放置析出固体。过滤, 用水洗至中性, 干燥。粗品用乙酸乙酯-无水乙醇混合溶剂重结晶, 得淡黄色针状结晶目标化合物4a~4p。
2 体外抗癌细胞增殖活性对合成的16个新目标化合物4a~4p及对照环丙沙星(ciprofloxacin, 1)和结构类似抗癌药物多柔比星(doxorubicin, DOX)用DMSO配成1.0×10-2 mol·L-1浓度的储备液, 用RPMI-1640稀释到所需浓度(50、10、5、1.0、0.1×10-6 mol·L-1)。取对数生长期的人肝癌Hep-3B细胞、人胰腺癌Capan-1细胞及人白血病HL60细胞分别以每孔5 000个细胞接种于96孔板, 培养隔夜后, 加入不同浓度的上述供试化合物溶液, 继续培养48 h后弃去培养基。每孔加入1 g·L-1 MTT溶液100 μL, 继续培养4 h后弃上清液。每孔加入二甲基亚砜150 μL, 轻轻振荡30 min, 用酶标仪在570 nm波长处测其吸光度值。计算各组对癌细胞的抑制率:抑制率% = [(1-实验组吸光度值)/对照组吸光度值]×100%。然后以各药物浓度的对数值对各浓度下的抑制率作线性回归, 得浓度-效应方程, 以此计算出各供试化合物对实验癌细胞的半数抑制浓度(IC50)。所有实验在相同条件下重复进行3次, 最终结果以Mean ± SD表示。
作者贡献: 张会丽负责化合物的合成与结构表征; 姜亚玲负责化合物的合成; 赵辉负责药理实验与论文写作; 黄文龙负责课题设计; 胡国强为论文责任负责人。
利益冲突: 无利益冲突。
| [1] |
Kashyap A, Singh PK, Silakari O. Counting on fragment based drug design approach for drug discovery[J]. Curr Top Med Chem, 2018, 18: 2284-2293. |
| [2] |
Lee KL, Ambler CM, Anderson DR, et al. Discovery of clinical candidate 1-{[(2S, 3S, 4S)-3-ethyl-4-fluoro-5-oxopyrrolidin-2-yl]methoxy}-7-methoxyisoquinoline-6-carboxamide (PF-06650833), a potent, selective inhibitor of interleukin-1 receptor associated kinase 4(IRAK4), by fragment-based drug design[J]. J Med Chem, 2017, 60: 5521-5525. DOI:10.1021/acs.jmedchem.7b00231 |
| [3] |
Guo ZR. A pharmacophore and scaffold hopping-based search and development of iricoxib[J]. Acta Pharm Sin (药学学报), 2018, 53: 1383-1386. |
| [4] |
Kar Mahapatra D, Asati V, Bharti SK. An updated patent review of therapeutic applications of chalcone drivatives (2014-present)[J]. Expert Opin Ther Pat, 2019, 29: 385-406. DOI:10.1080/13543776.2019.1613374 |
| [5] |
Dan W, Dai J. Recent developments of chalcones as potential antibacterial agents in medicinal chemistry[J]. Eur J Med Chem, 2020, 187: 111980. DOI:10.1016/j.ejmech.2019.111980 |
| [6] |
Boniface PK, Elizabeth FI. Flavones as a privileged scaffold in drug discovery:current developments[J]. Curr Org Synth, 2019, 16: 968-1001. DOI:10.2174/1570179416666190719125730 |
| [7] |
Ran F, Xing H, Liu Y, et al. Recent developments in androgen receptor antagonists[J]. Arch Pharm (Weinheim), 2015, 348: 757-775. DOI:10.1002/ardp.201500187 |
| [8] |
Filicori M. Clinical roles and applications of progesterone in reproductive medicine:an overview[J]. Acta Obstet Gynecol Scand, 2015, 94(Suppl 161): 3-7. |
| [9] |
Manosroi J, Rueanto K, Boonpisuttinant K, et al. Novel ferrocenic steroidal drug derivatives and their bioactivities[J]. J Med Chem, 2010, 53: 3937-3943. DOI:10.1021/jm901866m |
| [10] |
Mignani S, El Brahmi N, El Kazzouli S, et al. A novel class of ethacrynic acid derivatives as promising drug-like potent generation of anticancer agents with established mechanism of action[J]. Eur J Med Chem, 2016, 22: 656-673. DOI:10.1002/chem.201504131 |
| [11] |
Paludetto MN, Bijani C, Puisset F, et al. Metalloporphyrin-catalyzed oxidation of sunitinib and pazopanib, two anticancer tyrosine kinase inhibitors:evidence for new potentially toxic metabolites[J]. J Med Chem, 2018, 61: 7849-7860. DOI:10.1021/acs.jmedchem.8b00812 |
| [12] |
Jackson PA, Widen JC, Harki DA, et al. Covalent modifiers:a chemical perspective on the reactivity of α, β-unsaturated carbonyls with thiols via hetero-Michael addition reactions[J]. J Med Chem, 2017, 60: 839-885. DOI:10.1021/acs.jmedchem.6b00788 |
| [13] |
Dalton SE, Campos S. Covalent small molecules as enabling platforms for drug discovery[J]. Chembiochem, 2020, 21: 1080-1100. DOI:10.1002/cbic.201900674 |
| [14] |
Kathiravan MK, Khilare MM, Nikoomanesh K, et al. Topoisomerase as target for antibacterial and anticancer drug discovery[J]. J Enzyme Inhib Med Chem, 2013, 28: 419-435. DOI:10.3109/14756366.2012.658785 |
| [15] |
Idowu T, Schweizer F. Ubiquitous nature of fluoroquinolones:the oscillation between antibacterial and anticancer activities[J]. Antibiotics (Basel), 2017, 6: 26. DOI:10.3390/antibiotics6040026 |
| [16] |
Hu W, Huang XS, Wu JF, et al. Discovery of novel topoisomerase II inhibitors by medicinal chemistry approaches[J]. J Med Chem, 2018, 61: 8947-8980. DOI:10.1021/acs.jmedchem.7b01202 |
| [17] |
Li T, Gao LZ, Xie YS, et al. Synthesis and anti-proliferative activity of fluoroquinolone C-3 fused heterocyclic α, β-unsaturated ketones derived from ciprofloxacin[J]. Acta Pharm Sin (药学学报), 2015, 50: 569-573. |
| [18] |
Gao LZ, Xie YS, Yan Q, et al. Synthesis and anti-proliferative activity of fluoroquinolone (rhodanine unsaturated ketone) amide derivatives[J]. Acta Pharm Sin (药学学报), 2015, 50: 1008-1012. |
| [19] |
Wang N, Zhang HL, Chen CR, et al. Synthesis and antitumor activity of fluoroquinolone C-3 arylidene thiazolone derivatives from ciprofloxacin[J]. Acta Pharm Sin (药学学报), 2019, 54: 687-691. |
| [20] |
Hu GQ, Hou LL, Wang GQ, et al. Design, synthesis and antitumor activity of fluoroquinolone C-3 heterocycles:bis-oxadiazole methylsulfide derivatives derived from ciprofloxacin[J]. Acta Pharm Sin (药学学报), 2012, 47: 1017-1022. |
 2020, Vol. 55
2020, Vol. 55


