2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
慢性化脓性中耳炎(chronic suppurative otitis media, CSOM)是临床中常见的一种耳科病症, 为细菌感染中耳导致的炎症, 其临床症状表现为中耳慢性鼓膜穿孔、耳溢液分泌、听力损失等。喹诺酮类药物被广泛用于CSOM的临床治疗, 通常以口服或静脉注射给药。此类药物可抑制细菌的DNA促旋酶和拓扑异构酶Ⅳ, 与DNA-酶裂解复合物形成稳定结合, 抑制酶的催化活性和DNA连接, 导致染色体断裂, 促进细菌死亡[1]。但喹诺酮类药物可能引起中枢神经系统毒性、肌腱及关节毒性、血糖异常等不良反应, 同时, 喹诺酮作为抗生素也有增加细菌耐药性的风险[2-5]。为降低系统暴露量, 增加炎症部位的浓度, 近年来多种滴耳液被开发用于CSOM的治疗。已上市的喹诺酮类滴耳液有氧氟沙星滴耳液、环丙沙星滴耳液等[6-8]。帕珠沙星是第三代喹诺酮类抗菌药物, 其滴耳液制剂目前正处于临床开发阶段。
滴耳液通过耳部给药, 经鼓膜进入中耳, 再通过圆窗膜和镫骨进入内耳, 但耳部复杂的生理结构及血-淋巴迷路屏障导致局部使用的药物仍有少量进入体循环[9-12], 需建立高灵敏度的分析方法测定血药浓度, 获得系统药动学数据, 以进一步评价此类制剂的安全性。但检测血药浓度无法了解药物在耳部的传递过程, 因此也需测定耳溢液中药物浓度, 以评价滴耳液的局部分布。Spektor等[6]采用LC-MS/MS法测定了患者单次双耳滴耳4滴0.3%环丙沙星滴耳液(约为840 μg环丙沙星)后血清中的环丙沙星浓度, 定量下限为0.5 ng·mL-1, 但仅能测得给药后4 h的血药浓度。由于此类制剂给药剂量过低(微克级), 生物样品分析方法尤其是血浆中药物浓度的测定仍面临着一定挑战。
本文旨在建立快速、灵敏、简便的LC-MS/MS法测定人血浆及耳溢液中帕珠沙星的浓度, 用于CSOM患者单次使用甲磺酸帕珠沙星滴耳液后的血浆药动学及耳部药动学研究。
材料与方法药品和试剂 甲磺酸帕珠沙星对照品(批号: 130460-201302, 纯度99.8%)由中国食品药品检定研究院提供; 甲磺酸帕珠沙星-d4对照品(批号: 150C137, 纯度99.0%, 同位素纯度98.0%)由润佳(苏州)医药科技有限公司提供; 甲醇(色谱纯)和乙腈(色谱纯)均由德国Merck公司提供; 醋酸铵(色谱纯)由美国ROE公司提供; 去离子水由法国Millipore纯水仪制备。
仪器和材料 质谱系统为Sciex Triple QuadTM 6500+型三重四极杆串联质谱仪, 配备电喷雾电离源(ESI源), 美国AB Sciex公司; 液相色谱系统包括LC-30AD型二元输液泵、SIL-30AC型自动进样器、DGU-20A5R型脱气机和CTO-20A型柱温箱, 日本岛津公司; Analyst 1.6.3定量处理软件, 美国AB Sciex公司; 一次性拭子试管, 江苏省扬州洋生医药科技有限公司。
色谱条件 分析柱: HSS T3色谱柱(50 mm×2.1 mm, 1.8 μm, 美国Waters公司); 流动相: A相(含0.1%甲酸的1 mmol·L-1醋酸铵水溶液)-B相(甲醇), 梯度洗脱方式: 0~1 min, 25% B; 1~1.6 min, 25%~95% B; 1.6~2.0 min, 95% B; 2~2.1 min, 95%~25% B; 2.1~3.0 min, 25% B。流速: 0.55 mL·min-1; 进样量: 20.0 µL (血浆样品); 15.0 µL (耳溢液样品)。
质谱条件 离子源为ESI源; 正离子方式检测; 离子源温度为550 ℃; 源喷射电压为5 000 V; 离子源气体1压力为50 psi (1 psi ≈ 6.9 kPa); 离子源气体2压力为60 psi; 去簇电压为90 V; 气帘气体(N2)压力为30 psi; 用于帕珠沙星测定的碰撞能量为35 V, 用于帕珠沙星-d4测定的碰撞能量为36 V; 扫描方式为多反应监测模式(MRM)。用于定量的MRM离子对分别为: m/z 319.1→281.2 (帕珠沙星), m/z 323.1→285.2 (帕珠沙星-d4)。
标准系列样品和质控样品的制备
血浆 精密称取甲磺酸帕珠沙星对照品两份, 用甲醇溶解并定容, 获得质量浓度均为1.00 mg·mL-1的帕珠沙星储备液, 一份用于标准系列溶液配制, 一份用于质控溶液配制。用甲醇-水(50:50)依次稀释储备液获得浓度分别为0.200、0.500、1.00、4.00、16.0、40.0、80.0和160 ng·mL-1的标准系列溶液以及浓度为0.200、0.600、8.00和128 ng·mL-1的质控溶液。以人空白血浆稀释上述系列溶液获得质量浓度为0.010 0、0.025 0、0.050 0、0.200、0.800、2.00、4.00和8.00 ng·mL-1的血浆标准系列样品以及0.010 0、0.030 0、0.400和6.40 ng·mL-1的质控样品。精密称取甲磺酸帕珠沙星-d4对照品, 用甲醇溶解并定容, 获得浓度为1.00 mg·mL-1的帕珠沙星-d4储备液。用乙腈稀释该储备液至1.00 ng·mL-1, 作为内标工作溶液, 用于血浆样品测定。
耳溢液 用空白耳溢液匀浆液(以甲醇匀浆, 5:8, W/V)稀释帕珠沙星储备液, 获得质量浓度分别为0.500、1.00、3.00、10.0、30.0、150、500和1 000 ng·mg-1的耳溢液标准系列样品以及质量浓度为0.500、1.50、100和800 ng·mg-1的耳溢液质控样品。用乙腈稀释帕珠沙星-d4储备液至50.0 ng·mL-1, 作为内标工作溶液, 用于耳溢液样品测定。
血浆样品预处理 在100 µL血浆样品中分别加入内标溶液100 µL和乙腈400 µL, 涡流1 min后, 离心5 min (14 000 r·min-1), 取上清液500 µL至1 mL 96孔板中, 40 ℃氮气流下吹干, 加入20%甲醇水溶液100 µL复溶, 取20.0 µL进行LC-MS/MS分析。
耳溢液样品预处理 向含耳溢液样品的拭子试管中加入甲醇(1:0.5, W/V), 混匀涡流15 min。在棉签上滴加400 µL甲醇, 冲洗并挤压甲醇至试管中, 重复两次, 涡流混匀, 得到耳溢液样品匀浆液。取50 µL匀浆液, 加入内标溶液50 µL和乙腈100 µL, 涡流混匀1 min, 离心5 min (14 000 r·min-1)后, 取上清液20 µL至1 mL 96孔板中, 加入去离子水180 µL稀释, 涡流15 min (1 000 r·min-1), 取15.0 µL进行LCMS/MS分析。
方法验证 对建立的方法从方法的选择性、标准曲线、定量下限、精密度和准确度、稳定性、回收率、基质效应等方面进行了方法学验证。
选择性 取6个不同来源的人空白血浆、3个不同来源的人空白耳溢液甲醇匀浆液以及相应空白基质配制的定量下限(LLOQ)样品进行LC-MS/MS分析测定。考察不同来源基质是否干扰待测物及内标的测定。空白样品待测物保留时间处的峰面积应不高于LLOQ样品中待测物峰面积的20%, 内标保留时间处的峰面积应不高于内标峰面积的5%。
标准曲线 标准曲线样品处理按照“血浆/耳溢液样品预处理”项下操作, 以待测物浓度为横坐标, 待测物与内标物的峰面积比值为纵坐标, 用加权(W = 1/x2)最小二乘法进行线性回归运算, 求得的直线回归方程即为标准曲线, 标准曲线的相关系数(r2)应大于0.99。
定量下限 取空白血浆/空白耳溢液甲醇匀浆液配制的LLOQ样品, 每一基质进行6样本分析, 连续测定3天, 并根据当日标准曲线计算每一样本的测得浓度, 求算日内、日间的精密度和准确度。精密度应不大于20%, 准确度应在理论值的±20%之内。
精密度和准确度 取帕珠沙星低、中、高浓度质控样品, 按“血浆/耳溢液样品预处理”项下操作, 每个浓度进行6样本分析, 连续测定3天, 求算日内、日间的精密度和准确度。精密度应不大于15%, 准确度应在理论值的±15%之内。
基质效应 分别在不同来源空白血浆或空白耳溢液甲醇匀浆液中加入乙腈, 进行蛋白沉淀处理, 向上清液中加入帕珠沙星低、中、高三浓度对照质控溶液和内标溶液, 其余按“血浆/耳溢液样品预处理”操作。同时另取水代替空白基质, 操作与加基质样品相同。通过计算基质存在的峰面积与不含基质的相应峰面积的比值, 求算帕珠沙星和内标的基质因子, 二者基质因子的比值即为内标归一化的帕珠沙星的基质因子。若内标归一化基质因子精密度不大于15%, 即可忽略基质效应的影响。
在人空白血浆中加入2%经冻融后的全血制备成溶血血浆; 在人空白血浆中加入2%的脂肪乳剂制备成高脂血浆。取溶血血浆和高脂血浆分别配制成低、高两浓度的质控样品, 样品按“血浆样品预处理”操作, 每一浓度进行6样本分析。根据当日标准曲线分别计算溶血样品和高脂样品的精密度、准确度, 评价溶血和高脂血浆样品的基质效应。
回收率 分别用空白血浆或空白耳溢液甲醇匀浆液配制低、中、高三个浓度的质控样品, 样品按“血浆/耳溢液样品预处理”操作, 每一浓度进行6样本分析。同时另取空白基质加入乙腈, 向上清液中加入帕珠沙星低、中、高三浓度对照质控溶液和内标溶液, 得到每一浓度两种处理方法的峰面积比值即可计算回收率。待测物的提取回收率精密度不大于15%, 则说明选择的预处理方法重现性良好。
稳定性 考察帕珠沙星血浆样品室温放置28.5 h、预处理后的血浆样品4 ℃自动进样器放置25 h、血浆样品经4次冷冻-解冻循环以及-20 ℃放置29天和-70 ℃放置149天的稳定性。考察帕珠沙星全血样品室温放置2 h的稳定性。考察帕珠沙星耳溢液样品匀浆液室温放置18 h、耳溢液样品匀浆液制备后上清液4℃自动进样器放置27 h、耳溢液匀浆液样品经4次冷冻-解冻循环以及-20 ℃和-70 ℃放置238天的稳定性。各储存条件下每一浓度水平测定值的精密度不大于15%, 测定值的准确度在±15%之内则视为稳定。
人体药动学研究 药动学实验经江苏省人民医院及南京市第一医院伦理委员会批准, 受试者均自愿签署书面知情同意书。3例CSOM受试者单次单耳滴入10滴浓度为0.1%的甲磺酸帕珠沙星滴耳液(约为帕珠沙星630 μg), 耳浴10~15 min, 耳浴结束后, 滴耳液流出, 用拭子棉签沾取生理盐水清洗, 从内到外转5圈, 重复3次, 以最后一滴滴耳液入耳为0 min, 采集0、0.25、0.5、0.75、1、2、3、4、5、6、7、8、10和12 h的静脉血于肝素抗凝管内, 在4 ℃, 3 000 r·min-1下离心得到血浆样品, 于-70 ℃保存待测。称量采集前含拭子棉签的拭子试管, 用拭子棉签采集0、0.5、2、4、6、8、10和12 h的耳溢液于拭子试管内, 再次称量采集后的拭子试管, 前后两次称量质量差即为耳溢液重量, 耳溢液样品于-70 ℃保存待测。
结果 1 质谱分析帕珠沙星结构中既含有易获得质子的碱性氮原子, 也含有易失去质子的羧酸基团。相比于负离子检测模式, 实验中发现帕珠沙星在正离子检测模式下具有更高的质谱响应, 且ESI源比大气压电离源(APCI)有更高的离子化效率, 因此本次实验采用ESI电离源以正离子模式检测。在(+)ESI下, 帕珠沙星和帕珠沙星-d4主要生成[M+H]+离子, m/z分别为319.1和323.1。对[M+H]+峰进行产物离子扫描分析, 二者均易形成中性丢失一分子H2O和进一步中性丢失HF的产物离子图 1。为提高检测专属性, 选择了丢失H2O和HF的m/z 281.2和m/z 285.2产物离子作为MRM检测时的定量离子。
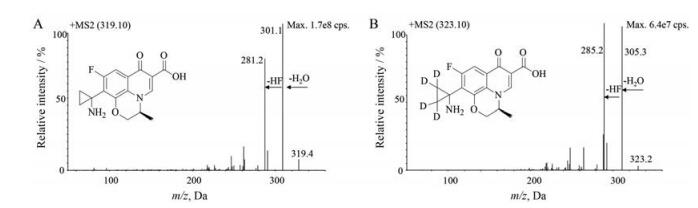
|
Figure 1 The chemical structures and the product ion spectra of pazufloxacin (A) and pazufloxacin-d4 (B) |
由图 2和图 3可见, 帕珠沙星和同位素内标的保留时间分别约为1.69和1.67 min, 且峰形良好。空白样品在帕珠沙星保留时间处的峰面积均低于LLOQ样品待测物峰面积的20%, 内标保留时间处的峰面积均低于内标峰面积的5%。结果表明, 空白人血浆及空白人耳溢液中的内源性物质对帕珠沙星和内标的测定均不存在干扰。
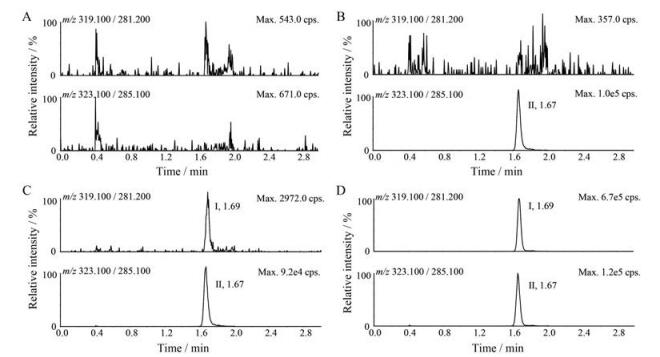
|
Figure 2 Typical MRM chromatograms of pazufloxacin (I) and pazufloxacin-d4 (II) in human plasma. A: Blank plasma; B: Blank plasma spiked with 1.00 ng·mL-1 pazufloxacin-d4; C: Blank plasma spiked with 0.010 ng·mL-1 pazufloxacin and 1.00 ng·mL-1 pazufloxacin-d4; D: Plasma sample 0.25 h after administration of 0.1% pazufloxacin ear drops |
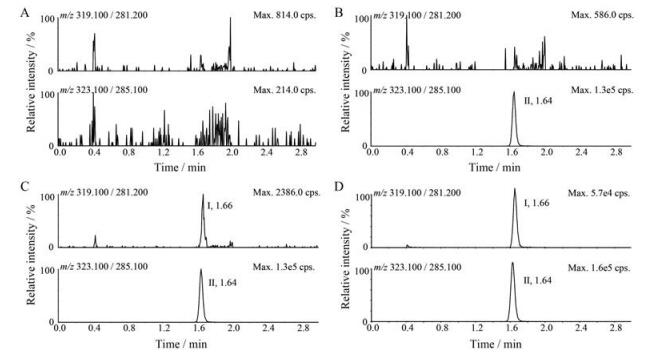
|
Figure 3 Typical MRM chromatograms of pazufloxacin (I) and pazufloxacin-d4 (II) in human otorrhea. A: Blank otorrhea; B: Blank otorrhea spiked with 50.0 ng·mL-1 pazufloxacin-d4; C: Blank otorrhea spiked with 0.500 ng·mg-1 pazufloxacin and 50.0 ng·mL-1 pazufloxacin-d4; D: Otorrhea sample 12 h after administration of 0.1% pazufloxacin ear drops |
测定人血浆及人耳溢液中帕珠沙星浓度的线性范围分别为0.010 0~8.00 ng·mL-1和0.500~1 000 ng·mg-1。典型标准曲线回归方程分别为y = 3.70 x + 0.003 29 (r = 0.998 8)和y = 0.024 6 x + 0.000 532 (r = 0.999 6), 表明在设定的浓度范围内线性良好。
2.3 定量下限测定帕珠沙星的血浆LLOQ样品的日内精密度小于8.2%, 日间精密度为8.5%, 准确度为-0.1%;耳溢液LLOQ样品的日内精密度均小于16.9%, 日间精密度为11.7%, 准确度为-4.2%, 均符合生物样品测定相关要求。结果表明LC-MS/MS法测定人血浆及耳溢液中帕珠沙星LLOQ分别可达到0.010 0和0.500 ng·mg-1。
2.4 准确度与精密度测定帕珠沙星的血浆及耳溢液低、中、高浓度质控样品的日内精密度均小于8.7%, 日间精密度均小于5.9%, 准确度在-1.7%~7.8%之间。待测物质控样品测试结果符合生物样品测定有关要求。
2.5 基质效应帕珠沙星血浆样品在低、中、高三浓度经内标校正后的基质因子分别为101.2%、102.7%、98.0%, 相应精密度分别为3.8%、1.3%、4.0%;帕珠沙星耳溢液样品在低、中、高三浓度经内标校正后的基质因子分别为111.9%、98.7%、98.6%, 相应精密度分别为6.9%、1.3%、1.8%。结果表明, 可忽略血浆及耳溢液基质效应对测定结果的影响。
溶血血浆配制的每一浓度水平的帕珠沙星的质控样品的精密度均小于8.0%, 准确度在1.0%~10.0%之间。高脂血浆配制的每一浓度水平的帕珠沙星的质控样品的精密度均小于5.9%, 准确度在-1.0%~4.7%之间。在本文的条件下可忽略溶血和高脂基质效应的影响。
2.6 回收率帕珠沙星在低、中、高三浓度的血浆样品中的平均回收率分别为85.8%、82.1%、78.6%, 相应的精密度分别为5.4%、3.3%、1.6%;帕珠沙星在低、中、高三浓度的耳溢液样品中的平均回收率分别为101.2%、119.9%、125.3%, 相应的精密度分别为1.9%、1.4%、1.1%。预处理方法的重现性较好。
2.7 稳定性血浆、全血及耳溢液样品匀浆液在各种稳定性考察条件下测定值的准确度均在-11.0%~ 12.1%之间, 帕珠沙星血浆及耳溢液样品在本文选定的储存条件下均稳定。
3 药动学研究3名患有CSOM的受试者单次单耳滴10滴0.1%甲磺酸帕珠沙星滴耳液(630 μg)后的血浆及耳溢液中帕珠沙星平均浓度随时间变化曲线见图 4。
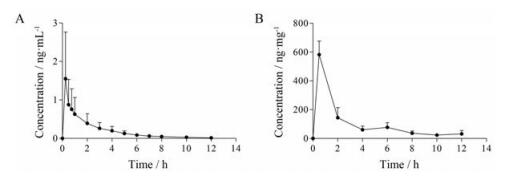
|
Figure 4 Mean plasma concentration-time (x ± s) profiles of pazufloxacin (A) and mean otorrhea concentration-time profiles of pazufloxacin (B) following a single-dose administration of 10 drops of 0.1% pazufloxacin ear drops in 3 patients with chronic suppurative otitis media (CSOM) |
甲磺酸帕珠沙星滴耳液给药量不足1 mg, 在经过耳部复杂的血迷路屏障后进入体循环的药物浓度极低。在血浆样品预处理条件考察时, 发现蛋白沉淀后上清液直接进样的灵敏度无法达到本实验LLOQ检测要求, 因此采用了蛋白沉淀处理后取上清液吹干浓缩法, 并采用20%甲醇水溶液作为复溶剂, 该方法提高了待测物的检测灵敏度, 通过梯度洗脱色谱分离最大程度地降低了基质效应的影响。
测定人耳溢液样品的方法建立过程中主要考察了耳溢液样品的预处理回收率。首先考察了帕珠沙星在拭子试管中的吸附性。将一定浓度的帕珠沙星溶液在拭子试管间经过3次转移, 测得3次转移后的帕珠沙星浓度与最初浓度的相对偏差在10%以内, 表明拭子试管对帕珠沙星无吸附。随后采取不同的处理方法优化帕珠沙星在拭子棉签上的回收率。在拭子试管中加入甲醇400 μL, 并取100 ng·mL-1的帕珠沙星溶液50 μL滴于拭子棉签上, 涡流混匀1 min, 测得帕珠沙星浓度仅为理论浓度的28%, 继续涡流混匀15 min, 测得帕珠沙星浓度为理论浓度的71%。为进一步提高回收率, 用甲醇400 µL冲洗并挤压拭子棉签, 重复两次, 涡流混匀, 最终试管中帕珠沙星浓度约为理论浓度的100%, 且该操作具有较好的重现性。
药动学研究测得血浆中帕珠沙星平均峰浓度Cmax为1.56 ± 2.1 ng·mL-1 (0.62~3.96 ng·mL-1), 不足临床口服剂量(200 mg)平均峰浓度(2 980 ng·mL-1)[13]的千分之一。测得耳溢液中帕珠沙星平均峰浓度Cmax为582 ± 162 ng·mg-1。若将耳溢液的浓度视为1 g·mL-1, 则该浓度约为血浆中Cmax的4×105倍。在给药12 h后, 耳溢液中帕珠沙星浓度低于Cmax的1/20, 但依旧高于血浆中Cmax的2×104倍。
本实验建立了快速、灵敏的LC-MS/MS法测定人血浆及耳溢液中帕珠沙星的浓度, LLOQ分别为0.010 0 ng·mL-1和0.500 ng·mg-1, 在局部滴耳帕珠沙星630 μg时可评价血浆和耳溢液中药物浓度至给药后12 h。药动学研究表明, 滴耳液可使耳溢液中帕珠沙星浓度在较长时间内维持较高水平, 而血浆中的帕珠沙星浓度不足5 ng·mL-1, 这为CSOM患者使用喹诺酮类抗生素滴耳液提供了安全性保障。
作者贡献:陈笑艳提供优质的质谱平台, 并指导和修改论文; 李冉冉、马媛媛参与实验并给出宝贵的参考意见; 林海霞提供资源丰富的联合培养平台。
利益冲突:无任何利益冲突。
| [1] |
Andriole VT. The quinolones:past, present, and future[J]. Clin Infect Dis, 2005, 41. |
| [2] |
Shi X H, Zheng Y, Ma W S, et al. Possible involvement of DEC1 on the adverse effects of quinolone antibiotics[J]. Toxicology, 2010, 271: 1-4. DOI:10.1016/j.tox.2010.03.001 |
| [3] |
Neuman MG, Cohenc LB, Nanau RM. Quinolones-induced hypersensitivity reactions[J]. Clin Biochem, 2015, 48: 716-739. DOI:10.1016/j.clinbiochem.2015.04.006 |
| [4] |
Simonson W. Antibiotic stewardship:revisiting quinolone antibiotics[J]. Geriatr Nurs, 2017, 38: 152-153. DOI:10.1016/j.gerinurse.2017.03.008 |
| [5] |
U. S.Food and Drug Administration. Updates Warnings for Fluoroquinolone Antibiotics[EB/OL]. 2016[2020-04-22].https://www.fda.gov/news-events/press-announcements/fda-updates-warnings-fluoroquinolone-antibiotics..
|
| [6] |
Spektor Z, Jasek MC, Jasheway D, et al. Pharmacokinetics of CIPRODEX otic in pediatric and adolescent patients[J]. Int J Pediatr Otorhinolaryngol, 2008, 72: 97-102. DOI:10.1016/j.ijporl.2007.09.017 |
| [7] |
Ohyama M, Furuta S, Ueno K, et al. Ofloxacin otic solution in patients with otitis media[J]. Otolaryng Head Neck, 1999, 125: 337-340. DOI:10.1001/archotol.125.3.337 |
| [8] |
Mair EA, Moss JR, Dohar JE, et al. Randomized clinical trial of a sustained-exposure ciprofloxacin for intratympanic injection during tympanostomy tube surgery[J]. Ann Otol Rhinol Laryngol, 2016, 125: 105-114. DOI:10.1177/0003489415599001 |
| [9] |
King EB, Salt AN, Eastwood HT, et al. Direct entry of gadolinium into the vestibule following intratympanic applications in Guinea pigs and the influence of cochlear implantation[J]. J Assoc Res Otolaryngol, 2011, 12: 741-751. DOI:10.1007/s10162-011-0280-5 |
| [10] |
Salt AN, King EB, Hartsock JJ, et al. Marker entry into vestibular perilymph via the stapes following applications to the round window niche of Guinea pigs[J]. Hear Res, 2012, 283: 14-23. DOI:10.1016/j.heares.2011.11.012 |
| [11] |
Glueckert R, Chacko LJ, Rask-Andersen H, et al. Anatomical basis of drug delivery to the inner ear[J]. Hear Res, 2018, 368: 10-27. DOI:10.1016/j.heares.2018.06.017 |
| [12] |
Salt AN, Plontke SK. Pharmacokinetic principles in the inner ear:influence of drug properties on intratympanic applications[J]. Hear Res, 2018, 368: 28-40. DOI:10.1016/j.heares.2018.03.002 |
| [13] |
Yamaki KI, Hasegawa T, Matsud I, et al. Pharmacokinetic characteristics of a new fluoroquinolone, pazufloxacin, in elderly patients[J]. J Infect Chemother, 1997, 3: 97-102. DOI:10.1007/BF02490182 |
 2020, Vol. 55
2020, Vol. 55


