2. 上海中药标准化研究中心, 上海 201203;
3. 江苏康缘制药有限公司, 江苏 连云港 222001
2. Shanghai R & D Center for Standardization of Chinese Medicines, Shanghai 201203, China;
3. Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China
红参为五加科植物人参(Panax ginseng C.A. Mey.)的栽培品经浸润、清洗、分选、蒸制、晾晒、烘干加工而成, 颜色由白变红。《中国药典》2015版记载[1], 红参可用于气不摄血, 崩漏下血。现代药理活性表明, 红参具有抗氧化、抗肿瘤、平喘、免疫抑制等药理作用[2-6]。化学成分主要有人参二醇(PPD)、人参三醇型(PPT)和齐墩果烷(OA)型人参皂苷。研究发现, 人参皂苷Ro在红参中大量存在, 其含量仅次于Rb1和Re[7]。人参皂苷Ro为五环OA型皂苷, C-3和C-28位连接糖链, 具有抗炎、抗衰老、抗氧化、抗血栓等多种药理作用。人参皂苷Ro对急性肝炎抑制作用强于齐墩果酸、甘草酸及其苷元[8], 同时具有治疗由UV-B辐射引起的皮肤老化[9]。此外, 人参皂苷Ro可抑制αIIb/β3介导纤维蛋白结合, 从而预防血小板聚集介导的血栓性疾病[10]。现行标准仅对PPT的Rg1和Re, PPD的Rb1进行限定, 忽视了红参中含量较高且活性较好的OA型人参皂苷Ro, 显然存在不合理之处。
目前, 红参中人参皂苷定量分析主要是对人参二醇型人参皂苷Rb1、Rc、Rb2和人参三醇型人参皂苷Rg1、Re等的测定[11]。Liu等[12]采用高效液相色谱串联紫外测定不同产地和时期齐墩果烷型人参皂苷Ro变化规律, 但该方法检测时间较长, 且人参皂苷Ro未达到基线分离。Wang等[7]采用超高效液相色谱串联质谱测定红参中人参皂苷Ro, 质谱存在价格昂贵、重现性较差等特点。因此, 有必要建立一种高效、廉价、操作简便的高效液相色谱方法, 用于测定人参皂苷Ro及其他活性成分。此外, 不同年份红参具有不同的化学成分和药理作用, 从外观很难鉴别不同生长年份红参。不同年份红参中人参皂苷含量差异不大, 难以通过含量对比鉴别不同年份红参[13]。研究表明, 通过对比人参皂苷Ro与Re的比值, 可以区别不同生长时期人参药材[12]。
针对现行质量控制方法存在指标性成分不合理、样品处理复杂、色谱条件保留时间过长、检测成本高等缺陷。本研究以人参皂苷Rg1、Re、Rb1和Ro为指标型成分, 以人参皂苷Ro/Re为限定值, 采用核壳色谱技术, 对提取条件、色谱条件等方面进行优化, 并对43批不同年限红参药材进行测定, 区分不同年份红参, 从而对红参药材及红参产品质量控制提供实验依据。
材料与方法仪器与试剂 安捷伦1260 Infinity II高效液相色谱仪(包括G1321型在线真空脱气机、1311A型四元泵、1367B型自动进样器、1316A型恒温箱、可变波长检测器); Sartorius BSA 124S-CW电子分析天平(北京赛多利斯仪器有限公司); Sartorius BT25S电子分析天平(北京赛多利斯仪器有限公司); KQ-250DB数控超声仪(昆山市超声仪器有限公司)。人参皂苷Rg1 (批号: PRF10031209)、Re (批号: PRF9030201)、Rb1 (批号: PRF10060602)、Ro (批号: PRF9121001)购于成都普瑞法科技开发有限公司, 纯度大于98%。超纯水, 甲醇(国药集团化学试剂有限公司), 乙腈和磷酸(色谱纯, 美国Fisher公司)。
实验材料 此次供研究用的43批红参药材(表 1)主要产地包括黑龙江、吉林、辽宁等东北三省份, 生长年限包括4、5、6年, 由不同生产药厂炮制而成, 其性状与《中国药典》2015年版(P153)规定一致, 均为正品红参, 具有较好的代表性。经上海中药标准化研究中心吴立宏研究员收集并鉴定, 标本保存在上海中药标准化研究中心。
| Table 1 Samples from 43 batches of red ginseng (HS) |
HPLC色谱条件 色谱柱为Thermo Accucore C18 (4.6 mm×150 mm, 2.6 μm), 柱温25 ℃; 流动相:乙腈(A)-0.1%磷酸水溶液(B); 梯度洗脱: 0~15 min, 19% A; 15~30 min, 19%~30% A; 30~50 min, 30% A。流速: 0.8 mL·min-1; 进样量: 10 μL; 检测波长: 203 nm。
对照品储备液制备 精密称取人参皂苷Rg1 (7.01 mg)、Re (8.33 mg)、Rb1 (9.63 mg)、Ro (6.86 mg), 溶于5 mL量瓶, 加甲醇稀释至刻度, 摇匀, 作为对照品储备液。
供试品溶液制备 分别取样品(过4号筛)红参粉末1 g, 精密称定, 置于100 mL锥形瓶中, 加入70%甲醇25 mL, 称定重量, 超声处理(功率250 W, 频率100 kHz) 50 min, 补足失重, 滤过, 弃去初滤液, 作为供试品溶液。
系统适用性 分别取混合标准品和样品, 按上述色谱条件进样分析。色谱峰分离度: Rg1和Re两峰之间分离度大于2, Rb1与其相邻峰分离度大于1.6, Ro与其相邻峰分离度大于1.6。拖尾因子: Rg1, 1.4~1.5; Re, 1.35~1.45; Rb1, 0.9~1.1; Ro, 1.35~1.45。理论板数按人参皂苷Rg1、Re、Rb1、Ro峰计算, 应分别不小于28 000、42 000、10 000、78 000。
耐用性 考察流速变化对色谱峰的影响。比较流速在0.6、0.8和1.0 mL⸱min-1时, 色谱峰的变化。比较柱温在20、25和30 ℃时, 色谱峰的变化。分别选取Thermo Accucore C18 (4.6 mm×150 mm, 2.6 μm)、Waters CORTECS C18 (4.6 mm×150 mm, 2.7 μm)和Poroshell EC-C18 (4.6 mm×150 mm, 2.7 μm)进行检测, 考察不同品牌色谱柱对色谱分离影响。比较5种高效液相色谱仪, Agilent 1100、Agilent 1260、Agilent 1260 InfinityII VWD、Agilent 1260 InfinityII DAD和Waters 2695对色谱分离影响。
线性范围 精密吸取对照品储备溶液, 用甲醇稀释成不同浓度对照品溶液, 人参皂苷Ro浓度依次为343、171.5、85.75、42.88、21.44、10.72 μg⸱mL-1; 人参皂苷Rg1浓度依次为350.5、175.25、87.63、43.81、21.91、10.95 μg⸱mL-1; 人参皂苷Re浓度依次为416.5、208.25、104.13、52.06、26.03、13.02 μg⸱mL-1; 人参皂苷Rb1浓度依次为481.5、240.75、120.38、60.19、30.09、15.05 μg⸱mL-1。按“HPLC色谱条件”项测定。
精密度 按“HPLC色谱条件”项下测定已知浓度对照品, 一天重复测定5次, 连续测定3天, 计算保留时间和峰面积RSD值。
重复性 取红参粉末(HS-27) 1 g, 精密称定, 平行5份, 按“供试品溶液制备”项下方法制备供试品溶液, 按“HPLC色谱条件”测定。
稳定性 测定供试品溶液(HS-27), 分别在0、2、4、8、12、24、48 h时测定, 计算峰面积RSD值。
加样回收率 取人参皂苷Ro、Rg1、Re、Rb1对照品适量, 精密称定, 加甲醇溶解, 配制成质量浓度为Ro 0.3 mg⸱mL-1、Rg1 0.5 mg⸱mL-1、Re 0.3 mg⸱mL-1、Rb1 0.9 mg·mL-1的对照品溶液。取已知含量(人参皂苷Rg1、Re、Rb1、Ro含量分别为3.44、2.01、5.63和2.10 mg⸱g-1)的红参粉末(HS-7)约0.5 g, 精密称定, 按50%、100%和150%分别加入不同浓度的对照品溶液, 按“供试品溶液制备”项下方法制备溶液, 按“HPLC色谱条件”项下测定, 计算加样回收率。
样品含量测定 分别取不同产地、年限、药厂的43批红参, 粉碎过筛(4号筛), 称取约1 g, 精密称定。按“供试品溶液制备”项下方法制备供试品溶液。混合对照品用甲醇稀释成不同浓度, 注入液相色谱仪, 按外标法计算样品中人参皂苷Rg1、Re、Rb1和Ro的含量。
结果 1 方法学考察 1.1 专属性通过对比混合对照品溶液和供试品溶液色谱图, 考察方法专属性。典型色谱图如图 1所示。结果表明, 该方法专属性良好。
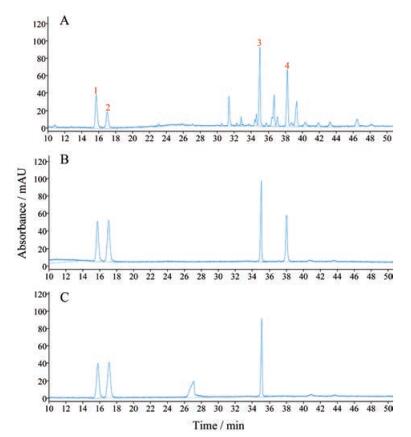
|
Figure 1 The typical chromatography of red ginseng (A), mix standard of mobile phase with 0.1% phosphoric acid solution (B), and mix standard of mobile phase with water (C). Peak 1: Ginsenoside Rg1; peak 2: Ginsenoside Re; peak 3: Ginsenoside Rb1; peak 4: Ginsenoside Ro |
随流速的增大, 色谱的保留时间整体后移, 被测定化合物色谱峰在不同流速下均满足测定要求(分离度大于1.5)。柱温在20~30 ℃之间, 对色谱峰影响不大。不同厂家色谱柱, 目标色谱峰的分离度均大于1.5。5种仪器测定样品, 色谱峰分离度大于1.5。
1.3 线性和范围分别以对照品浓度(x)为横坐标, 峰面积(y)为纵坐标, 计算分析物回归方程, 相关系数(R2)。以信噪比等于3和10分别计算检测限(LOD)和定量限(LOQ)。结果见表 2, 4种分析物的相关系数均≥0.999 8, 表明线性良好。
| Table 2 The calibration curve, linear range, regression, LOD, LOQ of ginsenoside Rg1, Re, Rb1 and Ro |
日内精密度, 计算人参皂苷Rg1、Re、Rb1、Ro保留时间RSD分别小于0.67%、0.42%、0.18%、0.13%, 峰面积RSD分别小于0.71%、0.81%、0.82%、1.46%。日间精密度, 计算人参皂苷Rg1、Re、Rb1、Ro保留时间RSD分别等于0.93%、0.62%、0.26%、0.19%, 峰面积RSD分别等于1.31%、1.28%、1.03%、1.64%, 表明精密度良好。
1.5 重复性结果表明人参皂苷Rg1、Re、Rb1、Ro平均含量分别为2.35、1.82、4.22、2.45 mg·g-1, RSD分别为0.37%、0.68%、1.01%、1.63%, 说明方法重复性良好。
1.6 稳定性人参皂苷Rg1、Re、Rb1、Ro峰面积RSD分别是1.56%、1.43%、1.23%、1.89%, 表明被分析物在48 h内稳定。
1.7 加样回收率结果表明, 人参皂苷Rg1回收率在97.72%~104.62%之间, RSD≤2.97%;人参皂苷Re在97.01%~100.61%之间, RSD≤2.74%;人参皂苷Rb1回收率在94.32%~96.53%之间, RSD≤1.89%;人参皂苷Ro回收率在94.44%~103.28%之间, RSD≤2.72%。
2 药材样品测定结果及含量限度制定结果显示(表 3), 43批不同来源红参药材中人参皂苷Ro含量范围为0.13%~0.43%, 平均含量为0.26%。人参皂苷Rg1含量范围为0.08%~0.37%, 平均含量为0.26%。人参皂苷Re含量范围为0.06%~0.41%, 平均含量为0.16%。人参皂苷Rb1含量范围为0.28%~0.91%, 平均含量为0.46%, 高于现行标准含量(0.20%)近一倍。结果表明, 红参中含有人参皂苷Rb1最多, 人参皂苷Ro次之, 人参皂苷Re含量最低。若取含量测定结果均值的80%作为红参中人参皂苷Rg1、Re、Rb1、Ro的含量限度, 则暂定为:本品按干燥品计算, 含人参皂苷Rg1和Re总量不得少于0.33%; Rb1不得少于0.37%; Ro不得少于0.20%。
| Table 3 The content of ginsenoside Rg1, Re, Rb1 and Ro in red ginseng (n = 2, x± s, mg·g-1) |
随生长年限的增加, 人参皂苷Rg1和Re平均含量逐渐减少, 但变化不显著。人参皂苷Rb1出现无规律变化, 人参皂苷Ro逐渐增加(图 2A)。4年生人参总皂苷甚至高于5年和6年生, 仅从有效成分含量限定, 无疑助长了商家采用4年生人参进行炮制。计算实验中所用的43批红参药材中人参皂苷Ro/Re的值, 见图 2B。发现随生长年限增加, 红参中人参皂苷Ro/Re的值逐渐升高。当限定值设为1.3时, 100%的6年生红参大于1.3, 94.4%的5年生红参大于1.3, 同时46.6%的4年生红参大于1.3。当限定值为1.5时, 90%的6年生红参大于1.5, 72%的5年生红参大于1.5, 40%的4年生红参大于1.5。当限定值为1.8时, 80%的6年生红参大于1.8, 27.7%的5年生红参大于1.8, 0.67%的4年生红参大于1.8。综上, 为限制4年人参进行红参炮制, 同时保证5年和6年大部分合格, 建议将人参皂苷Ro/Re的限定值设为1.3。
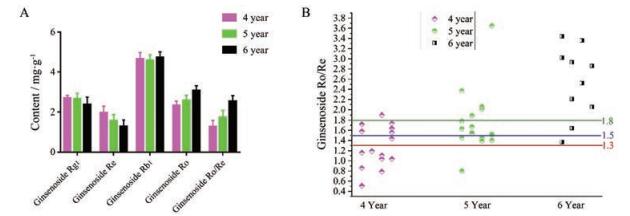
|
Figure 2 The average content of ginsenoside Rg1, Re, Rb1, Ro and Ro/Re (A) and the scatter plot of ginsenoside Ro/Re for all of 43 batches red ginseng (threshold of 1.3, 1.5 and 1.8 in the line) (B) |
比较2015版《中国药典》中红参“含量测定”项下供试品溶液制备与甲醇提取方法, 发现甲醇提取效率优于药典方法, 且甲醇提取后样品可直接进样, 无需进行后续步骤, 因此, 提取溶剂选择甲醇。为达到最佳提取效率, 比较了不同浓度的甲醇水溶液, 结果显示70%甲醇水溶液提取效率优于其他比例。比较了不同超声时间对人参皂苷提取效率的影响, 结果显示超声50 min明显好于其他时间。随料液比值增加, Rg1、Re和Rb1提取效率逐渐增大, Ro逐渐变小, 但变化均不显著, 为减少有机溶剂使用, 选取1:25为最终提取料液比。因此, 优化后红参样品提取方法简化了样品制备步骤、缩短制备时间、减少了试剂使用量, 可以达到甚至高于原药典提取效率。从而实现了简便、低毒、高效的目的。
对色谱条件进行优化, 发现流动相水相中添加0.1%磷酸, 人参皂苷Ro峰形明显改善, 而流动相为纯水, Ro峰形较差, 响应较低, 且保留时间漂移(图 1)。这可能是由于流动相中添加了磷酸使固体吸附剂质子化, 从而使人参皂苷Ro与分析柱中固体吸附剂相互作用更好[14]。。对比填料为普通C18和新型核壳色谱技术发现, 普通C18柱分离人参皂苷Rg1和Re需50~60 min, 而核壳色谱柱在20 min以内便可达到基线分离(分离度大于1.5)。核壳色谱柱由实心核和包裹实心核的多孔核层组成, 具有柱效高和柱压低的特点。研究发现其对黄芪、虎杖等复杂中药体系也具有较好的分离效果[15, 16]。通过对柱温、流速、流动相梯度优化, 红参中人参皂苷Rg1、Re、Rb1和Ro在50 min便可全部达到基线分离, 该方法比当前方法约省去一半时间。
人参皂苷Ro具有多种活性作用。对43批红参定量测定结果表明, 人参皂苷Ro平均含量低于人参皂苷Rb1、高于人参皂苷Rg1和Re, 与Wang等[7]测定红参中5种皂苷含量一致。此外, 人参皂苷Rb1平均含量为0.46%, 远高于现行质量标准的0.20%。综上, 应该增加人参皂苷Ro为指标成分, 且不少于0.20%, 人参皂苷Rb1限定标准应提升至不少于0.36%。同时, 人参皂苷Ro/Re作为不同生长年限红参的重要参考值, 为限制4年及以下商品红参药材, 建议人参皂苷Ro/Re的比值不得低于1.3。
作者贡献:杨远贵负责实验设计、样品收集、实验数据采集与分析、文章撰写; 杨颖博协助实验数据采集; 鞠政财协助数据分析; 张艳海协助液相色谱方法开发; 杨莉负责数据核对与文章修改; 王峥涛负责提供实验思路与设计。
利益冲突:所有作者均无利益冲突。
| [1] |
Chinese Pharmacopeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2015: 153.
|
| [2] |
Lee MR, Yun BS, In OH, et al. Comparative study of Korean white, red, and black ginseng extract on cholinesterase inhibitory activity and cholinergic function[J]. J Gins Res, 2011, 35: 421-428. DOI:10.5142/jgr.2011.35.4.421 |
| [3] |
Sohn SH, Kim SK, Kim YO, et al. A comparison of antioxidant activity of Korean white and red ginsengs on H2O2-induced oxidative stress in HepG2 hepatoma cells[J]. J Gins Res, 2013, 37: 442-450. DOI:10.5142/jgr.2013.37.442 |
| [4] |
Wu W, Sun L, Zhang Z, et al. Profiling and multivariate statistical analysis of Panax ginseng based on ultra-high-performance liquid chromatography coupled with quadrupole-time-of-flight mass spectrometry[J]. J Pharm Biomed, 2015, 107: 141-150. DOI:10.1016/j.jpba.2014.12.030 |
| [5] |
Sun BS, Pan FY, Sung CK. Repetitious steaming-induced chemical transformations and global quality of black ginseng derived from Panax ginseng by HPLC-ESI-MS/MSn based chemical profiling approach[J]. Biotechnol Bioprocess Eng, 2011, 16: 956-965. DOI:10.1007/s12257-011-0079-6 |
| [6] |
Fishbein AB, Wang CZ, Li XL, et al. Asian ginseng enhances the anti-proliferative effect of 5-fluorouracil on human colorectal cancer:comparison between white and red ginseng[J]. Arch Pharm Res, 2009, 32: 505-513. DOI:10.1007/s12272-009-1405-9 |
| [7] |
Wang M, Zhao ZX, Liu YL, et al. Simultaneous determination of five ginsenoside in red ginseng by UPLC[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2019, 30: 56-58. |
| [8] |
Matsuda H, Samukawa K, Kubo M. Anti-hepatitis activity of ginsenoside Ro[J]. Planta Med, 1991, 57: 523-526. DOI:10.1055/s-2006-960198 |
| [9] |
Kang HJ, Oh Y, Lee S, et al. Antioxidative properties of ginsenoside Ro against UV-B-induced oxidative stress in human dermal fibroblasts[J]. Biosci Biotechnol Biochem, 2015, 79: 2018-2021. DOI:10.1080/09168451.2015.1065170 |
| [10] |
Shin JH, Kwon HW, Cho HJ, et al. Vasodilator-stimulated phosphoprotein-phosphorylation by ginsenoside Ro inhibits fibrinogen binding to αⅡb/β3 in thrombin-induced human platelets[J]. J Gins Res, 2016, 40: 359-365. DOI:10.1016/j.jgr.2015.11.003 |
| [11] |
Wang Y, Choi HK, Brinckmann JA, et al. Chemical analysis of Panax quinquefolius (North American ginseng):a review[J]. J Chromatogr A, 2015, 1426: 1-15. DOI:10.1016/j.chroma.2015.11.012 |
| [12] |
Liu Z, Wang CZ, Zhu XY, et al. Dynamic changes in neutral and acidic ginsenosides with different cultivation ages and harvest seasons:identification of chemical characteristics for Panax ginseng quality control[J]. Molecules, 2017, 22: 734. DOI:10.3390/molecules22050734 |
| [13] |
Chung IM, Kim JW, Seguin P, et al. Ginsenosides and phenolics in fresh and processed Korean ginseng (Panax ginseng C.A. Meyer):effects of cultivation location, year, and storage period[J]. Food Chem, 2012, 130: 73-83. DOI:10.1016/j.foodchem.2011.06.056 |
| [14] |
Park HW, In G, Han ST, et al. Simultaneous determination of 30 ginsenosides in Panax ginseng preparations using ultra performance liquid chromatography[J]. J Gins Res, 2013, 37: 457. DOI:10.5142/jgr.2013.37.457 |
| [15] |
Tang D, Shen YB, Wang ZH, et al. Rapid analysis and guided isolation of Astragalus isoflavonoids by UHPLC-DAD-MSn and their cellular antioxidant defense on high glucose induced mesangial cells dysfunction[J]. J Agric Food Chem, 2018, 66: 1105-1113. DOI:10.1021/acs.jafc.7b02949 |
| [16] |
Tang D, Zhu JX, Wu AG, et al. Pre-column incubation followed by fast liquid chromatography analysis for rapid screening of natural methylglyoxal scavengers directly from herbal medicines:case study of Polygonum cuspidatum[J]. J Chromatogr A, 2013, 1286: 102-110. DOI:10.1016/j.chroma.2013.02.058 |
 2020, Vol. 55
2020, Vol. 55


