结核病是由结核分枝杆菌引起的传染性疾病, 根据世界卫生组织(World Health Organization, WHO) 2019年的报告显示, 目前全球约有17亿人口为结核分枝杆菌携带者, 2018年全世界新增约1千万名结核病患者, 约有145万名患者因感染结核分枝杆菌而死亡, 结核病是目前致死率排名前十的疾病之一, 其致死率高于艾滋病[1]。
2015年, WHO和UN (United Nations)在抗结核病方面均做出承诺, 计划到2030年结核病的死亡率和发病率相比于2015年分别下降90%和80%[2]。根据2018年的数据, 该目标的达成遇到巨大阻力, 这与多方面因素有关。目前公认区域性经济落后、HIV病毒感染导致免疫力下降和耐药性问题是全球结核病持续蔓延的主要因素。以耐药性问题为例, 耐药性结核病包括多重耐药结核病(multidrug-resistant TB, MDR-TB)、广泛耐药结核病(extensively drug-resistant TB, XDR-TB)。目前通过标准四药联用方案, 即异烟肼(isoniazid, H)、利福平(rifampicin, R)、吡嗪酰胺(pyrazinamide, Z)和乙胺丁醇(ethambutol, E)的联合使用, 最短6个月就能治愈1名敏感性结核病患者。而针对耐药性结核病的治疗, 临床上会引入二线和三线抗结核药物, 治疗需要延长至12到24个月, 同时伴随着较大的不良反应, 但对于MDR-TB的治愈率只有60%[3]。因此, 治疗耐药性结核病的关键在于寻找安全高效, 具有新作用靶点, 同时不与其他抗结核药物和抗逆转录病毒药物产生相互作用的药物, 从而组建更多元的联合用药方案, 达到最高疗效[4]。
1 分枝菌酸与聚酮合成酶13 (Pks13)分枝菌酸是结核分枝杆菌细胞壁的重要组成成分, 对稳定细胞壁结构, 维持其致密性以及耐受抗生素都起着关键作用[5]。通过切断合成分枝菌酸的通路, 破坏结核分枝杆菌的细胞壁, 除可以产生抗结核作用外, 还能提高其他抗结核药物在菌体内的浓度, 增强其他药物的抗结核活性, 在组建新的联合用药方案上有更大的选择空间。目前临床上应用的药物以及处在研究阶段的化合物多数都作用于分枝菌酸的生物合成通路, 如异烟肼、乙胺丁醇、SQ109等[5]。
分枝菌酸是一类长链脂肪酸, 其结构于1950年被报道[6]。分枝菌酸除了作为外膜和细胞壁的组成成分, 还有研究表明其结构与结核分枝杆菌的传染能力有关[7]。分枝菌酸的合成发生在细胞质内, 其合成通路(图 1)大体如下, 首先由FAS Ⅰ (fatty acid synthase types Ⅰ)和FAS Ⅱ (fatty acid synthase types Ⅱ)循环分别合成acyl-CoA和meroacyl-ACP。之后在FabD32的催化下, meroacyl-ACP变为meromycolyl-AMP; acyl-CoA在AccD4/AccD5的催化下变为2-carboxyl-acyl-CoA。最后在聚酮合成酶13 (Pks13)的催化下, meromycolyl-AMP和carboxyl-acyl-CoA连接形成分枝菌酸前体α-alkyl-β-ketoacyl derivatives[8, 9]。
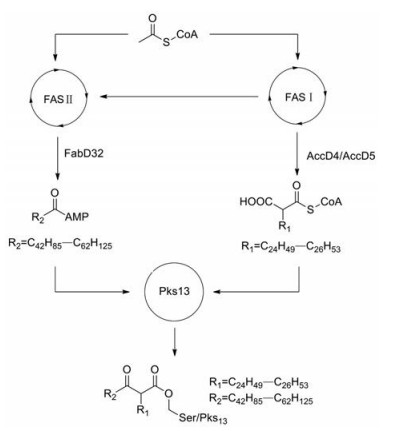
|
Figure 1 Biosynthetic pathway of α-alkyl-β-ketoacyl derivatives |
Pks13是聚酮合成酶(polyketide synthases)家族的一员[10]。该酶由5个结构域构成, 包括酮基合成酶结构域(keto synthase domain, KS)、酰基转移酶结构域(acyltransferase domain, AT)、两个酰基载体蛋白结构域(acyl-carrier protein domain, ACP)和硫酯酶结构域(thioesterase domain, TE)。Pks13通过介导克莱森缩合(Claisen-type condensation)合成分枝菌酸的关键前体, 在分枝菌酸的合成通路中占有重要地位, 抑制Pks13将会阻碍分枝菌酸的生物合成, 进而导致结核分枝杆菌死亡, 因此, Pks13是非常有前景的抗结核药物作用靶标。本文将简要介绍目前Pks13抑制剂的研究进展。
2 Pks13抑制剂 2.1 噻吩类Wilson等[11]基于全细胞筛选发现一类噻吩化合物具有抗结核活性, 进一步通过耐药突变和Pks13过表达测试表明该类化合物以Pks13为作用靶标。
TP2和TP4 (图 2)是其中活性最好的化合物, 对结核分枝杆菌H37Rv的MIC (最小抑菌浓度)值分别为1.0 μmol·L-1 (0.419 μg·mL-1)和0.5 μmol·L-1 (0.211 μg·mL-1), 并且对多重耐药菌株和广泛耐药菌株表现出良好的抑菌活性。TP2或TP4与异烟肼或利福平联用时, 表现出协同的抗结核活性, 活性与异烟肼和利福平联用时基本相当。随后Thanna等[12]对噻吩化合物进行优化, 得到先导化合物1 (图 2), 化合物1对结核分枝杆菌H37Rv的MIC值为0.23 μmol·L-1 (0.103 μg·mL-1), 对耐药菌株的MIC值为0.20~0.44 μmol·L-1 (0.090~0.197 μg·mL-1), 同时其杀菌活性(MBC)小于5 μmol·L-1 (2.24 μg·mL-1)。但化合物1对巨噬细胞内的结核分枝杆菌抑制活性IC90 = 9.75 μmol·L-1 (4.37 μg·mL-1)弱于异烟肼, 同时该化合物对THP-1细胞的IC50值为6.2 μmol·L-1 (2.78 μg·mL-1), 其安全性有待进一步提高。
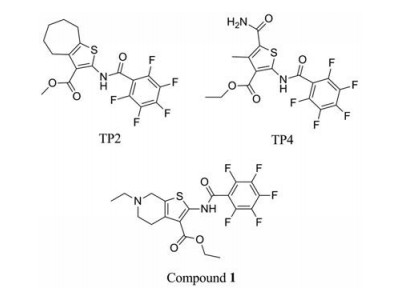
|
Figure 2 The structures of thiophene compounds |
噻吩类Pks13抑制剂的构效关系可归纳如下(图 3): ①五氟苯基酰胺是其抗结核活性所必需; ② 3位形成酯键, 其抗结核活性更好, 酯键替换为酰胺键, 活性下降5到15倍, 酯键水解为羧酸后, 其抗结核活性丧失; ③ 4和5位形成哌啶环是化合物1抗结核活性所必需, N上连接大位阻基团如金刚烷基等其抗结核活性丧失, 替换为环己烷后活性下降40倍; ④ 4和5位开环是可接受的, 5位酰胺有利于活性。
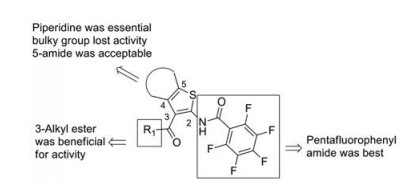
|
Figure 3 Structure-activity relationships of thiophene compounds |
Ioerger等[13]建立了全细胞筛选和耐药突变全基因组测序平台, 利用该平台研究人员发现一系列结构新颖的抗结核化合物, 进一步的研究表明苯并呋喃类化合物TAM1 (图 4)的作用靶标为Pks13, 其对结核分枝杆菌H37Rv的MIC值为2.0 μmol·L-1 (0.787 μg·mL-1)。随后Aggarwal等[14]对TAM1开展了基于结构的改造, 发现了活性更强成药性更好的化合物TAM16。其对结核分枝杆菌H37Rv的MIC值为0.09 μmol·L-1 (0.034 μg·mL-1), 对耐药菌株的MIC值为0.05~0.42 μmol·L-1 (0.019~0.160 μg·mL-1)。在类药性评估中, TAM16表现出良好的药代动力学性质, 口服生物利用度为28%, 同时没有明显地抑制细胞色素P450和hERG钾通道的作用。此外, TAM16产生耐药性的频率比异烟肼要低约100倍。在小鼠体内模型中, 200 mg·kg-1 TAM16给药2周后与异烟肼产生相似的抗结核活性, 同时, 200 mg·kg-1 TAM16和10 mg·kg-1利福平联用后, 肺部感染菌数降低3.9log10CFU, 与异烟肼和利福平联合给药时活性相当。TAM16是很有前景的抗结核候选药物。研究者还获得了TAM1和TAM16与Pks13的复合物晶体结构, 进一步证实了化合物的作用靶标, 为后续Pks13抑制剂的研发提供了指导。
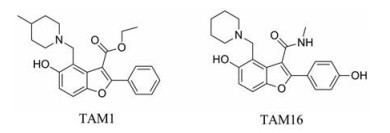
|
Figure 4 The structures of benzofurans |
苯并呋喃类Pks13抑制剂的构效关系可归纳如下(图 5): ①苯并呋喃环是其抗结核活性的基础, 能够与Phe1670残基上的苯环产生π-π堆积作用; ②5位羟基是其抗结核活性所必需, 能够与Asp1644残基产生氢键作用, 用甲氧基取代后活性下降; ③4位曼尼希碱是其抗结核活性所必需, 用氢原子取代后活性丧失, 用哌啶环构建曼尼希碱, 化合物的抗结核活性最佳; ④ 3位形成酰胺键, 化合物的稳定性更好, 水解成羧酸后, 其抗结核活性丧失; ⑤苯环的4′位羟基, 不但可以增强化合物在体内的稳定性, 同时能够与靶点的Gln1633残基形成氢键, 使其抗结核活性更好。
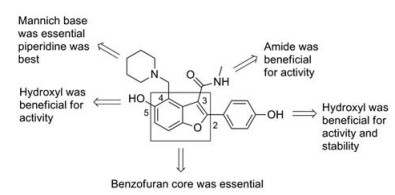
|
Figure 5 Structure-activity relationships of benzofurans |
Zhang等[15]针对苯并呋喃类化合物TAM1采用基于天然产物的环合改造策略, 将酯键中的氧原子与邻位苯环的2′位连接起来, 构建出以香豆雌酚(coumestan)为母核的化合物, 其中化合物2 (图 6)的抗结核活性最好, 对结核分枝杆菌H37Rv的MIC值为0.125~0.25 μg·mL-1。经实验验证, 该类化合物的作用靶点为Pks13。同时SIT (serum inhibition titration)实验表明, 含有酯键的TAM1很快水解, 30 min后提取的血清对结核分枝杆菌H37Rv无杀菌活性; 以香豆雌酚作为母核的化合物稳定性更优, 120 min时提取的血清对结核分枝杆菌H37Rv仍具有杀菌活性。
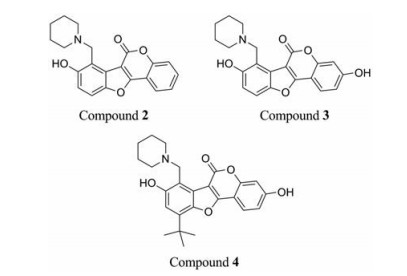
|
Figure 6 The structures of coumestans |
随后, 作者对化合物2进行进一步优化[16], 得到化合物3和化合物4 (图 6), 其对结核分枝杆菌H37Rv的MIC值分别达到0.003 9和0.007 8 μg·mL-1, 同时对多重耐药菌株和广泛耐药菌株具有相同的杀菌活性。对Vero细胞的IC50值为4和8 μg·mL-1, SI (selectivity index)值达到1 000以上, 具有较好的安全性。在SIT实验中化合物3表现出优于TAM16的抗结核活性, 同时具有较好的代谢稳定性。
香豆雌酚类Pks13抑制剂的构效关系可归纳如下(图 7): ①两个酚羟基分别与靶点的Asp1644和Gln1633形成氢键, 是其抗结核活性所必需; ②曼尼希碱同样是其抗结核活性所必需, 用哌啶环构建曼尼希碱, 化合物的抗结核活性最佳, 内酰胺使活性丧失; ③ A环上7位连接给电子基团, 可以提高抗结核活性。
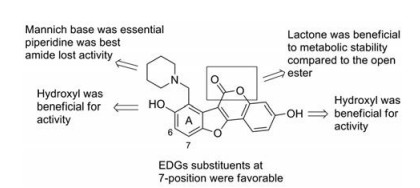
|
Figure 7 Structure-activity relationships of coumestans |
奥利司他(orlistat)是FDA批准上市的治疗肥胖症的药物(图 8), 研究证实奥利司他可以靶向分枝杆菌中许多的脂质酯酶(丝氨酸酯酶)[17], 通过抑制Ag85C、Rv3802、Pks13-TE三种结核分枝杆菌生物合成所必需的脂质酯酶, 从而抑制结核分枝杆菌的生长[18]。然而, 奥利司他对脂质酯酶的非特异性靶向性, 使得其对于结核分枝杆菌H37Rv的MIC值为15 μmol·L-1 (7.44 μg·mL-1)。目前奥利司他以及其衍生物在增强活性、延长酶的停留时间和增加结构的特异性等方面都需要进一步的改善。
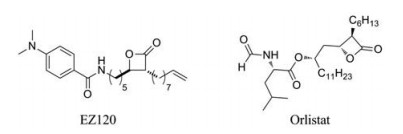
|
Figure 8 The structures of β-lactone Pks13 inhibitors |
EZ120及其衍生物是以Pks13和Ag85丝氨酸水解酶作为主要的靶点, 对结核分枝杆菌H37Rv表现出1.6 μmol·L-1 (0.686 μg·mL-1)的最小抑菌浓度(MIC), 并且其最小杀菌浓度(MBC)为6 μmol·L-1 (2.57 μg·mL-1)。此外, 与MIC值相比, EZ120对小鼠巨噬细胞的细胞毒性EC50高出200倍以上[19]。EZ120代表了一种活化的β-羟基酸和分枝菌酸的结构同源物, 在结核分枝杆菌细胞壁的生物合成中, 与至关重要的水解酶的结合位点结合。EZ120具有MIC和MBC低、对人体细胞毒性低、能够极好的穿透细胞膜等特点, 同时可以靶向细胞壁生物合成的必需酶, 使EZ120成为研究分枝菌酸生物合成水解酶的重要化合物。通过对其化学结构的进一步优化, 可以为新的结核分枝杆菌Pks13抑制剂研发提供思路。
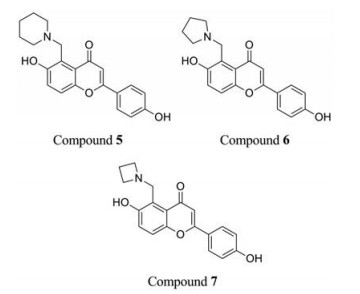
2.5 黄酮类鉴于Pks13在分枝菌酸生物合成中的重要性以及苯并呋喃类化合物TAM16良好的成药性, 本课题组采用骨架跃迁策略设计了一系列黄酮类化合物[20]。为了验证黄酮骨架的可行性, 首先合成化合物5 (图 9), 其对结核分枝杆菌的MIC值为3.84 μg·mL-1。通过分子对接技术, 发现5与TAM16在Pks13的TE结构域中构象相似。
|
Figure 9 The structures of flavones |
随后对5进行优化, 得到6和7 (图 9), 其对结核分枝杆菌H37Rv的MIC值分别为0.938和0.454 μg·mL-1, 对耐药菌株的MIC值为1.644~3.818 μg·mL-1。其中7对Vero细胞的IC50值为53.1 μg·mL-1, SI值为117, 具有较好的安全性。7具有良好的药代动力学性质, 口服生物利用度20.5%, 并且具有一定的体内抗结核活性。基于化合物7的结构优化正在进行。
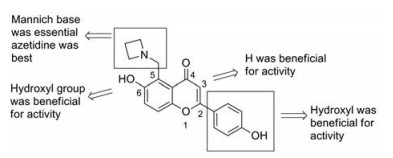
黄酮类Pks13抑制剂的构效关系可归纳如下(图 10): ① 6位羟基是其抗结核活性所必需, 能够与Asp1644产生氢键作用; ② 2位苯环上的酚羟基是其抗结核活性所必需, 能够与Gln1633和Ser1636产生氢键作用, 同时苯环能与Tyr1663产生π-π堆积作用; ③ 3位用氢原子取代, 有助于其抗结核活性, 用苯环、酯基或酰胺取代, 丧失抗结核活性; ④ 5位曼尼希碱同样是其抗结核活性所必需, 用氮杂环丁基构建曼尼希碱, 化合物的抗结核活性最佳。
|
Figure 10 Structure-activity relationships of flavones |
随着新药贝达喹啉(bedaquiline)和德拉马尼(delamanid)批准用于治疗多重耐药结核病, 以及包括linezolid、bedaquiline和pretomanid三种药物的Nix-TB疗法于2019年批准用于治疗广泛耐药、不耐受或者无反应的耐多药结核病, 对于MDR-TB和XDR-TB的治疗取得了一定的进展, 但目前世界范围结核病的形势依然严峻。
Pks13在分枝菌酸的生物合成中起到关键作用, 是非常有潜力的新型抗结核药物作用靶标。由于Pks13抑制剂具有完全不同于传统抗结核药物的作用机制, 不会和其他抗结核药物产生交叉耐药。同时, Pks13抑制剂对多重耐药菌株和广泛耐药菌株均呈现出良好的活性, 且未见其有影响细胞色素P450的作用, 预示其可能的药物-药物相互作用风险较低, 这将有助于组建新的联合用药方案。
但目前Pks13抑制剂的结构种类有限, 研究也并不充分, 并且现有抑制剂的半衰期普遍过短, 化合物在体内代谢较快。随着Pks13蛋白晶体结构的成功解析, 将给予研究者有力的支持。后续的研究应当基于Pks13蛋白晶体结构, 进一步改善已有先导化合物的成药性。同时, 可采用基于结构或配体的虚拟筛选技术方法发现更多结构新颖的Pks13抑制剂先导化合物, 进一步拓展Pks13抑制剂的结构类型, 为基于Pks13的抗结核药物研发奠定基础。
作者贡献: 丁威和赵文婷撰写论文初稿, 张东峰修改论文并定稿。
利益冲突: 本文无相关利益冲突。
| [1] |
World Health Organization. Global tuberculosis report 2019[R]. Geneva: WHO, 2019.
|
| [2] |
Lönnroth K, Raviglione M. The WHO's new end TB strategy in the post-2015 era of the sustainable development goals[J]. Trans R Soc Trop Med Hyg, 2016, 110: 148-150. DOI:10.1093/trstmh/trv108 |
| [3] |
Zumla A, Nahid P, Cole ST. Advances in the development of new tuberculosis drugs and treatment regimens[J]. Nat Rev Drug Discov, 2013, 12: 388-404. DOI:10.1038/nrd4001 |
| [4] |
Bahuguna A, Rawat DS. An overview of new antitubercular drugs, drug candidates, and their targets[J]. Med Res Rev, 2020, 40: 263-292. DOI:10.1002/med.21602 |
| [5] |
Marrakchi H, Lanéelle MA, Daffé M. Mycolic acids:structures, biosynthesis, and beyond[J]. Chem Biol, 2014, 21: 67-85. DOI:10.1016/j.chembiol.2013.11.011 |
| [6] |
Asselineau J, Lederer E. Structure of the mycolic acids of mycobacteria[J]. Nature, 1950, 166: 782-783. DOI:10.1038/166782a0 |
| [7] |
Vander Beken S, Al Dulayymi JR, Naessens T, et al. Molecular structure of the Mycobacterium tuberculosis virulence factor, mycolic acid, determines the elicited inflammatory pattern[J]. Eur J Immunol, 2011, 41: 450-460. DOI:10.1002/eji.201040719 |
| [8] |
Takayama K, Wang C, Besra GS. Pathway to synthesis and processing of mycolic acids in Mycobacterium tuberculosis[J]. Clin Microbiol Rev, 2005, 18: 81-101. DOI:10.1128/CMR.18.1.81-101.2005 |
| [9] |
Abrahams KA, Besra GS. Mycobacterial cell wall biosynthesis:a multifaceted antibiotic target[J]. Parasitology, 2018, 145: 116-133. DOI:10.1017/S0031182016002377 |
| [10] |
Cole ST, Brosch R, Parkhill J, et al. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence[J]. Nature, 1998, 393: 537-544. DOI:10.1038/31159 |
| [11] |
Wilson R, Kumar P, Parashar V, et al. Antituberculosis thiophenes define a requirement for Pks13 in mycolic acid biosynthesis[J]. Nat Chem Biol, 2013, 9: 499-506. DOI:10.1038/nchembio.1277 |
| [12] |
Thanna S, Knudson SE, Grzegorzewicz A, et al. Synthesis and evaluation of new 2-aminothiophenes against Mycobacterium tuberculosis[J]. Org Biomol Chem, 2016, 14: 6119-6133. DOI:10.1039/C6OB00821F |
| [13] |
Ioerger TR, O'Malley T, Liao R, et al. Identification of new drug targets and resistance mechanisms in Mycobacterium tuberculosis[J]. PLoS One, 2013, 8: e75245. DOI:10.1371/journal.pone.0075245 |
| [14] |
Aggarwal A, Parai MK, Shetty N, et al. Development of a novel lead that targets M. tuberculosis polyketide synthase 13[J]. Cell, 2017, 170: 249-259. DOI:10.1016/j.cell.2017.06.025 |
| [15] |
Zhang W, Lun S, Wang SH, et al. Identification of novel coumestan derivatives as polyketide synthase 13 inhibitors against Mycobacterium tuberculosis[J]. J Med Chem, 2018, 61: 791-803. DOI:10.1021/acs.jmedchem.7b01319 |
| [16] |
Zhang W, Lun S, Liu LL, et al. Identification of novel coumestan derivatives as polyketide synthase 13 inhibitors against Mycobacterium tuberculosis. Part Ⅱ[J]. J Med Chem, 2019, 62: 3575-3589. DOI:10.1021/acs.jmedchem.9b00010 |
| [17] |
Ravindran MS, Rao SP, Cheng X, et al. Targeting lipid esterases in mycobacteria grown under different physiological conditions using activity-based profiling with tetrahydrolipstatin (THL)[J]. Mol Cell Proteomics, 2014, 13: 435-448. DOI:10.1074/mcp.M113.029942 |
| [18] |
Goins CM, Sudasinghe TD, Liu X, et al. Characterization of tetrahydrolipstatin and stereoderivatives on the inhibition of essential Mycobacterium tuberculosis lipid esterases[J]. Biochemistry, 2018, 57: 2383-2393. DOI:10.1021/acs.biochem.8b00152 |
| [19] |
Lehmann J, Cheng TY, Aggarwal A, et al. An antibacterial β-lactone kills Mycobacterium tuberculosis by disrupting mycolic acid biosynthesis[J]. Angew Chem Int Ed, 2018, 57: 348-353. DOI:10.1002/anie.201709365 |
| [20] |
Zhao W, Wang B, Liu Y, et al. Design, synthesis, and biological evaluation of novel 4H-chromen-4-one derivatives as antituberculosis agents against multidrug-resistant tuberculosis[J]. Eur J Med Chem, 2020, 189: 112075. DOI:10.1016/j.ejmech.2020.112075 |
 2020, Vol. 55
2020, Vol. 55


