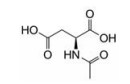
N-乙酰天冬氨酸(N-acetylaspartate, NAA)于1956年首次被报道[1], 是一种在中枢神经系统(central nervous system, CNS)内广泛存在的代谢物(图 1), 在脑中浓度可达到10 mmol·L-1甚至更多[2]。在NAA的研究过程中有两个发现具有重要意义: ① NAA是核磁共振波谱(proton magnetic resonance spectroscopy, 1H MRS)技术在脑内分析的主要代谢物。1H MRS技术能够实现在体无创测定脑区内代谢的分子水平, 安全且可重复测定, 广泛应用于临床神经系统疾病的检查, 如脑部肿瘤、梗塞、出血、变性、先天畸形和感染等。在正常成人脑组织中, NAA是1H MRS中的第1大峰, 位于δ 2.02~2.05。NAA主要存在于神经元内, 其含量减少通常代表神经元的丢失、损伤及功能缺陷[3]; ②染色体异常疾病Canavan病与NAA水解酶相关。本文将从NAA的分子机制、生理作用及其在CNS疾病中的研究进展, 以及未来药物研发等方面进行阐述。
|
Figure 1 Chemical structure of N-acetylaspartate (NAA) |
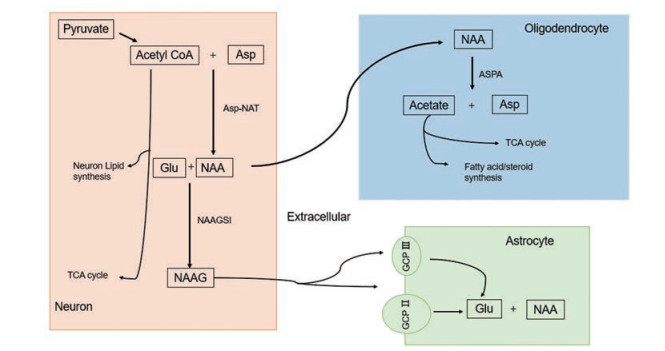
在神经元线粒体中, 天冬氨酸(L-aspartate, Asp)和乙酰辅酶A (acetyl CoA, 乙酰CoA)经Nat8L基因编码的L-天冬氨酸N-乙酰基转移酶(L-aspartate N-acetyltransferase, Asp-NAT)催化生成NAA (图 2), 速度大约为0.55 μmol·g-1·h-1, 周期为16~18 h[4, 5]。
|
Figure 2 Schematic diagram of NAA synthesis, utilization and breakdown in the brain. NAA is synthesized in neuronal mitochondria, and can then either be transported to oligodendrocytes for fatty acid synthesis and energy production, or can be used for the synthesis of N-acetylaspartylglutamate (NAAG) in neurons. NAAG is hydrolyzed by glutamate carboxypeptidase Ⅱ (GCP Ⅱ) and GCP Ⅲ on astrocytes, which then take up the breakdown products |
乙酰CoA作为NAA合成的底物之一, 调节与其合成相关的葡萄糖利用与后续生化反应都会影响NAA的合成。体内糖酵解过程的最终产物丙酮酸在丙酮酸脱氢酶的作用下脱氢生成乙酰CoA, 所以脑葡萄糖(Glc)的利用与NAA的合成直接耦合, 大约每40 mol Glc分子氧化合成1 mol NAA分子[4]。同时, NAA的合成可能受电子传递链的调节, 乙酰CoA是体内重要的产能过程三羧酸循环(tricarboxylic acid cycle, TCA)的底物, 其中产生的烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADP)参与电子传递链。Li等[6]发现使用电子传递链抑制剂抗霉素A处理SH-SY5Y细胞, 胞内NAA的含量降低, 这说明电子传递链会反馈性调节乙酰CoA向NAA的转化。
1.2 NAA的代谢在少突胶质细胞中, NAA在天冬氨酸酰基转移酶(aspartoacylase, ASPA)作用下被分解为乙酸(acetate)和Asp。ASPA的活性具有底物浓度依赖性[7], 在低浓度NAA (< 0.3 mmol·L-1)情况下, 酶反应速率呈现S形的动态曲线特征, 而在较高浓度(> 1.0 mmol·L-1)环境中会发生水解自我抑制。Khrenova等[8]进行了更加深入的研究, 发现不同浓度的NAA在水解反应中发挥不同作用, 在低浓度时作为ASPA活化剂, 中等浓度时为其底物, 高浓度时为其抑制剂。
1.3 NAA的转运钠协同二羧酸转运蛋白3 (NaDC3)是NAA主要的转运蛋白[9], 分布于胶质细胞表面。NAA是一种与琥珀酸结构相关的二羧酸, 在pH 7.3时有两个负电荷, 向胞外转运的过程中需要Na+的协同, Na+:NAA化学计量比为3:1[10]。
2 NAA的生理作用假说 2.1 有机渗透物早期不少研究者认为脑中大量存在的NAA可能作为一种调节渗透压的分子来调节神经元中的“阴离子缺乏” (anion deficit)[11, 12]。后来有学者认为NAA作为分子水泵转运神经元中的水分子, 维持酸碱平衡[13]。采用微透析法检测大鼠背外侧纹状体内细胞间隙不同浓度低渗溶液中的NAA含量, 与已知调节脑内总渗透压的牛磺酸相比, NAA的含量没有明显变化, 说明NAA并不能作为一种主要且有效的渗透压调节分子[14]。
2.2 参与髓鞘合成髓鞘在维持神经系统的正常连接和功能方面起着关键作用。除了神经元, 髓鞘中也存在NAA, 同时在白质内构成髓鞘的少突胶质细胞中也有NAA[15]。在少突胶质细胞中, NAA在ASPA的作用下被分解为乙酸和Asp, 乙酸参与大脑的发育过程, 与髓鞘的形成密切相关[16, 17]。NAA参与调节髓鞘磷脂合成相关基因的表达[18], 表现为Nat8L敲除小鼠脑内髓鞘脂质的含量减少; 加入NAA后, 与原代少突胶质细胞分化(TCF7l2、Olig2)和髓鞘脂质合成(Ugt8、Sgms1)相关基因的mRNA表达增加; 同时α酮戊二酸的含量有所增加, 增加的α酮戊二酸会激活组蛋白去甲基化酶, 降低H3K4me3和H3K9me2含量, 而少突胶质细胞的生长与成熟需要组蛋白去甲基化, 提示NAA可能通过改变少突胶质细胞的表观遗传修饰过程来抑制髓鞘合成。
2.3 与神经元能量代谢相关NAA与神经元能量代谢有关, 神经元线粒体中过量Asp转化为NAA的过程有利于谷氨酸形成α酮戊二酸, 继而通过TCA产生能量[19]。给予大鼠或灵长类动物线粒体毒素(3-ntiroproprionate)后NAA水平都显著性下降[20]。在轻度创伤性脑损伤中, ATP、CoA等神经能量物质含量会降低, 而NAA与它们的变化趋势一致[21]; 当损伤程度加重, NAA水平迅速下降, 因此必须利用一定比例的乙酰CoA来维持NAA在脑内相对稳定的水平, 这种结果势必影响乙酰CoA后续参与的能量生成、脂质合成和蛋白质乙酰化反应, 并且NAA的变化总是与ATP变化相似[22], 这都佐证了NAA与脑神经能量紧密相关。
2.4 N-乙酰天冬氨酰谷氨酸(N-acetylaspartylglutamate, NAAG)的生物合成前体在神经元胞体中, NAA可在N-乙酰天冬氨酰谷氨酸合成酶Ⅰ (N-acetylaspartylglutamate synthetase Ⅰ, NAAGSⅠ)的作用下与谷氨酸(Glu)生成NAAG。NAAG是哺乳动物CNS中广泛分布的肽类神经递质[23]。NAAG以钙依赖方式从去极化后的神经元释放, 在突触间隙被两种锌金属蛋白酶GCP Ⅱ (glutamate carboxypeptidase Ⅱ)和GCP Ⅲ水解为NAA和谷氨酸。GCP Ⅱ也被称为NAALADase (N-acylated-α-linked l-aminodipeptidase)或前列腺特异性膜抗原(PSMA), 是一种极具应用前景的前列腺癌标志物[24, 25]和特定抗癌药物靶点[26, 27], 脑中的GCP Ⅱ仅在胶质细胞表面表达[28]; 与GCP Ⅱ相比, GCP Ⅲ具有较低的NAAG水解活性, 在小脑、大脑皮层与海马表达较高。
阻断NAAG肽酶, 从而抑制NAAG的水解可以增强大脑的内源性神经保护作用。关于其神经保护机制存在几种理论: ①抑制NAAG水解可减少突触间隙的谷氨酸含量; ② NAAG可激活神经元与胶质细胞表面的Ⅱ型代谢性谷氨酸受体的mGluR3亚型, 从而抑制谷氨酸的释放, 减少病理条件下因为谷氨酸释放过多而引起的细胞毒性; ③ NAAG激活mGluR3后会激活谷氨酸转运蛋白GLT-1 (glutamate transporter-1)和GLAST (glutamate/aspartate transporter)的表达[29], 促进突触间隙多余的谷氨酸被摄取; ④抑制NAAG水解产物NAA的积累, 减少NAA-Na+共转运所导致的星形胶质细胞Na+超载从而起到神经保护作用。
3 NAA与疾病 3.1 Canavan疾病Canavan疾病是一种严重的神经系统疾病, 其病症多发生于婴儿时期, 在3~6个月期间迅速发展, 产生运动能力丧失、喂养困难、肌张力下降并伴随着智力下降与脑白质营养不良[30]。患者大脑中会产生一系列病理改变, 如出现星形胶质细胞肿胀, 并使髓鞘在分裂周期内形成空泡, 出现“海绵状”外观, 导致患者出现脑积水和巨头畸形等症状。Canavan疾病是一种常染色体隐性疾病, 因为ASPA基因编码缺陷导致ASPA活性受损, 致使NAA无法水解而大量蓄积。1H MRS测定结果发现Canavan患者脑内NAA的含量增高, 相较于正常人增加了大约35%[31], 该疾病目前没有合适的治疗方案。
NAA在Canavan疾病中的致病原因众说纷纭, 一种认为患者脑中NAA无法正常水解产生乙酸, 而来源于NAA的乙酸是少突胶质细胞参与髓鞘脂质合成的重要底物, 这使得CNS中髓鞘的生成无法正常进行, 阻碍CNS的成熟[19]; 而Canavan患者的脑组织中存在中度至极度水肿以及脑压增加的迹象, 这可能因为NAA代谢分解紊乱而无法正常发挥细胞水泵的作用, 导致星形胶质细胞水肿并引发一系列脑部异常, 提示NAA潜在的神经毒性; 直接向侧脑室注射NAA会降低抗氧化剂的防御能力并诱导蛋白质的氧化损伤, 说明累积的NAA可能从氧化损伤角度造成Canavan疾病[32]。
治愈此疾病的核心在于减少NAA的聚集。抑制NAA的合成或许可以缓解病症[33], 目前有针对Asp-NAT的抑制剂[34, 35], 但实际上NAA生成的缺乏会导致神经功能缺陷从而影响无意识的自我防御, 因此重点在于增加少突胶质细胞中ASPA酶的活性[36]。目前, 基因替代疗法作为治疗此疾病最有前景的疗法而备受关注, 靶向特定细胞与具有跨血脑屏障能力的重组腺相关病毒(AAV)载体逐步用于ASPA基因替代治疗[37, 38], 5年随访研究显示, 其在减少脑萎缩方面疗效确切, 患者耐受性好, 期待后续的深入研究。
3.2 多发性硬化症多发性硬化症(multiple sclerosis, MS)是一种CNS的免疫性脱髓鞘疾病[39], MS患者脑内出现NAA含量下降[40]且与病程严重程度呈正相关, 暗示神经胶质细胞增生伴随的神经元变性[41]。很多研究表明MS中神经细胞的变性和损伤与线粒体有关。线粒体活性的降低会减弱神经元之间的信号传导与轴突运输, 导致轴突的病理性改变[42], 影响髓鞘的生成。神经元线粒体损伤后会出现电子传递链亚基基因表达下降与细胞色素氧化酶活性抑制[43-45], NAA在线粒体中合成且受电子传递链的影响, 患者皮层神经元中NAA的含量在大脑萎缩前已经减少, 表明神经元电子传递链异常先于神经变性[46]。这提示线粒体中的NAA参与调节MS的发病, 若在患者发病早期进行靶向增加NAA的治疗, 也许可以缓解疾病的发展。
3.3 精神类疾病精神类疾病没有显著的病理改变, 病因不明, 诊断没有金标准, 只能依靠临床症状与相应疾病量表来衡量, 与其他疾病相比一直处于研究比较落后的局面。因此, 寻找精神类疾病合适的生物标记物至关重要, 既可以提高对疾病的发病机制及治疗效果的认识, 也能够独立于临床评级量表来评估治疗效果并预测治疗效果。各国研究者也在积极寻找可用于临床的生物标记物, NAA在脑内的含量仅次于谷氨酸, 也许可以作为一个有前景的精神类疾病的生物标记物。
3.3.1 抑郁症抑郁症是一种发病率连年升高的精神类疾病, 患者表现出较明显的快感缺失, 产生极度自我怀疑与自我否定, 不愿意与外界接触, 并伴随食欲减低、体重减轻、失眠和记忆力下降等症状, 严重者会有自杀倾向。目前全球至少有3.2亿人罹患抑郁症, 患病率超过4%, 全球每年因抑郁症自杀死亡人数高达100万人。
在抑郁状态下NAA的含量会发生改变, 但变化趋势并不一致。多数临床研究发现, 抑郁症患者脑内海马区和扣带回皮层NAA含量降低[47, 48], 这可能与神经元损伤有关[49]。但是对重症抑郁症患者的尸检结果显示[50], 其颞叶皮层内ASPA的mRNA显著降低, 暗示NAA升高。而动物研究发现, 纹状体内过表达Nat8L的小鼠表现出抑郁行为[51]; 在大鼠慢性轻度应激致抑郁模型中, 应激易感大鼠海马内NAA的含量高于抵抗组大鼠[52]; 幼时受到应激的猕猴纹状体内NAA显著增高[53]。动物的抑郁行为可能与特定脑区NAA的增加有关, NAA的升高会提高动物对应激的易感性。
即使在同一脑区, 经过不同类型抗抑郁治疗后, NAA的变化趋势也不尽相同。比如扣带回区域, 重复经颅磁刺激(repetitive transcranial magnetic stimulation, rTMS)与电休克治疗后NAA均出现显著性增加的情况[54, 55], 而电惊厥治疗(electroconvulsive therapy, ETC)后抑郁症状的减轻却伴随着NAA含量的降低[56]。但是药物治疗后海马区NAA的含量会出现相对一致的增加[57], 提高海马区的NAA水平或许可以缓解抑郁症状。
3.3.2 精神分裂症精神分裂症是一种重度精神疾病, 涉及感知觉、思维、情感和行为等多方面的障碍, 以及精神活动的不协调。患者一般意识清楚, 智力基本正常, 但部分患者在疾病过程中会出现认知功能的损害。病程一般迁延, 会反复发作、加重或恶化。发病机制尚不明确, 但涉及多种递质神经元的功能异常。
近年来, 精神分裂症中谷氨酸通路异常及NMDA受体功能减退是广为关注的学说之一。有研究证实背外侧前额叶皮层(DLPFC)中NAA与谷氨酸复合物(GLx)呈正相关[58], 提示NAA可能影响精神分裂症的发病。研究发现, NMDA受体阻断剂(氯胺酮、苯环己哌啶)会诱发精神分裂症状, NAAG有拮抗NMDA受体的作用[57], 提示NAAG可能会加重精神分裂症的病情, 而精神分裂症患者脑内NAAG肽酶含量的显著降低[59, 60]验证了这一观点。但不能单一地用NMDA受体功能降低来解释NAAG在精神分裂症中的作用。NAAG还可通过对mGluR3的激动作用来减少谷氨酸的释放, 减少因谷氨酸释放过多而引起的细胞毒性。通过质谱检测方法发现患者的额叶皮层中NAAG的含量相较于正常人下降了50%, NAA的含量无显著变化[61], 也有尸检结果显示NAAG含量下降[62]。以上研究说明, NAAG可能通过对NMDA受体的拮抗作用及mGluR3的激动作用影响精神分裂症的发病, 但具体哪一种因素占主导地位还需要进一步研究。
3.4 认知功能通常来说, 认知功能很难用生理生化指标来衡量, 早期有研究者试图找寻大脑认知与脑功能指标(大脑的尺寸、活动引发的相关电位变化及脑血流量)之间的关联, 结果并不显著。正常人在神经心理学测试或其他认知功能测量中的表现与NAA的绝对浓度呈相关性[63], 因此CNS疾病所引起的认知功能障碍与脑内代谢物含量的变化之间也存在关联。如长期抑郁症患者海马区NAA水平下降与较差的语言学习及记忆保留相关[47]; 帕金森病患者是否伴随认知障碍在NAA含量上有所体现[64], 伴有认知障碍的患者枕叶NAA出现显著降低; 阿尔茨海默病症状的改善可能与NAA的上调存在联系[65]; 在酒精依赖患者中, NAA水平降低与认知功能障碍程度相关[66]; 甲基苯丙胺(methamphetamine, MA)作为一种高成瘾性的神经兴奋类药物会对大脑认知产生影响[67, 68], Kim等[67]检测了吸入MA的青少年前扣带皮层的代谢情况, 发现MA组NAA的含量明显下降; 在评估选择性注意及认知灵活性的Stroop色词测试中, MA组的得分与NAA的含量存在明显的相关性, 但在正常人群中并未出现此种相关性, 其他可在1H MRS中被大量检测到的代谢物也未发现此种关联。精神分裂症患者普遍存在认知缺陷, NAAG肽酶抑制剂可增强认知功能[69]并阻断NMDA拮抗剂地佐西平诱导的认知功能障碍[70], 说明皮质NAAG减少与疾病之间存在联系。特异性脑区的NAA或NAAG含量的变化也许可以作为认知障碍的判断标准, 但在不同的病因与疾病表型下这种变化并不明确, 其相关性还需要进一步研究。
3.5 神经母细胞瘤神经母细胞瘤(neuroblastoma)是一种儿童最常见的颅外实体瘤, 多于婴儿期发病, 发病机制未知, 作为一种恶性的神经系统肿瘤至今没有好的治疗方案。具有亚细胞生理毒性浓度的NAA可以抑制神经母细胞瘤细胞系SH-SY5Y的生长, NAA与顺铂或5-氟尿嘧啶这两种化疗药物协同作用显示出更强的细胞毒性作用[71], 说明NAA在化疗中可能是一种潜在的辅助性化合物, 双重疗法可能对改善高危神经母细胞瘤患者的预后有益; 同时, 肿瘤组织中NAA含量的减少与肿瘤的严重程度直接相关, 在胶质瘤、星形细胞瘤、脑膜瘤及继发转移中尤其明显[72], 暗示NAA或许可以作为一种抑癌代谢产物。
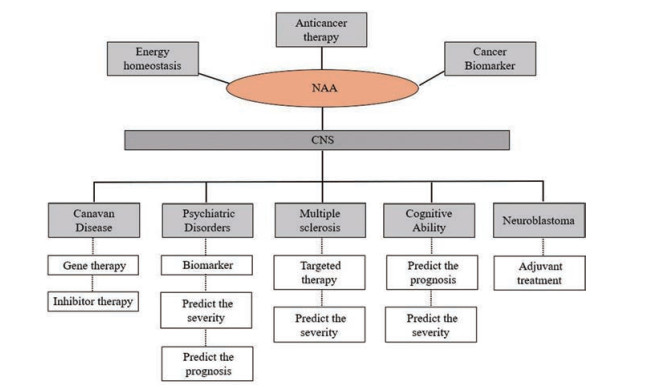
4 总结与展望NAA的发现比较久远, 但相较于体内其他分子(如脑啡肽)来说研究并不广泛, 在上世纪有近30年的时间内研究缓慢, NAA潜在的生物学及药理学功能需要进一步挖掘, 其对许多疾病具有预测和诊断的前景, 靶向治疗方式可能成为难治性疾病的突破口(图 3), 但还需要进一步研究: ① NAA在神经元中的作用还未明确, NAA含量变化可否改变神经元的功能状态; ② NAA如何定位于少突胶质细胞上发挥与髓鞘生成相关的作用。目前研究并没有阐明NAA特异性转运至少突胶质细胞分解的原因, 这可能是白质类疾病治疗的新希望; ③ NAA可否作为一些疾病可靠的生物标志物, 尤其在精神疾病领域。大量的1H MRS研究表明, 精神类疾病(情感障碍、强迫症、精神分裂症和痴呆症)中NAA浓度降低, 药物治疗后出现NAA含量增加[57]。目前研究数据非常多样, 但并不能从中得到明确的解释。各类研究在患者的选择标准、研究的大脑区域和数据分析方面都有所不同, NAA及NAAG在这些疾病中的变化并没有统一的结论; ④疾病中NAA含量的变化因素。从分子角度理解, NAA的合成与分解受到相关酶的调控, 靶向NAA相关酶来调节NAA含量从而治疗疾病具有很大的前景, 如Canavan疾病中的ASPA基因替代治疗, 或者以这些酶为靶点的药物筛选; ⑤ NAA可否更加广泛地用于预测疾病的预后效果。周围神经病变可能涉及CNS的改变, 而糖尿病并发周围神经病变的患者存在脑部NAA降低的情况, 其变化可预测糖尿病神经病变[73]及其他精神退行性疾病[74]的预后, 包括应用于急性脑部损伤[75]和脑梗死等疾病, 这对推动医学进步、提高患者生活质量具有重要意义。
|
Figure 3 NAA has the prospect of prediction and diagnosis for diseases, and targeted therapy may become the breakthrough of refractory diseases |
近年来, 不少研究开始探索NAA在CNS之外的作用。棕色脂肪细胞中存在大量NAA, NAA的浓度会影响棕色脂肪细胞的表型[76], 并干预呼吸作用和脂解作用, 影响葡萄糖耐量和胰岛素敏感性。无脂饮食会造成脂肪细胞NAT8L敲除小鼠死亡, 但可以通过补充NAA挽救[77], 这暗示NAA是脂肪细胞和全身能量稳态的关键能量代谢产物, 在治疗糖尿病与肥胖症方面可能有新的惊喜; NAA的浓度在肿瘤组织中显著增高[78, 79], 干预NAA的合成会阻碍卵巢癌细胞的生长与存活[80], 表明NAA是一种重要的肿瘤代谢物。在未来, 靶向NAA进行肿瘤治疗与生物标记物的确定非常具有应用前景。
作者贡献: 曹琳玉进行了全文撰写及图表绘制; 丁虹琬、姚开云、张建军参与文章校对与修改; 本文的通讯作者为王贵彬, 提供文章思路, 负责主要的审阅与校对修改工作。
利益冲突: 所有作者不存在利益冲突。
| [1] |
Tallan HH, Moore S, Stein WH. N-Acetyl-L-aspartic acid in brain[J]. J Biol Chem, 1956, 219: 257-264. |
| [2] |
Inglese M, Rusinek H, George IC, et al. Global average gray and white matter N-acetylaspartate concentration in the human brain[J]. Neuroimage, 2008, 41: 270-276. DOI:10.1016/j.neuroimage.2008.02.034 |
| [3] |
Clark JB. N-Acetyl aspartate:a marker for neuronal loss or mitochondrial dysfunction[J]. Dev Neurosci, 1998, 20: 271-276. DOI:10.1159/000017321 |
| [4] |
Moreno A, Ross BD, Bluml S. Direct determination of the N-acetyl-L-aspartate synthesis rate in the human brain by (13)C MRS and[1-(13)C]glucose infusion[J]. J Neurochem, 2001, 77: 347-350. DOI:10.1046/j.1471-4159.2001.t01-1-00282.x |
| [5] |
Baslow MH. Evidence supporting a role for N-acetyl-L-aspartate as a molecular water pump in myelinated neurons in the central nervous system. An analytical review[J]. Neurochem Int, 2002, 40: 295-300. DOI:10.1016/S0197-0186(01)00095-X |
| [6] |
Li S, Clements R, Sulak M, et al. Decreased NAA in gray matter is correlated with decreased availability of acetate in white matter in postmortem multiple sclerosis cortex[J]. Neurochem Res, 2013, 38: 2385-2396. DOI:10.1007/s11064-013-1151-8 |
| [7] |
Le Coq J, An HJ, Lebrilla C, et al. Characterization of human aspartoacylase:the brain enzyme responsible for Canavan disease[J]. Biochemistry, 2006, 45: 5878-5884. DOI:10.1021/bi052608w |
| [8] |
Khrenova MG, Kots ED, Varfolomeev SD, et al. Three faces of N-acetylaspartate:activator, substrate, and inhibitor of human aspartoacylase[J]. J Phys Chem B, 2017, 121: 9389-9397. DOI:10.1021/acs.jpcb.7b08759 |
| [9] |
Huang W, Wang H, Kekuda R, et al. Transport of N-acetylaspartate by the Na(+)-dependent high-affinity dicarboxylate transporter NaDC3 and its relevance to the expression of the transporter in the brain[J]. J Pharmacol Exp Ther, 2000, 295: 392-403. |
| [10] |
Patel TB, Clark JB. Synthesis of N-acetyl-L-aspartate by rat brain mitochondria and its involvement in mitochondrial/cytosolic carbon transport[J]. Biochem J, 1979, 184: 539-546. DOI:10.1042/bj1840539 |
| [11] |
McIntosh JC, Cooper JR. Studies on the function of N-acetyl aspartic acid in brain[J]. J Neurochem, 1965, 12: 825-835. DOI:10.1111/j.1471-4159.1965.tb10267.x |
| [12] |
Margolis RU, Barkulis SS, Geiger A. A comparison between the incorporation of 14C from glucose into N-acetyly-L-aspartic acid and aspartic acid in brain perfusion experiments[J]. J Neurochem, 1960, 5: 379-382. DOI:10.1111/j.1471-4159.1960.tb13377.x |
| [13] |
Taylor DL, Davies SE, Obrenovitch TP, et al. Extracellular N-acetylaspartate in the rat brain:in vivo determination of basal levels and changes evoked by high K+[J]. J Neurochem, 1994, 62: 2349-2355. |
| [14] |
Taylor DL, Davies SE, Obrenovitch TP, et al. Investigation into the role of N-acetylaspartate in cerebral osmoregulation[J]. J Neurochem, 1995, 65: 275-281. |
| [15] |
Nordengen K, Heuser C, Rinholm JE, et al. Localisation of N-acetylaspartate in oligodendrocytes/myelin[J]. Brain Struct Funct, 2015, 220: 899-917. DOI:10.1007/s00429-013-0691-7 |
| [16] |
Sumi K, Uno K, Noike H, et al. Behavioral impairment in SHATI/NAT8L knockout mice via dysfunction of myelination development[J]. Sci Rep, 2017, 7: 16872. DOI:10.1038/s41598-017-17151-1 |
| [17] |
Nave KA, Werner HB. Myelination of the nervous system:mechanisms and functions[J]. Annu Rev Cell Dev Biol, 2014, 30: 503-533. DOI:10.1146/annurev-cellbio-100913-013101 |
| [18] |
Singhal NK, Huang H, Li S, et al. The neuronal metabolite NAA regulates histone H3 methylation in oligodendrocytes and myelin lipid composition[J]. Exp Brain Res, 2017, 235: 279-292. DOI:10.1007/s00221-016-4789-z |
| [19] |
Madhavarao CN, Arun P, Moffett JR, et al. Defective N-acetylaspartate catabolism reduces brain acetate levels and myelin lipid synthesis in Canavan's disease[J]. Proc Natl Acad Sci U S A, 2005, 102: 5221-5226. DOI:10.1073/pnas.0409184102 |
| [20] |
Dautry C, Vaufrey F, Brouillet E, et al. Early N-acetylaspartate depletion is a marker of neuronal dysfunction in rats and primates chronically treated with the mitochondrial toxin 3-nitropropionic acid[J]. J Cereb Blood Flow Metab, 2000, 20: 789-799. DOI:10.1097/00004647-200005000-00005 |
| [21] |
Vagnozzi R, Tavazzi B, Signoretti S, et al. Temporal window of metabolic brain vulnerability to concussions:mitochondrial-related impairment——part Ⅰ[J]. Neurosurgery, 2007, 61: 379-388. DOI:10.1227/01.NEU.0000280002.41696.D8 |
| [22] |
Moffett JR, Arun P, Ariyannur PS, et al. N-Acetylaspartate reductions in brain injury:impact on post-injury neuroenergetics, lipid synthesis, and protein acetylation[J]. Front Neuroenergetics, 2013, 5: 11. |
| [23] |
Miyamoto E, Kakimoto Y, Sano I. Identification of N-acetyl-alpha-aspartylglutamic acid in the bovine brain[J]. J Neurochem, 1966, 13: 999-1003. DOI:10.1111/j.1471-4159.1966.tb10297.x |
| [24] |
Huber F, Montani M, Sulser T, et al. Comprehensive validation of published immunohistochemical prognostic biomarkers of prostate cancer-what has gone wrong? A blueprint for the way forward in biomarker studies[J]. Br J Cancer, 2015, 112: 140-148. DOI:10.1038/bjc.2014.588 |
| [25] |
Queisser A, Hagedorn SA, Braun M, et al. Comparison of different prostatic markers in lymph node and distant metastases of prostate cancer[J]. Mod Pathol, 2015, 28: 138-145. DOI:10.1038/modpathol.2014.77 |
| [26] |
Foss CA, Mease RC, Cho SY, et al. GCPⅡ imaging and cancer[J]. Curr Med Chem, 2012, 19: 1346-1359. DOI:10.2174/092986712799462612 |
| [27] |
Lv QZ, Yang JC, Wang YJ. Advances in prostate-specific membrane antigen-mediated antitumor drugs[J]. Acta Pharm Sin (药学学报), 2016, 51: 234-240. |
| [28] |
Berger UV, Luthi-Carter R, Passani LA, et al. Glutamate carboxypeptidase Ⅱ is expressed by astrocytes in the adult rat nervous system[J]. J Comp Neurol, 1999, 415: 52-64. DOI:10.1002/(SICI)1096-9861(19991206)415:1<52::AID-CNE4>3.0.CO;2-K |
| [29] |
Iantomasi T, Favilli F, Vincenzini MT. Evidence of glutathione transporter in rat brain synaptosomal membrane vesicles[J]. Neurochem Int, 1999, 34: 509-516. DOI:10.1016/S0197-0186(99)00027-3 |
| [30] |
Hoshino H, Kubota M. Canavan disease:clinical features and recent advances in research[J]. Pediatr Int, 2014, 56: 477-483. DOI:10.1111/ped.12422 |
| [31] |
Janson CG, McPhee SW, Francis J, et al. Natural history of Canavan disease revealed by proton magnetic resonance spectroscopy (1H-MRS) and diffusion-weighted MRI[J]. Neuropediatrics, 2006, 37: 209-221. DOI:10.1055/s-2006-924734 |
| [32] |
Pederzolli CD, Rockenbach FJ, Zanin FR, et al. Intracerebroventricular administration of N-acetylaspartic acid impairs antioxidant defenses and promotes protein oxidation in cerebral cortex of rats[J]. Metab Brain Dis, 2009, 24: 283-298. DOI:10.1007/s11011-009-9137-6 |
| [33] |
Sohn J, Bannerman P, Guo F, et al. Suppressing N-acetyl-L-aspartate synthesis prevents loss of neurons in a murine model of canavan leukodystrophy[J]. J Neurosci, 2017, 37: 413-421. DOI:10.1523/JNEUROSCI.2013-16.2016 |
| [34] |
Thangavelu B, Mutthamsetty V, Wang Q, et al. Design and optimization of aspartate N-acetyltransferase inhibitors for the potential treatment of Canavan disease[J]. Bioorg Med Chem, 2017, 25: 870-885. DOI:10.1016/j.bmc.2016.11.060 |
| [35] |
Mutthamsetty V, Dahal GP, Wang Q, et al. Development of bisubstrate analog inhibitors of aspartate N-acetyltransferase, a critical brain enzyme[J]. Chem Biol Drug Des, 2020, 95: 48-57. DOI:10.1111/cbdd.13586 |
| [36] |
von Jonquieres G, Spencer ZHT, Rowlands BD, et al. Uncoupling N-acetylaspartate from brain pathology:implications for Canavan disease gene therapy[J]. Acta Neuropathol, 2018, 135: 95-113. DOI:10.1007/s00401-017-1784-9 |
| [37] |
Leone P, Shera D, McPhee SW, et al. Long-term follow-up after gene therapy for canavan disease[J]. Sci Transl Med, 2012, 4: 165ra163. |
| [38] |
Deverman BE, Ravina BM, Bankiewicz KS, et al. Gene therapy for neurological disorders:progress and prospects[J]. Nat Rev Drug Discov, 2018, 17: 641-659. DOI:10.1038/nrd.2018.110 |
| [39] |
Noseworthy JH, Lucchinetti C, Rodriguez M, et al. Multiple sclerosis[J]. N Engl J Med, 2000, 343: 938-952. DOI:10.1056/NEJM200009283431307 |
| [40] |
Gonen O, Catalaa I, Babb JS, et al. Total brain N-acetylaspartate:a new measure of disease load in MS[J]. Neurology, 2000, 54: 15-19. DOI:10.1212/WNL.54.1.15 |
| [41] |
Polacek H, Kantorova E, Hnilicova P, et al. Increased glutamate and deep brain atrophy can predict the severity of multiple sclerosis[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2019, 163: 45-53. DOI:10.5507/bp.2018.036 |
| [42] |
Waxman SG. Axonal conduction and injury in multiple sclerosis:the role of sodium channels[J]. Nat Rev Neurosci, 2006, 7: 932-941. DOI:10.1038/nrn2023 |
| [43] |
Dutta R, McDonough J, Yin X, et al. Mitochondrial dysfunction as a cause of axonal degeneration in multiple sclerosis patients[J]. Ann Neurol, 2006, 59: 478-489. DOI:10.1002/ana.20736 |
| [44] |
Pandit A, Vadnal J, Houston S, et al. Impaired regulation of electron transport chain subunit genes by nuclear respiratory factor 2 in multiple sclerosis[J]. J Neurol Sci, 2009, 279: 14-20. DOI:10.1016/j.jns.2009.01.009 |
| [45] |
Campbell GR, Ziabreva I, Reeve AK, et al. Mitochondrial DNA deletions and neurodegeneration in multiple sclerosis[J]. Ann Neurol, 2011, 69: 481-492. DOI:10.1002/ana.22109 |
| [46] |
Ge Y, Gonen O, Inglese M, et al. Neuronal cell injury precedes brain atrophy in multiple sclerosis[J]. Neurology, 2004, 62: 624-627. DOI:10.1212/WNL.62.4.624 |
| [47] |
Jayaweera HK, Lagopoulos J, Duffy SL, et al. Spectroscopic markers of memory impairment, symptom severity and age of onset in older people with lifetime depression:discrete roles of N-acetyl aspartate and glutamate[J]. J Affect Disord, 2015, 183: 31-38. DOI:10.1016/j.jad.2015.04.023 |
| [48] |
Tosun S, Tosun M, Akansel G, et al. Proton magnetic resonance spectroscopic analysis of changes in brain metabolites following electroconvulsive therapy in patients with major depressive disorder[J]. Int J Psychiatry Clin Pract, 2020, 24: 96-101. DOI:10.1080/13651501.2019.1699118 |
| [49] |
Gules E, Iosifescu DV, Tural U. Plasma neuronal and glial markers and anterior cingulate metabolite levels in major depressive disorder:a pilot study[J]. Neuropsychobiology, 2020. DOI:10.1159/000505782 |
| [50] |
Aston C, Jiang L, Sokolov BP. Transcriptional profiling reveals evidence for signaling and oligodendroglial abnormalities in the temporal cortex from patients with major depressive disorder[J]. Mol Psychiatry, 2005, 10: 309-322. DOI:10.1038/sj.mp.4001565 |
| [51] |
Miyamoto Y, Iegaki N, Fu K, et al. Striatal N-acetylaspartate synthetase Shati/Nat8l regulates depression-like behaviors via mGluR3-mediated serotonergic suppression in mice[J]. Int J Neuropsychopharmacol, 2017, 20: 1027-1035. DOI:10.1093/ijnp/pyx078 |
| [52] |
Akimoto H, Oshima S, Sugiyama T, et al. Changes in brain metabolites related to stress resilience:metabolomic analysis of the hippocampus in a rat model of depression[J]. Behav Brain Res, 2019, 359: 342-352. DOI:10.1016/j.bbr.2018.11.017 |
| [53] |
Coplan JD, Lu D, El Sehamy AM, et al. Early life stress associated with increased striatal N-acetyl-aspartate:cerebrospinal fluid corticotropin-releasing factor concentrations, hippocampal volume, body mass and behavioral correlates[J]. Chronic Stress (Thousand Oaks), 2018. DOI:10.1177/2470547018768450 |
| [54] |
Zheng H, Jia F, Guo G, et al. Abnormal anterior cingulate N-acetylaspartate and executive functioning in treatment-resistant depression after rTMS therapy[J]. Int J Neuropsychopharmacol, 2015, 18: pyv059. DOI:10.1093/ijnp/pyv059 |
| [55] |
Merkl A, Schubert F, Quante A, et al. Abnormal cingulate and prefrontal cortical neurochemistry in major depression after electroconvulsive therapy[J]. Biol Psychiatry, 2011, 69: 772-779. DOI:10.1016/j.biopsych.2010.08.009 |
| [56] |
Njau S, Joshi SH, Espinoza R, et al. Neurochemical correlates of rapid treatment response to electroconvulsive therapy in patients with major depression[J]. J Psychiatry Neurosci, 2017, 42: 6-16. DOI:10.1503/jpn.150177 |
| [57] |
Paslakis G, Traber F, Roberz J, et al. N-Acetyl-aspartate (NAA) as a correlate of pharmacological treatment in psychiatric disorders:a systematic review[J]. Eur Neuropsychopharmacol, 2014, 24: 1659-1675. DOI:10.1016/j.euroneuro.2014.06.004 |
| [58] |
Coughlin JM, Tanaka T, Marsman A, et al. Decoupling of N-acetyl-aspartate and glutamate within the dorsolateral prefrontal cortex in schizophrenia[J]. Curr Mol Med, 2015, 15: 176-183. DOI:10.2174/1566524015666150303104811 |
| [59] |
Tsai G, Passani LA, Slusher BS, et al. Abnormal excitatory neurotransmitter metabolism in schizophrenic brains[J]. Arch Gen Psychiatry, 1995, 52: 829-836. DOI:10.1001/archpsyc.1995.03950220039008 |
| [60] |
Tkachev D, Mimmack ML, Huffaker SJ, et al. Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia[J]. Int J Neuropsychopharmacol, 2007, 10: 557-563. DOI:10.1017/S1461145706007334 |
| [61] |
Wood PL. Targeted lipidomics and metabolomics evaluations of cortical neuronal stress in schizophrenia[J]. Schizophr Res, 2019, 212: 107-112. DOI:10.1016/j.schres.2019.08.003 |
| [62] |
Zhang R, Zhang T, Ali AM, et al. Metabolomic profiling of post-mortem brain reveals changes in amino acid and glucose metabolism in mental illness compared with controls[J]. Comput Struct Biotechnol J, 2016, 14: 106-116. DOI:10.1016/j.csbj.2016.02.003 |
| [63] |
Ross AJ, Sachdev PS. Magnetic resonance spectroscopy in cognitive research[J]. Brain Res Brain Res Rev, 2004, 44: 83-102. DOI:10.1016/j.brainresrev.2003.11.001 |
| [64] |
Nie K, Zhang Y, Huang B, et al. Marked N-acetylaspartate and choline metabolite changes in Parkinson's disease patients with mild cognitive impairment[J]. Parkinsonism Relat Disord, 2013, 19: 329-334. DOI:10.1016/j.parkreldis.2012.11.012 |
| [65] |
Lin R, Li L, Zhang Y, et al. Electroacupuncture ameliorate learning and memory by improving N-acetylaspartate and glutamate metabolism in APP/PS1 mice[J]. Biol Res, 2018, 51: 21. DOI:10.1186/s40659-018-0166-7 |
| [66] |
Morley KC, Lagopoulos J, Logge W, et al. Brain N-acetyl aspartate and associations with cognitive impairment in alcohol dependent patients[J]. J Clin Exp Neuropsychol, 2020, 42: 111-117. DOI:10.1080/13803395.2019.1685078 |
| [67] |
Kim JE, Kim GH, Hwang J, et al. Metabolic alterations in the anterior cingulate cortex and related cognitive deficits in late adolescent methamphetamine users[J]. Addict Biol, 2018, 23: 327-336. DOI:10.1111/adb.12473 |
| [68] |
King G, Alicata D, Cloak C, et al. Neuropsychological deficits in adolescent methamphetamine abusers[J]. Psychopharmacology (Berl), 2010, 212: 243-249. DOI:10.1007/s00213-010-1949-x |
| [69] |
Janczura KJ, Olszewski RT, Bzdega T, et al. NAAG peptidase inhibitors and deletion of NAAG peptidase gene enhance memory in novel object recognition test[J]. Eur J Pharmacol, 2013, 701: 27-32. DOI:10.1016/j.ejphar.2012.11.027 |
| [70] |
Olszewski RT, Janczura KJ, Ball SR, et al. NAAG peptidase inhibitors block cognitive deficit induced by MK-801 and motor activation induced by d-amphetamine in animal models of schizophrenia[J]. Transl Psychiatry, 2012, 2: e145. DOI:10.1038/tp.2012.68 |
| [71] |
Mazzoccoli C, Ruggieri V, Tataranni T, et al. N-Acetylaspartate (NAA) induces neuronal differentiation of SH-SY5Y neuroblastoma cell line and sensitizes it to chemotherapeutic agents[J]. Oncotarget, 2016, 7: 26235-26246. DOI:10.18632/oncotarget.8454 |
| [72] |
Brandao LA, Castillo M. Adult brain tumors:clinical applications of magnetic resonance spectroscopy[J]. Magn Reson Imaging Clin N Am, 2016, 24: 781-809. DOI:10.1016/j.mric.2016.07.005 |
| [73] |
Hansen TM, Brock B, Juhl A, et al. Brain spectroscopy reveals that N-acetylaspartate is associated to peripheral sensorimotor neuropathy in type 1 diabetes[J]. J Diabetes Complications, 2019, 33: 323-328. DOI:10.1016/j.jdiacomp.2018.12.016 |
| [74] |
Liu W, Yu H, Jiang B, et al. The predictive value of baseline NAA/Cr for treatment response of first-episode schizophrenia:a (1)H MRS study[J]. Neurosci Lett, 2015, 600: 199-205. DOI:10.1016/j.neulet.2015.06.029 |
| [75] |
Stovell MG, Yan JL, Sleigh A, et al. Assessing metabolism and injury in acute human traumatic brain injury with magnetic resonance spectroscopy:current and future applications[J]. Front Neurol, 2017, 8: 426. DOI:10.3389/fneur.2017.00426 |
| [76] |
Prokesch A, Pelzmann HJ, Pessentheiner AR, et al. N-Acetylaspartate catabolism determines cytosolic acetyl-CoA levels and histone acetylation in brown adipocytes[J]. Sci Rep, 2016, 6: 23723. DOI:10.1038/srep23723 |
| [77] |
Hofer DC, Zirkovits G, Pelzmann HJ, et al. N-Acetylaspartate availability is essential for juvenile survival on fat-free diet and determines metabolic health[J]. FASEB J, 2019, 33: 13808-13824. DOI:10.1096/fj.201801323R |
| [78] |
Sreekumar A, Poisson LM, Rajendiran TM, et al. Metabolomic profiles delineate potential role for sarcosine in prostate cancer progression[J]. Nature, 2009, 457: 910-914. DOI:10.1038/nature07762 |
| [79] |
Fong MY, McDunn J, Kakar SS. Identification of metabolites in the normal ovary and their transformation in primary and metastatic ovarian cancer[J]. PLoS One, 2011, 6: e19963. DOI:10.1371/journal.pone.0019963 |
| [80] |
Zand B, Previs RA, Zacharias NM, et al. Role of increased N-acetylaspartate levels in cancer[J]. J Natl Cancer Inst, 2016, 108: djv426. DOI:10.1093/jnci/djv426 |
 2020, Vol. 55
2020, Vol. 55


