2. 南京中医药大学, 江苏省海洋药用生物资源研究与开发重点实验室, 江苏 南京 210023;
3. 南京中医药大学药学院, 江苏 南京 210023
2. Jiangsu Key Laboratory of Research and Development in Marine Bio-resource Pharmaceutics, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China
中药动物药是以动物整体、组织器官、分泌物或病理产物等作为药用的中药材, 是传统中药的重要组成部分[1]。早在汉代《神农本草经》即有关于动物药的记载, 包括犀角、羚羊角和阿胶等在内的67种动物药。时至今日, 以羚羊角、水牛角、阿胶、鹿角胶等角类与胶类动物药仍在使用, 在中药制药、中医临床等领域不可或缺。角类、胶类动物药来源于动物的皮肤或皮肤衍化组织, 既有共性, 又各自特点突出:两者均以蛋白质类成分为主, 角类主要含有角蛋白, 而胶类以胶原蛋白为主。作为中医临床及中药制药行业的重要品种, 角类、胶类动物药效应物质基础研究缺少适宜的思路与方法, 多年来仍参照植物药的研究思路, 即主要研究小分子次生代谢产物, 对蛋白质类、肽类、糖类等大分子初生代谢产物研究不充分, 阻碍了动物药功效物质基础的深入开展, 严重制约着临床应用、制药工艺及质量控制等方面的研究。尽管2015版《中国药典》已经将DNA条形码、专属性肽段鉴定等技术方法增加至动物药标准中。但胶类药材是高温熬制处理后的产物, DNA破坏严重, 扩增获得专属性基因的难度非常大。因此, 阿胶、龟甲胶和鹿角胶均以专属性肽段进行鉴定, 而角类动物药的鉴别、检查和含量测定等项目有待提升或补充。因而, 角类、胶类动物药功效物质基础研究亟待深入开展。
本文基于课题组对角类、胶类动物药的前期研究与认识, 结合国内外动物药研究进展与现状, 在蛋白质组、多肽组应用于动物药研究的基础上[1], 提出“动物药修饰组(modifications in animal-derived TCMs)”的概念, 即围绕动物药蛋白质、肽类成分在炮制加工、提取熬制及体内消化液作用等过程发生的化学修饰、修饰类别、修饰位点和修饰数量等开展定性与定量研究, 并进一步关联动物药传统功效特点与修饰组的相关性与规律研究, 对角类、胶类动物药的蛋白质、肽类物质与功效相关性规律进行探讨, 提出可行的研究思路与解决方法, 以系统阐明其功效物质基础。
1 角类与胶类动物药蛋白质组成类别角类动物药犀角、水牛角、羚羊角、山羊角和牦牛角等, 同为皮肤衍化组织, 但角质角又分为“表皮角”与“洞角”, 犀角属表皮角, 由表皮角质层所产生的毛状角质纤维组成, 固着在鼻骨和额骨上; 羚羊角、水牛角及山羊角等是由额骨的突起衍生出来形成的对称骨枝, 外包一层角质套而成, 药用部位即是外层角质套[2], 因角内部是空心的, 所以此类角被称为“洞角”, 如图 1A所示。角类动物药中主要为角蛋白类(keratins, KRTs)成分。
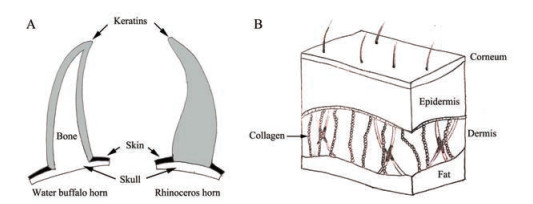
|
Figure 1 Schematic diagrams of animal horn and skin. A: Anatomy of water buffalo horn and rhinoceros horn; B: Anatomy of animal skin |
角蛋白(keratin, KRT)是外胚层细胞的结构蛋白, 广泛存在于生物体的组织结构中。在不同机体组织、不同个体乃至于不同物种之间角蛋白含量差异较大。由于构成二硫键的关键氨基酸——半胱氨酸(Cys)的含量不同, 角蛋白可分为硬角蛋白和软角蛋白两大类。软角蛋白存在于皮肤和其他一些细胞组织中, 而纤维化的硬角蛋白, 广泛存在于人和动物的表皮及其衍化组织中; 硬角蛋白为构成角、蹄甲和鳞片等的主要成分, 是结缔组织极其重要的结构蛋白质, 起着保护机体的作用[3]。
胶原(collagen, COL)是动物体内一类重要的蛋白质, 约占动物总蛋白的30%, 主要分布在皮肤、结缔组织和骨骼等部位, 支撑着皮肤与各个组织器官形态、结构的完整性, 有保护机体和支撑器官的重要作用。胶类药材是动物皮肤胶原在高温熬制过程中, 发生不同程度的水解并溶解, 经过浓缩干燥后得到的药材, 胶类动物药中主要的成分为水溶性胶原类物质[4], 由图 1B所示, 动物皮肤真皮层中富含大量的胶原蛋白。
2 基于蛋白质组、多肽组学方法研究角质类、皮肤类动物药的物质基础活性/毒性蛋白质、肽类成分的研究发现主要有两个思路:一个是活性导向下的成分分离、纯化与鉴定研究; 另一个是基于转录组-蛋白质组-多肽组等多组学联合应用, 结合生物信息学分析、筛选、合成及验证活性/毒性蛋白质、肽段的研究思路[1, 5]。前者的研究思路早期被用来分离纯化天然毒素类成分, 如芋螺毒素、蝎毒和蛇毒等, 因活性或毒性强烈, 选择合适的活性导向评价指标, 可精准锁定活性成分, 纯化并鉴定多种毒素类成分, 然而这个思路并不适用于中药动物药中活性蛋白质、肽类成分的发现。
中药动物药的物质基础与天然毒素类成分的特性不同, 大部分中药动物药按传统加工炮制方法处理后, 动物药来源的饮片或提取物中主要为变性蛋白、非特异性降解肽段等成分, 与基于天然空间结构产生剧烈活性/毒性的蛋白质、肽类毒素完全不同, 如从全蝎分泌的毒素中分离发现了具有多种生物活性的多肽[6-8], 然而中医临床对全蝎的使用则是经过煎煮、浓缩, 最终制成相应的汤药或中成药来发挥功效, 这种起效方式特点与蝎毒天然毒性肽截然不同。因此, 对于中药动物药功效物质基础的研究需要有特定的方法手段, 以解决中药动物药特有的科学问题。
2.1 角类动物药的物质基础研究 2.1.1 蛋白质类成分角蛋白、角蛋白相关蛋白(keratin associated protein)、桥粒蛋白(desmoplakin)、连接蛋白(junction plakoglobin)等与结构密切相关的蛋白质类成分为角类动物药的主要成分, 角蛋白组成及相对含量在不同物种中存在差异。如图 2所示, 以犀角(共鉴定出237个蛋白质)、羚羊角(359个)、水牛角(253个)及山羊角(377个)中鉴定的蛋白质数量作图分析, 可见其中非共有的蛋白质(unique proteins)分别为犀角74个、水牛角70个、羚羊角137个和山羊角129个, 这些差异蛋白质中角蛋白数量并不多; 而64个共有部分中, 角蛋白及结构蛋白为主要组成成分[9]。因此, 角蛋白为角类动物药的共有物质基础。
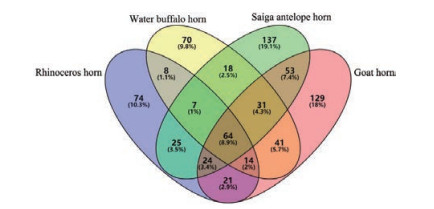
|
Figure 2 Venn diagram comparison of the identified proteins in animal horns |
然而, 不同角类药材中共有角蛋白类成分相对含量亦存在差异, 基于同位素相对标记与绝对定量(isobaric tags for relative and absolute quantification, iTRAQ)技术的定量蛋白质组及主成分分析(principal component analysis, PCA)研究不同角类动物药时, 角蛋白、角蛋白相关蛋白和桥粒蛋白等结构蛋白的相对含量差异决定了不同角类动物药的归类。此外, 研究发现不同角中转谷氨酰胺酶(transglutaminase, TGM)的相对含量不同, TGM的作用是促进角质组织中异肽键的形成, 对角质结构的形成发挥重要作用, 同时形成的异肽键可抵抗蛋白质的提取与溶解, 这可能影响到不同角类动物药其蛋白质类物质溶出、释放的速度与程度[10]。
2.1.2 肽类成分角类动物药在经过煎煮或在胃肠道消化液的作用下会释放出肽类物质, 这些也是角类动物药重要的物质基础[11]。水牛角水煎液解热活性部位(小于3 kDa)中鉴定了824个肽段, 这些肽段主要来源于KRT14、KRT34及KRT86, 从肽段的裂解、释放规律来看, 煎煮提取过程中, 角蛋白的N末端和C末端更易于释放肽段[12]。动物的角质经胃肠道消化液降解后也会释放出肽类成分, 如羚羊角与山羊角在仿生提取模式下, 经人工胃液与人工肠液处理后, 可释放出大量肽段, 其中58%肽段来源于角蛋白, 如图 3所示, 根据热图(heatmap)分析及序列比对(alignment)分析, 在胃肠道消化液的作用下, 角蛋白中的4个区域更易于释放出肽类物质[13]。在角类动物药蛋白质、肽类成分鉴定过程中, 由于犀牛的蛋白质数据库不完善, 赛加羚羊、山羊及水牛同属于牛科(Bovidae), 因此只能通过搜索牛科动物或劳亚兽总目(Laurasiatheria)的蛋白质数据库来完成蛋白质与多肽的鉴别, 这样会缺失部分因同源蛋白序列差异导致的鉴定数量不充分, 后续可通过构建不同动物的专属蛋白质数据库来完善[1]。
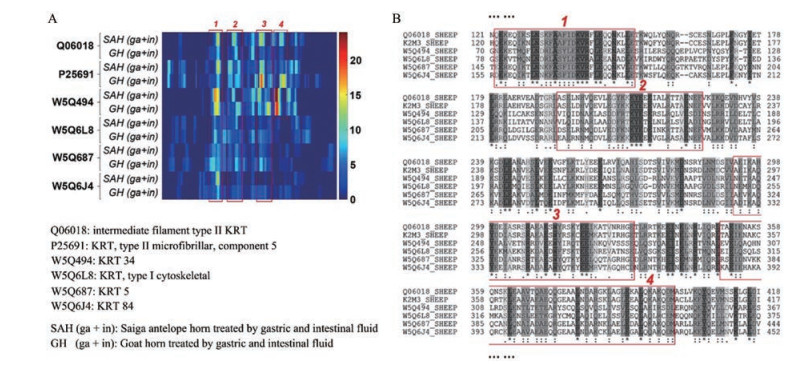
|
Figure 3 Heatmap of the common keratins (KRTs) in saiga antelope horn and goat horn (A). Alignment of six common KRTs in saiga antelope horn and goat horn. Red boxes represent the important regions in each KRT (B) |
胶类动物药主要包含:以动物皮为原料熬制的阿胶、黄明胶和鹿皮胶等, 以骨质角熬制而成的鹿角胶、麋角胶等, 以及以龟甲熬制得到的龟甲胶。胶类动物药主要成分也是蛋白质类, 但与角类动物药不同的是胶原蛋白为胶类动物药的主要成分, 胶原蛋白原本水溶性不好, 但是在高温、高压熬制加工过程中, 胶原蛋白发生溶胀、降解而形成了溶液/溶胶, 经过浓缩、干燥, 可得到固体胶[14], 相比于胶原蛋白, 胶类动物药水溶性显著提高, 更利于有效成分的溶出与释放。
参照药典方法将阿胶药材溶解, 胰蛋白酶酶解后, 采用nano LC Obitrap MS/MS鉴定, 发现鉴定的1 700多个肽段中, 80%以上肽段来源于不同类别的胶原蛋白, 包括Ⅰ型胶原α1链(COL1A1)、Ⅰ型胶原α2链(COL1A2)、Ⅱ型胶原α1链(COL2A1)、Ⅲ型胶原α1链(COL3A1), 其中以COL1A2来源的肽段为主。COL1A2作为高保守蛋白质, 广泛存在于不同动物体内, 是构成胶类动物药的重要蛋白类成分之一, 如鹿皮胶、阿胶、黄明胶、猪皮胶和马皮胶等药材的胰酶产物中均能检测到大量COL1A2来源的肽段[15]。
胶原蛋白的基本结构单元为“甘氨酸-氨基酸X-氨基酸Y (Gly-Xaa-Yaa)”, 其中Xaa与Yaa多为脯氨酸(proline, Pro)或羟脯氨酸(hydroxyproline, Hyp), Hyp和Pro在维持胶原蛋白稳定性方面发挥重要作用[16]。Pro经过羟基化(hydroxylation)修饰后即为Hyp, 胶原蛋白及其非特异性降解的肽类物质为胶类动物药的重要功效物质基础。
3 角类、胶类动物药的特定肽类成分与功效相关性研究角类、胶类动物药在煎煮提取或口服后消化液作用下, 均易释放出肽段, 由于肽类成分的来源蛋白质不同:角类肽段主要源于角蛋白, 胶类肽段主要源于胶原蛋白, 角类与胶类动物药肽类物质组成差异明显。角类动物药的传统功效主要为“清热解毒、凉血定惊”, 而胶类动物药以“滋阴、养血”功效为主, 传统功效特点的不同可能与其肽类成分差异相关。
3.1 含巯基(-SH)肽类成分为角类动物药的关键功效物质基础近年来, -SH及活性硫簇(reactive sulfur species, RSS)受到广泛关注, 如HS·、H2Sn、H2S等与多种生物效应、疾病相关[17]。在惊厥动物模型中, 血浆-SH的水平显著降低, 而二硫键(-S-S-)的水平显著升高[18], -SH与-S-S-的比例(-SH/-S-S-)与病理模型密切相关。Erel等[19]研究发现, 正常机体血浆中-SH/-S-S-维持在相对稳定的水平, 病理状态下机体的-SH/-S-S-会发生不同程度的上调或下调, 如糖尿病、肥胖、肺炎患者或抽烟人群血浆中-S-S-的水平偏高, 而肿瘤患者血浆中-S-S-的水平则偏低。
角类动物药煎煮液、仿生提取液中以变性蛋白类、多肽类和寡肽类等物质为主。这些成分多源于角蛋白的N-和C-末端序列, 且由于煎煮或酶解过程中角蛋白-S-S-结构发生断裂转变成游离-SH, 这些成分多含有-SH结构。角类动物药提取液中的含-SH肽类物质为重要特征性物质, 可能与角类动物药的传统功效密切相关[20, 21]。
有研究表明, 水牛角提取液可干预发热大鼠体内生物标记物, 影响包括脂类、前列腺素(PGs)类、白三烯(LTs)类及Cys等物质, 通过干预花生四烯酸代谢通路(arachidonic acid metabolism)与氧化应激通路(oxidative stress)来发挥退热作用[12, 21], 而生物标记物Cys中所含-SH的氧化/还原形态在氧化应激代谢通路中发挥重要作用。在水牛角、牦牛角和山羊角等角类动物药提取液中均可测到游离-SH类成分。大鼠连续口服给予山羊角提取物后, 其血浆中游离-SH与总-SH水平相较于正常大鼠显著升高, 而阿司匹林对大鼠血浆中的游离-SH与总-SH水平无影响; 口服给予大剂量山羊角提取物30 min后, 大鼠血浆中游离-SH水平即达峰值, 8 h后血浆中游离-SH水平趋于正常, 表明口服给予山羊角提取物后, 提取液中的-SH可通过某种方式转移或转化进入血浆[22]。这些研究提示, 含-SH肽类物质可能为角类动物药的重要功效物质, 与其传统功效密切相关, 后续应围绕含-SH肽类物质的系统表征、作用特点与机制、体内转运过程等方面开展深入研究。
3.2 胶类动物药的胶原蛋白为关键功效物质基础阿胶补血滋阴、润燥和止血; 鹿角胶温补肝肾、益精养血; 龟甲胶滋阴、养血和止血。胶类动物药多具滋阴补血的功效。现代研究表明, 阿胶可改善贫血、白细胞减少、血小板减少等症[23, 24]; 阿胶可通过抵抗免疫细胞凋亡发挥免疫保护的作用[25]; 阿胶具有促进骨修复的作用, 通过促进碱性磷酸酶的合成来促进大鼠成骨细胞分化, 可改善大鼠胫骨钻孔造成的股损伤[25]。
胶原蛋白水解物或胶原来源的肽段具有抗氧化、抗衰老、皮肤保护等多种功效[26-29]。胶类动物药中富含胶原蛋白与胶原肽, 现代研究表明分子质量 < 8 kDa的胶原肽可促进真皮成纤维细胞外基质中蛋白质的合成, 尤其是弹性蛋白、胶原蛋白、基质金属蛋白酶等合成[30]; 中药麋鹿角活性部位(分子质量 < 3 kDa部位)中富含胶原肽, 可显著促进成骨细胞增殖[31]; 摄入胶原蛋白可改变肝脏脂质代谢相关基因表达, 作用于过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor, PPAR)通路和提高脂肪酸代谢, 改善血液脂质轮廓, 降低血液胆固醇水平[32]。富含胶原蛋白的动物皮经煎煮、熬制后, 胶原蛋白发生非特异性降解, 形成水溶性良好的肽类成分, 部分肽类可透过生物膜吸收入血而发挥多种生物效应[33]。这些研究结果提示, 胶原蛋白来源的肽类成分为胶类动物药的关键功效物质基础, 在胶原来源肽类成分的系统鉴定、表征基础上, 结合传统功效相关性等方面开展深入研究。
4 基于修饰组学的角质类、皮肤类动物药物质基础研究蛋白质的翻译后修饰(post-translational modifications, PTMs)是对翻译后的蛋白质进行化学修饰, 以改变蛋白质的理化性质, 从而影响蛋白质在体内的生物活性, 干预细胞信号通路等[34]。PTMs通常指蛋白质在生物体的信号通路传导、生理生化反应过程中特定位点的氨基酸发生的化学变化, 在中药动物药物质基础研究过程中, 作者留意到一些动物药, 如角类、胶类等, 在生产加工、煎煮熬制和生物体内消化液作用等过程中, 部分氨基酸位点会发生化学反应与化学变化, 称之为“修饰”。“动物药修饰组”可针对动物药在生产加工过程或体内过程中发生的化学修饰系统开展定性与定量研究。
水牛角水煎液的肽组学分析发现, 鉴定获得的多肽中, 含有丰富的含Cys肽段, 且肽段中的甲硫氨酸(Met)易发生氧化修饰(oxidation), 天冬酰胺(Asn)与谷氨酰胺(Gln)易发生脱酰胺修饰(deamidation)转变成天冬氨酸(Asp)和谷氨酸(Glu), N端肽段易发生乙酰化修饰(acetylation)[12]。阿胶、鹿皮胶、牛皮胶和猪皮胶等胶类动物药研究中发现, 除了Asn与Gln易发生脱酰胺修饰外, Pro发生的羟基化修饰为最主要的修饰类型[15]。由此可见, 动物药中蛋白质肽类成分发生修饰的情况应是普遍存在的。以下以角类与胶类动物药蛋白质、肽类物质的基础研究为例, 探讨修饰组的内容。
4.1 角类动物药修饰组的探讨水牛角煎煮提取过程中二硫键的断裂, 本质上是角蛋白发生化学反应而引起了蛋白质、肽类成分的化学变化, 应归于修饰的范畴。如图 4所示, 图中蓝色线段代表鉴定的肽段在对应序列中的覆盖情况, 即肽段序列。图 4A展示了水牛角提取液中鉴定的部分肽段信息, 主要来源于Ⅱ型角蛋白(Q5XQN5) Met1~Gly40片段, 可见肽段的N端均发生了乙酰化修饰, 值得注意的是, 肽段SRQSTVSFRSGGGR与SRQ (+0.98) STVSFRSGGGR均被鉴定出来, 说明仅有部分Q (Gln)发生了脱酰胺修饰, 而非全部Gln, 这提示Gln4的脱酰胺修饰不完全是源于角蛋白中固有的PTMs, 也可能是在提取加工过程中发生的修饰。此外, 图 4B展示了鉴定的部分来源于Ⅱ型角蛋白(Q148H4)的含Cys肽段序列(红框表示)。由于角蛋白煎煮提取过程中发生了二硫键断裂的化学反应, 水牛角中才得以鉴定到丰富的含-SH肽类成分。

|
Figure 4 Modifications of KRTs identified in water buffalo horn. A: Acetylation and deamidation in KRT; B: -SH of cystine exposed after disulfide bond cleavage |
Pro发生的羟基化修饰后形成Hyp是胶原蛋白中最主要的修饰。胶类动物药的制备工艺为高温熬制溶解胶原蛋白, 再经过浓缩干燥后制得固体胶块。然而在胶类动物药肽组学研究过程中发现, Pro的羟基化、Asn和Gln的脱乙酰化为胶类主要的修饰类型。鹿皮胶经过胰蛋白酶处理后获得的专属性肽段SGETGASGPPGFAGEK, 同时可检测到带有羟基化修饰的肽段SGETGASGPP (+15.99) GFAGEK[15], 如图 5所示, 从MS/MS图谱的y7离子开始, 两个肽段对应的y离子均相差15.99 (Δm/z), 可确定肽段发生羟基化的位点。这表明在胶类药材中, 同一个Pro的位点上可能同时存在Pro与Hyp。但是, Hyp是在动物胶原蛋白体内合成后发生的PTMs, 还是在胶类药材生产加工过程中发生的修饰, 有待深入研究阐释。
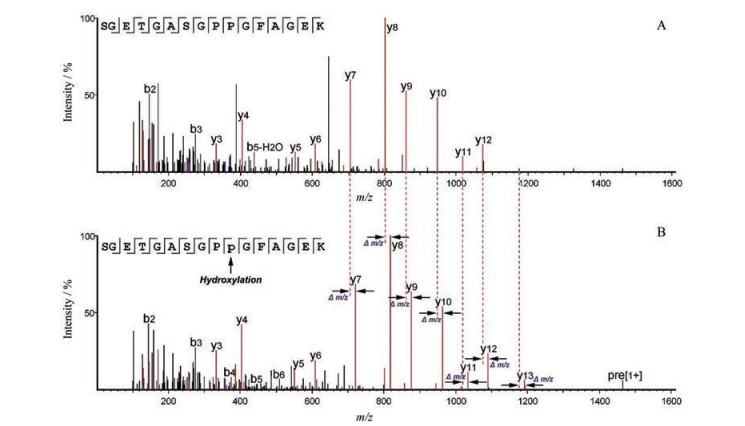
|
Figure 5 Comparison of MS/MS spectra of peptide SGETGASGPPGFAGEK and hydroxylated SGETGASGPpGFAGEK. A: MS/MS spectra of SGETGASGPPGFAGEK; B: MS/MS spectra of hydroxylated peptide with 10Pro to 10Hyp |
对于角质类动物药应围绕两方面开展肽类成分的规律性研究:一方面, 角蛋白降解、溶出释放出肽段序列的规律性研究, 如角蛋白KRT14 (F1MC11)在煎煮提取过程中释放的肽段主要源于其N-和C-末端[12], 角蛋白KRT34 (W5Q494)在半仿生法(人工胃液与人工肠液作用)提取下获得的肽段, 主要来源于KRT34的Phe78-Leu100和Glu299-Glu320片段[13]; 另一方面, 角蛋白中含-SH肽类物质的释放规律研究, 含-SH肽类物质属低丰度成分, 需进一步富集、鉴定与表征, 以探讨含-SH肽类物质的来源蛋白及氨基酸序列的规律性。
胶类动物药肽类物质规律性研究应围绕: ①蛋白质、肽类发生羟基化与脱酰胺化修饰的位点与修饰数量, 如COL1A1、COL1A2、COL2A1及COL3A1等主要胶原蛋白中Pro发生羟基化修饰转化为Hyp的位点与数量, Asn与Gln发生脱酰胺化修饰的位点与数量; ②羟基化与脱酰胺化发生位点与周围氨基酸序列的规律性研究, 如COL1A2的Gly-Xaa-Yaa结构单元上, Pro处于Yaa位点时易发生羟基化修饰, 处于Xaa位点则几乎不发生羟基化修饰。类似的, 当Asn或Gln处于Yaa位点时易发生脱酰胺化修饰, 而处于Xaa位则发生脱酰胺化修饰较少。因此, 应探讨羟基化与脱酰胺化修饰对肽段的降解与溶出影响的规律性, 进一步关联修饰组对胶原蛋白来源肽段生物活性影响的规律性。
5.2 胶类动物药含Hyp的肽类成分功效特点与体内过程研究胶原蛋白来源的多肽以含Hyp的肽段功效特点较为突出, 如二肽Pro-Hyp和Hyp-Gly表现出多种生物效应, 通过促进CD4+细胞分化来抑制小鼠的过敏反应[35]; Pro-Hyp可通过促进软骨细胞分化, 维持永久性软骨中成熟成骨细胞的数量发挥软骨保护作用[36], 可促进真皮成纤维细胞增殖及透明质酸的合成[37]; 口服Pro-Hyp和Hyp-Gly可改善皮肤屏障功能障碍, 增加皮肤角质层水分[38]。体内过程研究表明, 口服胶原蛋白后血浆中可检测到Ala-Hyp-Gly、Ser-Hyp-Gly、Ala-Hyp、Phe-Hyp、Leu-Hyp、Ile-Hyp、Gly-Pro-Hyp及Pro-Hyp-Gly一系列含Hyp寡肽[33], 峰值浓度范围为0.67~23.84 μmol·L-1[39]。由此可见, 含Hyp肽类成分为关键功效物质基础, 胶类动物药应以含Hyp肽类成分为研究对象, 围绕“补血、养血、滋阴”等传统功效开展体内与体外生物效应评价研究, 结合同位素标记方法研究含Hyp肽类成分体内过程[40]。
5.3 角类、胶类动物药质量标准优化研究2015版《中国药典》收录角质类动物药为水牛角与羚羊角, 胶类动物药包括龟甲胶、阿胶与鹿角胶。水牛角与羚羊角项“鉴别”仅为外观或显微鉴别, 两者缺少基于现代分析或生化技术手段的鉴别方法, 且缺少特征性或功效性成分的含量测定方法。龟甲胶、阿胶与鹿角胶项下采用正离子电喷雾(ESI+)条件下的多反应检测(multiple reaction monitoring, MRM)的质谱法进行鉴别, 含量测定以L-Hyp、Gly、Ala及L-Pro为指标。
对于角类动物药来说, 质量标准提高应该围绕专属性鉴别及含量测定两方面, 专属性鉴别可基于DNA条形码或专属性肽段的研究提升质量标准。对于胶类动物药, 应进一步寻找和探究合理、准确的专属性肽段, 以解决用近亲缘性伪品原料掺假生产伪品胶类药材不易检测的问题, 如马皮特征肽的发现可用于阿胶中马皮源成分的检测[41]。可考虑采用功效肽段或专属性肽段的含量为指标制定含量测定方法与限量。
此外, 鉴于动物药的基原动物种属差异较大, 为了提高动物药蛋白质、多肽类化学成分的专属性与准确性, 有必要完善动物药专属蛋白质数据库[1]。数据库完善建立在全基因测序、蛋白质功能注释等工作基础上, 需多学科交叉合作共同完成, 但是在数据库未构建的情况下, 可通过转录组学方法构建动物药蛋白质数据库, 或应用近亲缘物种蛋白质数据库比对来研究动物药蛋白质肽类物质基础, 还可以借助生物信息学或蛋白质分析软件等, 采用从头测序(de novo sequencing)方法计算动物药中存在的可能的肽段序列, 通过合成多肽与目标肽段在分子量、质谱碎片信息和保留时间等多方面数据比对, 确定肽段序列, 寻找确定专属性肽段或效应肽段。
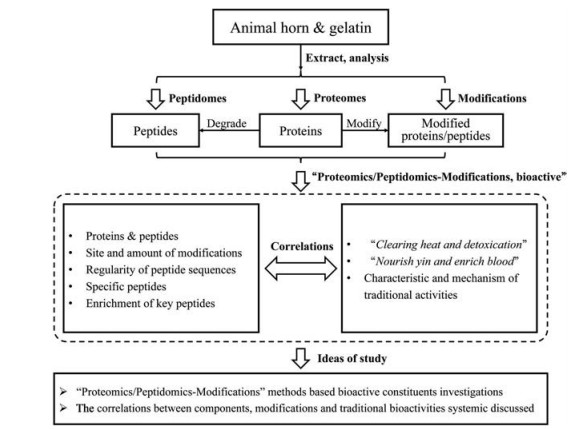
6 结语与展望随着现代高分辨质谱的发展, 蛋白质组学、多肽组学的研究日趋成熟, 角类与胶类动物药中蛋白质、肽类物质快速鉴定工作可高效开展。然而, 动物药生产加工、体内消化降解等过程带来的蛋白质、肽类成分结构变化规律, 以及与传统功效的相关性仍不明确, 为此, 本文提出基于“蛋白质/肽组学-修饰组学”的研究思路, 针对动物药研究存在的问题, 围绕动物药效应/指标性蛋白质或多肽类成分的寻找与发现, 以及关键蛋白质类或多肽类成分结构/序列与传统功效相关性与规律性等方面研究归纳并提出思路与方法, 如图 6所示, 开展以下工作: ①系统鉴定与表征角类及胶类动物药中蛋白质、肽类物质组成; ②明确鉴定的蛋白质、肽类成分发生修饰的位点与数量; ③将肽段序列规律性、修饰位点与数量的规律性整合, 与传统加工方法及传统功效关联, 揭示角类及胶类动物药功效物质基础与功效作用特点的科学内涵, 为深入开展动物药质量控制、功效物质基础研究提供参考与依据, 为解决中药动物药研究中存在的关键问题提出思路与方法, 推动中药动物药的发展。
|
Figure 6 Ideas and strategies for investigating the correlations between proteins/peptides and their bioactivities in animal horn and animal gelatin derived traditional Chinese medicines based on integrated "proteomics/peptidomics-modifications" methods |
作者贡献: 刘睿与赵明负责论文的框架构思与撰写, 段金廒负责对论文进行整体设计与指导。
利益冲突: 研究内容无任何利益冲突。
| [1] |
Yang B, Gao WY, Zhang YJ. Research ideas and methods of protein and peptides in animal medicine based on transcriptomics-proteomics-peptidomics integrated association analysis strategy[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 1033-1038. |
| [2] |
Huang TL, Yu P. Analysis of α-keratins in the horns of rhinoceros and buffalo by non-native capillary isoelectric focusing[J]. Chromatographia, 1997, 46: 437-439. DOI:10.1007/BF02490883 |
| [3] |
Jia RY, He YF, Wang RM, et al. Advanced in structure, extract and application of keratins[J]. Chemistry (化学通报), 2008, 4: 265-271. |
| [4] |
Mei NN, Zhou GY, Wang DL. Research progress and application of animal collagen and its hydrolysate[J]. Food Ind (食品工业), 2019, 40: 247-252. |
| [5] |
Liu R, Cheng JM, Wu H. Discovery of food-derived dipeptidyl peptidase Ⅳ inhibitory peptides:a review[J]. Int J Mol Sci, 2019, 20: 463. DOI:10.3390/ijms20030463 |
| [6] |
Romero-Gutierrez T, Peguero-Sanchez E, Cevallos MA, et al. A deeper examination of thorellius atrox scorpion venom components with omic techonologies[J]. Toxins (Basel), 2017, 9: pii:E399. DOI:10.3390/toxins9120399 |
| [7] |
Cao ZY, Mi ZM, Cheng GF, et al. Purification and characterization of a new peptide with analgesic effect from the scorpion Buthus martensi Karch[J]. J Pept Res, 2004, 64: 33-41. DOI:10.1111/j.1399-3011.2004.00164.x |
| [8] |
Cao ZY, Shen WQ, Pan YP, et al. Purification, characterization of two peptides from Buthus martensi Karch[J]. J Pept Res, 2003, 62: 252-259. DOI:10.1046/j.1399-3011.2003.00095.x |
| [9] |
Liu R, Wang F, Huang Q, et al. Available sustainable alternatives replace endangered animal horn based on their proteomic analysis and bio-effect evaluation[J]. Sci Rep, 2016, 6: 36027. DOI:10.1038/srep36027 |
| [10] |
Liu R, Huang Q, Zhu Z, et al. Further evidence for sustainable alternatives to replace threatened animal horn based on quantitative proteomic analysis[J]. Electrophoresis, 2018, 39: 3185-3190. DOI:10.1002/elps.201800282 |
| [11] |
Liu R, Duan JA, Wu H, et al. Analysis and identification of water soluble components of water buffalo horn[J]. Acta Pharm Sin (药学学报), 2015, 50: 594-598. |
| [12] |
Liu R, Huang Q, Duan JA, et al. Peptidome characterization of the antipyretic fraction of Bubali Cornu aqueous extract by nano liquid chromatography with orbitrap mass spectrometry detection[J]. J Sep Sci, 2017, 40: 587-595. DOI:10.1002/jssc.201600821 |
| [13] |
Liu R, Zhu Z, Qian D, et al. Comparison of the peptidome released from keratins in Saiga antelope horn and goat horn under simulated gastrointestinal digestion[J]. Electrophoresis, 2019, 40: 2759-2766. DOI:10.1002/elps.201900078 |
| [14] |
Yang H, Shen Y, Xu Y, et al. A novel strategy for the discrimination of gelatinous Chinese medicines based on enzymatic digestion followed by nano-flow liquid chromatography in tandem with orbitrap mass spectrum detection[J]. Int J Nanomedicine, 2015, 10: 4947-4955. |
| [15] |
Liu R, Huang Y, Xu H, et al. A strategy for identifying species-specific peptide biomarkers in deer-hide gelatin using untargeted and targeted mass spectrometry approaches[J]. Anal Chim Acta, 2019, 1092: 32-41. DOI:10.1016/j.aca.2019.09.064 |
| [16] |
Jenkins CL, Bretscher LE, Guzei IA, et al. Effect of 3-hydroxyproline residues on collagen stability[J]. J Am Chem Soc, 2003, 125: 6422-6427. DOI:10.1021/ja034015j |
| [17] |
Koike S, Nishimoto S, Ogasawara Y. Cysteine persulfides and polysulfides produced by exchange reactions with H2S protect SH-SY5Y cells from methylglyoxal-induced toxicity through Nrf2 activation[J]. Redox Biol, 2017, 12: 530-539. DOI:10.1016/j.redox.2017.03.020 |
| [18] |
Liang LP, Patel M. Plasma cysteine/cystine redox couple disruption in animal models of temporal lobe epilepsy[J]. Redox Biol, 2016, 9: 45-49. DOI:10.1016/j.redox.2016.05.004 |
| [19] |
Erel O, Neselioglu S. A novel and automated assay for thiol/disulphide homeostasis[J]. Clin Biochem, 2014, 47: 326-332. DOI:10.1016/j.clinbiochem.2014.09.026 |
| [20] |
Wang CX, Liu R, Qian DW, et al. Determination of free thiols in animal horn derived traditional Chinese medicines[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 35-38. |
| [21] |
Liu R, Huang Q, Shan JJ, et al. Metabolomics of the antipyretic effects of Bubali Cornu (water buffalo horn) in rats[J]. PLoS One, 2016, 11: e0158478. DOI:10.1371/journal.pone.0158478 |
| [22] |
Liu R, Chen JY, Zhu ZH, et al. Determination of thiol in Caprae Hircus Cornu and its effect on thiol level in rat plasma[J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2018, 34: 617-620. |
| [23] |
Wang D, Ru W, Xu Y, et al. Chemical constituents and bioactivities of Colla Corii Asini[J]. Drug Discov Ther, 2014, 8: 201-207. DOI:10.5582/ddt.2014.01038 |
| [24] |
Wu H, Ren C, Yang F, et al. Extraction and identification of collagen-derived peptides with hematopoietic activity from Colla Corii Asini[J]. J Ethnopharmacol, 2016, 182: 129-136. DOI:10.1016/j.jep.2016.02.019 |
| [25] |
Han J. The Traditional Chinese Medicine Ejiao Is an Immunoportective Agent Against Apoptosis (阿胶通过抵抗免疫细胞凋亡起到免疫保护的作用)[D]. Beijing: Peking Union Medical College, 2018.
|
| [26] |
Sibilla S, Godfrey M, Brewer S, et al. An overview of the beneficial effects of hydrolysed collagen as a nutraceutical on skin properties:scientific background and clinical studies[J]. Open Nutraceut J, 2015, 8: 29-42. DOI:10.2174/1876396001508010029 |
| [27] |
Jiang YP, Qiu ZQ, Wang YT, et al. Study on anti-fatigue, anti-oxidative and hemostatic effects of small molecule Asini Corii Colla[J]. Chin Pharm Bull (中国药理学通报), 2019, 35: 203-208. |
| [28] |
Liang R, Fan C, Li Y, et al. Immunomodulatory effects of low molecular weight peptide of Colla Corii Asini[J]. Sci Tech Food Ind (食品工业科技), 2019, 40: 306-310, 315. |
| [29] |
An MP, Zhang SY, Zhang Y, et al. Effect of Asini Corii Colla on immune function in hypoimmune mice[J]. Drug Eval Res (药物评价研究), 2018, 41: 567-571. |
| [30] |
Edgar S, Hopley B, Genovese L, et al. Effects of collagen-derived bioactive peptides and natural antioxidant compounds on proliferation and matrix protein synthesis by cultured normal human dermal fibroblasts[J]. Sci Rep, 2018, 8: 10474. DOI:10.1038/s41598-018-28492-w |
| [31] |
Zhai YJ, Zhu ZH, Zhu Y, et al. Characterization of collagen peptides in Elaphuri Davidiani Cornu aqueous extract with proliferative activity on osteoblasts using nano-liquid chromatography in tandem with orbitrap mass spectrometry[J]. Molecules, 2017, 22: 166. DOI:10.3390/molecules22010166 |
| [32] |
Tometsuka C, Koyama YI, Ishijima T, et al. Collagen peptide ingestion alters lipid metabolism-related gene expression and the unfolded protein response in mouse liver[J]. Br J Nutr, 2017, 117: 1-11. |
| [33] |
Iwai K, Hasegawa T, Taguchi Y, et al. Identification of food-derived collagen peptides in human blood after oral ingestion of gelatin hydrolysates[J]. J Agric Food Chem, 2005, 53: 6531-6536. DOI:10.1021/jf050206p |
| [34] |
Mann M, Jensen ON. Proteomic analysis of post-translational modifications[J]. Nat Biotechnol, 2003, 21: 255-261. DOI:10.1038/nbt0303-255 |
| [35] |
Nishikimi A, Koyama YI, Sayaka I, et al. Collagen-derived peptides modulate CD4+ T-cell differentiation and suppress allergic responses in mice[J]. Immun Inflamm Dis, 2018, 6: 245-255. DOI:10.1002/iid3.213 |
| [36] |
Nakatani S, Mano H, Sampei C, et al. Chondroprotective effect of the bioactive peptide prolyl-hydroxyproline in mouse articular cartilage in vitro and in vivo[J]. Osteoarthr Cartil, 2009, 17: 1620-1627. DOI:10.1016/j.joca.2009.07.001 |
| [37] |
Ohara H, Ichikawa S, Matsumoto H, et al. Collagen-derived dipeptide, proline-hydroxyproline, stimulates cell proliferation and hyaluronic acid synthesis in cultured human dermal fibroblasts[J]. J Dermatol, 2010, 37: 330-338. DOI:10.1111/j.1346-8138.2010.00827.x |
| [38] |
Shimizu J, Asami N, Kataoka A, et al. Oral collagen-derived dipeptides, prolyl-hydroxyproline and hydroxyprolyl-glycine, ameliorate skin barrier dysfunction and alter gene expression profiles in the skin[J]. Biochem Biophys Res Commun, 2015, 456: 626-630. DOI:10.1016/j.bbrc.2014.12.006 |
| [39] |
Ichikawa S, Morifuji M, Ohara H, et al. Hydroxyproline-containing dipeptides and tripeptides quantified at high concentration in human blood after oral administration of gelatin hydrolysate[J]. Int J Food Sci Nutr, 2009, 61: 52-60. |
| [40] |
Taga Y, Kusubata M, Ogawa-Goto K, et al. Highly accurate quantification of hydroxyproline-containing peptides in blood using a protease digest of stable isotope-labeled collagen[J]. J Agric Food Chem, 2014, 62: 12096-12102. DOI:10.1021/jf5039597 |
| [41] |
Gong LP, Hang BJ, Chi LL, et al. Identification of the horse skin marker peptide for test of horse-hide gelatin in donkey-hide gelatin[J]. Chin J Pharm Anal (药物分析杂志), 2018, 38: 364-369. |
 2020, Vol. 55
2020, Vol. 55


