作者贡献:王怀松负责撰写及修改论文; 丁娅提出研究思路、审阅并修改论文。
利益冲突:所有作者声明本文无利益冲突。
功能材料与生物、医药领域的交叉融合, 用于解决疾病诊断与治疗方面的科学难题, 一直受到广泛关注。特别是一些新型纳米材料, 如磁性纳米颗粒、贵金属纳米粒子、半导体量子点、聚合物纳米材料、金属有机配位聚合物、脂质体等, 已被成功应用于生物医学中的疾病标志物检测、细胞/活体成像以及药物的靶向递送等方面[1-3]。其中, 金属有机配位聚合物(coordination polymers, CPs)是由有机配体和金属离子(或金属簇)通过配位作用, 形成的网状聚合物, 具有结构多样性、高比表面积、高载药能力以及生物可降解等优点[4, 5]。
根据结晶程度的不同, CPs可分为无定型的配位聚合物颗粒(coordination polymer particles, CPPs)和高结晶度的金属有机框架(metal-organic frameworks, MOFs)[6]。CPs材料稳定的多孔性能被Yaghi、Kitagawa和Férey等课题组发现和发展, 并极大推进了该类材料的广泛应用[7-12]。其中, MOFs由于具有明确的化学结构、可调控的周期性多孔结构和易于功能化修饰等特点, 在气体储存/分离、催化、传感、生物成像和药物递送等领域得到了更广泛的应用。通过调控制备条件, MOFs的尺寸可降至纳米级别[13]。与其他无机、小分子或聚合物纳米粒在结构上存在显著差异, 纳米级的MOFs (nanoscale MOFs, NMOFs)在生物医药领域可表现出其独特的优点[4, 14, 15]: ①配体、配位中心(金属离子/簇)和制备条件的多样性, 可得到不同结构、理化性质、形貌和尺寸的NMOFs; ② NMOFs结构的多样性易于结合小分子或生物分子, 获得其生物活性或功能; ③尺寸可调的孔隙结构便于装载多种客体分子(如荧光分子、药物分子、蛋白质和酶等); ④金属与配体之间的配位作用相对不稳定, 使NMOFs具有较好的生物可降解性; ⑤通过选用生物毒性较低的配体与金属离子/簇, 可使NMOFs具有较好的生物相容性和较低的生物毒性。
NMOFs除自身有机配体和金属离子/簇可具有成像和疾病治疗能力外, 大量NMOFs也作为载体用于装载显影试剂或药物分子, 并用于疾病诊疗研究和应用(图 1)。具有良好生物成像功能的NMOFs材料已用于基于生物分子荧光传感/成像、核磁共振成像(magnetic resonance imaging, MRI)和计算机断层扫描(computed tomography, CT)等的疾病诊断和定位; 在疾病治疗方面, 除了以药物分子作为有机配体外, NMOFs已被证实可有效装载小分子药物、基因、多肽和酶等客体物质, 尤其在肿瘤的靶向递药方面, 展现出了较大潜力。因此, 在疾病诊断与治疗领域, MOFs (特别是NMOFs), 值得被广泛而深入地研究。
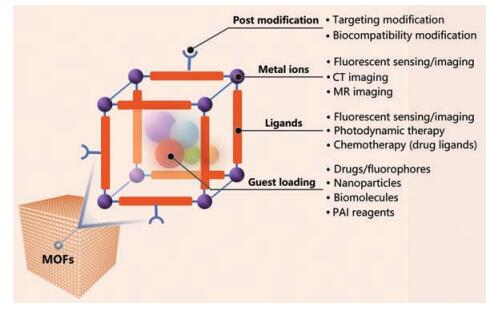
|
Figure 1 Metal-organic frameworks (MOFs) applied in the field of biomedicine |
用于合成MOFs的金属离子和配体种类繁多, 金属离子主要为过渡金属元素, 如: Zn2+、Fe3+、Mn2+、Zr4+、Co2+、Cu2+等, 以及稀土元素La3+、Eu3+、Tb3+等。MOFs的配体多选用含氮杂环类或芳香羧酸化合物。含氮杂环类配体的MOFs中, 应用最广泛的是沸石咪唑酯框架(zeolitic imidazolate frameworks, ZIFs), 或称为金属多氮唑框架(metal azolate frameworks, MAFs)。由咪唑类配体和锌或钴为配位中心进行反应得到的一种类似于分子筛结构的多孔MOFs[16, 17]。含羧酸配体的MOFs中, 比较经典的如MIL (materials of institute Lavoisier)系列, 是由过渡金属作为配位中心与对苯二甲酸类羧酸配体通过溶剂热法制备而得[11]。与氮杂环类配体相比较, 羧酸配体具有较好的配位能力, 因此含羧酸配体的MOFs具有相对较强的稳定性。
目前, 最常见的MOFs合成方法有溶剂热(水热)法、微波法、超声法和机械力学合成法等(图 2)。

|
Figure 2 Schematic illustration of the preparation of MOFs, and the post-modification of MOFs |
溶剂热(水热)法是使用最广泛的合成方法, 是将金属离子与有机配体溶解于溶剂中, 并密封在反应釜中, 在高温、高压条件下, 一般反应12~72 h, 得到MOFs晶体。该方法所使用的溶剂多以水或亲水性有机溶剂为主, 例如N, N-二甲基甲酰胺(DMF)、乙醇、甲醇等。采用溶剂热(水热)法的优点在于:高温高压下, 溶剂对反应原料的溶解性高, 可得到高质量的MOFs晶体; 通过改变溶剂类型, 可得到形貌和结构不同的MOFs材料; 在含水溶剂中, 合成的MOFs晶体, 通常具有较好的稳定性等。但溶剂热(水热)法反应时间较长, 反应过程难以控制, 较难批量制备。
微波合成法在溶剂热法的基础上发展而来。该方法将反应试剂与溶剂混匀后, 置于微波反应器中。在施加振荡电场后, 反应物中的原子吸收电磁波形成热效应, 从而导致温度上升, 促进了金属离子与有机配体的络合配位。微波合成法优点在于:反应速度快, 合成过程仅需几十分钟, 可大大改善溶剂热法反应时间长的缺点; 且加热均匀, 能够得到纳米级尺寸的MOFs颗粒[18]。因此, 微波合成法在快速制备NMOFs方面具有广泛的应用。
此外, MOFs的制备方法还有机械力学合成法和超声波合成法等[19-21]。机械力学合成法是将配体和金属盐混合, 通过球磨机的研磨而得到MOFs材料。该方法无需有机溶剂或仅用少量有机溶剂, 有利于MOFs材料的后期处理。超声波合成法是利用超声波空化现象, 使反应体系局部产生短暂的高温高压, 在短时间内得到粒径均匀的NMOFs。该方法可大幅降低晶化时间, 并得到小尺寸的NMOFs。在MOFs制备过程中, 所采用的制备方法、溶剂种类、溶液pH值、配体和金属离子的比例与浓度、反应温度和时间等, 都会影响所制备的MOFs的形貌、结构以及结晶程度。因此, 在制备具有特定形貌、结构和功能的MOFs时, 应充分考察反应条件, 选择合适的方法。
大多情况下, 所选用的配体和金属离子/簇除构成框架型结构外, 并不能赋予MOFs材料特殊的生物学功能。在已有MOFs的形貌和结构基础上, 对其进行功能化修饰, 是目前制备功能化MOFs的一个重要研究方向。修饰方法通常利用配位作用、配体共价修饰和表面包覆等途径, 将目标功能基团引入MOFs表面(图 2)。该方法可改善MOFs的生物相容性(如表面脂质体、聚乙二醇和细胞膜的包覆等)和提高其生物靶向性(如靶向多肽、适配体和叶酸的修饰等)。修饰方法要求MOFs结构中具有能够发生反应的官能团或位点, 且反应过程中结构稳定, 拓扑结构不发生改变。
2 基于MOFs的生物传感与成像MOFs在生物传感与生物医学成像领域具有广泛应用, 特别是荧光传感和成像。MOFs作为荧光传感载体, 可用于生物小分子、蛋白质、酶、核酸、体内代谢物等生物标志性分子的荧光传感、检测与成像[22-27]; MOFs也可作为优良载体, 设计生物分子的电化学传感器; 此外, MOFs中的一些金属离子或客体纳米粒可作为MR或CT成像的造影剂(图 3)。MOFs能够实现较好的传感与成像, 主要体现在其形态多样的多孔结构, 以及框架结构与目标分子之间的相互作用, 如氢键和π-π键作用等。
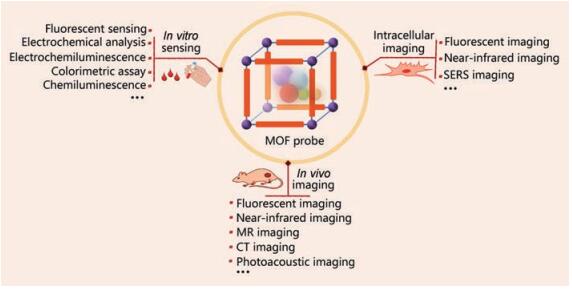
|
Figure 3 MOF-based probes for in vitro sensing, intracellular imaging, and in vivo imaging |
随着MOFs结构种类的增多, 其功能也趋于多元化。MOFs作为传感器载体, 在疾病的体外诊断、气体传感、温度传感、环境检测等领域都有潜在的应用前景[28-30]。在疾病体外诊断方面, 荧光传感方法应用最为广泛。MOFs的发光性质主要来自有机配体、金属离子或装载于其中的客体染料/发光颗粒。基于配体的发光现象包括配体自身共轭体系的发光; 基于金属离子的发光, 主要是镧系MOFs中配体与镧系金属离子(如Eu3+、Tb3+等)之间的“天线效应”, 即通过有机配体吸收的能量传递给发光能力较弱的镧系离子, 从而大幅提高镧系离子的荧光强度; 此外, MOFs材料也存在电荷转移发光性质, 包括配体到金属离子的电荷转移、金属到配体的电荷转移和配体内的电荷转移。
利用MOFs自身的荧光性质, 实现目标生物分子的传感/检测, 主要通过MOFs的多孔结构, 及其结构中的功能基团, 与目标物特异性识别, 并引发MOFs荧光性质的改变, 如:目标物导致“天线效应”或电荷转移能力发生变化, 进而改变MOFs荧光发射强度; 或目标物导致MOFs框架结构的塌陷或解离, 使包埋于其中的荧光染料释放出来, 产生荧光信号。该类方法主要用于在生理过程中起重要作用小分子(如葡萄糖、多巴胺、氨基酸、活性氧等)的传感[14]。
而有些本身不具有荧光性质的MOFs (如MIL-101、UiO-66-NH2和MIL-88等)还可以作为淬灭剂, 与荧光标记的生物分子组装, 用于设计荧光传感器。特别是荧光分子标记的核酸适配体可吸附于MOFs表面, 由于荧光共振能量转移(fluorescence resonance energy transfer, FRET)和光诱导电子转移(photoinduced electron-transfer, PET)等原因, 导致所标记荧光分子的信号淬灭; 当与目标物相互作用后, 所吸附的荧光标记物, 从MOFs表面脱附, 使荧光分子的荧光复燃, 从而实现目标物的传感与检测。该方法主要用于生物大分子, 如DNA/RNA和酶的传感与检测[23, 31, 32]。
在电化学传感方面, 由于多数MOFs导电性较差, 并不能作为理想的电化学材料使用。然而, MOFs的多孔性质, 使其允许导电性客体进入孔道, 或将客体物质包载于MOFs材料中, 进而制备出导电性良好的MOFs材料[33]。在电化学传感材料中, 与MOFs结合的客体物质包括贵金属纳米颗粒、量子点、氧化石墨烯和碳纳米管等。这些客体物质的参与, 既保持了MOFs的结构优点, 又提升了其电化学性能, 从而推动了MOFs功能材料在电化学分子领域的应用[34, 35]。MOFs功能材料用于电化学分析, 主要通过以下途径实现: ① MOFs材料中具有电化学信号的功能基团与目标物相互作用, 产生电信号的改变; ②将MOFs作为载体, 在其孔道结构内部装载电活性客体物质, 实现电化学信号检测; ③利用MOFs的高比表面积与高孔隙度特点, 对目标物进行特异性强吸附, 提高区域浓度, 提高检测信号。基于MOFs功能材料的电化学方法中, 最常用的是循环伏安(cyclic voltammetry, CV)法, 可用于从氨基酸等小分子到核酸、蛋白等生物大分子的检测[36, 37]。另一种较常用的方法为电化学发光(electrochemical luminescence, ECL)分析法。该方法综合了电化学分析法和化学发光分析法的优点。MOFs可作为ECL标识物的载体, 对电极进行修饰[38]。MOFs与目标物的特异性识别与吸附, 使其修饰的电极能进一步提高ECL方法的灵敏度。
此外, MOFs材料还可用于生物分子的比色传感和化学发光方法传感等方面[39, 40]。例如, MOFs可包覆酶或具有模拟酶的性质, 可通过3, 3', 5, 5'-四甲基联苯胺(TMB)-H2O2体系, 实现生物分子(如尿酸和谷胱甘肽等)的比色传感[41, 42]。利用MOFs (如MIL-53, PCN-22和NH2-MIL-88等)的类过氧化物酶活性, 通过鲁米诺-H2O2体系对砷盐和葡萄糖等分子进行化学发光传感[40, 43]。
2.2 细胞成像分析一些NMOFs材料(如ZIF-8, ZIF-90和UiO-66等), 因其纳米尺寸、形貌均一, 且生物相容性好, 与光学成像技术结合, 为细胞成像领域开辟了新方向。目前, 大部分基于NMOFs的细胞成像研究是利用材料的发光性质。发光性质可来自于NMOFs本身, 也可源于包载于NMOFs内部的荧光客体物质; 成像波长范围既可以在可见光区, 也可红移至近红外光区。例如, 在ZIF-90包载荧光分子(如rhodamine B, RhB)的系统中, ATP可与ZIF-90中2-醛基咪唑配体竞争性地和Zn2+配位, 破坏ZIF-90框架结构, 并释放荧光分子, 产生荧光信号[44]。该方法选择性好, 被进一步应用于细胞中ATP的成像。此外, UiO-66是一种具有良好荧光淬灭特性和核酸适配体吸附能力的NMOFs。将UiO-66与光标记适配体组装, 利用适配体的高特异性识别能力, 可用于细胞中miRNAs (如miR-21, miR-96和miR-125b)的荧光成像研究[45]。
此外, MOFs作为表面增强拉曼光谱(surface-enhanced Raman scattering, SERS)基底, 近些年得到了较大发展[46, 47]。通过对MOFs孔道和功能基团的调控, 可增强其对目标分析物的识别和富集能力, 从而增强SERS信号。MOFs基底对SERS的增强因子可达106, 并且通过改变MOFs的结构, 可实现不同生物分子的高灵敏和高选择性检测[48]。利用MOFs的优点, 将有望开发出基于SERS的细胞高效成像技术[49]。然而, 目前以MOFs作为基底的SERS细胞成像技术少有报道, 仍处在初始研究阶段。
2.3 体内成像分析NMOFs材料除了细胞成像外, 也用于体内成像分析。通过对NMOFs的表面修饰, 提高其生物相容性和靶向性。在肿瘤治疗方面, NMOFs可通过实体瘤的高通透性和滞留效应(enhanced permeability and retention effect, EPR effect)达到病灶。NMOFs已通过近红外成像、光声成像(photoacoustic imaging, PAI)、CT和MRI等技术应用在体内成像。由于可见光在体内穿透性较差, 因此基于NMOFs的体内成像可应用近红外发光客体物质与NMOFs形成复合材料的方法[50]。
CT扫描是基于X射线衰减的成像技术, 可得到骨骼的详细结构, 但在没有造影剂的情况下, 正常组织和病理组织的形态结构难以区分。NMOFs中的金属离子, 在CT造影剂方面展现出了优势。含有高原子序数金属离子的NMOFs已被用作CT造影剂, 如Hf4+和Zr4+形成的NMOFs, 利用二氧化硅和PEG修饰后, 给小鼠静脉注射, 可观察到肝脏和脾脏中CT信号的衰减增强[51]。
MRI作为一种无辐射成像技术, 具有良好的空间分辨率、深层组织穿透性和软组织对比度。由于MRI的灵敏度相对较低, 通常需要造影剂以增强成像效果。基于Gd3+或Mn2+的NMOFs目前已被用作MRI的T1阳性造影剂[52, 53]; 而基于铁的NMOFs主要用作T1阴性造影剂, 也是最常用的一类MRI造影剂, 例如含Fe3+的MIL系列NMOFs (MIL-101-Fe和MIL-100等)具备低毒性, 同时是较好的MRI的造影剂[54, 55]。此外, 同时具备MRI和CT功能的NMOFs复合材料也有报道, 如在Gd3+-NMOF与金纳米棒的复合材料中, Gd3+作为MRI的T1造影剂, 金纳米棒作为CT成像的造影剂, 可同时实现动物体内的MRI和CT分析[56]。
PAI是一种较新的非电离、无辐射、非侵入生物成像技术, 具有组织穿透力强和图像对比度高等优点。PAI常用的造影剂包括:有机染料分子造影剂、贵金属造影剂、碳纳米材料造影剂和金属氧化物等[57, 58]。这些造影剂可与NMOFs形成复合材料, 对体内进行多功能成像或治疗, 如吲哚青绿(indocyanine green, ICG)是用于临床的近红外有机染料, 包覆于NMOFs中并注射到动物体内, 可得到较强的PAI信号[59]。
3 基于MOFs的疾病治疗MOFs因其高比表面积、尺寸及孔径的可调控以及易于功能化修饰等优点, 在疾病治疗领域受到广泛关注。特别是NMOFs材料, 可装载各种疾病治疗相关客体物质, 如药物分子、蛋白质、酶、基因、光敏剂、染料和纳米粒子等, 进而形成NMOFs复合材料, 充分发挥客体物质的疾病治疗作用。目前, 大部分NMOFs复合材料是通过静脉注射方式给药, 进行化疗、光动力学治疗(photodynamic therapy, PDT)、光热治疗(photothermal therapy, PTT)和“诊疗一体化”等(图 4)。已有少量文献报道, NMOFs复合材料可作为口服药物保护剂, 如胰岛素给药方法一般通过皮下注射方式, 以调节血糖浓度。而一种NMOFs材料, NU-1000, 可装载胰岛素, 并在模拟胃酸环境中保持稳定, 且在模拟血液中可很好地发挥胰岛素作用, 说明NMOFs在设计口服药物方面也具有较大潜力[60]。

|
Figure 4 MOF-based composites for disease treatment |
在疾病治疗中, NMOFs用于药物递送最为广泛[61, 62]。因结构多样性和多孔性特点, 可设计出多种药物递送方式, 如:一些含羧基或含氮杂环类药物, 可直接作为配体, 合成NMOFs; 利用NMOFs孔结构装载药物分子; NMOFs表面可进一步进行生物相容性和靶向性修饰等。到达所靶向的组织后, 可通过NMOFs的缓慢降解或从孔结构中扩散方式, 对药物进行释放。NMOFs用于递药可克服许多药物的给药局限性, 如水溶性差、不稳定和药物体内分布问题等。
许多刺激响应性NMOFs, 可在各种生物环境刺激下, 如肿瘤组织酸性环境、温度变化和近红外照射等, 使装载于其中的药物释放。特别是NMOFs中配位键对外界酸性的敏感性而被广泛应用于药物释放。其中, 对ZIFs材料的研究较多, 如ZIF-8 (MAF-4)。ZIF-8可用于装载多柔比星、紫杉醇和5-氟尿嘧啶等抗癌药物, 以及装载基因和蛋白质等生物分子, 在肿瘤部位的酸性条件下, 会缓慢释放装载的药物分子, 达到疾病精准治疗目的[63-66]; 温度敏感型的NMOFs复合材料也有少量应用于药物释放, 如将温敏性聚(N-异丙基丙烯酰胺) [poly(N-isopropyl acrylamide), PNIPAM]修饰于UiO-66表面, 通过温度变化, 改变PNIPAM聚集形态, 实现UiO-66中装载药物的释放[67]; 通过近红外光照射, 使NMOFs中装载的药物释放, 也是较常用的方法, 如将具有光热性质的聚吡咯(polypyrrole, PPy)与MIL-100(Fe)制备成复合材料, 在近红外光照射下, 由于PPy的光热效应导致局部温度升高, 从而使MIL-100(Fe)中的药物得到可控释放[68]。此外, 还可以通过离子响应、湿度变化以及氧化还原等途径, 促使NMOFs进行药物释放, 但在该领域这些方法报道较少[69]。因此, 利用NMOFs开发新型刺激响应药物递送系统具有良好的前景。
3.2 光动力学治疗PDT是通过光敏剂的光动力反应进行疾病治疗。在常用的光敏剂中, 卟啉类化合物应用最为广泛。在PDT过程中, 卟啉类化合物作为光敏剂, 可高效产生单线态氧1O2[70]。酞菁类化合物是四氮杂卟啉的衍生物, 具有较好的热和化学稳定性以及光电性质, 并且分子结构具有可调节性。由于无取代的金属酞菁类化合物溶解性很差, 极大地限制了该类光敏剂的应用。卟啉类和酞菁类化合物因其疏水性, 在生理条件下容易发生自聚集现象, 从而限制了这些光敏剂对光的吸收和1O2的产生效率。在这种情况下, 如果加大用药剂量, 则会产生较大的不良反应。含羧基或氨基的卟啉衍生物作为NMOFs配体, 已成功应用到动物体内的PDT。在NMOFs结构中, 卟啉衍生物配体的自聚集现象被抑制, 从而提高了活性氧的产率。NMOFs的多孔性质, 也增加了活性氧从材料内部扩散出来, 杀伤细胞的作用。此外, 卟啉衍生物也可直接装载于NMOFs孔道内部, 进行光动力治疗。
3.3 光热治疗PTT通常是在肿瘤治疗过程中, 利用光热转换剂产生热量, 消融肿瘤细胞的一种光疗技术。该方法通过穿透性较好的近红外光激发能量转换为热能, 使体内局部温度升高, 进而杀伤病变细胞[71]。目前, NMOFs在PTT领域应用较少。NMOFs可与光热试剂(如金纳米棒等)形成NMOFs复合物, 在光热试剂进行PTT治疗的同时, 还可以通过NMOFs载药等方式, 实现多方式联合治疗。
4 MOFs在生物医药领域其他方面的应用除了用于生物传感和成像外, MOFs在生物样品的前处理(即药物和生物分子的特异性富集)和色谱分离分析方面也有广泛应用。MOFs的孔道结构具有分子筛作用, 其配体和金属离子可与分析物质之间产生π-π键、氢键和配位键等相互作用。因此, MOFs对不同的药物分子或生物分子具有良好的吸附与分离能力。如在MIL系列MOFs中, MIL-100(Cr)展现出良好的多肽吸附能力, 并且可作为MALDI-TOF MS分析的基底材料, 提高多肽的质谱检测信号[72, 73]。MOFs良好的热稳定性使其成为一种理想的气相色谱固定相材料。一些MOFs (如MIL-53, MIL-100, 和MIL-101等)可直接固定于气相色谱(gas chromatography, GC)毛细管柱内壁, 用于目标物质(特别是手性物质)的分离[74-76]。MOFs也可作为高效液相色谱(high performance liquid chromatography, HPLC)固定相。基于MOFs固定相的HPLC方法多以有机溶剂作为流动相。因MOFs形貌不规则, 且粒度难以精确控制到微米级别, 作为HPLC固定相易造成柱效低和柱压高等问题, 目前应用相对较少。
5 总结与展望MOFs在生物医药领域的应用, 主要体现在生物传感和药物递送等方面。因其具有较大的比表面积、丰富的多孔结构类型以及可功能化修饰等优点, MOFs在疾病诊断和治疗方面具有潜在优势。目前大多相关研究还处在初始阶段, 仍有一些问题需要解决, 如:
① MOFs的生物毒性。由于MOFs材料中, 还有大量金属离子和配体分子, 难免会导致其生物毒性较大。为避免或改善其生物相容性, 可选用内源性生物分子(如氨基酸和核苷酸等), 以及选用生物毒性较低的金属离子。同时, 对所形成的MOFs材料结构, 也应进行生物毒性考察。
② MOFs结构的稳定性。MOFs材料在含水体系中存在不稳定现象, 而这种不稳定现象, 可导致基于MOFs的功能材料难以在水相溶液中制备或组装; 并且, 在体内可能会被迅速降解, 而达不到靶向成像或缓释药物的目的。对于水稳定性MOFs材料的制备, 可选用含水溶剂、含羧酸配体以及高价态金属离子进行反应。
③ MOFs形貌的控制。反应温度、溶剂、时间和浓度等都会影响MOFs的结构和形貌。在体内成像和药物递送时, 需要得到理想的纳米尺寸。除了考察不同合成条件, 也可通过改变合成技术实现, 如采用微波辅助方法, 可得到相比于溶剂热法更小的MOFs颗粒。
④ MOFs的表面修饰。由于MOFs表面为配体和金属离子, 可能存在生物相容性差或不稳定的现象。因此, 对MOFs的表面修饰显得非常重要。一些多肽分子、蛋白质、核酸适配体以及其他生物相容性比较好的聚合物, 如聚乙二醇、壳聚糖和二氧化硅等, 都能较好地改善MOFs的生物相容性和稳定性。
| [1] |
Hu M, Huang L. Nanomaterial manipulation of immune microenvironment in the diseased liver[J]. Adv Funct Mater, 2019, 29: 1805760. |
| [2] |
Xie J, Gong L, Zhu S, et al. Emerging strategies of nanomaterial-mediated tumor radiosensitization[J]. Adv Mater, 2019, 31: 1802244. DOI:10.1002/adma.201802244 |
| [3] |
Hu Y, Lv T, Ma Y, et al. Nanoscale coordination polymers for synergistic NO and chemodynamic therapy of liver cancer[J]. Nano Lett, 2019, 19: 2731-2738. DOI:10.1021/acs.nanolett.9b01093 |
| [4] |
Della Rocca J, Liu D, Lin W. Nanoscale metal-organic frameworks for biomedical imaging and drug delivery[J]. Acc Chem Res, 2011, 44: 957-968. |
| [5] |
Paul M, Dastidar P. Coordination polymers derived from non-steroidal anti-inflammatory drugs for cell imaging and drug delivery[J]. Chemistry, 2016, 22: 988-998. DOI:10.1002/chem.201503706 |
| [6] |
Wang JL, Wang XY, Wang YH, et al. Room-temperature preparation of coordination polymers for biomedicine[J]. Coordin Chem Rev, 2020, 411: 213256. DOI:10.1016/j.ccr.2020.213256 |
| [7] |
Kitagawa S, Kitaura R, Noro S. Functional porous coordination polymers[J]. Angew Chem Int Ed, 2004, 43: 2334-2375. DOI:10.1002/anie.200300610 |
| [8] |
Fischer RA, Woell C. Functionalized coordination space in metal-organic frameworks[J]. Angew Chem Int Ed, 2008, 47: 8164-8168. DOI:10.1002/anie.200801612 |
| [9] |
Furukawa H, Ko N, Go YB, et al. Ultrahigh porosity in metal-organic frameworks[J]. Science, 2010, 329: 424-428. DOI:10.1126/science.1192160 |
| [10] |
Yaghi OM, Li G, Li H. Selective binding and removal of guests in a microporous metal-organic framework[J]. Nature, 1995, 378: 703-706. DOI:10.1038/378703a0 |
| [11] |
Férey G, Mellot-Draznieks C, Serre C, et al. A chromium terephthalate-based solid with unusually large pore volumes and surface area[J]. Science, 2005, 309: 2040-2042. DOI:10.1126/science.1116275 |
| [12] |
Férey G, Serre C, Mellot-Draznieks C, et al. A hybrid solid with giant pores prepared by a combination of targeted chemistry, simulation, and powder diffraction[J]. Angew Chem Int Ed, 2004, 43: 6296-6301. DOI:10.1002/anie.200460592 |
| [13] |
Cai X, Xie Z, Li D, et al. Nano-sized metal-organic frameworks:synthesis and applications[J]. Coord Chem Rev, 2020, 417: 213366. DOI:10.1016/j.ccr.2020.213366 |
| [14] |
Wang HS. Metal-organic frameworks for biosensing and bioimaging applications[J]. Coord Chem Rev, 2017, 349: 139-155. DOI:10.1016/j.ccr.2017.08.015 |
| [15] |
Liu Y, Xie XY, Cheng C, et al. Strategies to fabricate metal-organic framework (MOF)-based luminescent sensing platforms[J]. J Mater Chem C, 2019, 7: 10743-10763. DOI:10.1039/C9TC03208H |
| [16] |
Park KS, Ni Z, Côté AP, et al. Exceptional chemical and thermal stability of zeolitic imidazolate frameworks[J]. Proc Natl Acad Sci U S A, 2006, 103: 10186-10191. DOI:10.1073/pnas.0602439103 |
| [17] |
Zhang JP, Zhang YB, Lin JB, et al. Metal azolate frameworks:from crystal engineering to functional materials[J]. Chem Rev, 2012, 112: 1001-1033. DOI:10.1021/cr200139g |
| [18] |
Laybourn A, Katrib J, Ferrari-John RS, et al. Metal-organic frameworks in seconds via selective microwave heating[J]. J Mater Chem A, 2017, 5: 7333-7338. DOI:10.1039/C7TA01493G |
| [19] |
Wei JZ, Gong FX, Sun XJ, et al. Rapid and low-cost electrochemical synthesis of UiO-66-NH2 with enhanced fluorescence detection performance[J]. Inorg Chem, 2019, 58: 6742-6747. DOI:10.1021/acs.inorgchem.9b00157 |
| [20] |
Razavi SAA, Morsali A. Ultrasonic-assisted linker exchange (USALE):a novel post-synthesis method for controlling the functionality, porosity, and morphology of MOFs[J]. Chemistry, 2019, 25: 10876-10885. DOI:10.1002/chem.201901554 |
| [21] |
Brekalo I, Yuan W, Mottillo C, et al. Manometric real-time studies of the mechanochemical synthesis of zeolitic imidazolate frameworks[J]. Chem Sci, 2020, 11: 2141-2147. DOI:10.1039/C9SC05514B |
| [22] |
Hao YB, Shao ZS, Cheng C, et al. Regulating fluorescent aptamer-sensing behavior of zeolitic imidazolate framework (ZIF-8) platform via lanthanide ion doping[J]. ACS Appl Mater Interfaces, 2019, 11: 31755-31762. DOI:10.1021/acsami.9b12253 |
| [23] |
Wang HS, Liu HL, Wang K, et al. Insight into the unique fluorescence quenching property of metal-organic frameworks upon DNA binding[J]. Anal Chem, 2017, 89: 11366-11371. DOI:10.1021/acs.analchem.7b02256 |
| [24] |
Wang HS, Li J, Li JY, et al. Lanthanide-based metal-organic framework nanosheets with unique fluorescence quenching properties for two-color intracellular adenosine imaging in living cells[J]. NPG Asia Mater, 2017, 9: e354. DOI:10.1038/am.2017.7 |
| [25] |
He C, Liu D, Lin W. Nanomedicine applications of hybrid nanomaterials built from metal-ligand coordination bonds:nanoscale metal-organic frameworks and nanoscale coordination polymers[J]. Chem Rev, 2015, 115: 11079-11108. DOI:10.1021/acs.chemrev.5b00125 |
| [26] |
Lustig WP, Mukherjee S, Rudd ND, et al. Metal-organic frameworks:functional luminescent and photonic materials for sensing applications[J]. Chem Soc Rev, 2017, 46: 3242-3285. DOI:10.1039/C6CS00930A |
| [27] |
Lian X, Fang Y, Joseph E, et al. Enzyme-MOF (metal-organic framework) composites[J]. Chem Soc Rev, 2017, 46: 3386-3401. DOI:10.1039/C7CS00058H |
| [28] |
Kumar P, Kim KH, Deep A. Recent advancements in sensing techniques based on functional materials for organophosphate pesticides[J]. Biosens Bioelectron, 2015, 70: 469-481. DOI:10.1016/j.bios.2015.03.066 |
| [29] |
Kumar V, Kim KH, Kumar P, et al. Functional hybrid nanostructure materials:advanced strategies for sensing applications toward volatile organic compounds[J]. Coord Chem Rev, 2017, 342: 80-105. DOI:10.1016/j.ccr.2017.04.006 |
| [30] |
Langdon-Jones EE, Pope SJA. The coordination chemistry of substituted anthraquinones:developments and applications[J]. Coord Chem Rev, 2014, 269: 32-53. DOI:10.1016/j.ccr.2014.02.003 |
| [31] |
Yang SP, Chen SR, Liu SW, et al. Platforms formed from a three-dimensional Cu-based zwitterionic metal-organic framework and probe ss-DNA:selective fluorescent biosensors for human immunodeficiency virus 1 ds-DNA and sudan virus RNA sequences[J]. Anal Chem, 2015, 87: 12206-12214. DOI:10.1021/acs.analchem.5b03084 |
| [32] |
Zhao HQ, Qiu GH, Liang Z, et al. A zinc(II)-based two-dimensional MOF for sensitive and selective sensing of HIV-1 ds-DNA sequences[J]. Anal Chim Acta, 2016, 922: 55-63. DOI:10.1016/j.aca.2016.03.054 |
| [33] |
Stavila V, Talin AA, Allendorf MD. MOF-based electronic and optoelectronic devices[J]. Chem Soc Rev, 2014, 43: 5994-6010. DOI:10.1039/C4CS00096J |
| [34] |
Osman DI, El-Sheikh SM, Sheta SM, et al. Nucleic acids biosensors based on metal-organic framework (MOF):paving the way to clinical laboratory diagnosis[J]. Biosens Bioelectron, 2019, 141: 111451. DOI:10.1016/j.bios.2019.111451 |
| [35] |
Song Y, Xu M, Gong C, et al. Ratiometric electrochemical glucose biosensor based on GOD/AuNPs/Cu-BTC MOFs/macroporous carbon integrated electrode[J]. Sens Actuator B Chem, 2018, 257: 792-799. DOI:10.1016/j.snb.2017.11.004 |
| [36] |
Ling P, Lei J, Zhang L, et al. Porphyrin-encapsulated metal-organic frameworks as mimetic catalysts for electrochemical DNA sensing via allosteric switch of hairpin DNA[J]. Anal Chem, 2015, 87: 3957-3963. DOI:10.1021/acs.analchem.5b00001 |
| [37] |
Ling P, Lei J, Ju H. Porphyrinic metal-organic framework as electrochemical probe for DNA sensing via triple-helix molecular switch[J]. Biosens Bioelectron, 2015, 71: 373-379. DOI:10.1016/j.bios.2015.04.046 |
| [38] |
Zheng H, Yi H, Dai H, et al. Fluoro-coumarin silicon phthalocyanine sensitized integrated electrochemiluminescence bioprobe constructed on TiO2 MOFs for the sensing of deoxynivalenol[J]. Sens Actuator B Chem, 2018, 269: 27-35. DOI:10.1016/j.snb.2018.04.149 |
| [39] |
Wang Z, Yang J, Li Y, et al. Zr-based MOFs integrated with a chromophoric ruthenium complex for specific and reversible Hg2+ sensing[J]. Dalton Trans, 2018, 47: 5570-5574. DOI:10.1039/C8DT00569A |
| [40] |
Yi X, Dong W, Zhang X, et al. MIL-53(Fe) MOF-mediated catalytic chemiluminescence for sensitive detection of glucose[J]. Anal Bioanal Chem, 2016, 408: 8805-8812. DOI:10.1007/s00216-016-9681-y |
| [41] |
Badoei-Dalfard A, Sohrabi N, Karami Z, et al. Fabrication of an efficient and sensitive colorimetric biosensor based on Uricase/Th-MOF for uric acid sensing in biological samples[J]. Biosens Bioelectron, 2019, 141: 111420. DOI:10.1016/j.bios.2019.111420 |
| [42] |
Wang J, Li W, Zheng YQ. Nitro-functionalized metal-organic frameworks with catalase mimic properties for glutathione detection[J]. Analyst, 2019, 144: 6041-6047. DOI:10.1039/C9AN00813F |
| [43] |
Xie D, Ma Y, Gu Y, et al. Bifunctional NH2-MIL-88(Fe) metal-organic framework nanooctahedra for highly sensitive detection and efficient removal of arsenate in aqueous media[J]. J Mater Chem A, 2017, 5: 23794-23804. DOI:10.1039/C7TA07934F |
| [44] |
Deng J, Wang K, Wang M, et al. Mitochondria targeted nanoscale zeolitic imidazole framework-90 for ATP imaging in live cells[J]. J Am Chem Soc, 2017, 139: 5877-5882. DOI:10.1021/jacs.7b01229 |
| [45] |
Wu Y, Han J, Xue P, et al. Nano metal-organic framework (NMOF)-based strategies for multiplexed microRNA detection in solution and living cancer cells[J]. Nanoscale, 2015, 7: 1753-1759. DOI:10.1039/C4NR05447D |
| [46] |
Sugikawa K, Furukawa Y, Sada K. SERS-active metal-organic frameworks embedding gold nanorods[J]. Chem Mater, 2011, 23: 3132-3134. DOI:10.1021/cm200737c |
| [47] |
Yuan Y, Panwar N, Yap SHK, et al. SERS-based ultrasensitive sensing platform:an insight into design and practical applications[J]. Coord Chem Rev, 2017, 337: 1-33. DOI:10.1016/j.ccr.2017.02.006 |
| [48] |
Sun H, Cong S, Zheng Z, et al. Metal-organic frameworks as surface enhanced raman scattering substrates with high tailorability[J]. J Am Chem Soc, 2019, 141: 870-878. DOI:10.1021/jacs.8b09414 |
| [49] |
Lahr RH, Vikesland PJ. Surface-enhanced raman spectroscopy (SERS) cellular imaging of intracellulary biosynthesized gold nanoparticles[J]. ACS Sustain Chem Eng, 2014, 2: 1599-1608. DOI:10.1021/sc500105n |
| [50] |
Liu D, Lu K, Poon C, et al. Metal-organic frameworks as sensory materials and imaging agents[J]. Inorg Chem, 2014, 53: 1916-1924. DOI:10.1021/ic402194c |
| [51] |
Dekrafft KE, Boyle WS, Burk LM, et al. Zr- and Hf-based nanoscale metal-organic frameworks as contrast agents for computed tomography[J]. J Mater Chem, 2012, 22: 18139-18144. DOI:10.1039/c2jm32299d |
| [52] |
Wang YM, Liu W, Yin XB. Self-limiting growth nanoscale coordination polymers for fluorescence and magnetic resonance dual-modality imaging[J]. Adv Funct Mater, 2016, 26: 8463-8470. DOI:10.1002/adfm.201602925 |
| [53] |
Yang Y, Chao Y, Liu J, et al. Core-shell and co-doped nanoscale metal-organic particles (NMOPs) obtained via post-synthesis cation exchange for multimodal imaging and synergistic thermo-radiotherapy[J]. NPG Asia Mater, 2017, 9: e344. DOI:10.1038/am.2016.205 |
| [54] |
Wang D, Zhou J, Chen R, et al. Controllable synthesis of dual-MOFs nanostructures for pH-responsive artemisinin delivery, magnetic resonance and optical dual-model imaging-guided chemo/photothermal combinational cancer therapy[J]. Biomaterials, 2016, 100: 27-40. DOI:10.1016/j.biomaterials.2016.05.027 |
| [55] |
Zhang Y, Liu C, Wang F, et al. Metal-organic-framework-supported immunostimulatory oligonucleotides for enhanced immune response and imaging[J]. Chem Commun, 2017, 53: 1840-1843. DOI:10.1039/C6CC09280B |
| [56] |
Shang W, Zeng C, Du Y, et al. Core-shell gold nanorod@metal-organic framework nanoprobes for multimodality diagnosis of glioma[J]. Adv Mater, 2017, 29: 1604381. DOI:10.1002/adma.201604381 |
| [57] |
Cheheltani R, Ezzibdeh RM, Chhour P, et al. Tunable, biodegradable gold nanoparticles as contrast agents for computed tomography and photoacoustic imaging[J]. Biomaterials, 2016, 102: 87-97. DOI:10.1016/j.biomaterials.2016.06.015 |
| [58] |
Ni Y, Kannadorai RK, Peng J, et al. Naphthalene-fused BODIPY near-infrared dye as a stable contrast agent for in vivo photoacoustic imaging[J]. Chem Commun, 2016, 52: 11504-11507. DOI:10.1039/C6CC05126J |
| [59] |
Cai W, Gao H, Chu C, et al. Engineering phototheranostic nanoscale metal-organic frameworks for multimodal imaging-guided cancer therapy[J]. ACS Appl Mater Interfaces, 2017, 9: 2040-2051. DOI:10.1021/acsami.6b11579 |
| [60] |
Chen Y, Li P, Modica JA, et al. Acid-resistant mesoporous metal-organic framework toward oral insulin delivery:protein encapsulation, protection, and release[J]. J Am Chem Soc, 2018, 140: 5678-5681. DOI:10.1021/jacs.8b02089 |
| [61] |
Abánades Lázaro I, Forgan RS. Application of zirconium MOFs in drug delivery and biomedicine[J]. Coord Chem Rev, 2019, 380: 230-259. DOI:10.1016/j.ccr.2018.09.009 |
| [62] |
Yang J, Yang YW. Metal-organic frameworks for biomedical applications[J]. Small, 2020, 16: 1906846. DOI:10.1002/smll.201906846 |
| [63] |
Wu Q, Niu M, Chen X, et al. Biocompatible and biodegradable zeolitic imidazolate framework/polydopamine nanocarriers for dual stimulus triggered tumor thermo-chemotherapy[J]. Biomaterials, 2018, 162: 132-143. DOI:10.1016/j.biomaterials.2018.02.022 |
| [64] |
Liang Z, Yang Z, Yuan H, et al. A protein@metal-organic framework nanocomposite for pH-triggered anticancer drug delivery[J]. Dalton Trans, 2018, 47: 10223-10228. DOI:10.1039/C8DT01789A |
| [65] |
Sun CY, Qin C, Wang XL, et al. Zeolitic imidazolate framework-8 as efficient pH-sensitive drug delivery vehicle[J]. Dalton Trans, 2012, 41: 6906-6909. DOI:10.1039/c2dt30357d |
| [66] |
He L, Pang K, Liu W, et al. Core-shell noble-metal@zeolitic-imidazolate-framework nanocarriers with high cancer treatment efficiency in vitro[J]. J Mater Chem B, 2019, 7: 1050-1055. DOI:10.1039/C8TB03318H |
| [67] |
Nagata S, Kokado K, Sada K. Metal-organic framework tethering PNIPAM for ON-OFF controlled release in solution[J]. Chem Commun, 2015, 51: 8614-8617. DOI:10.1039/C5CC02339D |
| [68] |
Zhu YD, Chen SP, Zhao H, et al. PPy@MIL-100 nanoparticles as a pH- and near-IR-irradiation-responsive drug carrier for simultaneous photothermal therapy and chemotherapy of cancer cells[J]. ACS Appl Mater Interfaces, 2016, 8: 34209-34217. DOI:10.1021/acsami.6b11378 |
| [69] |
Cai W, Wang J, Chu C, et al. Metal organic framework-based stimuli-responsive systems for drug delivery[J]. Adv Sci, 2019. DOI:10.1002/advs.201801526 |
| [70] |
Zhao Y, Wang J, Cai X, et al. Metal-organic frameworks with enhanced photodynamic therapy:synthesis, erythrocyte membrane camouflage, and aptamer-targeted aggregation[J]. ACS Appl Mater Interfaces, 2020, 12: 23697-23706. DOI:10.1021/acsami.0c04363 |
| [71] |
Liu Y, Bhattarai P, Dai Z, et al. Photothermal therapy and photoacoustic imaging via nanotheranostics in fighting cancer[J]. Chem Soc Rev, 2019, 48: 2053-2108. DOI:10.1039/C8CS00618K |
| [72] |
Gu ZY, Chen YJ, Jiang JQ, et al. Metal-organic frameworks for efficient enrichment of peptides with simultaneous exclusion of proteins from complex biological samples[J]. Chem Commun, 2011, 47: 4787-4789. DOI:10.1039/c1cc10579e |
| [73] |
Yang SS, Shi MY, Tao ZR, et al. Recent applications of metal-organic frameworks in matrix-assisted laser desorption/ionization mass spectrometry[J]. Anal Bioanal Chem, 2019, 411: 4509-4522. DOI:10.1007/s00216-019-01876-1 |
| [74] |
Yang CX, Ren HB, Yan XP. Fluorescent metal-organic framework MIL-53(Al) for highly selective and sensitive detection of Fe3+ in aqueous solution[J]. Anal Chem, 2013, 85: 7441-7446. DOI:10.1021/ac401387z |
| [75] |
Gu ZY, Yang CX, Chang N, et al. Metal-organic frameworks for analytical chemistry:from sample collection to chromatographic separation[J]. Acc Chem Res, 2012, 45: 734-745. DOI:10.1021/ar2002599 |
| [76] |
Kou WT, Yang CX, Yan XP. Post-synthetic modification of metal-organic frameworks for chiral gas chromatography[J]. J Mater Chem A, 2018, 6: 17861-17866. DOI:10.1039/C8TA06804F |
 2020, Vol. 55
2020, Vol. 55


