作者贡献:安南负责综述的撰写、相关文献的资料收集、信息分析和文章作图; 陈子琦参与了部分内容的撰写和文献整理; 黄敏是综述框架的构思者及负责人, 指导论文写作并对论文进行了修改和检查。全体作者都阅读并同意最终的文本。
利益冲突:所有作者均不存在利益冲突。
2. 中国科学院大学, 北京 100009
2. University of Chinese Academy of Sciences, Beijing 100009, China
血管是生物在进化过程中出现的器官, 可通过运输血液向组织输送氧气、营养物质及生长因子, 同时排出代谢废物, 维持机体正常新陈代谢[1]。血管内壁的内皮细胞(endothelial cells)参与血管新生及血管稳态维持, 有利于氧气和营养物质的供给, 满足机体代谢需求。人们对内皮细胞功能的关注很大程度上因为其在血管新生(angiogenesis)过程中的重要作用。血管新生是指从已有血管发展成新血管的过程, 主要包括血管基底膜降解, 血管内皮细胞激活、增殖和迁移, 以及重建形成新血管和血管网等, 是个涉及多细胞和多分子的复杂过程。内皮细胞是血管新生过程的核心参与者, 其可塑性极强, 长期处于静息状态, 一旦受到血管内皮生长因子(vascular endothelial growth factor, VEGF)等信号的刺激就可立即切换至活化、高度增殖和迁移的状态, 启动血管新生[2]。
对于血管新生机制的研究已有数十年历史, 特别是对肿瘤血管新生过程参与肿瘤生长和转移的研究已取得显著进展。临床研究已证实, 抑制内皮细胞VEGF信号通路可作为治疗肿瘤的策略[3]。近期研究表明, 内皮细胞的代谢状态和血管内皮生长因子的刺激对于血管新生过程同等重要[4, 5]。尽管对细胞代谢的研究已经有了一个多世纪的历史, 但关于内皮细胞代谢的研究在最近几年才受到关注。本综述总结了内皮细胞代谢研究的最新进展, 重点讨论了肿瘤微环境中内皮细胞的代谢改变, 旨在通过增加对内皮细胞代谢的认识, 为血管新生相关疾病的治疗策略提供新思路。
1 内皮细胞和血管新生在生物体发育过程中, 血管网络会随生物体代谢需求的变化而扩展, 以保证为所有组织提供充足氧气和营养物质。内皮细胞排列于血管内壁, 在血管系统中发挥至关重要的作用。成熟内皮细胞在正常情况下一般维持静息状态, 当在缺氧、损伤或其他病理刺激下, 会被迅速激活, 形成新的血管, 以便向低氧组织输送氧气和营养物质。参与血管新生的内皮细胞根据其定位和功能的不同, 可分为3型[2]: ①尖端细胞(tip cell), 位于新生血管最前端, 可以形成丝状伪足, 响应VEGF的刺激并在新生血管处发芽; ②茎细胞(stalk cell), 与尖端细胞相邻, 通过细胞增殖使血管新芽延长; ③方阵细胞(phalanx cell), 存在于成熟血管中, 主要功能是将生长中的血管新芽与已存在的血管连接起来, 调节血管稳态并发挥屏障功能[2, 6, 7]。
血管新生过程主要受信号分子的调控, 其代表性激活剂是VEGF。血管内皮生长因子受体2 (vascular endothelial growth factor receptor 2, VEGFR2)是接收血管生成信号的主要受体[8]。VEGF与内皮细胞上的VEGFR2结合, 可诱导尖端内皮细胞的形成。尖端内皮细胞形成后, VEGF刺激尖端细胞表达Delta样配体4 (Delta-like 4, DLL4)。DLL4可以调控周边内皮细胞Notch信号通路并下调VEGFR2的表达, 促使周边内皮细胞展现出茎细胞表型。此外, 尖端细胞与茎细胞之间也可以相互转化[9]。当2个相邻的尖端细胞接触时, 它们可以连接并形成血管。当血管成熟后, 内皮细胞会成为方阵细胞恢复至静息状态[2]。
2 正常组织血管内皮细胞的代谢内皮细胞代谢可将营养物质转化为能量和生物大分子, 以支持内皮细胞的增殖和迁移[1]。研究表明, 内皮细胞的代谢能够调控血管新生[1]。下文将从葡萄糖代谢、氨基酸代谢和脂肪酸代谢等方面阐述内皮细胞的代谢特点和调控机制(图 1)。
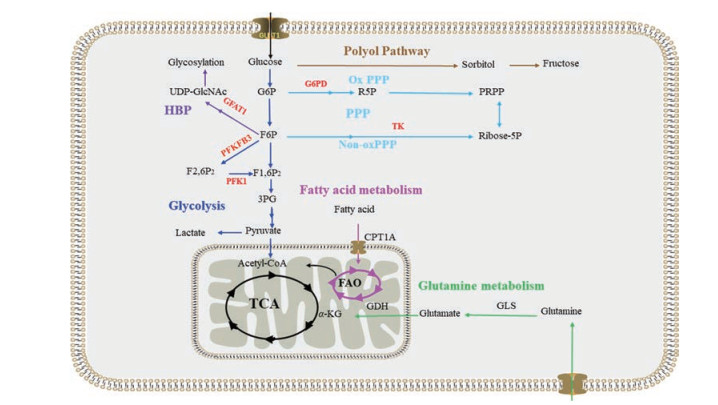
|
Figure 1 Overview of metabolic pathways and their rate-limiting metabolic enzymes (red) in endothelial cells. HBP: Hexosamine biosynthesis pathway; G6P: Glucose-6-phosphate; F6P: Fructose-6-phosphate; F1, 6P2: Fructose-1, 6-bisphosphate; F2, 6P2: Fructose-2, 6-bisphosphate; 3PG: 3-Phosphoglycerate; GFAT1: Glutamine fructose-6-phosphate amino-transferase 1; UDP-GlcNAc: Uridine diphosphate N-acetylglucosamine; PFKFB3: Phosphofructokinase-2/fructose-2, 6-bisphosphatase isoform 3; PFK1: Phosphofructokinase-1; G6PD: Glucose-6-phosphate dehydrogenase; Ox: Oxidative; PPP: Pentose phosphate pathway; PRPP: 5-Phosphoribosyl-1-pyrophosphate; Ribose-5P: Ribose-5-phosphate; TK: Transketolase; TCA: Tricarboxylic acid; FAO: Fatty acid oxidation; GLUT1: Glucose transporter 1; CPT1A: Carnitine palmitoyl transferase 1A; GLS: Glutaminase; GDH: Glutamate dehydrogenase; α-KG: α-Ketoglutarate; Acetyl-CoA: Acetyl coenzyme A |
葡萄糖是血管内皮细胞的主要能量来源。血管内皮细胞利用葡萄糖转运体(glucose transporter, GLUT)通过易化扩散的方式摄取葡萄糖。血管内皮细胞摄取的葡萄糖可通过以下途径代谢, 通过不同的机制调控血管新生。
2.1.1 糖酵解途径在氧气充足情况下, 大多数哺乳动物细胞摄取的葡萄糖通过线粒体充分地氧化磷酸化, 产生大量腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)和其他供能小分子。内皮细胞沿血管内壁排列的特点使其能够充分接触到血液中的氧气。从理论上讲, 内皮细胞的线粒体呼吸应该在能量供应方面占主导地位; 然而事实并非如此, 研究表明内皮细胞的能量供给高度依赖于糖酵解, 其85%的ATP是通过糖酵解途径产生的[2, 10, 11]。葡萄糖在被内皮细胞摄取后, 通过糖酵解途径被代谢为丙酮酸。在正常情况下, 糖酵解产生的丙酮酸只有不到1%进入三羧酸循环(tricarboxylic acid cycle, TCA)被氧化[2]。在人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)中, 糖酵解通量大约比葡萄糖氧化通量高200倍以上[4]。
内皮细胞选择糖酵解作为能量供给的主要代谢方式, 意味着每摩尔葡萄糖生成ATP的净产量比氧化磷酸化低将近20倍, 但这种选择使内皮细胞能更好地适应外界环境变化, 主要表现在以下几个方面: ①高度糖酵解能产生大量乳酸, 而乳酸具有促血管生成的功能[12-15]; ②低氧化磷酸化使得血管中的氧气消耗量低, 从而最大限度地保留了血管中的氧气, 保证了向周围组织输送的氧气量; ③当葡萄糖供给充足时, 糖酵解产生ATP的速度比氧化磷酸化更快, 能保证内皮细胞运动迁移时对能量的瞬间需求; ④内皮细胞高度依赖糖酵解使葡萄糖上的碳能够进入糖酵解侧支来维持生物大分子的合成; ⑤糖酵解是无氧代谢, 其速率不受氧气水平限制, 使内皮细胞能够在低氧组织中维持正常功能, 保障了低氧组织氧气和营养物质的供给[16, 17]。
在静息状态下, 内皮细胞的糖酵解水平维持在较高状态, 当它们被激活发生分裂和迁移时, 糖酵解的通量可能会翻倍[2]。在血管新生过程中, VEGF的刺激会使葡萄糖转运蛋白1 (glucose transporter 1, GLUT1)表达增加, 促进内皮细胞对葡萄糖的摄取[18]; VEGF还能上调糖酵解关键代谢酶磷酸果糖激酶-2/果糖-2, 6-二磷酸酶3 (phosphofructokinase-2/fructose-2, 6-biophosphatase 3, PFKFB3)的表达水平, 提高糖酵解水平[4, 18, 19]。PFKFB3是一种糖酵解调节剂, 可以催化果糖-6-磷酸生成果糖-2, 6-双磷酸, 后者能以变构方式激活磷酸果糖激酶1 (phosphofructokinase 1, PFK1), 提高糖酵解水平[2]。此外, PFKFB3和其他糖酵解酶可以与肌动蛋白结合, 分散至片状伪足和丝状伪足中, 以有利于局部区域通过糖酵解快速产生ATP, 保证细胞迁移和血管新生过程中细胞骨架重塑的能量需求[4]。
2.1.2 磷酸戊糖途径磷酸戊糖途径(pentose phosphate pathway, PPP)是糖酵解的一条重要支路, 由氧化型和还原型2个分支组成。氧化型磷酸戊糖途径可以利用糖酵解中间代谢产物6-磷酸葡萄糖(glucose-6-phosphate, G6P)生成烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)和5-磷酸核糖(ribose-5-phosphate, R5P); 还原型磷酸戊糖途径则利用糖酵解中间产物6-磷酸果糖和3-磷酸甘油醛生成5-磷酸核酮糖。磷酸戊糖途径产生的NADPH可用于维持细胞内氧化还原平衡, 并参与脂肪酸、一氧化氮(nitric oxide, NO)和谷胱甘肽的合成, 而5-磷酸核酮糖则参与合成RNA和DNA[20-23]。有研究表明, 抑制磷酸戊糖途径氧化支路的限速酶6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase, G6PD)和非氧化支路的限速酶转酮醇酶(transketolase, TK)均能影响内皮细胞的活力和迁移能力[24, 25]。
在正常生理状态下, 血管内皮细胞摄取的葡萄糖仅有1%~3%通过磷酸戊糖途径代谢[11, 25-28]; 然而当脂多糖等刺激使内皮细胞处于氧化应激状态时[26], 有高达80%的葡萄糖进入磷酸戊糖途径, 以维持细胞的氧化还原平衡[29]。另外, 磷酸戊糖途径还可以通过调控VEGF信号通路[25, 30]促进血管新生。
2.1.3 己糖胺合成途径血管内皮细胞摄取的一部分葡萄糖可进入糖酵解另一支路-己糖胺合成途径(hexosamine biosynthesis pathway, HBP)中进行代谢并参与糖基化修饰过程。谷氨酰胺-6-磷酸果糖酰胺基转移酶(glutamine fructose-6-phosphate amino-transferase, GFAT)是HBP途径的限速酶, 该酶催化产生的尿苷二磷酸N-乙酰氨基葡萄糖(uridine diphosphate N-acetylglucosamine, UDP-GlcNAc)是N-糖基化和O-糖基化修饰的底物[31-33]。现有研究表明, HBP途径主要是通过影响蛋白的糖基化修饰来调控血管新生。例如, 利用2-脱氧葡萄糖抑制N-糖基化修饰[34]或升高血管内皮细胞的O-糖基化修饰, 可通过影响不同信号分子的糖基化修饰抑制血管新生[35]; 利用半乳糖凝集素-3 (galectin-3)抑制VEGFR2的N-聚糖相互作用, 可促进VEGF刺激血管生成[36]。另外, Notch受体的糖基化调控及与DLL4的相互作用也在内皮细胞分化过程中发挥了重要作用[37]。
2.1.4 多元醇途径当葡萄糖含量超过糖酵解的处理能力时, 葡萄糖会进入多元醇途径, 葡萄糖被醛糖还原酶还原为山梨糖醇, 然后转化为果糖[38, 39]。醛糖还原酶将NADPH转化为NADP+, 所以多元醇途径的激活会大量消耗NADPH, 使得维持氧化还原稳态的谷胱甘肽水平降低, 最终导致活性氧(reactive oxygen species, ROS)的积累。有研究表明, 抑制醛糖还原酶可降低视网膜血管过度生长引起的内皮细胞氧化损伤和细胞凋亡, 提示抑制多元醇途径可以有效抑制血管新生[40, 41]。此外, 多元醇途径还可通过影响VEGFR2和成纤维细胞生长因子(fibroblast growth factor, FGF)的信号传导参与血管新生过程[42, 43]。
2.1.5 线粒体氧化磷酸化尽管血管内皮细胞高度依赖于糖酵解代谢过程, 但血管内皮细胞的线粒体功能并没有受损, 这意味着血管内皮细胞摄取的葡萄糖能够通过线粒体的TCA循环途径进行氧化磷酸化代谢。有研究发现, VEGF能够通过激活蛋白激酶B (protein kinase B, 又称Akt)依赖的信号通路促进葡萄糖在线粒体的氧化磷酸化代谢过程[44], 而干扰Notch信号通路的负调控子去乙酰化酶(sirtuin1, SIRT1)则可抑制葡萄糖在线粒体的氧化磷酸化代谢, 进而抑制血管新生[45]。
尽管如此, 葡萄糖在线粒体的氧化磷酸化过程是否参与调控血管新生以及如何调控血管新生仍然具有争议。内皮细胞中线粒体具有体积较小、数量稀少的特点, 内皮细胞中线粒体的体积仅占细胞总体积的5%, 而在肝细胞中高达30%[46]。因此, 线粒体在内皮细胞中供能有限[2]。有研究表明, 血管内皮细胞生成的所有ATP中仅有15%来自于线粒体的氧化磷酸化途径[1], 因此生成ATP并不是线粒体促进血管新生的主要机制[47]。然而, 也有例外, 血脑屏障毛细血管内皮细胞中的线粒体数量很多, 是外周肌肉毛细血管内皮细胞线粒体数量的5倍, 它们主要利用线粒体的氧化磷酸化代谢途径产生大量ATP, 以提供血脑屏障单向物质转运的能量需求[48]。此外, 在一氧化碳存在的情况下, 线粒体氧化磷酸化会有所增强[49]。
除此之外, 有观点认为, 血管内皮细胞的线粒体氧化磷酸化过程主要通过产生ROS和NO, 将其作为信号分子调控相关信号通路来促进血管新生[50]。例如, 肺部血管内皮细胞的细胞骨架可感受并传导因呼吸运动而产生的机械力, 进而促进线粒体氧化磷酸化过程并产生ROS, 进而激活核因子kappa-B (nuclear factor kappa-B, NF-κB)信号通路上调血管细胞黏附分子1 (vascular cell adhesion molecule-1, VCAM-1)的表达并促进血管新生[51]。由于线粒体呼吸参与调控血管新生相关的信号通路, 因此靶向血管内皮细胞的线粒体氧化磷酸化代谢途径也被认为是抑制血管新生的一种策略[52]。
2.2 氨基酸代谢氨基酸是内皮细胞所需的重要营养物质, 目前对内皮细胞氨基酸代谢的研究相对较少, 主要关注于谷氨酰胺代谢。谷氨酰胺是细胞增殖所必需的营养物质[53, 54], 主要提供碳源和氮源用于生物合成并维持氧化还原平衡。谷氨酰胺合成的多胺前体保证了内皮细胞的正常生长。在人脐静脉内皮细胞中, 谷氨酰胺贡献了TCA循环30%的碳源, 相当于糖酵解和脂肪酸来源碳源的总和[5]。
谷氨酰胺进入内皮细胞后由谷氨酰胺酶1 (glutaminase 1, GLS1)催化生成谷氨酸。哺乳动物细胞中通常表达2种GLS同功酶, 分别为GLS1和GLS2。GLS1催化谷氨酰胺驱动进入TCA循环, 而GLS2催化谷氨酰胺作为碳源和氮源合成谷胱甘肽, 以维持氧化还原稳态。目前尚不清楚内皮细胞中是否存在GLS1和GLS2表达的差异, 但有研究表明, 在小鼠视网膜微血管中, 尖端细胞GLS2表达比茎细胞高[55]。干扰内皮细胞GLS1能降低尖端内皮细胞的分化能力, 而抑制谷氨酰胺代谢会减弱尖端细胞的迁移能力和茎细胞的增殖, 诱导内皮细胞产生衰老表型, 对体内血管出芽产生抑制作用。此外, 谷氨酰胺可被天冬酰胺合酶(asparagine synthetase, ASNS)代谢为天冬酰胺。沉默ASNS会抑制血管出芽。因此, 靶向GLS1和ASNS等氨基酸代谢酶是潜在的抗血管生成治疗方法[56]。
在内皮细胞中, 谷氨酰胺代谢对ATP的产生也有一定贡献。特别是当葡萄糖代谢通路发生障碍时, 谷氨酰胺代谢通路对ATP的贡献将显著增加。谷氨酰胺还能够抑制瓜氨酸转运, 抑制瓜氨酸转化为精氨酸, 进而抑制精氨酸在内皮细胞内转化为NO, 调控血管张力和血压。此外, 精氨酸还可被代谢生成尿素、肌酸、聚酰胺脯氨酸、谷氨酸和胍基丁胺等, 通过调控内皮细胞中作为信号分子的ROS水平, 来调控血管新生[1, 57]。精氨酸还能在精氨酸酶的作用下转化为鸟氨酸[58]。鸟氨酸进一步代谢为多胺后, 可通过增加内皮细胞的基因表达和蛋白合成促进血管新生[59]。
丝氨酸合成途径是糖酵解的众多旁路之一。3-磷酸甘油酸在磷酸甘油脱氢酶(phosphoglycerate dehydrogenase, PHGDH)的作用下代谢为3-磷酸羟基丙酮酸, 进而被代谢为磷酸丝氨酸和丝氨酸。丝氨酸对内皮细胞的氧化还原平衡的维持有着重要作用。干扰PHGDH后, 内皮细胞ROS水平升高并引发细胞凋亡[60]。此外, 有研究表明, VEGF通过增加甘氨酸转运体1水平, 进而增加内皮细胞内的甘氨酸含量, 从而促进血管新生。目前, 甘氨酸影响血管新生的具体机制还有待进一步探索[61]。
2.3 脂肪酸代谢大多数细胞利用葡萄糖和谷氨酰胺进行核苷酸合成, 而内皮细胞则主要利用脂肪酸参与核苷酸合成。内皮细胞通过脂肪酸氧化(fatty acid oxidation, FAO)代谢途径补充TCA循环, 合成核苷酸前体天冬氨酸、三磷酸嘧啶核苷前体单磷酸尿苷以及DNA。肉碱棕榈酰转移酶1A (carnitine palmitoyl transferase 1A, CPT1A)是细胞脂肪酸氧化的一种限速酶, 能够促进脂肪酸进入线粒体进行脂肪酸氧化[5]。干扰内皮细胞CPT1A能降低脂肪酸氧化和脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate, dNTP)的合成, 抑制细胞增殖和血管出芽[5]。
内皮细胞通过脂肪酸合成途径来生成脂肪酸, 脂肪酸合酶(fatty acid synthase, FASN)是血管发芽所必需的[62]。内皮细胞可通过脂肪酸转移蛋白(fatty acid transport protein, FATP)摄取脂肪酸, 血液中的脂肪酸也可通过被动扩散进入内皮细胞[63]。当前, 内皮细胞脂肪酸的利用以及内皮细胞脂肪酸与周围组织运输之间的平衡的调控有待进一步研究。此外, 不同类型内皮细胞对脂肪酸的利用是否有所区别也有待阐明。
3 肿瘤组织血管内皮细胞的代谢重塑血管新生是肿瘤发生发展的特征之一[64]。与正常组织一样, 肿瘤组织需要血液输送氧气和营养物质, 同时排出代谢废物, 而这些生理需求都由肿瘤组织内部的新生血管完成。正常情况下, 当生物体发育成熟后, 血管系统会长期保持静止状态, 只有在机体受到损伤时才会出现短暂血管新生; 而在肿瘤发展过程中, 血管新生则变成了一种常态。随着肿瘤不断生长, 肿瘤对氧气和营养物质的需求也逐渐增长, 持续的血管新生得以满足肿瘤细胞的代谢需求[64, 65], 因此肿瘤血管新生对肿瘤生长和转移都至关重要。
目前对调控肿瘤血管新生的信号通路已经有了较为深入的认识。肿瘤血管新生受多种血管生成信号分子的调控, 包括VEGF、血管生成素等[66]。
与正常内皮细胞相比, 肿瘤组织的内皮细胞会发生代谢重塑[67]。现有认识表明[67], 肿瘤微环境内皮细胞的糖酵解、脂肪酸氧化及谷氨酰胺代谢在肿瘤血管新生过程中发挥了不可或缺的作用。在肿瘤血管新生时, 不同类型内皮细胞的代谢特征也有所不同(图 2)。此外, 与正常组织不同, 肿瘤组织由于肿瘤细胞糖酵解的增强造成的低糖环境也会上调VEGF的表达[68]; 肿瘤微环境中的代谢产物乳酸水平的升高在血管新生过程中也发挥了一定功效[69]。肿瘤微环境中的血管新生受到血管生成信号分子和环境中代谢产物的共同驱动。
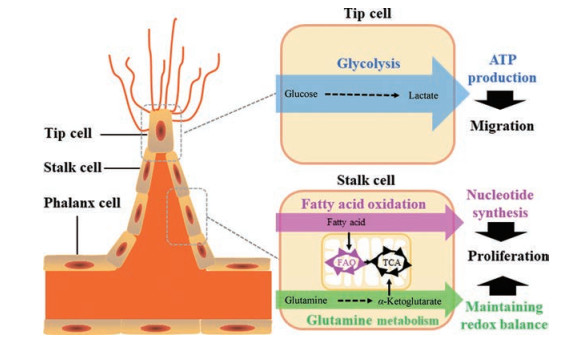
|
Figure 2 Metabolic pathways of endothelial cells in tumor angiogenesis. Three types of endothelial cells are involved in angiogenesis, tip cells, stalk cells, and phalanx cells. Metabolic pathways are differentially involved in different types of vascular endothelial cells in tumor angiogenesis. The migratory tip cells preferentially use glycolysis to produce adenosine triphosphate (ATP) while proliferative stalk cells rely on fatty acid oxidation and glutamine metabolism for nucleotide synthesis and maintaining redox balance. Metabolic pathways, such as glucose metabolism, amino acid metabolism, and fatty acid metabolism in endothelial cells, have different contributions to angiogenesis |
葡萄糖代谢异常是肿瘤细胞代谢最突出的特点, 肿瘤细胞有氧糖酵解能力是正常细胞的20~30倍[70]。与肿瘤细胞一样, 肿瘤血管内皮细胞比正常的内皮细胞更依赖于糖酵解来产生ATP, 表现出高糖酵解表型, 其作用机制可能与葡萄糖转运蛋白GLUT1和糖酵解代谢酶PFKFB3的表达增加有关[71, 72]。肿瘤微环境低氧和促炎性细胞因子都会上调PFKFB3[4]。此外, 与正常内皮细胞相比, 肿瘤微环境中的内皮细胞会激活磷酸戊糖和丝氨酸生物合成途径, 用于核苷酸的合成[71]。针对以上特点, 有研究证明可以通过抑制PFKFB3降低肿瘤微环境中内皮细胞的糖酵解以阻止肿瘤细胞的增殖[73]。PFKFB3的小分子抑制剂3-(3-pyridinyl)-1-(4-pyridinyl)-2-propen-1-one (3-PO)能剂量依赖地抑制内皮细胞糖酵解; 低剂量的3-PO使肿瘤附近的血管趋向于正常化, 高剂量的3-PO则会抑制内皮细胞增殖影响血管的完整性, 从而干扰肿瘤的生长[74]。值得关注的是, 这种治疗策略的目的是将肿瘤微环境中内皮细胞的糖酵解降低到正常内皮细胞水平, 而不是将其降低过多或完全消除糖酵解通量。因为过量降低内皮细胞的糖酵解水平会诱导内皮细胞死亡, 导致血管结构的完整性受损, 从而促进肿瘤细胞的逃逸和转移[74]。
尽管糖酵解至关重要, 但肿瘤微环境中的内皮细胞仍然保留了线粒体的基本功能[75]。线粒体氧化磷酸化不但能够增加细胞利用其他营养物质产生能量的灵活性, 而且还提供用于生物合成的代谢产物以支持细胞增殖, 这对于过度增殖的肿瘤微环境中的内皮细胞尤为重要。目前鲜有报道肿瘤微环境中内皮细胞的磷酸戊糖途径、己糖胺合成途径以及多元醇途径是否发生改变, 还有待深入研究。
3.2 氨基酸代谢谷氨酰胺对于肿瘤内皮细胞的存活及血管新生过程具有重要作用, 但其主要促进肿瘤内皮细胞的增殖而非迁移[76]。与肿瘤细胞不同, 补充抗氧化剂或TCA中间代谢物无法弥补正常内皮细胞在谷氨酰胺饥饿时受到的增殖抑制, 而这意味着肿瘤微环境中的内皮细胞可能以不同方式更加依赖于利用谷氨酰胺代谢通路[56]。有研究发现肿瘤微环境中的血管内皮细胞可以利用谷氨酰胺进行多胺类化合物的合成[77]; 内皮细胞中26%的鸟氨酸来源于谷氨酰胺, 而鸟氨酸正是多胺合成重要的前体物质。同时, 谷氨酰胺对于精氨酸的合成也至关重要。有研究发现, 额外添加精氨酸对于内皮细胞克服谷氨酰胺缺失有重要作用[56]。
3.3 脂肪酸代谢增殖的内皮细胞可利用脂肪酸来维持TCA循环, 以支持内皮细胞在增殖过程中从头合成核苷酸。有研究发现, 敲除内皮细胞中的脂肪酸氧化关键限速酶CPT1A并不会导致内皮细胞的能量缺乏, 也不会破坏其氧化还原稳态, 而是会阻碍核苷酸从头合成, 进而抑制DNA复制。通过同位素标记实验发现, 脂肪酸可以进入TCA循环, 通过合成天冬氨酸和尿苷酸参与DNA合成。敲除CPT1A并阻断这一过程能降低内皮细胞的天冬氨酸及dNTP储备, 抑制病理性血管增生[5]。此外, 还有研究表明抑制脂肪酸合成也会抑制肿瘤血管新生。靶向脂肪酸合酶FASN的奥利司他(orlistat)可以通过减少内皮细胞脂肪酸合成、降低内皮细胞迁移能力以及减缓内皮细胞的增殖来发挥抗血管生成的效应[78]。以上证据提示, 内皮细胞脂肪酸代谢阻断剂可通过抑制肿瘤血管新生而抑制肿瘤生长和转移。同时, 有研究发现, 抑制内皮细胞表面的脂肪酸转位酶(fatty acid translocase, FAT/CD36)的功能也可有效抑制血管新生[79], 提示通过多种手段干预脂肪酸在内皮细胞的转运或代谢都能有效抑制血管新生, 具有潜在的抗肿瘤作用。
4 总结与展望尽管对细胞代谢的研究已有一个多世纪的历史, 但有关内皮细胞代谢的研究直到最近几年才受到越来越多的关注。本文总结了对内皮细胞代谢的已有认识以及最新研究进展。从现有认识来看, 内皮细胞在代谢方面最显著的特征是其高度依赖糖酵解途径, 并以糖酵解作为内皮细胞的主要能量来源; 而脂肪酸代谢主要供给于生物合成。此外, 新近引起关注的谷氨酰胺代谢与天冬酰胺代谢也是内皮细胞能量代谢的重要来源, 受到了越来越多的关注。内皮细胞的以上代谢特征能使其更好地适应外界环境的变化, 这体现了内皮细胞代谢特点与功能相匹配的特征。
当前, 人们对内皮细胞代谢的认识仍然更多停留在代谢表型的描述上, 表型背后精细复杂的调控机制还有待深入阐述。例如, 细胞内部亚细胞局部区域的代谢特点及调控机制、内皮细胞与其他类型细胞的代谢交互影响及其分子机制、内皮细胞亚型特异性的代谢特征及其调控机制等。对内皮细胞代谢的深入研究有望进一步深入了解内皮细胞代谢在血管新生及血管相关疾病中扮演的角色。
血管新生是肿瘤的特征之一, 抑制肿瘤血管新生是重要的抗肿瘤策略。过去40多年抗血管新生的药物研发主要集中于血管生成信号蛋白, 例如针对血管内皮生长因子VEGF已研发出靶向药物贝伐单抗(bevacizumab)、舒尼替尼(sunitinib)以及阿柏西普(aflibercept)。虽然在临床上取得了很大进展, 但是也存在毒性大、易耐药等问题[3]。近来研究表明, 内皮细胞的代谢状态和血管内皮生长因子的刺激对于血管新生过程同等重要[4, 5]。目前靶向内皮细胞糖酵解代谢酶PFKFB3的抑制剂等已在临床治疗中取得初步成效[74]。近年来, 越来越多研究表明, 靶向肿瘤血管内皮细胞的代谢是抗肿瘤药物研发的重要方向。对正常内皮细胞和肿瘤微环境中内皮细胞之间代谢差异的研究可能为抗血管生成药物的研发提供新思路, 为血管相关疾病的治疗提供更多选择。
| [1] |
De Bock K, Georgiadou M, Carmeliet P. Role of endothelial cell metabolism in vessel sprouting[J]. Cell Metab, 2013, 18: 634-647. |
| [2] |
Potente M, Gerhardt H, Carmeliet P. Basic and therapeutic aspects of angiogenesis[J]. Cell, 2011, 146: 873-887. DOI:10.1016/j.cell.2011.08.039 |
| [3] |
Welti J, Loges S, Dimmeler S, et al. Recent molecular discoveries in angiogenesis and antiangiogenic therapies in cancer[J]. J Clin Invest, 2013, 123: 3190-3200. DOI:10.1172/JCI70212 |
| [4] |
De Bock K, Georgiadou M, Schoors S, et al. Role of PFKFB3-driven glycolysis in vessel sprouting[J]. Cell, 2013, 154: 651-663. DOI:10.1016/j.cell.2013.06.037 |
| [5] |
Schoors S, Bruning U, Missiaen R, et al. Fatty acid carbon is essential for dNTP synthesis in endothelial cells[J]. Nature, 2015, 520: 192-197. DOI:10.1038/nature14362 |
| [6] |
Carmeliet P. Angiogenesis in life, disease and medicine[J]. Nature, 2005, 438: 932-936. DOI:10.1038/nature04478 |
| [7] |
Mazzone M, Dettori D, de Oliveira RL, et al. Heterozygous deficiency of PHD2 restores tumor oxygenation and inhibits metastasis via endothelial normalization[J]. Cell, 2009, 136: 839-851. DOI:10.1016/j.cell.2009.01.020 |
| [8] |
Meyer RD, Mohammadi M, Rahimi N. A single amino acid substitution in the activation loop defines the decoy characteristic of VEGFR-1/FLT-1[J]. J Biol Chem, 2006, 281: 867-875. |
| [9] |
Jakobsson L, Franco CA, Bentley K, et al. Endothelial cells dynamically compete for the tip cell position during angiogenic sprouting[J]. Nat Cell Biol, 2010, 12: 943-953. DOI:10.1038/ncb2103 |
| [10] |
Culic O, Gruwel ML, Schrader J. Energy turnover of vascular endothelial cells[J]. Am J Physiol, 1997, 273: C205-C213. DOI:10.1152/ajpcell.1997.273.1.C205 |
| [11] |
Krützfeldt A, Spahr R, Mertens S, et al. Metabolism of exogenous substrates by coronary endothelial cells in culture[J]. J Mol Cell Cardiol, 1990, 22: 1393-1404. DOI:10.1016/0022-2828(90)90984-A |
| [12] |
Hunt TK, Aslam RS, Beckert S, et al. Aerobically derived lactate stimulates revascularization and tissue repair via redox mechanisms[J]. Antioxid Redox Signal, 2007, 9: 1115-1124. DOI:10.1089/ars.2007.1674 |
| [13] |
Ruan GX, Kazlauskas A. Lactate engages receptor tyrosine kinases Axl, Tie2, and vascular endothelial growth factor receptor 2 to activate phosphoinositide 3-kinase/Akt and promote angiogenesis[J]. J Biol Chem, 2013, 288: 21161-21172. |
| [14] |
Sonveaux P, Copetti T, De Saedeleer CJ, et al. Targeting the lactate transporter MCT1 in endothelial cells inhibits lactate-induced HIF-1 activation and tumor angiogenesis[J]. PLoS One, 2012, 7: e33418. DOI:10.1371/journal.pone.0033418 |
| [15] |
Végran F, Boidot R, Michiels C, et al. Lactate influx through the endothelial cell monocarboxylate transporter MCT1 supports an NF-κB/IL-8 pathway that drives tumor angiogenesis[J]. Cancer Res, 2011, 71: 2550-2560. DOI:10.1158/0008-5472.CAN-10-2828 |
| [16] |
Buchwald P. A local glucose-and oxygen concentration-based insulin secretion model for pancreatic islets[J]. Theor Biol Med Model, 2011, 8: 20. DOI:10.1186/1742-4682-8-20 |
| [17] |
Gatenby RA, Gillies RJ. Why do cancers have high aerobic glycolysis?[J]. Nat Rev Cancer, 2004, 4: 891-899. DOI:10.1038/nrc1478 |
| [18] |
Parra-Bonilla G, Alvarez DF, Al-Mehdi AB, et al. Critical role for lactate dehydrogenase A in aerobic glycolysis that sustains pulmonary microvascular endothelial cell proliferation[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 299: L513-L522. DOI:10.1152/ajplung.00274.2009 |
| [19] |
Peters K, Kamp G, Berz A, et al. Changes in human endothelial cell energy metabolic capacities during in vitro cultivation. The role of "aerobic glycolysis" and proliferation[J]. Cell Physiol Biochem, 2009, 24: 483-492. DOI:10.1159/000257490 |
| [20] |
Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation[J]. Science, 2009, 324: 1029-1033. DOI:10.1126/science.1160809 |
| [21] |
Lunt SY, Vander Heiden MG. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation[J]. Annu Rev Cell Dev Biol, 2011, 27: 441-464. DOI:10.1146/annurev-cellbio-092910-154237 |
| [22] |
Cairns RA, Harris IS, Mak TW. Regulation of cancer cell metabolism[J]. Nat Rev Cancer, 2011, 11: 85-95. DOI:10.1038/nrc2981 |
| [23] |
Anastasiou D, Poulogiannis G, Asara JM, et al. Inhibition of pyruvate kinase M2 by reactive oxygen species contributes to cellular antioxidant responses[J]. Science, 2011, 334: 1278-1283. DOI:10.1126/science.1211485 |
| [24] |
Zhang Z, Apse K, Pang J, et al. High glucose inhibits glucose-6-phosphate dehydrogenase via cAMP in aortic endothelial cells[J]. J Biol Chem, 2000, 275: 40042-40047. DOI:10.1074/jbc.M007505200 |
| [25] |
Vizán P, Sánchez-Tena S, Alcarraz-Vizán G, et al. Characterization of the metabolic changes underlying growth factor angiogenic activation: identification of new potential therapeutic targets[J]. Carcinogenesis, 2009, 30: 946-952. DOI:10.1093/carcin/bgp083 |
| [26] |
Spolarics Z, Spitzer JJ. Augmented glucose use and pentose cycle activity in hepatic endothelial cells after in vivo endotoxemia[J]. Hepatology, 1993, 17: 615-620. DOI:10.1002/hep.1840170415 |
| [27] |
Dobrina A, Rossi F. Metabolic properties of freshly isolated bovine endothelial cells[J]. Biochim Biophys Acta, 1983, 762: 295-301. DOI:10.1016/0167-4889(83)90084-8 |
| [28] |
Jongkind JF, Verkerk A, Baggen RG. Glutathione metabolism of human vascular endothelial cells under peroxidative stress[J]. Free Radic Biol Med, 1989, 7: 507-512. DOI:10.1016/0891-5849(89)90026-9 |
| [29] |
Spolarics Z, Wu JX. Role of glutathione and catalase in H2O2 detoxification in LPS-activated hepatic endothelial and Kupffer cells[J]. Am J Physiol, 1997, 273: G1304-G1311. |
| [30] |
Leopold JA, Walker J, Scribner AW, et al. Glucose-6-phosphate dehydrogenase modulates vascular endothelial growth factor-mediated angiogenesis[J]. J Biol Chem, 2003, 278: 32100-32106. DOI:10.1074/jbc.M301293200 |
| [31] |
Hart GW, Housley MP, Slawson C. Cycling of O-linked β-N-acetylglucosamine on nucleocytoplasmic proteins[J]. Nature, 2007, 446: 1017-1022. DOI:10.1038/nature05815 |
| [32] |
Helenius A. How N-linked oligosaccharides affect glycoprotein folding in the endoplasmic reticulum[J]. Mol Biol Cell, 1994, 5: 253-265. DOI:10.1091/mbc.5.3.253 |
| [33] |
Love DC, Hanover JA. The hexosamine signaling pathway: deciphering the "O-GlcNAc code"[J]. Sci STKE, 2005, 2005: re13. |
| [34] |
Merchan JR, Kovács K, Railsback JW, et al. Antiangiogenic activity of 2-deoxy-D-glucose[J]. PLoS One, 2010, 5: e13699. DOI:10.1371/journal.pone.0013699 |
| [35] |
Luo B, Soesanto Y, McClain DA. Protein modification by O-linked GlcNAc reduces angiogenesis by inhibiting Akt activity in endothelial cells[J]. Arterioscler Thromb Vasc Biol, 2008, 28: 651-657. DOI:10.1161/ATVBAHA.107.159533 |
| [36] |
Markowska AI, Jefferies KC, Panjwani N. Galectin-3 protein modulates cell surface expression and activation of vascular endothelial growth factor receptor 2 in human endothelial cells[J]. J Biol Chem, 2011, 286: 29913-29921. DOI:10.1074/jbc.M111.226423 |
| [37] |
Benedito R, Roca C, Sörensen I, et al. The Notch ligands Dll4 and Jagged1 have opposing effects on angiogenesis[J]. Cell, 2009, 137: 1124-1135. DOI:10.1016/j.cell.2009.03.025 |
| [38] |
Lorenzi M. The polyol pathway as a mechanism for diabetic retinopathy: attractive, elusive, and resilient[J]. Exp Diabetes Res, 2007, 2007: 61038. |
| [39] |
Tang WH, Martin KA, Hwa J. Aldose reductase, oxidative stress, and diabetic mellitus[J]. Front Pharmacol, 2012, 3: 87. |
| [40] |
Obrosova IG, Kador PF. Aldose reductase/polyol inhibitors for diabetic retinopathy[J]. Curr Pharm Biotechnol, 2011, 12: 373-385. DOI:10.2174/138920111794480642 |
| [41] |
Oyama T, Miyasita Y, Watanabe H, et al. The role of polyol pathway in high glucose-induced endothelial cell damages[J]. Diabetes Res Clin Pract, 2006, 73: 227-234. DOI:10.1016/j.diabres.2006.02.010 |
| [42] |
Tammali R, Reddy AB, Srivastava SK, et al. Inhibition of aldose reductase prevents angiogenesis in vitro and in vivo[J]. Angiogenesis, 2011, 14: 209-221. DOI:10.1007/s10456-011-9206-4 |
| [43] |
Yadav UC, Srivastava SK, Ramana KV. Prevention of VEGF-induced growth and tube formation in human retinal endothelial cells by aldose reductase inhibition[J]. J Diabetes Complicat, 2012, 26: 369-377. DOI:10.1016/j.jdiacomp.2012.04.017 |
| [44] |
Wright GL, Maroulakou IG, Eldridge J, et al. VEGF stimulation of mitochondrial biogenesis: requirement of AKT3 kinase[J]. FASEB J, 2008, 22: 3264-3275. DOI:10.1096/fj.08-106468 |
| [45] |
Csiszar A, Labinskyy N, Pinto JT, et al. Resveratrol induces mitochondrial biogenesis in endothelial cells[J]. Am J Physiol Heart Circ Physiol, 2009, 297: H13-H20. |
| [46] |
Tang X, Luo YX, Chen HZ, et al. Mitochondria, endothelial cell function, and vascular diseases[J]. Front Physiol, 2014, 5: 175. |
| [47] |
Li X, Sun X, Carmeliet P. Hallmarks of endothelial cell metabolism in health and disease[J]. Cell Metab, 2019, 30: 414-433. DOI:10.1016/j.cmet.2019.08.011 |
| [48] |
Oldendorf WH, Brown WJ. Greater number of capillary endothelial cell mitochondria in brain than in muscle[J]. Proc Soc Exp Biol Med, 1975, 149: 736-738. DOI:10.3181/00379727-149-38889 |
| [49] |
Kaczara P, Motterlini R, Kus K, et al. Carbon monoxide shifts energetic metabolism from glycolysis to oxidative phosphorylation in endothelial cells[J]. FEBS Lett, 2016, 590: 3469-3480. DOI:10.1002/1873-3468.12434 |
| [50] |
Davidson SM. Endothelial mitochondria and heart disease[J]. Cardiovasc Res, 2010, 88: 58-66. DOI:10.1093/cvr/cvq195 |
| [51] |
Ali MH, Pearlstein DP, Mathieu CE, et al. Mitochondrial requirement for endothelial responses to cyclic strain: implications for mechanotransduction[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 287: L486-L496. DOI:10.1152/ajplung.00389.2003 |
| [52] |
Park D, Dilda PJ. Mitochondria as targets in angiogenesis inhibition[J]. Mol Aspects Med, 2010, 31: 113-131. DOI:10.1016/j.mam.2009.12.005 |
| [53] |
Polet F, Feron O. Endothelial cell metabolism and tumour angiogenesis: glucose and glutamine as essential fuels and lactate as the driving force[J]. J Intern Med, 2013, 273: 156-165. DOI:10.1111/joim.12016 |
| [54] |
Cantelmo AR, Brajic A, Carmeliet P. Endothelial metabolism driving angiogenesis: emerging concepts and principles[J]. Cancer J, 2015, 21: 244-249. DOI:10.1097/PPO.0000000000000133 |
| [55] |
Strasser GA, Kaminker JS, Tessier-Lavigne M. Microarray analysis of retinal endothelial tip cells identifies CXCR4 as a mediator of tip cell morphology and branching[J]. Blood, 2010, 115: 5102-5110. DOI:10.1182/blood-2009-07-230284 |
| [56] |
Huang H, Vandekeere S, Kalucka J, et al. Role of glutamine and interlinked asparagine metabolism in vessel formation[J]. EMBO J, 2017, 36: 2334-2352. DOI:10.15252/embj.201695518 |
| [57] |
Li X, Carmeliet P. Targeting angiogenic metabolism in disease[J]. Science, 2018, 359: 1335-1336. DOI:10.1126/science.aar5557 |
| [58] |
Morris SM. Recent advances in arginine metabolism: roles and regulation of the arginases[J]. Br J Pharmacol, 2009, 157: 922-930. DOI:10.1111/j.1476-5381.2009.00278.x |
| [59] |
Eelen G, de Zeeuw P, Treps L, et al. Endothelial cell metabolism[J]. Physiol Rev, 2018, 98: 3-58. |
| [60] |
Vandekeere S, Dubois C, Kalucka J, et al. Serine synthesis via PHGDH is essential for heme production in endothelial cells[J]. Cell Metab, 2018, 28: 573-587. DOI:10.1016/j.cmet.2018.06.009 |
| [61] |
Oberkersch RE, Santoro MM. Role of amino acid metabolism in angiogenesis[J]. Vascul Pharmacol, 2019, 112: 17-23. DOI:10.1016/j.vph.2018.11.001 |
| [62] |
Wei X, Schneider JG, Shenouda SM, et al. De novo lipogenesis maintains vascular homeostasis through endothelial nitric-oxide synthase (eNOS) palmitoylation[J]. J Biol Chem, 2011, 286: 2933-2945. DOI:10.1074/jbc.M110.193037 |
| [63] |
Wong BW, Wang X, Zecchin A, et al. The role of fatty acid β-oxidation in lymphangiogenesis[J]. Nature, 2017, 542: 49-54. DOI:10.1038/nature21028 |
| [64] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144: 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [65] |
Carmeliet P, Jain RK. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature, 2011, 473: 298-307. DOI:10.1038/nature10144 |
| [66] |
Jain RK. Antiangiogenesis strategies revisited: from starving tumors to alleviating hypoxia[J]. Cancer Cell, 2014, 26: 605-622. DOI:10.1016/j.ccell.2014.10.006 |
| [67] |
Goveia J, Stapor P, Carmeliet P. Principles of targeting endothelial cell metabolism to treat angiogenesis and endothelial cell dysfunction in disease[J]. EMBO Mol Med, 2014, 6: 1105-1120. DOI:10.15252/emmm.201404156 |
| [68] |
Zhang L, Conejo-Garcia JR, Yang N, et al. Different effects of glucose starvation on expression and stability of Vegf mRNA isoforms in murine ovarian cancer cells[J]. Biochem Biophys Res Commun, 2002, 292: 860-868. |
| [69] |
Choi SH, Kwon OJ, Park JY, et al. Inhibition of tumour angiogenesis and growth by small hairpin HIF-1α and IL-8 in hepatocellular carcinoma[J]. Liver Int, 2014, 34: 632-642. DOI:10.1111/liv.12375 |
| [70] |
Liu JY, Ren LW, Li S, et al. Research progress of tumor immune and tumor metabolic drug targets[J]. Acta Pharm Sin (药学学报), 2019, 54: 1718-1727. |
| [71] |
Cantelmo AR, Conradi LC, Brajic A, et al. Inhibition of the glycolytic activator PFKFB3 in endothelium induces tumor vessel normalization, impairs metastasis, and improves chemotherapy[J]. Cancer Cell, 2016, 30: 968-985. |
| [72] |
Yeh W, Lin CJ, Fu WM. Enhancement of glucose transporter expression of brain endothelial cells by vascular endothelial growth factor derived from glioma exposed to hypoxia[J]. Mol Pharmacol, 2008, 73: 170-177. DOI:10.1124/mol.107.038851 |
| [73] |
Schoors S, De Bock K, Cantelmo AR, et al. Partial and transient reduction of glycolysis by PFKFB3 blockade reduces pathological angiogenesis[J]. Cell Metab, 2014, 19: 37-48. DOI:10.1016/j.cmet.2013.11.008 |
| [74] |
Conradi L, Brajic A, Cantelmo AR, et al. Tumor vessel disintegration by maximum tolerable PFKFB3 blockade[J]. Angiogenesis, 2017, 20: 599-613. DOI:10.1007/s10456-017-9573-6 |
| [75] |
Koziel A, Woyda-Ploszczyca A, Kicinska A, et al. The influence of high glucose on the aerobic metabolism of endothelial EA.hy926 cells[J]. Pflugers Arch, 2012, 464: 657-669. DOI:10.1007/s00424-012-1156-1 |
| [76] |
Kim B, Li J, Jang C, et al. Glutamine fuels proliferation but not migration of endothelial cells[J]. EMBO J, 2017, 36: 2321-2333. DOI:10.15252/embj.201796436 |
| [77] |
Morrison RF, Seidel ER. Vascular endothelial cell proliferation: regulation of cellular polyamines[J]. Cardiovasc Res, 1995, 29: 841-847. DOI:10.1016/S0008-6363(96)88621-4 |
| [78] |
Browne CD, Hindmarsh EJ, Smith JW. Inhibition of endothelial cell proliferation and angiogenesis by orlistat, a fatty acid synthase inhibitor[J]. FASEB J, 2006, 20: 2027-2035. DOI:10.1096/fj.05-5404com |
| [79] |
Missiaen R, Morales-Rodriguez F, Eelen G, et al. Targeting endothelial metabolism for anti-angiogenesis therapy: a pharmacological perspective[J]. Vascul Pharmacol, 2017, 90: 8-18. DOI:10.1016/j.vph.2017.01.001 |
 2020, Vol. 55
2020, Vol. 55


