根据美国癌症协会数据显示, 癌症已经成为人口死亡的主要原因[1]。目前, 关于癌症治疗的手段主要为手术、放疗、化疗和免疫治疗[2]。其中, 化疗在控制和治疗癌症中最为有效[3, 4]。从短叶红豆杉树皮中提取的二萜生物碱——紫杉醇(PTX)被广泛应用[5], 但PTX水溶性较差, 不易被人体吸收, 限制了其治疗效果。1992年美国食品和药品管理局(FDA)批准了紫杉醇注射液(Taxol)在临床上使用[6], 其中加入蓖麻油提高其水溶性, 但给药后却产生严重的肾毒性和神经毒性[7]。2005年白蛋白结合的紫杉醇制剂(Abraxance)在临床上开始使用, 但存在造价高、半衰期短和消除快的弊端[8, 9]。
研究人员尝试不同纳米递送系统来改善PTX水溶性和抗肿瘤活性, 包括胶束[10]、脂质体[11]和纳米晶等药物输送系统。对癌细胞或癌症组织的异质性的研究, 导致越来越多的刺激响应胶束被设计用于靶向肿瘤, 增加化疗药物在肿瘤组织的毒性和降低对正常组织的损伤[12, 13]; 相对于正常细胞, 癌细胞中谷胱甘肽(GSH)和活性氧(ROS)水平偏高, 部分癌细胞谷胱甘肽水平甚至可以达到正常细胞的4倍以上[14]; 已有报道证明二硫键具有还原刺激性反应, 并广泛应用在还原敏感型纳米递药系统中[15, 16]; 由孙进课题组[17]发现二硫键与硫醚键一样具有氧化环境刺激响应, 即二硫键也可被氧化成亲水的砜或亚砜, 导致酯键水解。因此, 对于氧化还原敏感释药的纳米载体不仅硫醚键可以实现, 二硫键也同样具有刺激响应。由维生素E琥珀酸酯和聚乙二醇1 000酯化形成的聚乙二醇1 000维生素E琥珀酸酯(TPGS), 具有良好的增溶性、乳化性、稳定性和P-糖蛋白(P-gp)抑制作用, 因此被广泛应用到多药耐药(MDR)药物载体中[18]。另一种离子型表面活性剂脱氧胆酸钠(NADC), 已多次作为疏水性药物的载体, 因其羧基可以与输水性药物的氨基产生静电作用, 可增加载药量[19]。
为了提高PTX溶解性、降低细胞毒性和增强药物载体稳定性, 本研究合成了由二硫键和油酸(OA)修饰的TPGS-S-S-OA与NADC自组装成混合胶束, 作为PTX注射给药载体, 通过对混合胶束的处方考察、表征和体外释放, 及其溶血性考察, 探究由二硫键修饰的氧化还原胶束外壳装载PTX抗癌药物的可行性。
材料与方法材料 PTX (纯度99.8 %, 江苏红豆杉药业股份有限公司); TPGS、二硫苏糖醇(DTT) (美国Sigma公司); 脱氧胆酸钠(北京博奥拓达科技有限公司); TPGS-S-S-OA和硫醚键修饰的TPGS-S-OA由本实验室自制; 其他试剂均为色谱级, 如乙腈。
实验动物 SPF级Wistar大鼠, 体重200~220 g, 沈阳药科大学动物中心提供。动物合格证号: SCXK (辽) 2019-0023。所有动物实验均符合伦理学标准, 并获得沈阳药科大学动物实验中心批准(No.211002300032403)。
主要仪器 Nanosizer ZS激光粒度仪(英国马尔文仪器有限公司); 650-60型荧光光谱仪、H-600透射电镜(TEM)、紫外分光光度计、Primaide高效液相色谱仪(HPLC) (日本Hitachi公司)。色谱条件为流动相:乙腈:水(50:50, v/v)、流速: 1 mL·min-1、柱温: 30 ℃和紫外检测器:波长227 nm。
TPGS-OA临界胶束浓度(CMC)的测定 依据芘作为显色剂, 结合荧光探针技术, 采用650-60型荧光光谱仪, 以333和335 nm为检测波长, 发射波长为339 nm, 测定荧光强度。最后根据335和333 nm荧光强度比值随聚合物浓度变化绘制曲线。
TPGS-OA/NADC混合胶束的制备 将摩尔比例(4:0、3:1、2:2、1:3、0:4, 聚合物浓度为10 mmol·L-1)的TPGS-S-S-OA和NADC分别溶于1.5 mL乙醇溶液和适量水溶液中, 于800 r·min-1磁力搅拌, 25 ℃搅拌过夜以挥发乙醇溶液, 然后将胶束溶液于10 000 r·min-1离心15 min, 0.22 μm微孔滤膜滤过, 即得未载药的混合胶束溶液; 将TPGS-S-S-OA和PTX按照比例10:1、20:1和20:3, 分别溶于1.5 mL乙醇溶液中, 其余步骤与上述相同, 得载药胶束。TPGS-S-OA胶束制备方法与上述一致。
TPGS-OA/NADC混合胶束的表征 用激光粒度仪对混合胶束粒径分布和zeta电位进行评价; 采用TEM对胶束的外观形态进行考察, 即用2%磷钨酸染色剂对附着在铜网上的胶束溶液进行染色, 2 min后用滤纸吸取多余的染色剂, 再次进行复染, 最后用TEM进行观察。
载药量和包封率的测定 采用超速离心法测定混合胶束的载药量, 采用HPLC测定PTX浓度, 将载药胶束溶液于超滤离心管中离心(4 500 r·min-1, 15 min), 收集滤液, 乙腈稀释后过0.45 μm微孔滤膜, 测定滤液中PTX浓度; 另取等体积未离心处理的混合胶束溶液, 乙腈稀释后于100 W功率下超声5 min破乳, 测定PTX浓度。为了测定胶束的载药量, 取等体积载药胶束溶液, 冷冻干燥后称重。按公式(1)和(2)分别计算胶束的包封率(EE)和载药量(DL):
| $ \begin{array}{l} \mathrm{EE}(\%)=\frac{W_{1}}{W_{2}} \times 100 \% \end{array} $ | (1) |
| $ \mathrm{DL}(\%)=\frac{W_{1}}{W} \times 100 \% $ | (2) |
其中, W1为混合胶束滤液中的PTX质量; W2为载药胶束溶液中PTX的总质量; W为冻干后混合胶束的质量。
稳定性分析 考察纳米混合胶束于4 ℃、1个月条件下的物理稳定性, 将新制备的不同摩尔比TPGS-OA/NADC混合胶束放置于玻璃瓶中, 通过载药量监测混合胶束稳定性。
体外氧化还原释药考察 用透析法对TPGS-S-S-OA/NADC和TPGS-S-OA/NADC混合胶束进行体外释放考察, PTX质量浓度为1 mg·mL-1, 将2 mL载药混合胶束放入透析袋(再生纤维素透析膜, 截留分子量为3 500 Mw), 两头扎紧放入15 mL锥形管中, 保持37 ℃、80 r·min-1摇床中释放, 释放介质分别为pH 7.4 H2O2溶液(1% Tween 80)、pH 5.5和pH 7.4 DTT溶液(1% Tween 80), 介质浓度均为0、2和10 mmol·L-1, 各10 mL, 分别在0.25、0.5、1、1.5、2、2.5、4、6、8、20、24、28、32和36 h取样0.5 mL, 同时补充等体积的释放介质。采用HPLC方法测定PTX含量。
体外溶血实验 取5 mL大鼠血样持续搅拌20 min, 除去纤维蛋白后将血样与生理盐水混合, 于1 500 r·min-1离心15 min, 去除上清液后, 加入生理盐水继续离心, 直至上清液澄清透明为止。去掉上清液, 取红细胞配制成2%红细胞悬液。将1.25 mL红细胞悬液加入PTX混合胶束0.15 mL中, 再加入1 mL生理盐水(混合胶束质量浓度分别为10、25、50和100 μg·mL-1)作为样品溶液; 将等体积的红细胞分别与生理盐水和蒸馏水混合, 作为阴性对照和阳性对照。所有样品于37 ℃水浴条件下温育3 h, 以1 500 r·min-1离心15 min, 取上清液于540 nm处测量血红蛋白的紫外吸光度, 按公式(3)计算出各混合胶束的溶血率(HR):
| $ \operatorname{HR}(\%)=\frac{A_{\text {样 }}-A_{\text {阴 }}}{A_{\text {阳 }}-A_{\text {阴 }}} \times 100 \% $ | (3) |
其中, A样为样品血红蛋白的吸光度值; A阴和A阳分别为阴性对照和阳性对照样品血红蛋白的吸光度值。
统计学分析 数据采用均值±标准差表示, 均数差异用Origin进行单因素方差分析, 经统计学处理, P < 0.05表示具有显著性差异。
结果与讨论 1 混合胶束的自组装特点考察不同修饰情况的CMC值, 结果见图 1。由图所示, TPGS-S-S-OA和TPGS-S-OA的CMC值分别为0.89×10-3和1.10×10-3 g·L-1, 较TPGS的CMC值(2.45×10-3 g·L-1)显著降低, TPGS的CMC值与文献[20]报道(2.5×10-3 g·L-1)基本一致。结果证明, 此方法可行, 修饰后可以对TPGS的高CMC值有所改善, 增加了胶束在生物环境中稳定性。通过对TPGS结构修饰可以降低CMC值是因为胶束的CMC值与其疏水段作用相关, 当胶束中疏水段增加时, 具有更低的CMC值[21, 22]。而OA是不饱和烯烃所构成的疏水长链, 根据文献报道苯环、双键和C=O等化学键间存在π-π共轭、p-π共轭可增加胶束系统稳定性[12]。因此, 用OA对TPGS修饰不仅可以增加胶束的疏水段的长度, 降低聚合物CMC值, 还会进一步增加胶束的稳定性, 使得药物载体经血液稀释后也会在生物环境中具有很好的稳定性。肿瘤快速增长对不饱和脂肪酸的需求增加, OA引入也可以起到被动靶向作用——营养靶向[12]。
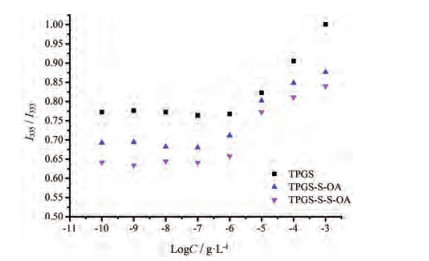
|
Figure 1 Fluoresence intensity ratio (I335/I333) of pyrene as a function of logarithm polymer concentration D-α-tocopherol polyethyleneglycol 1 000 succinate (TPGS), TPGS-S-OA, TPGS-S-S-OA micelle. TPGS-S-S-OA: TPGS modified by disulfide bond and oleic acid (OA); TPGS-S-OA: TPGS modified by thioether bond and OA |
采用纳米沉淀技术制备了载PTX的混合胶束, 这是由于修饰后的TPGS胶束具有较低的CMC值, 可以在水中自组装生成纳米胶束。TPGS-OA和NADC结构示意图见图 2A。因为混合胶束的配方对胶束载体存在影响, 因此, 对TPGS-OA和NADC的摩尔比例进行考察, 主要以载药量、包封率和稳定性(4 ℃)作为胶束配方的考察指标。由于载体和药物比例对胶束的稳定性及包封率均有影响, 预先设定载体和药物比为20:1。在处方优化筛选中(表 1)可以看出, 随着NADC的摩尔比的增加, 胶束的载药量呈增长趋势, 最大增长率可达到50.2%左右; 随着载药量升高导致包封率略微降低, 但影响并不大, 均在94%以上。对于NADC的加入可提高TPGS-OA胶束的载药量的原因, 推测是NADC的羧基和PTX羟基的静电或氢键之间的作用, 增加了药物与载体之间的作用力。但是由于NADC的CMC值较高(1.47 g·L-1)[19], 胶束的稳定性较差。对于胶束稳定性考察发现, 只有TPGS-OA/NADC配方比例为3:1情况下混合胶束才可在1个月内保持稳定, 其余混合胶束配方稳定性均在15天以下。为此, 选择TPGS-OA/NADC摩尔比为3:1的配方, 不仅兼顾了良好的稳定性并保持了较高的载药量和包封率。TPGS与硫醚键和二硫键的链接方式基本相同, 未见明显差异。
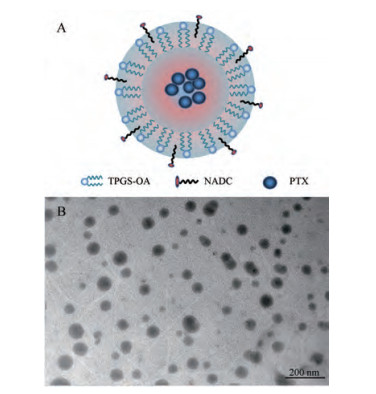
|
Figure 2 Schematic diagram of TPGS-OA/NADC micelle structure (A); transmission electron microscope of TPGS-S-S-OA/NADC mixed micelle (B) |
| Table 1 The effects of the prescription ratio of mixed micelles on the entrapment efficiency (EE) and drug loading (DL) of micelles were investigated. Model drug: Paclitaxel; NADC: Sodium deoxycholate. n = 3, x±s |
当胶束载药量增加时会导致胶束粒径相对增大[23], 对药物的包封率和稳定性也会产生影响, 因此, 对配方中载体和药物比例(10:1、20:1和20:3)进行了考察(表 2)。在纳米胶束药物递送中, 粒径分布对于给药后药物的分布和摄取有至关重要的作用。粒径在100 nm左右的纳米粒向肿瘤部位聚集更有利(高通透性和滞留效应, EPR), 可以抵抗肾脏的过滤作用, 不易被排除体外。不同药脂比胶束对粒径有较大影响, 在未载药胶束中38.47 ± 10.4 nm粒径可占载药胶束粒径的10%~40%, 可见PTX载入对胶束的粒径和包封率有影响, 在载体和药物比例为20:3时其包封率降到68%, 而载体和药物比例为20:1时包封率高达98%。并且在20:3时胶束的稳定性大大降低, 仅在20天内稳定, 粒径也大于200 nm。而载体和药物比例为20:1和10:1时在所考察的1个月内胶束保持稳定, 这从胶束的电位结果可以看出。因此, 经过对TPGS-OA混合胶束配方的设计和优化, 最后得到TPGS-OA/NADC (3:1)摩尔浓度10 mmol·L-1的胶束溶液, 其载药量约为4.45%、包封率约为98%、电位为-24 mV和粒径约为96 nm。从TPGS-S-S-OA/NADC的透射电镜图(图 2B)可以看出, 胶束具有均一和光滑的外观, 其粒径的大小与粒径测试结果相似。TPGS-S-S-OA/NADC混合胶束的粒径分布和电位图见图 3。
| Table 2 Physical characterization of nano-mixed micelles with different drug-fat ratio. n = 3, x±s |
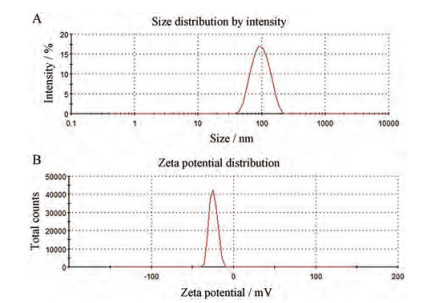
|
Figure 3 The particle size distribution (A) and potential (B) of TPGS-S-S-OA/NADC mixed micelle |
在硫醚键发生氧化响应释药时, 不论是单硫醚还是间隔的硫醚键, 靠近疏水药物的硫原子才是控制释药的开关[24]。通过用H2O2模拟ROS (氧化环境)和DTT模拟GSH (还原环境)来探讨二硫键和硫醚键在两种环境下释药的区别, 结果见图 4A~C。在pH 7.4、10 mmol·L-1 DTT存在下, 二硫键具有良好的还原响应释药特性, 在2.5 h内95% PTX从TPGS-S-S-OA/NADC混合胶束中释放出来; 在pH 7.4、2 mmol·L-1 DTT环境下混合胶束也可在5 h内完全释药。从图 4A可以看出, 硫醚键对还原环境也有响应, 但其释药速度却低于二硫键的释药速度, 推测可能由于二硫键的硫解(降解为硫醇基团)速度大于硫醚键的硫解速度, 从而导致硫醚键在高还原环境(10 mmol·L-1 DTT)下36 h仅释放80%药物。而在氧化环境中二硫键和硫醚键修饰的混合胶束释药方式有所改变, 在pH 7.4条件下考察了10和2 mmol·L-1 H2O2两种浓度下的氧化介质, 从图 4B中不难看出, 在高浓度氧化介质下, 二硫键同硫醚键一样具有优良的氧化释药能力, 其在5 h内释放96% PTX, 而硫醚键修饰的胶束在相同时间内释放约97% PTX。在低浓度氧化介质下, TPGS-S-OA/NADC胶束在6 h内释放约97% PTX, 而TPGS-S-S-OA/NADC胶束释药较缓慢, 8 h内释药量约为80%, 25 h才达到94%的释药量。这是因为当硫被ROS氧化为具有亲水性质亚砜基团而促进相邻酯键水解时, 二硫键消耗了更多的氧。由于肿瘤组织的ROS水平比正常细胞高约100倍左右[25], 在高氧化环境(10 mmol·L-1 H2O2)下二硫键与硫醚键一样具有优良的氧化敏感释药能力, 因此, 二硫键可作为在氧化环境中刺激响应释药的开关, 又因为二硫键广泛存在于蛋白质中, 属于内源性物质, 故以二硫键所修饰的混合胶束作为最终配方。不论是TPGS-S-S-OA/NADC还是TPGS-S-OA/NADC混合胶束在pH 7.4缓冲溶液中均有良好的稳定性。
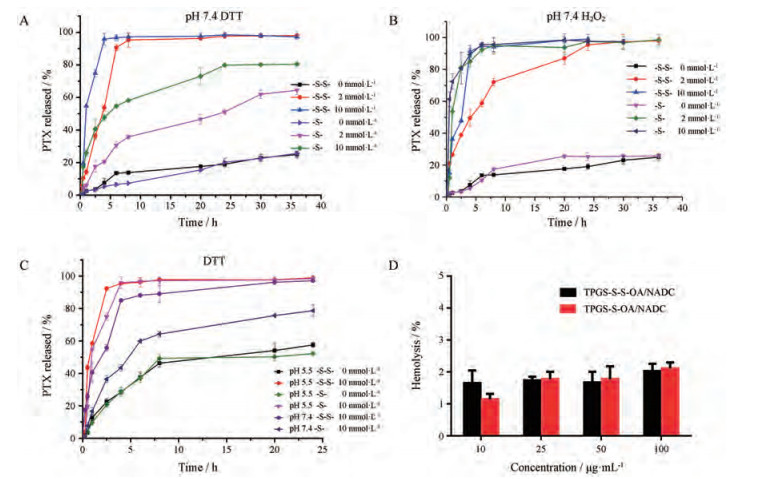
|
Figure 4 Paclitaxel (PTX) release of TPGS-S-S-OA/NADC mixed micelle and TPGS-S-OA/NADC mixed micelle in vitro in DL-dithiothreitol (DTT) at pH 7.4 (A). PTX release of TPGS-S-S-OA/NADC mixed micelle and TPGS-S-OA/NADC mixed micelle in H2O2 at pH 7.4 (B). PTX release of TPGS-S-S-OA/NADC and TPGS-S-OA/ NADC mixed micelles in DTT at pH 5.5 and pH 7.4 (C). Hemolysis rate of mixed micelles with different concentration gradients in vitro (D) |
由于肿瘤组织偏酸性, 本研究又考察了在pH 5.5 (肿瘤组织内涵体pH值)下0、2、10 mmol·L-1 DTT释放介质中胶束的释药情况, 并与pH 7.4进行对比。由图 4C所示, 不论二硫键还是硫醚键, 胶束的释药速度在pH 5.5介质中均大于pH 7.4介质中, 前者约为后者的2倍, 在25 h时PTX释放均达到了55%左右, 这可能是酯键在酸性条件下稳定性变差的缘故。由于载PTX混合胶束用于静脉注射, 还考察了制剂的溶血情况(图 4D)。结果表明, 当质量浓度从10 μg·mL-1增加到100 μg·mL-1时胶束引起的溶血略有增加但均小于2%, 因此, 该混合胶束的溶血性可忽略(小于5%)。
结论本文采用纳米沉淀法制备TPGS-S-S-OA/NADC和TPGS-S-OA/NADC混合纳米胶束, 通过对TPGS结构修饰, 获得低CMC值的聚合物载体, 使得胶束易于自组装, 与其他胶束制备方法相比该方法简单。通过对混合胶束的配方和药脂比优化得到更有利于在肿瘤部位聚集的纳米胶束载体。在本研究中, 二硫键的引入保证了胶束良好的氧化还原释放能力, 在高浓度氧化环境中与硫醚键的释药行为基本一致, 但低浓度时释药效果略低于硫醚键。因此, 引入二硫键的混合胶束可以负载疏水性药物, 并在肿瘤组织的高氧化还原环境中具备刺激响应的释药特性。
| [1] |
Ruman U, Fakurazi S, Masarudin MJ, et al. Nanocarrier-based therapeutics and theranostics drug delivery systems for next generation of liver cancer nanodrug modalities[J]. Int J Nanomedicine, 2020, 15: 1437-1456. DOI:10.2147/IJN.S236927 |
| [2] |
Feng X, Chen Y, Li L, et al. Preparation evaluation and metabolites study in rats of novel amentoflavone-loaded TPGS/soluplus mixed nanomicelles[J]. Drug Deliv, 2020, 27: 137-150. DOI:10.1080/10717544.2019.1709920 |
| [3] |
Miao YQ, He SF, Liang JY, et al. Preliminary study of lipid bilayer-coated calcium phosphate nanoparticles as a drug carrier for antitumor drug[J]. Acta Pharm Sin (药学学报), 2017, 52: 977-984. |
| [4] |
Bocci G, Kerbel RS. Pharmacokinetics of metronomic chemotherapy:a neglected but crucial aspect[J]. Nat Rev Clin Oncol, 2016, 13: 69-73. DOI:10.1038/nrclinonc.2015.217 |
| [5] |
Kim SC, Kim DW, Shim YH, et al. In vivo evaluation of polymeric micellar paclitaxel formulation:toxicity and efficacy[J]. J Control Release, 2001, 72: 191-202. DOI:10.1016/S0168-3659(01)00275-9 |
| [6] |
Amato I. Chemists vie to make a better taxol[J]. Science, 1992, 256: 311. |
| [7] |
Bhatt P, Lalani R, Vhora I, et al. Liposomes encapsulating native and cyclodextrin enclosed paclitaxel:enhanced loading efficiency and its pharmacokinetic evaluation[J]. Int J Pharm, 2018, 536: 95-107. DOI:10.1016/j.ijpharm.2017.11.048 |
| [8] |
Lin W, Rui SY, Wen LY, et al. Preliminary study of lipid bilayer-coated calcium phosphate[J]. Acta Pharm Sin (药学学报), 2015, 50: 1240-1245. |
| [9] |
Sparreboom A, Scripture CD, Trieu V, et al. Comparative preclinical and clinical pharmacokinetics of a cremophor-free, nanoparticle albumin-bound paclitaxel (ABI-007) and paclitaxel formulated in cremophor (Taxol)[J]. Clin Cancer Res, 2005, 11: 4136-4143. DOI:10.1158/1078-0432.CCR-04-2291 |
| [10] |
Chiappetta DA, Sosnik A. Poly(ethylene oxide)-poly(propylene oxide) block copolymer micelles as drug delivery agents:improved hydrosolubility, stability and bioavailability of drugs[J]. Eur J Pharm Biopharm, 2007, 66: 303-317. DOI:10.1016/j.ejpb.2007.03.022 |
| [11] |
Li S, Chen L, Wang G, et al. Anti-ICAM-1 antibody-modified nanostructured lipid carriers:a pulmonary vascular endothelium-targeted device for acute lung injury therapy[J]. J Nanobiotechnol, 2018, 16: 105-119. DOI:10.1186/s12951-018-0431-5 |
| [12] |
Wang J, Sun X, Mao W, et al. Tumor redox heterogeneity-responsive prodrug nanocapsules for cancer chemotherapy[J]. Adv Mater, 2013, 25: 3670-3676. DOI:10.1002/adma.201300929 |
| [13] |
Meng F, Hennink WE, Zhong Z. Reduction-sensitive polymers and bioconjugates for biomedical applications[J]. Biomaterials, 2009, 30: 2180-2198. DOI:10.1016/j.biomaterials.2009.01.026 |
| [14] |
Zhang F, Zhu G, Jacobson O, et al. Transformative nanomedicine of an amphiphilic camptothecin prodrug for long circulation and high tumor uptake in cancer therapy[J]. ACS Nano, 2017, 11: 8838-8848. DOI:10.1021/acsnano.7b03003 |
| [15] |
Guo X, Wang L, Duval K, et al. Dimeric drug polymeric micelles with acid-active tumor targeting and FRET- traceable drug release[J]. Adv Mater, 2018, 30: 3-13. |
| [16] |
Bernabeu E, Gonzalez L, Cagel M, et al. Novel Soluplus®-TPGS mixed micelles for encapsulation of paclitaxel with enhanced in vitro cytotoxicity on breast and ovarian cancer cell lines[J]. Colloids Surfaces B, 2016, 140: 403-411. DOI:10.1016/j.colsurfb.2016.01.003 |
| [17] |
Duhem N, Danhier F, Préat V. Vitamin E-based nanomedicines for anti-cancer drug delivery[J]. J Control Release, 2014, 182: 33-44. DOI:10.1016/j.jconrel.2014.03.009 |
| [18] |
Bernabeu E, Gonzalez L, Cagel M, et al. Deoxycholate-TPGS mixed nano-micelles for encapsulation of methotrexate with enhanced in vitro cytotoxicity on breast cancer cell lines[J]. J Drug Deliv Sci Tech, 2019, 50: 293-304. DOI:10.1016/j.jddst.2019.01.041 |
| [19] |
Cagel M, Bernabeu E, Gonzalez L, et al. Mixed micelles for encapsulation of doxorubicin with enhanced in vitro cytotoxicity on breast and ovarian cancer cell lines versus Doxil[J]. Biomed Pharmacother, 2017, 95: 894-903. DOI:10.1016/j.biopha.2017.09.006 |
| [20] |
Bao Y, Guo Y, Zhuang X, et al. D-α-Tocopherol polyethylene glycol succinate-based redox-sensitive paclitaxel prodrug for overcoming multidrug resistance in cancer cells[J]. Mol Pharm, 2014, 11: 3196-3209. DOI:10.1021/mp500384d |
| [21] |
Li X, Zhang Y, Fan Y, et al. Preparation and evaluation of novel mixed micelles as nanocarriers for intravenous delivery of propofol[J]. Nano Res Lett, 2011, 6: 275-284. DOI:10.1186/1556-276X-6-275 |
| [22] |
Hao DL, Wang J, Xie R, et al. pH responsive docetaxel micelles with improved therapeutic efficacy on mice xenograft tumor[J]. Acta Pharm Sin (药学学报), 2019, 53: 797-805. |
| [23] |
Yang YQ, Lin WJ, Zhao B, et al. Synthesis and physicochemical characterization of amphiphilic triblock copolymer brush containing pH-sensitive linkage for oral drug delivery[J]. Arabian J Chem, 2014, 4: 265-270. |
| [24] |
Luo C, Sun J, Liu D, et al. Self-assembled redox dual-responsive prodrug-nanosystem formed by single thioether-bridged paclitaxel-fatty acid conjugate for cancer chemotherapy[J]. Nano Lett, 2016, 16: 5401-5408. DOI:10.1021/acs.nanolett.6b01632 |
| [25] |
Peiró CJ, Previtali V, Troelsen NS, et al. Prodrug strategies for targeted therapy triggered by reactive oxygen species[J]. Med Chem Commun, 2019, 10: 1531-1549. DOI:10.1039/C9MD00169G |
 2020, Vol. 55
2020, Vol. 55


