2. 广东药科大学, 广东省药物新剂型重点实验室, 广东 广州 510006;
3. 广东药科大学, 广东省局部精准递药制剂工程技术研究中心, 广东 广州 510006;
4. 澳门科技大学, 中药质量研究国家重点实验室, 澳门 000853
2. Guangdong Provincial Key Laboratory of Advanced Drug Delivery, Guangdong Pharmaceutical University, Guangzhou 510006, China;
3. Guangdong Provincial Engineering Center of Topical Precise Drug Delivery System, Guangdong Pharmaceutical University, Guangzhou 510006, China;
4. State Key Laboratory for Quality Research in Chinese Medicines, Macau University of Science and Technology, Macau 000853, China
水溶性药物临床应用广泛, 能在体内快速溶解、扩散[1], 但在体内应用起始阶段容易出现药物释放过快、局部浓度过高等现象, 有可能増加药物的毒副作用。研究发现, 一些载体如微球、微囊、脂质体、水凝胶和纳米粒等对水溶性药物能起到一定的缓释作用, 但这些载体对水溶性药物的负载能力有限, 载药量大多不超过20%[2-9]。因此, 构建高负载能力的缓释递送系统对充分发挥水溶性药物的疗效、降低毒副作用具有重要意义。
二维(two-dimensional, 2D)纳米材料具有层状结构、高比表面积、高度各向异性等独特性质, 是有效提高药物负载量非常有前景的纳米载体之一[10]。氮化碳(carbon nitride, C3N4)是一种新兴的2D纳米材料, 分为α相、β相、立方相、准立方相及类石墨相5种结构, 其中石墨相氮化碳(graphitic phase carbon nitride, g-C3N4)的结构最为稳定[11]。g-C3N4主要以3-s-三嗪环作为结构单元, 延展形成高聚C-N链, 同时各高聚链间存在氢键网络并构筑类似二维石墨烯的π-π共轭电子结构, 再以类石墨形式堆叠成2D片层结构[12], 所形成的单原子厚度和二维平面可提供较大的比表面积。此外, g-C3N4具有电荷迁移距离短、溶解性高、电子结构可调、半导体光催化活性更好及通过表面修饰能够调节结构表面化学性质等优点, 在光催化、传感器及生物医药等领域有着广泛的应用前景[13]。Liu等[14]以罗丹明B为模型药物通过静电力吸附和氢键作用负载在氮化碳纳米片(graphitic carbon nitride nanosheets, g-C3N4-NS)上, 当罗丹明B质量浓度为20 mg·L-1时载药量可达108.6 mg·g-1。利用g-C3N4-NS与药物之间产生的多种作用力, g-C3N4-NS对药物负载量有可能得到进一步提高。
丹酚酸B (salvianolic acid B, Sal B)是丹参提取物中具有芳香结构的酚酸类化合物, 由咖啡酸与丹参素通过酯键缩合而成, 含有2个羧基与7个酚羟基, 具有很强的抗氧化、抑制细胞凋亡、抑制血小板聚集和血栓形成等多种药理作用, 临床应用主要有注射用丹参多酚酸盐和注射用丹参总酚酸等。但是Sal B亲水性极好, 难以达到长期稳定的释放和理想的治疗效果[15]。本研究先制备块状g-C3N4 (bulk graphitic carbon nitride, b-g-C3N4), 再使用碱化学-超声辅助剥离法得到g-C3N4-NS, 并对g-C3N4-NS的稳定性进行探究; 采用聚乙烯亚胺(polyethyleneimine, PEI)对g-C3N4-NS进行修饰, 以增加g-C3N4-NS的稳定性并实现表面电荷的反转, 进一步考察了g-C3N4-NS对Sal B的负载能力和释放行为, 期望得到一种能够实现水溶性药物缓慢释放、稳定可控的具有高载药量递送系统。
材料与方法主要仪器 KSL-1200X马弗炉(合肥科晶材料技术有限公司); DelsaTM Nano C激光粒度电位仪(美国Beckman Coulter公司); LC-20A高效液相色谱仪、RF-5301PC荧光分光光度计、Perkin Elmer Spectrum One傅里叶红外光谱仪、UV-2500PC紫外-可见光分光光度计(日本Shimadzu公司); S-4800扫描电镜、H-7650透射电镜(日本Hitachi公司); Empyrean瑞影X-射线粉末衍射仪(荷兰PANalytical B.V.公司); Multiskan FC型酶标仪(上海赛默飞世尔仪器有限公司); Observer A1倒置显微镜(德国Zeiss公司)。
药品和试剂 尿素(ACS, 99.0%~100.5%, 美国Alfa Aesar化学有限公司); 稀HCl (分析纯, 天津致远化学试剂厂); 聚乙烯亚胺(MW 70 000, 50%水溶液, 上海阿拉丁试剂有限公司); 甘露醇(分析纯, 天津福晨化学试剂厂); 丹酚酸B (含量≥98.0%, 上海历鼎生物科技有限公司); α-MEM培养基(美国Gibco公司); NaOH、氯化钠(分析纯, 天津大茂化学试剂厂); 2-脱氧-5-氟尿苷(含量≥98.0%, 上海九鼎化学试剂有限公司); 甲醇、乙腈(色谱纯, 北京迪马科技有限公司); 甲酸(分析纯, 广州化学试剂厂); 无水乙醇(分析纯, 天津百世化工有限公司); 蒸馏水(广州屈臣氏食品饮料有限公司); 透析袋(MWCO: 3 000, 纤维素酯膜, 美国Spectrum公司)。
细胞和动物 L929细胞(小鼠成纤维细胞, 购自中国科学院上海细胞库); 野生AB系斑马鱼(中山大学医学院惠赠)。
g-C3N4-NS的制备
b-g-C3N4的制备 参考文献[16]采用高温热分解尿素法制备b-g-C3N4。称取尿素20 g放入坩埚中, 置于马弗炉以10 ℃·min-1阶梯式升温至500 ℃保温4 h。降至室温后, 取出坩埚, 将浅黄色的b-g-C3N4进行研磨, 水洗3次, 备用。
g-C3N4-NS的制备 参考文献[17]对制备方法加以改进, 称取b-g-C3N4 1 g, 加入NaOH溶液50 mL, 100 ℃加热回流12 h, 得到黄色的悬浮液, 3 000 r·min-1离心5 min, 弃去上清多余的NaOH溶液, 沉淀加入蒸馏水超声分散。悬浮液继续3 000 r·min-1离心5 min, 保留上清, 底部沉淀加入蒸馏水使分散均匀, 重复数次直至无沉淀出现。合并上清, 0.22 μm微孔滤膜过滤去除体系多余的OH-, 用蒸馏水重新分散滤膜上的沉淀, 即得g-C3N4-NS胶体溶液。
g-C3N4-NS冻干复溶 取g-C3N4-NS 5 mL直接冻干, 余下g-C3N4-NS平均分为4组, 以2%的乳糖、甘露醇、牛血清白蛋白和蔗糖作为冻干保护剂, -60 ℃预冻6 h, 冷冻干燥后加入蒸馏水复溶。
g-C3N4-NS的表征
透射电镜、扫描电镜及原子力显微镜观察g-C3N4-NS的形貌 取适量g-C3N4-NS样品滴在覆膜的铜网上, 用2%磷钨酸负染干燥后置于透射电镜下观察; 取少量g-C3N4-NS溶液烘干, 涂布在黏有导电胶的样品座上喷金处理, 置于扫描电镜下观察; 取少量g-C3N4-NS溶液滴在云母片上过夜烘干, 置于原子力显微镜下观察。
X-射线粉末衍射仪及红外光谱仪解析g-C3N4-NS的结构特征 使用X-射线粉末衍射仪以Cu-Kα靶为发射源(λ = 0.154 nm), 记录g-C3N4-NS粉末及b-g-C3N4扫描角度为10°~70°的衍射强度曲线; 分别取少量g-C3N4-NS粉末及b-g-C3N4混合溴化钾压片, 使用红外光谱仪测定样品特征峰, 扫描波段为400~4 000 cm-1。
紫外-可见光分光光度计及荧光分光光度计测定g-C3N4-NS的光学性质 使用紫外分光光度计测定g-C3N4-NS溶液的特征吸收峰, 扫描范围为200~800 nm, 另使用紫外可见漫反射光谱仪在相同条件下测定b-g-C3N4特征吸收峰; 室温下取适量g-C3N4-NS溶液, 最大激发波长为365 nm, 使用荧光分光光度计测定荧光发射光谱。
g-C3N4-NS稳定性考察
g-C3N4-NS在离子环境下的稳定性 向g-C3N4-NS胶体溶液中分别加入等量的细胞培养基DMEM、NaCl、pH调节剂(用HCl和NaOH溶液将体系pH值分别调节为1、3、7、10和14)、水溶性非离子型试剂氟尿苷和水溶性离子型药物Sal B, 经3 000 r·min-1离心5 min, 观察g-C3N4-NS在离子环境下的稳定性。
g-C3N4-NS在离子环境中的荧光特性 将g-C3N4-NS分别置于不同pH值环境(pH 1、3、9和14)和离子环境(NaCl、Sal B), 以g-C3N4-NS原液(pH 7)作对照, 在1、3、5、24、48、72、96和120 h分别测定上清液的荧光强度(λEx = 365 nm), 考察g-C3N4-NS在离子环境中荧光特性的变化。
g-C3N4-NS在离子环境下产生的絮凝物表征 收集g-C3N4-NS在离子环境(NaCl、Sal B)中产生的絮凝物, 分别用蒸馏水洗涤3次, 干燥后使用透射电镜和扫描电镜观察絮凝物的形貌, 使用X-射线衍射仪测定絮凝物晶体结构特征。
PEI-g-C3N4-NS的制备与表征
PEI-g-C3N4-NS的制备 取适量g-C3N4-NS经8 000 r·min-1离心20 min, 取上清液加入50% PEI水溶液, 调节pH至7, 超声30 min, 即得PEI-g-C3N4-NS。
PEI-g-C3N4-NS的表征 取适量PEI-g-C3N4-NS溶液, 采用激光粒度电位仪测定粒径、多分散指数(polydispersity index, PDI)及zeta电位; 分别取少量PEI-g-C3N4-NS粉末及PEI混合溴化钾压片测定样品特征峰, 扫描波段为400~4 000 cm-1。
PEI-g-C3N4-NS的稳定性 取PEI-g-C3N4-NS 2 mL, 分别与2 mL的细胞培养基DMEM、pH 7.4磷酸盐缓冲液(PBS)和0.9%生理盐水等混合, 于37 ℃孵育, 在0、1、4、12、24、48及72 h分别测定PEI-g-C3N4-NS的粒径分布。
PEI-g-C3N4-NS的体外评价
Sal B的HPLC含量测定 精密称取Sal B 2 mg, 用80%甲醇水溶液溶解, 然后转移到10 mL棕色量瓶中, 摇匀, 定容至刻度, 得到280 μmol·L-1 Sal B母液。再用80%甲醇水溶液依次稀释, 得到浓度分别为1.4、2.8、14.0、28.0、56.0 μmol·L-1的系列标准溶液。各取样品20 μL, 用HPLC进行分析, 测得的色谱峰面积(Y)对Sal B标准溶液浓度(X)进行线性回归得出标准曲线方程, 建立HPLC分析Sal B的色谱条件及绘制标准曲线。
Sal B负载率的测定 取PEI-g-C3N4-NS溶液(约50 μg·mL-1) 4 mL, 加入20 mL不同浓度(0.35、0.70、2.00、4.00、6.00、10.00、20.00和50.00 μmol·L-1)的Sal B溶液, 避光搅拌12 h, 25 000 r·min-1低温高速离心35 min, 弃上清, 沉淀、水洗、离心, 循环3次, 即得。沉淀中加入80%甲醇水溶液20 mL, 超声20 min使Sal B从载体上脱落, 再于25 000 r·min-1低温高速离心35 min, 取上清1 mL, HPLC分析Sal B含量(W), 并通过下式计算药物负载率(DL)。
| $\mathrm{DL}(\%)=W_{\text {drug in nanomaterial }} / W_{\text {nanomaterial }} \times 100 \%$ | (1) |
Sal B的释放 采用透析袋扩散法考察Sal B的体外释放。取负载Sal B的PEI-g-C3N4-NS的重悬液2 mL, 置于透析袋内并完全浸入10 mL蒸馏水中, 保持37 ℃、100 r·min-1振摇。分别在5、10、15、30 min和1、2、4、6、8、12、24、48、72、96、108、120、144、168 h将透析袋取出并置于新鲜的等量释放介质中, 取1 mL含药物的释放介质加入等量甲醇, 用HPLC分析药物含量, 计算Sal B的累积释放率, 绘制PEI-g-C3N4-NS的药物体外累积释放曲线。另称取等量的Sal B, 用2 mL蒸馏水溶解, 置于透析袋中作为游离药物对照组。
PEI-g-C3N4-NS体外细胞毒性实验 取对数生长期的L929细胞, 以每孔约1.0×105个细胞数接种在96孔板, 置于37 ℃、5% CO2培养箱孵育24 h。实验分2组, 即游离PEI组和PEI-g-C3N4-NS组。加入含不同浓度药液的培养基100 μL, 同时设置阴性对照孔和空白调零孔, 每个浓度设6个复孔。孵育24 h后弃去药液, 每孔加入5 mg·mL-1 MTT液100 μL, 37 ℃继续培养4 h后, 吸弃上清, 每孔再加入DMSO 100 μL, 避光震荡10 min, 以酶标仪检测490 nm处的吸光度值(A), 计算细胞存活率(SR):
| $\operatorname{SR}(\%)=\left(A_{\text {sample }}-A_{\text {blank }}\right) /\left(A_{\text {control }}-A_{\text {blank }}\right) \times 100 \%$ | (2) |
斑马鱼的繁殖及其受精卵的采集 当日下午喂食后将雌雄鱼按1:2比例放入繁殖盒内, 并用透明隔板将雌雄鱼隔开。次日早上8点左右, 将布罩和隔板撤走, 在光照刺激下鱼开始追尾交配, 受精卵则会落入繁殖盒内。30 min后, 将雌雄亲鱼捞出并将受精卵吸出转移至新鲜的胚胎培养液中。
PEI-g-C3N4-NS斑马鱼胚胎发育毒性实验 受精卵用胚胎培养液轻轻清洗1次, 在显微镜下挑选成功受精的受精卵, 用于胚胎发育毒性暴露实验。胚胎发育毒性实验参考OECD指导文件[18]并对实验方法加以改进。实验设置1个对照组和7个药物组, 药物组分别为12.5、25、50、100、200、400和800 μg·mL-1 PEI-g-C3N4-NS溶液。胚胎在2 hpf (hours past fertilization)转移到24孔板内, 每组60个胚胎(n = 60), 每孔20个胚胎, 重复3孔, 每孔加入药液2 mL。24孔板在28 ℃恒温培养箱内静置培养, 14 h/10 h光暗循环, 每24 h更换新鲜的药液, 胚胎发育至96 hpf时停止处理。PEI-g-C3N4-NS使用时用胚胎培养液溶解并稀释至工作浓度。在暴露过程中, 显微镜下统计24、48、72、96 hpf死亡胚胎数和48、72、96 hpf孵化胚胎数, 倒置显微观察并记录胚胎发育过程中出现的形态变化。
| $ 死亡率 (\%) = 死亡胚胎数 / 60 \times 100 \% $ | (3) |
| $ 卵化率 (\%) = 卵化胚胎数 / 60 \times 100 \% $ | (4) |
统计学分析 使用SPSS 16.0软件的单因素方差分析检验实验组之间的统计分析, 实验数据以x±s表示, P < 0.05被认为具有统计学意义。
结果 1 g-C3N4-NS的制备与表征 1.1 b-g-C3N4的合成由图 1A的a图可见热分解尿素得到b-g-C3N4呈疏松多孔的骨架, 且内部有许多致密无序的孔道及材料本身明显的褶皱结构。
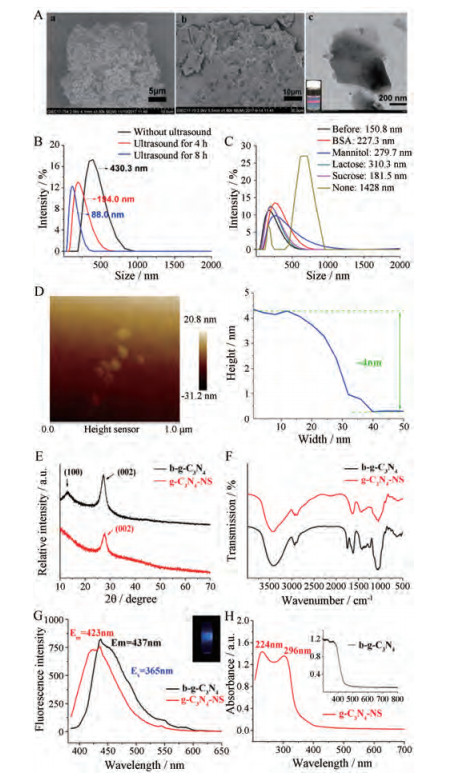
|
Figure 1 Characterization of graphitic carbon nitride (g-C3N4). A: Scanning electron microscope (SEM) images of bulk graphitic carbon nitride (b-g-C3N4) (a), graphitic carbon nitride nanosheets (g-C3N4-NS) (b) and transmission electron microscope (TEM) image of g-C3N4-NS (c); B: Effect of ultrasonic time on particle size of g-C3N4-NS; C: Particle size of g-C3N4-NS reconstituted after lyophilization using different lyoprotectants; D: Atomic force microscope (AFM) image of g-C3N4-NS; E: X-ray diffraction (XRD) of g-C3N4-NS; F: Fourier infrared spectrum (FTIR) of g-C3N4-NS; G: Fluorescence spectrum of g-C3N4-NS; H: Ultraviolet spectrophotometer (UV-Vis) for g-C3N4-NS compared to diffuse reflection spectroscopy (DRS) for b-g-C3N4 |
采用碱化学-超声辅助剥离法对b-g-C3N4进行剥离, 得到g-C3N4-NS可通过延长超声时间控制尺寸(图 1B), 最终g-C3N4-NS在超声8 h后尺寸可达88 nm。冷冻干燥后得到g-C3N4-NS固体粉末难以再均匀分散, 冻干前后尺寸从150.8 nm变为1 428 nm, 增大了近10倍(图 1C)。冻干保护剂可使样品均能重新均匀分散, 提高g-C3N4-NS再分散性能。
1.3 g-C3N4-NS的形貌特征g-C3N4-NS胶体溶液外观呈蓝色乳光, 并具有强烈的丁达尔效应, 如图 1A的b图所示扫描电镜下样品呈不规则的片状结构, 从材料的局部边缘放大看是由几层薄片堆叠而成。扫描电镜液体样品的制备方法是在锡箔纸上滴样, 在后续样品干燥过程中, g-C3N4-NS之间因失水作用使片层之间范德华引力作用增强而趋向团聚, 并发生层层堆积, 导致冷冻干燥后g-C3N4-NS的再分散性能较差[19]。因此, 在图 1A的c图透射电镜视野下难以观察到纳米尺寸的单个g-C3N4-NS。使用原子力显微镜进一步检测g-C3N4-NS的高度和微观尺寸, 如图 1D所示g-C3N4-NS横向尺寸约100 nm, 高度约4 nm。从以上结果均可看出, 碱化学-超声辅助剥离法可将b-g-C3N4剥离成横向尺寸较小、厚度较薄的g-C3N4-NS。
1.4 g-C3N4-NS的结构特征图 1E为b-g-C3N4和g-C3N4-NS的X-射线衍射曲线, b-g-C3N4在2θ为13.1°和27.4°附近有明显的衍射峰, 分别对应共轭芳香体系层间堆积和层内基元结构周期性排列的特征峰。剥离后g-C3N4-NS中观察到13.1°处的衍射峰消失且27.4°处的衍射峰减弱, 说明g-C3N4的层间堆积结构遭到破坏, 形成单层或较薄的纳米片[20]。红外光谱结果(图 1F)显示, b-g-C3N4与g-C3N4-NS图谱基本一致, 3 200~3 500 cm-1宽带归属于三嗪环上的N-H的伸缩振动峰, 1 200~1 600 cm-1归属于氮杂环化合物中的C-N和C=N的伸缩振动峰, 810 cm-1归属于三嗪环骨架振动特征峰[21], 说明剥离后g-C3N4的分子结构并未受到破坏。
1.5 g-C3N4-NS的光学性质g-C3N4-NS在365 nm激发下发出强烈的蓝色荧光, g-C3N4-NS的荧光光谱发生蓝移如图 1G所示, 这可能是因为碱化学处理造成了g-C3N4的光学性质的变化。在紫外光谱中, g-C3N4-NS在224和296 nm处出现尖锐的吸收峰(图 1H), 而b-g-C3N4的紫外可见光漫反射最大吸收波长位于400 nm。g-C3N4-NS的最大吸收发生蓝移, 这是由于量子尺寸效应所致[22, 23]。
2 g-C3N4-NS稳定性考察 2.1 g-C3N4-NS在离子环境的稳定性及荧光特性如图 2A所示, g-C3N4-NS在强酸条件下稳定性较差, 底部有沉淀生成。随着时间的增加, g-C3N4-NS荧光强度逐渐降低。在弱酸性、中性及碱性条件下g-C3N4-NS均可稳定存在, 未出现沉淀现象且荧光性能稳定, 进一步说明g-C3N4-NS在弱酸性、中性及碱性环境中的化学稳定性较好。g-C3N4-NS在强电解质NaCl、弱酸性解离型药物Sal B环境中均会出现沉淀, 在水溶性非解离型试剂氟尿苷中未出现沉淀, 初步证明g-C3N4-NS在离子环境下稳定性差。在NaCl溶液中随着时间的增加, g-C3N4-NS的荧光强度逐渐降低; 在Sal B溶液中1 h后荧光骤降, 往后时间点荧光强度持续降低(图 2B)。总体来看, 在不同离子环境下g-C3N4-NS的荧光强度降幅速率为Sal B > NaCl, 表明不同离子对g-C3N4-NS稳定性变化的诱导能力不同, 这可能是由于各离子的电荷密度不同, 与荷电g-C3N4-NS之间产生的静电相互作用强弱也不同。
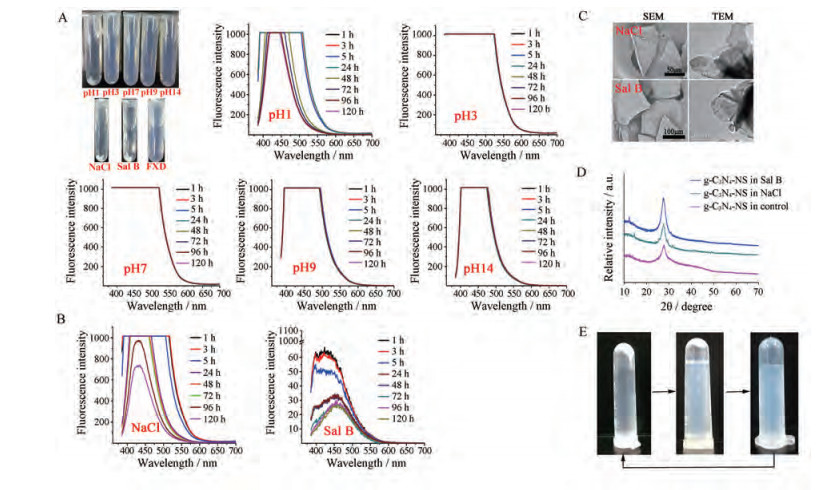
|
Figure 2 Compatibility and stability of g-C3N4-NS in ion environment and characterization of flocs produced by g-C3N4-NS in ion environment. A: Compatibility of g-C3N4-NS in acid-base or ionic and non-ionic environments; B: Fluorescence intensity changes of g-C3N4-NS in ionic environment; C: SEM and TEM images of flocculation caused by the contact between g-C3N4-NS and ion; D: XRD of flocculation caused by g-C3N4-NS in ionic environment; E: Reversibility of flocculation |
g-C3N4-NS在两种离子环境中所生成的沉淀物是由许多片层错落堆叠而形成块状, 如图 2C所示, 沉淀物应是g-C3N4-NS层层堆积或层层自组装的聚集体。g-C3N4-NS的X-射线衍射曲线中在2θ = 27.6°时有1个衍射峰对应层间堆积作用, 絮凝物在相同角度处也存在相应衍射峰(图 2D), 且峰强明显高于g-C3N4-NS, 进一步说明沉淀物是g-C3N4-NS聚集体。不同离子环境下生成的絮凝物衍射峰强大小为Sal B > NaCl, 表明不同离子对层层自组装的诱导能力不同。经振摇后絮凝现象可分散, 提示其层层自组装行为是可逆的(图 2E)。
3 PEI-g-C3N4-NS的制备及体外评价 3.1 PEI-g-C3N4-NS的表征g-C3N4-NS修饰前的粒径为88.0 nm, 带负电, 经PEI修饰后粒径增大为133.7 nm, 且电位由-32.1 mV转为43.4 mV (图 3A)。在FTIR结果中(图 3B), 1 462 cm-1处归属于PEI的仲胺基N-H面内弯曲振动峰[24]。g-C3N4-NS的特征峰分别为809 cm-1归属于三嗪环弯曲振动峰和1 619 cm-1处归属于CN杂环的拉伸峰。相较于g-C3N4-NS, PEI-g-C3N4-NS归属于g-C3N4中三嗪环的弯曲振动峰发生红移, 以及在1 462 cm-1处出现归属于仲胺基团N-H的面内弯曲振动峰, 表明PEI与g-C3N4-NS之间存在相互作用[25]。以上结果表明PEI成功修饰g-C3N4-NS并实现了电荷切换。
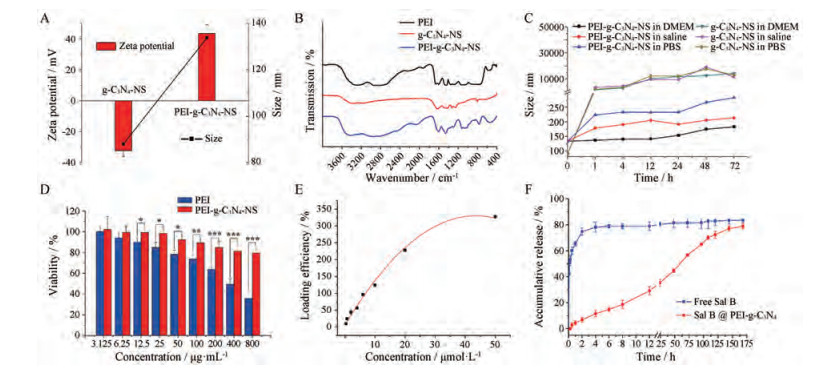
|
Figure 3 Characterization of PEI-g-C3N4-NS (carbon nitride nanosheets modified by polyethyleneimine). A: Zeta potential and particle size; B: FTIR; C: Particle size change of PEI-g-C3N4-NS and g-C3N4-NS in cell culture medium (DMEM), saline and phosphate buffer saline (PBS); D: The cytotoxicity of PEI-g-C3N4-NS in L929 cells. n = 6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001; E: Loading efficiency of salvianolic acid B (Sal B) in different concentration; F: Cumulative release of Sal B from PEI-g-C3N4-NS in distilled water at 37 ℃ in 168 h. n = 6, x±s |
生理介质中粒径稳定性考察(图 3C)结果显示, PEI-g-C3N4-NS与g-C3N4-NS相比, 在37 ℃与生理盐水、PBS或DMEM中孵育72 h粒径较稳定, 不会产生聚集现象, 说明修饰后的PEI-g-C3N4-NS稳定性增加, 满足药物载体的要求。
3.3 PEI-g-C3N4-NS的体外细胞毒性PEI对g-C3N4-NS进行修饰后, 细胞毒性与PEI自身相比具有显著性降低的趋势(图 3D), 并且PEI-g-C3N4-NS在3.125~800 μg·mL-1内生物相容性良好。
3.4 Sal B的负载如图 3E所示, 随着Sal B浓度的增加, 载药率也会随之增大, 随药物浓度继续增加至50 μmol·L-1时, 载药率逐渐趋向饱和, PEI-g-C3N4-NS对Sal B的最大负载率可达327.4%。
3.5 Sal B的释放PEI-g-C3N4-NS载体组的药物释放速度明显慢于游离药物组(图 3F), 直到168 h药物释放完全。在体外释放的前12 h中, 游离Sal B在5 min时即有释放, 在第6~8 h释放完全, 游离Sal B组的累积释放率约80.4%。PEI-g-C3N4-NS载体组呈现缓慢释放Sal B的趋势, 在168 h的累积释放率达79.2%。因此, PEI-g-C3N4-NS作为水溶性药物Sal B递送载体具有更好的缓释性能。分别采用零级动力学方程、一级动力学方程和Higuchi方程进行拟合, 探讨Sal B的体外释药机制, 见表 1。结果显示, Higuchi模型对Sal B的释放具有最优的拟合程度, 提示药物释放可能主要依照扩散机制。
| Table 1 The fit curves of Sal B release from PEI-g-C3N4-NS |
28 ℃下受精2 h的斑马鱼胚胎在梯度浓度PEI-g-C3N4-NS的暴露条件下, 斑马鱼胚胎在24、48、72和96 hpf的死亡率, 见图 4A。结果显示, 在24及48 hpf阶段, 质量浓度在50 μg·mL-1以内的PEI-g-C3N4-NS对斑马鱼胚胎的死亡率没有影响, 在100~800 μg·mL-1时斑马鱼胚胎随着浓度的升高死亡率有上升的趋势, 并于72及96 hpf阶段趋于稳定, 在高质量浓度800 μg·mL-1时96 hpf阶段斑马鱼胚胎累积死亡率为18.33%。由图 4B显示, 在48~96 hpf经不同质量浓度PEI-g-C3N4-NS处理后, 随着PEI-g-C3N4-NS浓度增加, 各组胚胎呈现不同的孵化程度, 其中质量浓度在12.5及25 μg·mL-1时累积孵化率与对照组相当; 在50~800 μg·mL-1时累积孵化率出现轻微下降; 在800 μg·mL-1时累积孵化率为81.67%。以上结果说明PEI-g-C3N4-NS在浓度低于800 μg·mL-1时对斑马鱼胚胎的死亡率及孵化率影响较小。
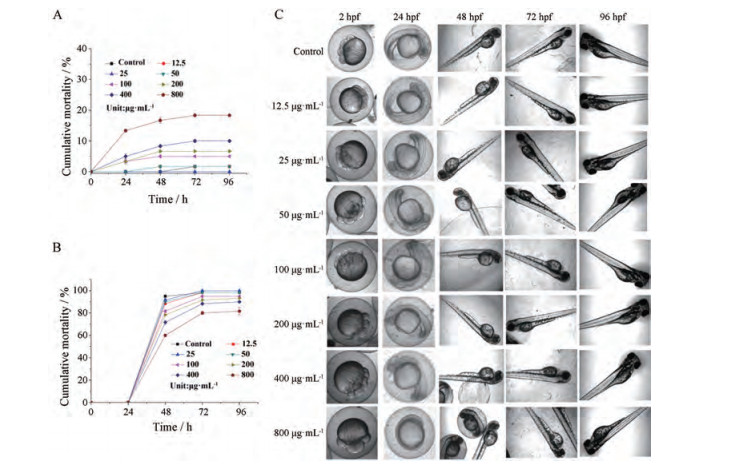
|
Figure 4 Acute toxic effect of PEI-g-C3N4-NS on zebrafish embryo. n = 60, x±s. A: Effect of PEI-g-C3N4-NS on embryo mortality of zebrafish; B: Effect of PEI-g-C3N4-NS on embryo hatchability of zebrafish; C: Effect of PEI-g-C3N4-NS on the embryonic development of zebrafish. hpf: Hours past fertilization |
由图 4C表示, 在梯度质量浓度12.5~400 μg·mL-1的PEI-g-C3N4-NS处理24 hpf时, 受精卵外观较为圆润, 无外膜畸变, 外膜亦无破损和杂质黏附, 卵内胚胎发育正常, 无明显延迟, 但在浓度为800 μg·mL-1处理24 hpf时斑马鱼胚胎与对照组相比出现轻微的发育迟缓现象; 48 hpf时结果显示, 经各浓度PEI-g-C3N4-NS处理后, 与对照组比较, 药物组的幼鱼孵化后体长、大小等正常, 腹部、尾部等无弯曲、缺失等明显畸形发生, 形态发育良好, 但质量浓度为400和800 μg·mL-1处理的斑马鱼胚胎仍有少部分未完全脱膜; 在72和96 hpf阶段中, 12.5~400 μg·mL-1 PEI-g-C3N4-NS处理后的斑马鱼幼鱼在显微镜视野下心脏起搏有力, 血液通畅, 尾部、节间等血管发育良好, 且无心包囊肿等现象的出现。以上结果显示, PEI-g-C3N4-NS在质量浓度800 μg·mL-1时对斑马鱼胚胎的发育有轻微延缓作用, 但不影响斑马鱼胚胎的孵化及形态的变化。
讨论在b-g-C3N4中, C原子和N原子以共价键紧密相连形成聚合三嗪环单元并构成g-C3N4片层, 片层之间的范德华作用力又会进一步层层堆积成块体。g-C3N4在碱溶液中进行剥离时有两种可能发生的反应: ①OH-和-NH2在g-C3N4层间形成氢键; ② OH-与-NH2末端连接的杂环C原子之间发生亲电取代, 导致部分-NH2基团被OH-取代。g-C3N4表面会被强碱所侵蚀, 使g-C3N4表面带负电, 同时也会插到g-C3N4的层间, 层间的弱范德华力被破坏, 导致片层分离, 形成g-C3N4-NS[26]。但对于获得尺寸更小的g-C3N4-NS还存在一定难度, 因此本文借助超声对g-C3N4-NS进一步剥离。超声辅助剥离主要依靠超声过程中会有微气泡的生成与炸裂, 在介质中产生振荡, g-C3N4表面的气泡使得分散在溶剂中的g-C3N4被压碎; 而在g-C3N4附近但不接触的地方产生的振荡会在介质中形成微射流冲击g-C3N4表面, 形成剪切力进而使g-C3N4层与层之间分离, 进一步得到更小尺寸的纳米片[13]。通过探究g-C3N4-NS在不同离子环境下的外观稳定性以简单探讨g-C3N4-NS的稳定性是否与离子的诱导有关, 进一步利用荧光半定量分析以明确不同离子诱导对纳米片稳定性造成的不同影响。最后通过收集沉淀物采用透射电镜、扫描电镜、X-射线衍射仪以说明沉淀物产生的机制可能是基于电荷驱动纳米片层层自组装。
PEI是一类应用广泛的可生物降解的聚合物, 可修饰石墨烯等材料以提高其在生理环境中的稳定性。利用PEI修饰g-C3N4-NS, 有助于提高g-C3N4在生理介质中的稳定性, 使其成为具有前景的药物载体。本研究利用PEI-g-C3N4-NS负载Sal B, 既提高了Sal B的载药量又能使其缓慢释放, 从而有望解决这种亲水性药物“剂量突释”的问题, 为开发水溶性药物缓释制剂提供借鉴。本研究制备的g-C3N4-NS与b-g-C3N4相比, 具有更大的比表面积、更多的活性位点, 如图 5所示PEI-g-C3N4-NS的两面均可负载药物, 其中Sal B带负电, PEI-g-C3N4-NS带正电, 两者通过静电力结合, 使得药物在PEI-g-C3N4-NS表面大量积聚。此外, PEI-g-C3N4-NS还可通过π-π堆积作用, 从而进一步提高对具有芳香结构的Sal B药物分子的吸附量, 两种作用力的结合使得PEI-g-C3N4-NS对Sal B的负载率可达327.4%, 而且Sal B无突释效应, 7天累积释放率达79.2%, 缓释作用明显。

|
Figure 5 Illustration of Sal B loading mechanism on g-C3N4-NS |
斑马鱼是一类热带淡水鱼, 其具有尺寸小、实验中并易于观察, 且与人类基因具有87%同源性的特点, 因而常被用来作为评估纳米材料环境毒性或作为生物纳米材料毒性的基本生物模型[27]。已有研究应用斑马鱼胚胎毒性实验评估石墨烯[28]、3D打印材料的生物相容性[29], 考察氧化锌纳米粒的毒性机制[30]等。在本研究中, 除了用L929细胞考察PEI-g-C3N4-NS的体外毒性外, 还利用斑马鱼动物模型进一步考察其毒性作用。实验结果显示, PEI-g-C3N4-NS浓度低于800 μg·mL-1时对斑马鱼胚胎毒性较低。因此, 综合细胞毒性及斑马鱼胚胎发育毒性实验结果, PEI-g-C3N4-NS浓度低于800 μg·mL-1时具有较好的生物相容性。
| [1] |
Du HH, Guan QX, Zhu T, et al. Advances in new technologies for improving the stability of water-soluble drugs[J]. J China Pharm (中国药房), 2017, 28: 994-997. |
| [2] |
Jiang Y, Zhang XM, Mu HJ, et al. Preparation and evaluation of injectable rasagiline mesylate dual-controlled drug delivery system for the treatment of Parkinson's disease[J]. Drug Deliv, 2018, 25: 143-152. DOI:10.1080/10717544.2017.1419514 |
| [3] |
Abulateefeh SR, Alkawareek MY, Alkilany AM. Tunable sustained release drug delivery system based on mononuclear aqueous core-polymer shell microcapsules[J]. Int J Pharm, 2019, 558: 291-298. DOI:10.1016/j.ijpharm.2019.01.006 |
| [4] |
Li WZ, Han WX, Zhao N, et al. The effects of essential oils of traditional Chinese medicine on the pharmaceutical properties of flexible nano-liposomes loaded with palmatine chloride[J]. Acta Pharm Sin (药学学报), 2017, 52: 992-997. |
| [5] |
Jian YF, Bu W, Li WW, et al. Preparation and stability investigation in vitro of solid lipid nanoparticles loaded with doxorubicin hydrochloride by double emulsion method[J]. China Pharm (中国药师), 2018, 21: 2096-2100. |
| [6] |
Zhu Q, Cheng HB, Huo YN, et al. Sustained ophthalmic delivery of highly soluble drug using pH-triggered inner layer-embedded contact lens[J]. Int J Pharm, 2018, 544: 100-111. DOI:10.1016/j.ijpharm.2018.04.004 |
| [7] |
Zhang Y, Fei WD, Tao JY, et al. Preparation and in vitro evaluation of arsenic trioxide-loaded phospholipid capped mesoporous silica nanoparticles modified with Angiopep-2 as targeting drug delivery system[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 1289-1297. |
| [8] |
Mondal L, Mukherjee B, Das K, et al. CD-340 functionalized doxorubicin-loaded nanoparticle induces apoptosis and reduces tumor volume along with drug-related cardiotoxicity in mice[J]. Int J Nanomed, 2019, 14: 8073-8094. DOI:10.2147/IJN.S220740 |
| [9] |
Wang QQ, Chen ML, Hu X, et al. Preparation and characterization of timolol maleate cubic nanoparticles for ocular administration[J]. Acta Pharm Sin (药学学报), 2018, 53: 1894-1900. |
| [10] |
Chimene D, Alge DL, Gaharwar AK. Two-dimensional nanomaterials for biomedical applications:emerging trends and future prospects[J]. Adv Mater, 2015, 27: 7261-7284. DOI:10.1002/adma.201502422 |
| [11] |
Qie J, Li M, Liu L, et al. Research of photocatalyst g-C3N4 using first principles hyaluronic acid and its derivatives as drug carriers[J]. Prog Chem (化学进展), 2016, 28: 1569-1577. |
| [12] |
Zheng X, Yu PY, Wang JP. Intramolecular vibrational energy transfer in carbon nitride examined by ultrafast 2D infrared spectroscopy[J]. Spectrosc Spect Anal (光谱学与光谱分析), 2018, 38: 117-118. |
| [13] |
Li JY, Liang F, Tian L, et al. Progress in preparation method of g-C3N4 nanosheets[J]. Chem Bull (化学通报), 2018, 81: 387-393. |
| [14] |
Liu CG, Wu XT, Li XF, et al. Synthesis of graphene-like g-C3N4/Fe3O4 nanocomposites with high photocatalytic activity and for drug delivery[J]. RSC Adv, 2014, 4: 62492-62498. DOI:10.1039/C4RA10616D |
| [15] |
Yuan CP, Hou HM, Ou SY. Progress in the pharmacokinetics and relative studies of salvianolic acid B[J]. Chin J New Drugs (中国新药杂志), 2015, 24: 791-799. |
| [16] |
Liu J, Liu Y, Liu N, et al. Metal-free efficient photocatalyst for stable visible water splitting via a two-electron pathway[J]. Science, 2015, 347: 970-974. DOI:10.1126/science.aaa3145 |
| [17] |
Cheng F, Yan J, Zhou C, et al. An alkali treating strategy for the colloidization of graphitic carbon nitride and its excellent photocatalytic performance[J]. J Colloid Interface Sci, 2016, 468: 103-109. DOI:10.1016/j.jcis.2016.01.044 |
| [18] |
OECD. Test No.236: fish embryo acute toxicity (FET) test[S]. Paris: OECD, 2013.
|
| [19] |
Amiri M, Salehniya H, Habibi YA. Graphitic carbon nitride/chitosan composite for adsorption and electrochemical determination of mercury in real samples[J]. Ind Eng Chem Res, 2016, 55: 8114-8122. DOI:10.1021/acs.iecr.6b01699 |
| [20] |
Xu QC, Wang J, Zhang XM, et al. Preparation and photocatalytic performance of g-C3N4 nanosheets with high specific surface area[J]. Chem Bioeng (化学与生物工程), 2018, 35: 20-25. |
| [21] |
Yin J, Liao GZ, Zhu DY, et al. g-C3N4 preparation and photocatalytic activity of g-C3N4/rGO composite[J]. J Environ Sci-China (中国环境科学), 2016, 36: 735-740. |
| [22] |
Chai B, Peng TY, Mao J, et al. Graphitic carbon nitride (g-C3N4)-Pt-TiO2 nanocomposite as an efficient photocatalyst for hydrogen production under visible light irradiation[J]. Phys Chem Chem Phys, 2012, 14: 16745-16752. DOI:10.1039/c2cp42484c |
| [23] |
Cao SW, Yu JG. g-C3N4-based photocatalysts for hydrogen generation[J]. J Phys Chem Lett, 2014, 5: 2101-2107. DOI:10.1021/jz500546b |
| [24] |
Wang JH, Yin XL, Ji YF. Cr (Ⅵ) adsorption on polyethyleneimine modified graphite oxide[J]. Chin J Inorg Chem (无机化学学报), 2015, 31: 1185-1193. |
| [25] |
Huang Y, Fu M, He T. Synthesis of g-C3N4/BiVO4 nanocomposite photocatalyst and its application in photocatalytic reduction of CO2[J]. Acta Phys Chim Sin (物理化学学报), 2015, 31: 1145-1152. DOI:10.3866/PKU.WHXB201504015 |
| [26] |
Ma HC, Liu JJ, Yu YC, et al. Preparation of two-dimensional graphite phase carbon nitride nanosheets and research progress in photocatalysis[J]. Chin J Appl Chem(应用化学), 2019, 36: 259-268. |
| [27] |
Li LM. Preliminary Evaluation of the Biological Toxicity of Single-Walled Carbon Nanotubes by Using Zebrafish Embryos (利用斑马鱼胚胎初步评价单壁碳纳米管的生物毒性)[D]. Guangxi: Guangxi Medical University, 2013.
|
| [28] |
Liu XT, Mu XY, Wu XL, et al. Toxicity of multi-walled carbon nanotubes, graphene oxide, and reduced graphene oxide to zebrafish embryos[J]. Biomed Environ Sci, 2014, 27: 676-683. |
| [29] |
Macdonald NP, Zhu F, Hall CJ, et al. Assessment of biocompatibility of 3D printed photopolymers using zebrafish embryo toxicity assays[J]. Lab Chip, 2016, 16: 291-297. DOI:10.1039/C5LC01374G |
| [30] |
Bai W, Zhang ZY, Tian WJ, et al. Toxicity of zinc oxide nanoparticles to zebrafish embryo:a physicochemical study of toxicity mechanism[J]. J Nanopart Res, 2010, 12: 1645-1654. DOI:10.1007/s11051-009-9740-9 |
 2020, Vol. 55
2020, Vol. 55


