环磷酰胺(cyclophosphamide, CPA)是一种应用广泛的化疗药与免疫抑制剂, 可用于治疗淋巴癌、乳腺癌以及白血病等多种癌症, 还可用于骨髓移植[1]。CPA虽然药效显著, 但也有明显的副作用, 其中较为突出的就是肝毒性[2, 3]。CPA需要在体内经代谢才能发挥药效活性。进入体内后, 肝脏将CPA代谢成为磷酰胺氮芥(glyciphosphoramide, PM)以及丙烯醛(acrolein, Acr)。磷酰胺氮芥可通过结合癌细胞DNA上特定的亲核基团或者通过激活caspase-9依赖的细胞凋亡途径而杀灭肿瘤细胞[4, 5]。同时, 磷酰胺氮芥也可与正常细胞的DNA结合, 生成多种加合产物, 导致细胞死亡[6, 7]。因此, 磷酰胺氮芥既是CPA的活性代谢产物, 也是其毒性代谢产物。临床上, CPA的肝毒性存在很大的个体差异, 其主要原因就是不同病患对其的代谢能力不同[8]。药物在体内的代谢活化依赖于肝脏中的细胞色素P450 (cytochrome P450, CYP450)。CPA在体内代谢活化并致毒的关键酶是人CYP家族中的CYP2B6[9, 10], 即小鼠CYP2B10[11, 12]。
氧化苦参碱(oxymatrine, OMT)是从豆科槐属植物苦参中提取分离出的一种生物碱, 具有清热利湿、利尿解毒等作用[13]。现代药理学研究表明, OMT具有抗炎、抗病毒以及抑制肿瘤血管新生的作用[14, 15], 此外, 还可缓解化疗引起的白细胞减少症[16]。临床上, OMT可能会与CPA联合给药用于肿瘤治疗[17]。同时已有研究表明, OMT可增强CPA对小鼠Lewis肺癌生长的抑制作用[18]。而OMT对CPA诱导肝毒性的影响, 将在本研究中予以探讨。
材料与方法药物与试剂 环磷酰胺(纯度≥97%, 美国Sigma公司); 氧化苦参碱(纯度≥98.5%, 中国上海源叶生物科技有限公司); 谷草转氨酶(aspartate aminotransferase, AST)检测试剂盒和谷丙转氨酶(alanine aminotransferase, ALT)检测试剂盒(中国南京建成生物工程研究所); BCA试剂盒(美国Thermo公司); RNAiso Plus、PrimeScript Master Mix和SYBR Premix Ex Taq (日本Takara公司); β-Actin和CYP2B6抗体(美国GeneTex公司); 过氧化物酶结合的山羊兔抗(美国Jackson ImmunoResearch公司); 牛血清白蛋白(bovine serum albumin, BSA) (美国VWR公司); 脱脂奶粉、丙烯酰胺、Tween-20和qPCR引物(中国上海生工生物工程股份有限公司); 甲醇、异丙醇、氯仿和无水乙醇(中国国药集团化学试剂有限公司); 其他试剂均购自美国Sigma公司。
主要仪器 Synergy H4酶标仪(美国Bio-Tek公司); Applied Biosystems实时荧光定量PCR仪QuantStudio 6 Flex Real-Time PCR (美国Thermo Fisher Scientific公司); 蛋白垂直电泳仪和转膜仪(美国Bio-Rad公司); 三重四级杆质谱仪(美国Waters公司); GL-802微型台式真空泵(中国其林贝尔仪器制造有限公司)。
实验动物 SPF级C57BL/6小鼠, 雄性, 18~22 g, 购自中国上海斯莱克实验动物有限责任公司, 合格证号SCXK (沪) 2017-0005。饲养条件: (22 ± 1) ℃, 相对湿度(65 ± 10)%, 7:00~19:00, 19:00~7:00, 明暗循环照明。本文中动物福利和实验过程均遵循上海中医药大学实验动物伦理委员会的规定。
动物处理 ① OMT单独单次给药实验:小鼠按bliss法随机分为6组, control组3只、OMT (100 mg·kg-1)给药4、8、12、18和24 h组各3只。禁食6 h后OMT灌胃(intragastric administration, ig)给药, 给药4、8、12、18和24 h后处理取材, 摘眼球取血, 供测定血清生化指标。肝组织保存在锡箔纸内, 液氮速冻, 转移到-80 ℃冰箱保存, 备用。② OMT单独长期给药实验:小鼠按bliss法随机分为2组, control组和OMT (100 mg·kg-1)给药组, 各3只。禁食6 h后OMT灌胃给药, 连续灌胃给药10天后处理取材, 摘眼球取血, 供测定血清生化指标。肝组织保存在锡箔纸内, 液氮速冻, 转移到-80 ℃冰箱保存, 备用。③ CPA + OMT联合给药实验:小鼠按bliss法随机分为3组, 每组12只, 分别为control、CPA (200 mg·kg-1)、CPA (200 mg·kg-1) + OMT (100 mg·kg-1)组。禁食6 h后开始给药, OMT连续灌胃给药10天, CPA隔天腹腔注射(intraperitoneal injection, ip)给药, CPA给药时间为上次OMT灌胃后16 h。末次CPA给药结束后4 h处理取材, 摘眼球取血, 供测定血清生化指标。肝组织保存在锡箔纸内, 液氮速冻, 转移到-80 ℃冰箱保存, 备用。
血清ALT/AST活力检测 血液于4 ℃静置2 h后, 常温离心, 860 ×g离心15 min, 取上层血清于新eppendorf (EP)管中, 按试剂盒步骤操作检测血清ALT和AST活性。其余血清液氮速冻后置于-80 ℃冰箱保存。
RNA提取和Real-time PCR实验 剪取一定量肝组织置于1.5 mL EP管中, 加适量Trizol匀浆溶解后置冰上, 加入氯仿振荡, 静置后于4℃, 12 000 ×g离心15 min, 取上清转移至新EP管, 加入异丙醇摇匀静置10 min, 于4 ℃, 12 000 ×g离心10 min, 得到RNA沉淀, 抽弃上清, 加入预冷75%乙醇, 于4 ℃, 7 500 ×g离心5 min, 弃乙醇, 沉淀置超净工作台上晾干, 加入适量DEPC (diethyl pyrocarbonate)水充分溶解, 即得到RNA溶液, -80 ℃保存备用。将RNA用PrimerScriptTM Mix试剂盒逆转录为cDNA, 按照实时荧光定量试剂盒说明书方法进行real-time PCR扩增实验。目标基因的相对表达量用β-actin标准化, 采用2-△△Ct法。所用引物序列见表 1。
| Table 1 List of primers for quantitative polymerase chain reaction (qPCR). FP: Forward primer; RP: Reverse primer |
Western blot实验 剪取一定量肝组织置于1.5 mL EP管, 每管加肝组织质量10倍的预冷裂解液[含1% PMSF (phenylmethylsulfonyl fluoride)和1‰ cooktail (leupeptin、pepstatin和aprotinin)蛋白酶抑制剂混合液]。使用高通量组织研磨机在60 Hz, 60 s条件下研磨匀浆2次。冰浴超声制备匀浆液后, 冰上静置10 min充分裂解。4 ℃, 10 000 ×g离心10 min, 分取上清液至新EP管, 即得到组织总蛋白。采用BCA试剂盒测定蛋白浓度, 并用loading buffer调齐蛋白浓度和体积, 经99 ℃, 10 min加热变性处理制得总蛋白样本, 储存于-20 ℃。将蛋白样本进行SDS-PAGE电泳并转至PVDF膜。用5% BSA封闭后加入CYP2B10和β-actin一抗, 4 ℃孵育过夜。TBST洗去一抗, 二抗室温孵育1 h后, TBST清洗, 并置于全自动成像仪中显影。以β-actin为参比, 条带用Alpha View SA软件处理并定量。
肝组织微粒体制备 剪取300 mg肝组织置于10 mL EP管中, 加3 mL 0.25 mol·L-1蔗糖溶液, 电动匀浆。匀浆液4 ℃, 10 000 ×g离心20 min, 取上清转移至新EP管。将等量上清转移至超高速离心机专用离心管, 封口后于4℃, 105 000 ×g离心60 min, 弃上清, 沉淀用2 mL 0.25 mol·L-1蔗糖溶液重悬, 并转移至新的专用离心管, 封口后于4 ℃, 105 000 ×g离心60 min, 弃上清。沉淀用0.5 mL 0.25 mol·L-1蔗糖溶液重悬获得微粒体, 以BCA法定量微粒体蛋白浓度, 并调定终浓度为1 μg·μL-1备用。
CYP2B10酶活力检测实验 安非他酮(bupropion, 底物)能够特异地被CYP2B10 (人CYP2B6)代谢。通过测定底物的减少量来考察CYP2B10酶的活性。配制孵育体系如下:小鼠肝微粒体(mice liver microsome, MLM) (1 mg·mL-1)、G-6-P (glucose-6-phosphate, 10 mmol·L-1)、G-6-P-H (glucose-6-phosphate dehydrogenase, 1 unit·mL-1)、NADPH (nicotinamide adenine dinucleotide phosphate hydrogen, 1 mmol·L-1)、MgCl2 (4 mmol·L-1)、Tris-HCl buffer (20 mmol·L-1, pH 7.4)、安非他酮(10 μmol·L-1), 体系总体积为200 μL。体系甲醇含量不超过1%, 反应温度37 ℃, 孵育时间为30 min。反应结束后, 加入500 μL含柳胺酚(osalmide, 内标)的冰乙腈终止反应, 震荡1 min, 4 ℃, 15 000 ×g离心10 min。取550 μL各探针反应液, 混合后于37 ℃氮吹, 加入90 μL初始流动相复溶, 震荡1 min, 于4 ℃, 15 000 ×g离心10 min后, 取上清液至液相小瓶中。应用三重四级杆质谱仪(美国Waters公司)进行多反应监测正离子模式质谱扫描(multiple reaction monitoring, MRM)。离子源参数如下:毛细管电压(capillary voltage), 3.00 kV; 离子源温度(source temperature), 120 ℃; 萃取电压(extractor), 1.0 V; 滤镜电压(RF lens), 0.4 V; 脱溶剂温度(desolvation temperature), 350 ℃; 脱溶剂气流速(desolvation gas flow), 550 L·Hr-1; 锥孔气流速(cone gas flow), 50 L·Hr-1。
统计分析 实验数据用x± standard error (SE)表示, 用统计软件SPSS 16.0中的单因素方差分析进行处理, 组间两两比较采用LSD-t检验, 以P < 0.05表示差异具有显著性。
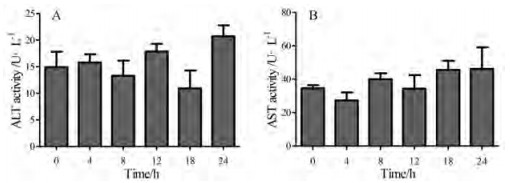
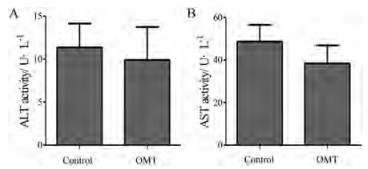
结果 1 OMT对小鼠血清ALT和AST活力的影响OMT (100 mg·kg-1)单独单次给药或单独给药小鼠10天后的血清ALT和AST活力检测显示, 给药后不同时间点的小鼠血清中转氨酶活力均与给药零时刻相比无显著变化(图 1、2)。
|
Figure 1 Effects of OMT on serum ALT and AST activity in mice. A: Serum ALT activity; B: Serum AST activity. n = 3-5, x ± SE. OMT: Oxymatrine; ALT: Alanine aminotransferase; AST: Aspartate aminotransferase; SE: Standard error |
|
Figure 2 Effects of OMT on serum ALT and AST activity at 10 days after mice were given with OMT. A: Serum ALT activity; B: Serum AST activity. n = 3, x ± SE |
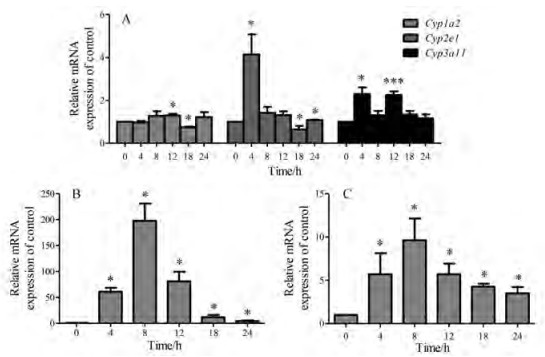
OMT (100 mg·kg-1)灌胃给药小鼠, 于4、8、12、18和24 h后处理取材, 提取肝组织RNA进行常见Ⅰ相药物代谢酶基因的qPCR分析。结果显示OMT在给药后不同时间点均可显著升高小鼠肝脏Cyp2b10和Cyp2c55的mRNA水平, 并且Cyp2b10升高的水平显著高于Cyp2c55, 而对Cyp1a2、Cyp2e1和Cyp3a11的mRNA水平没有明显的提高(图 3)。
|
Figure 3 Effects of OMT on hepatic mRNA expression of some CYP450 genes in mice. A: Hepatic mRNA expression of Cyp1a2, Cyp2e1, and Cyp3a11; B: Hepatic mRNA expression of Cyp2b10; C: Hepatic mRNA expression of Cyp2c55. n = 3-4, x ± SE. *P < 0.05, ***P < 0.001 vs control group. CYP450: Cytochrome P450 |
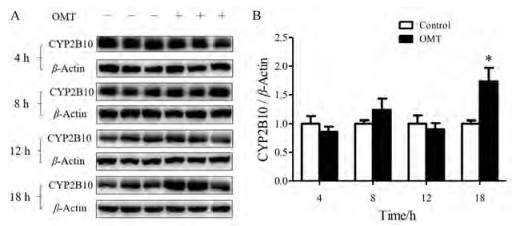
OMT (100 mg·kg-1)灌胃给药小鼠, 于4、8、12和18 h后处理取材, 提取肝组织蛋白, 以Western blot法检测CYP2B10的蛋白表达, 结果显示OMT给药后18 h小鼠肝脏CYP2B10的蛋白表达显著增加, 4~12 h无显著变化(图 4)。
|
Figure 4 Effects of OMT on hepatic CYP2B10 protein expression in mice. A: Hepatic CYP2B10 protein expression; B: The quantitative densitometric analysis of CYP2B10 protein. n = 3-4, x ± SE. *P < 0.05 vs control group |
OMT (100 mg·kg-1)灌胃给药小鼠, 18 h后处理取材, 制备肝微粒体, 质谱检测CYP2B10的酶活性。底物安非他酮能够特异地被CYP2B10酶代谢, 通过测定安非他酮的减少量来反应CYP2B10酶的活性。根据底物安非他酮减少量的差异来表征CYP2B10酶活性的差异。数据显示, 与control组相比, OMT组安非他酮/内标峰面积比值明显下降(图 5), 提示OMT给药18 h后, 小鼠肝脏CYP2B10酶活性增加。
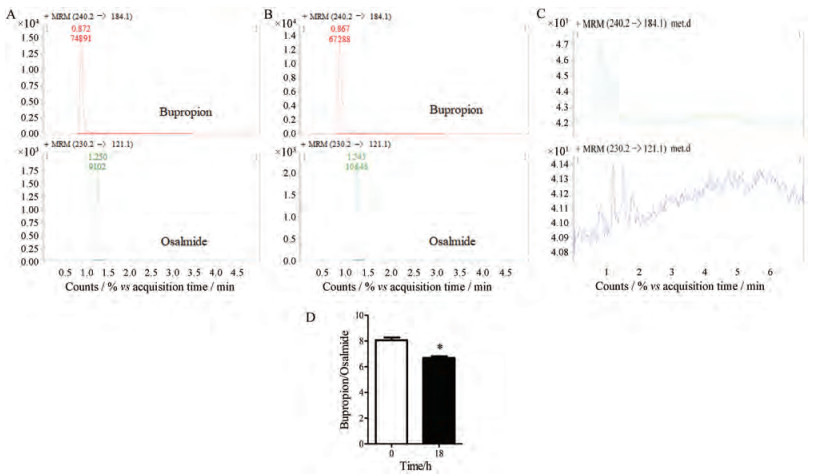
|
Figure 5 Effects of OMT on hepatic CYP2B10 enzymatic activity in mice. A: Mass spectrum of bupropion catalyzed by liver microsomes from control mice; B: Mass spectrum of bupropion catalyzed by liver microsomes from OMT-treated mice; C: Mass spectrum of solvents; D: Peak area ratio of substrate/internal standard. The decrease of substrate reflects CYP2B10 enzymatic activity. n = 3, x ± SE. *P < 0.05 vs control group |
OMT (100 mg·kg-1)与CPA (200 mg·kg-1)联合给药, OMT每日定时灌胃给药10天, CPA隔天腹腔注射给药, 给药时间为上一次OMT灌胃后16 h。
5.1 对小鼠死亡率的影响给药过程中跟踪记录小鼠死亡情况。结果发现, 单用CPA会导致小鼠死亡, 死亡率为33.3%。与OMT联合给药提高了小鼠死亡率, 达到58.3%, 提示OMT与CPA联合给药增加了CPA的毒性(表 2)。
| Table 2 Mortality of mice administered with OMT and CPA. CPA: Cyclophosphamide |
分析小鼠血清ALT和AST活力结果发现, 联合给药组转氨酶活性平均水平有所升高, 但由于组间差异大, 无统计学差异。分析所有小鼠ALT、AST水平发现, CPA组和联合给药组中, 死亡小鼠的血清转氨酶水平普遍更高。观察小鼠肝脏病理切片H & E染色结果发现, 联合给药组小鼠肝脏病理损伤较CPA组明显加重, 联合给药加剧了中央静脉内皮脱落、肝实质细胞坏死、以及炎性细胞浸润等病变(图 6)。
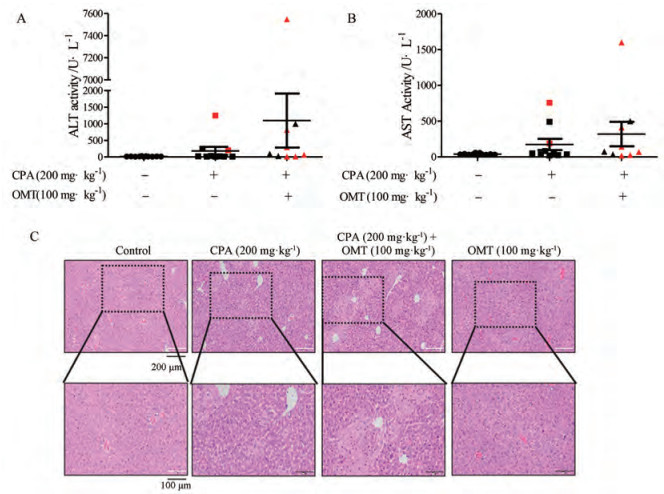
|
Figure 6 Serum ALT and AST activity, and liver pathological observation. A: Serum ALT activity; B: Serum AST activity. n = 9-12, x ± SE. Red is for dead mice, black is for undead mice. C: Liver H & E staining. Typical images were chosen from each experimental group. n = 3. Scale length of the upper images: 200 μm; Scale length of the partial enlarged images: 100 μm. H & E: Hematoxylin-eosin |
分析小鼠肝组织的Cyp2b10 mRNA表达结果发现, 联合给药组肝组织Cyp2b10的mRNA表达水平均明显升高, 但与ALT和AST相似, 同样由于组间差异大, 并无统计学差异。分析所有小鼠的Cyp2b10 mRNA表达水平发现, CPA组和联合给药组中, 死亡小鼠肝组织Cyp2b10 mRNA表达水平普遍更高(图 7)。
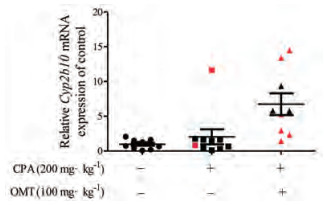
|
Figure 7 Effects of combined administration of OMT and CPA on hepatic Cyp2b10 mRNA expression in mice. n = 9-12, x ± SE. Red is for dead mice, black is for undead mice |
以上实验发现联合给药组转氨酶活性水平明显升高, 但由于组间差异大, 并无统计学差异。分析所有动物发现, CPA组和联合给药组中, 死亡小鼠的血清转氨酶ALT、AST水平普遍更高。对这一现象进行相关性分析发现, 小鼠的死亡情况与血清转氨酶ALT、AST活力具有一定相关性。联合给药实验中分析小鼠肝组织Cyp2b10 mRNA表达水平, 发现联合给药组小鼠肝组织中Cyp2b10的mRNA水平显著升高, 而死亡小鼠肝组织Cyp2b10的mRNA水平普遍更高。对这一现象进行Spearman相关性分析发现, 小鼠的死亡情况与小鼠肝组织Cyp2b10 mRNA水平的升高两者之间具有显著相关性, 呈中度正相关(图 8)。
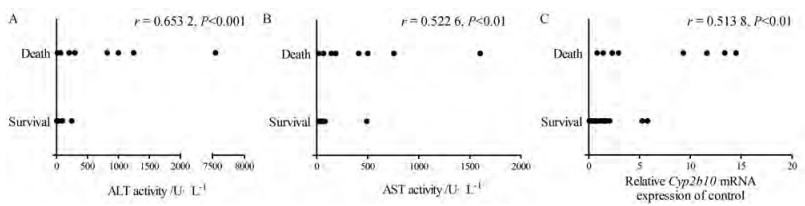
|
Figure 8 Correlation between the death of mice and serum ALT/AST activity or hepatic Cyp2b10 mRNA expression. A: Correlation between the death of mice with serum ALT activity, r = 0.653 2, P < 0.001; B: Correlation between the death of mice with serum AST activity, r = 0.522 6, P < 0.01; C: Correlation between the death of mice with hepatic Cyp2b10 mRNA expression, r = 0.513 8, P < 0.01. n = 30, x ± SE |
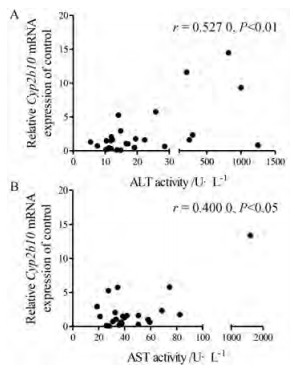
以上结果表明小鼠死亡情况分别与血清ALT、AST和肝组织Cyp2b10 mRNA表达都具有一定的相关性。进一步分析发现, 小鼠血清转氨酶ALT、AST与肝组织Cyp2b10 mRNA水平两者也呈正相关(图 9)。
|
Figure 9 Correlation between serum ALT/AST activity and hepatic Cyp2b10 mRNA expression. A: Correlation between serum ALT activity with hepatic Cyp2b10 mRNA expression, r= 0.527 0, P < 0.01; B: Correlation between serum AST activity with hepatic Cyp2b10 mRNA expression. r = 0.400 0, P < 0.05. n= 30, x ± SE |
CPA是一线化疗药, 对多种肿瘤具有良好治疗作用, 但是其毒副作用在临床应用时是一个不容忽视的问题。肝脏是CPA代谢活化的场所, 同时也是CPA毒性的靶器官。CPA进入肝脏后, 首先形成中间代谢产物4-OH CPA (4-hydroxycyclophosphamide), 可转化成为其互变异构体醛磷酰胺(aldophosphamide), 醛磷酰胺自发发生β消除, 生成PM以及Acr, 从而发挥药效或毒性[5]。4碳位羟基化是CPA活化的限速步骤[1, 19], 这个代谢过程主要由细胞色素CYP2B6完成, 部分由CYP3A4和CYP2C9完成[9, 10]。除环磷酰胺以外, 另一种乳腺癌治疗药物他莫昔芬, 也是由CYP2B6代谢活化。CYP2B6可将他莫昔芬代谢成4-羟基他莫昔芬、α-羟基他莫昔芬以及α, 4-二羟基他莫昔芬等产物[20]。以上产物可与DNA生成加合物, 从而发挥抗癌药效与毒性。由此可见, CYP2B6是人体内非常重要的药物代谢酶。人肝脏中的CYP2B6, 即小鼠的CYP2B10[11, 12]。有研究发现, 小鼠敲除生物节律钟(circadian locomotor output cycles kaput, Clock)基因后, 其CYP2B10表达显著上升; 对该基因敲除小鼠给药CPA, 能够造成相对野生型小鼠更严重的肝损伤[21]。上述结果提示, CYP2B10表达上升, 可通过增强CPA代谢而加剧其肝毒性。
OMT是具有抗肿瘤活性的中药单体, 对化疗引起的白细胞减少症也有一定缓解作用。本研究发现OMT单独给药小鼠可显著提高肝脏中CYP2B10的mRNA和蛋白表达, 并提高其酶活性, 提示OMT与CPA联合给药有可能会通过增强其代谢而加剧其肝毒性。OMT与CPA联合给药小鼠与CPA单独给药小鼠相比, 小鼠死亡率明显上升, 死亡小鼠较存活小鼠的肝损伤程度更为严重, 死亡小鼠肝脏中Cyp2b10 mRNA水平也明显高于存活小鼠。小鼠死亡率与肝损伤程度有良好的相关性(ALT, r = 0.653 2, P < 0.001; AST, r = 0.522 6, P < 0.01), 其中P < 0.05说明两者具有相关性, 0.40 < r < 0.69[22]说明两者呈中度正相关。Cyp2b10 mRNA表达水平分别与小鼠死亡率之间(r = 0.513 8, P < 0.01)和肝损伤程度之间(ALT, r = 0.527 0, P < 0.01; AST, r = 0.400 0, P < 0.05)均有良好相关性, 呈中度正相关。以上结果说明, OMT可通过促进CYP2B10表达, 增强CPA代谢, 加剧其肝毒性。
中药活性单体与化疗药联合用药以达到减毒增效的目的一直是肿瘤领域研究的热点[23-25]。然而, 中药单体具有多种药理活性, 通过药物-药物相互作用也可能产生毒性[26], 应当引起重视。本研究将有助于提醒在临床上的OMT与CPA联合使用问题, 注意潜在的肝脏毒副作用。
| [1] |
de Jonge ME, Huitema AD, Rodenhuis S, et al. Clinical pharmacokinetics of cyclophosphamide[J]. Clin Pharmacokinet, 2005, 44: 1135-1164. DOI:10.2165/00003088-200544110-00003 |
| [2] |
Fraiser LH, Kanekal S, Kehrer JP. Cyclophosphamide toxicity. Characterising and avoiding the problem[J]. Drugs, 1991, 42: 781-795. DOI:10.2165/00003495-199142050-00005 |
| [3] |
Locatelli M, Colleoni M, Noberasco C, et al. Hepatic toxicity from cyclophosphamide, methotrexate, fluorouracil (CMF regimen)[J]. Ann Oncol, 1999, 10: 1394-1395. DOI:10.1023/A:1008356726147 |
| [4] |
Schwartz PS, Waxman DJ. Cyclophosphamide induces caspase 9-dependent apoptosis in 9L tumor cells[J]. Mol Pharmacol, 2001, 60: 1268-1279. DOI:10.1124/mol.60.6.1268 |
| [5] |
Fenselau C, Kan MN, Rao SS, et al. Identification of aldophosphamide as a metabolite of cyclophosphamide in vitro and in vivo in humans[J]. Cancer Res, 1977, 37: 2538-2543. |
| [6] |
Tang MS, Wang HT, Hu Y, et al. Acrolein induced DNA damage, mutagenicity and effect on DNA repair[J]. Mol Nutr Food Res, 2011, 55: 1291-1300. DOI:10.1002/mnfr.201100148 |
| [7] |
Loeber R, Michaelson E, Fang Q, et al. Cross-linking of the DNA repair protein Omicron6-alkylguanine DNA alkyltransferase to DNA in the presence of antitumor nitrogen mustards[J]. Chem Res Toxicol, 2008, 21: 787-795. DOI:10.1021/tx7004508 |
| [8] |
Huitema AD, Spaander M, Mathĵt RA, et al. Relationship between exposure and toxicity in high-dose chemotherapy with cyclophosphamide, thiotepa and carboplatin[J]. Ann Oncol, 2002, 13: 374-384. DOI:10.1093/annonc/mdf052 |
| [9] |
Huang Z, Roy P, Waxman DJ. Role of human liver microsomal CYP3A4 and CYP2B6 in catalyzing N-dechloroethylation of cyclophosphamide and ifosfamide[J]. Biochem Pharmacol, 2000, 59: 961-972. DOI:10.1016/S0006-2952(99)00410-4 |
| [10] |
Roy P, Yu LJ, Crespi CL, et al. Development of a substrate-activity based approach to identify the major human liver P-450 catalysts of cyclophosphamide and ifosfamide activation based on cDNA-expressed activities and liver microsomal P-450 profiles[J]. Drug Metab Dispos, 1999, 27: 655-666. |
| [11] |
Hrycay EG, Bandiera SM. Expression, function and regulation of mouse cytochrome P450 enzymes:comparison with human P450 enzymes[J]. Curr Drug Metab, 2009, 10: 1151-1183. DOI:10.2174/138920009790820138 |
| [12] |
Kőhalmy K, Tamási V, Kóbori L, et al. Dehydroepiandrosterone induces human CYP2B6 through the constitutive androstane receptor[J]. Drug Metab Dispos, 2007, 35: 1495-1501. DOI:10.1124/dmd.107.016303 |
| [13] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Volume I. BeiJing: The Medicine Science and Technology Press of China, 2015: 124-125.
|
| [14] |
Wang JM, Cui Y. Research progress in chemical components, pharmacological effectiveness and toxicity of radix et rhizoma sophorae tonkinensis[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2011, 17: 229-232. |
| [15] |
Zhu XW, Bao JR, Bu R. Progress on the anti-tumor activities of matrine and oxymatrine[J]. Chem Reagents (化学试剂), 2010, 32: 32-36. |
| [16] |
Ho JW, Ngan Hon PL, Chim WO. Effects of oxymatrine from Ku Shen on cancer cells[J]. Anticancer Agents Med Chem, 2009, 9: 823-826. DOI:10.2174/187152009789124673 |
| [17] |
Liang B, Li SF, Wang XY, et al. Synergism and attenuation effects of oxymatrine on cyclophosphamide[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2012, 27: 1901-1904. |
| [18] |
Wang R, Jiang XJ, Zheng J, et al. Oxymatrine promotes the antitumor activity of cyclophosphamide against Lewis lung carcinoma in mice[J]. Acad J Second Mil Med Univ (第二军医大学学报), 2008, 29: 399-403. |
| [19] |
Ekhart C, Gebretensae A, Rosing H, et al. Simultaneous quantification of cyclophosphamide and its active metabolite 4-hydroxycyclophosphamide in human plasma by high-performance liquid chromatography coupled with electrospray ionization tandem mass spectrometry (LC-MS/MS)[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 854: 345-349. DOI:10.1016/j.jchromb.2007.04.024 |
| [20] |
Notley LM, Crewe KH, Taylor PJ, et al. Characterization of the human cytochrome P450 forms involved in metabolism of tamoxifen to its alpha-hydroxy and alpha, 4-dihydroxy derivatives[J]. Chem Res Toxicol, 2005, 18: 1611-1618. DOI:10.1021/tx050140s |
| [21] |
Zhao M, Zhao H, Deng J, et al. Role of the CLOCK protein in liver detoxification[J]. Br J Pharmacol, 2019, 176: 4639-4652. DOI:10.1111/bph.14828 |
| [22] |
Schober P, Boer C, Schwarte LA, et al. Correlation coefficients:appropriate use and interpretation[J]. Anesth Analg, 2018, 126: 1763-1768. DOI:10.1213/ANE.0000000000002864 |
| [23] |
Ma WZ, Guo Q, Li Y, et al. Co-assembly of doxorubicin and curcumin targeted micelles for synergistic delivery and improving anti-tumor efficacy[J]. Eur J Pharm Biopharm, 2017, 112: 209-223. DOI:10.1016/j.ejpb.2016.11.033 |
| [24] |
Sai K, Li WY, Chen YS, et al. Triptolide synergistically enhances temozolomide-induced apoptosis and potentiates inhibition of NF-κB signaling in glioma initiating cells[J]. Am J Chin Med, 2014, 42: 485-503. DOI:10.1142/S0192415X14500323 |
| [25] |
Wang CW, Chen CL, Wang CK, et al. Cisplatin-, doxorubicin-, and docetaxel-induced cell death promoted by the aqueous extract of Solanum nigrum in human ovarian carcinoma cells[J]. Integr Cancer Ther, 2015, 14: 546-555. DOI:10.1177/1534735415588826 |
| [26] |
Xu S, Liu J, Shi J, et al. 2, 3, 4', 5-tetrahydroxystilbene-2-O-β-D-glucoside exacerbates acetaminophen-induced hepatotoxicity by inducing hepatic expression of CYP2E1, CYP3A4 and CYP1A2[J]. Sci Rep, 2017, 7: 16511. DOI:10.1038/s41598-017-16688-5 |
 2020, Vol. 55
2020, Vol. 55


