胰高血糖素样肽-1 (glucagon like-peptide-1, GLP-1)是肠道L细胞分泌的一种降糖激素, 通过结合并激活其受体发挥抗糖尿病作用, 包括葡萄糖依赖性地促进胰岛素的生物合成和分泌、促进胰岛β细胞增殖和化生、抑制β细胞凋亡等[1]。GLP-1的发现开启了糖尿病治疗的新时代。注射用重组艾塞那肽-人血清白蛋白融合蛋白(酵母菌), 简称E2HSA (injectable recombinant protein of exendin-4 and human serum albumin), 是我国自主研发的一种超长效GLP-1受体激动剂, 用于治疗2型糖尿病(type 2 diabetes mellitus, T2DM), 目前处于临床研究阶段。前期研究表明, E2HSA可以结合并激活GLP-1受体, 并且多种T2DM动物模型中的研究证明其具有显著的抗糖尿病作用[2-4]。
1型糖尿病(type 1 diabetes mellitus, T1DM)是一种由胰岛β细胞严重破坏导致胰岛素绝对缺乏而诱发高血糖的疾病, 目前无法治愈, 需要终身使用胰岛素治疗。由胰岛β细胞损伤引起的胰岛素缺失是T1DM的发病基础, 而大量研究表明GLP-1可以促进β细胞增殖和化生, 抑制其发生凋亡[4]。因此, GLP-1类药物可能有益于T1DM患者的血糖控制。本文将从细胞和整体动物水平研究E2HSA对小鼠胰岛β细胞的保护作用, 并初步探索其作用机制, 从而为拓展其临床应用提供实验依据。
材料与方法药物、试剂及实验仪器 注射用重组艾塞那肽-人血清白蛋白融合蛋白(酵母菌, E2HSA, 批号20120706, 浙江华阳药业有限公司), 4 ℃保存; 艾塞那肽注射液(百泌达, exendin-4, 批号A935047, 美国Baxter Pharmaceutical Solutions LLC公司), 4 ℃保存; DMEM/F12培养基(美国Hyclone公司); CCK-8 (cell counting kit-8)测定试剂盒(上海同仁化学); Bromodeoxyuridine (BrdU)和BrdU抗体(武汉博士德生物技术有限公司); 四氧嘧啶、水溶性胆固醇和碘化丙啶(propidium iodide, PI) (Sigma公司); RIPA (radio-immunoprecipitation assay)蛋白裂解液、蛋白酶抑制剂、复合磷酸酶抑制剂、BCA (bicinchoninic acid)蛋白定量试剂盒、5×上样缓冲液(北京普利莱基因生物技术有限公司); 兔PKB (protein kinase B)抗体(美国SAB公司); 兔PDX-1 (pancreatic duodenal homeobox-1)抗体(美国Santa Cruz公司); ECL (electro-chemi-luminescence)发光液(北京康为世纪科技有限公司); 小鼠β-actin抗体、辣根过氧化物酶标记的山羊抗兔二抗、辣根过氧化物酶标记的山羊抗小鼠二抗、FITC (fluorescein isothiocyanate)标记的山羊抗小鼠二抗(北京中杉金桥生物技术有限公司); 小鼠胰岛素ELISA (enzyme-linked immune sorbent assay)试剂盒(美国ALPCO公司); U-Quant酶标仪(美国BIO-TEK公司); 流式细胞分析仪(美国Beckman Coulter公司); 倒置荧光显微镜(德国Leica公司); Western blot电泳仪和转膜仪(美国Biotek公司)。
动物与细胞株 正常ICR小鼠, 雄性, 20~22 g, 购自北京维通利华实验动物技术有限公司, 许可证编号为SCXK (京) 2002-0003, 饲养于中国医学科学院药物研究所SPF级(屏障设施)动物房。小鼠胰岛素瘤细胞株NIT-1购自美国ATCC细胞库。动物实验操作和福利均遵循中国医学科学院、北京协和医学院药物研究所实验动物伦理与动物福利委员会的规定。
E2HSA对NIT-1细胞活力的影响 将处于对数生长期的NIT-1细胞消化并接种于96孔板(1.5×104个/孔), 同时加入E2HSA, 使其终浓度分别为0.1、1、10、100和1 000 nmol·L-1。设置空白对照孔和阳性对照孔(exendin-4, 100 nmol·L-1), n = 6。37 ℃、5.0% CO2条件下培养24 h, 加入CCK-8反应液。继续培养4 h, 测定450 nm处吸收度, 以650 nm处吸收度进行校正。
E2HSA对NIT-1细胞增殖的影响 将NIT-1细胞接种至24孔板(8×104个/孔), 同时加入BrdU (25 μmol·L-1)。37 ℃、5.0% CO2条件下培养0.5 h, 加入E2HSA (100 nmol·L-1), 设置空白对照孔和阳性对照孔(exendin-4, 100 nmol·L-1)。继续培养36 h, 接着弃去培养基, 并加入磷酸盐缓冲液(phosphate buffered saline, PBS)清洗3次(5 min/次), 加入4%多聚甲醛, 室温固定50 min。按照以下步骤进行免疫荧光标记:加入0.5% TritonX-100/PBS, 室温孵育10 min, 清洗后加入2 mol·L-1 HCl, 室温作用40 min, 清洗后加入3%正常山羊血清工作液, 37 ℃孵育30 min, 加入BrdU单克隆抗体(1:50), 37 ℃孵育30 min, 加入含0.1% Tween-20的PBS缓冲液, 清洗后加入FITC标记的山羊抗小鼠二抗(1:50), 37 ℃避光孵育30 min, 加入去离子水清洗2次(5 min/次), 封片, 倒置荧光显微镜下观察并拍照。
E2HSA对水溶性胆固醇诱导NIT-1细胞损伤后细胞活力的影响 将NIT-1细胞接种至96孔板(1.5×104个/孔), 37℃、5.0% CO2条件下培养24 h, 然后加入水溶性胆固醇(0.25 mmol·L-1), 1 h后再加入E2HSA, 使其终浓度分别为0.1、1、10、100和1 000 nmol·L-1, 设置未加入水溶性胆固醇的正常对照孔、加入水溶性胆固醇的模型对照孔和阳性对照孔(exendin-4, 100 nmol·L-1), n = 6。继续培养12 h, 加入CCK-8反应液, 培养4 h后测定450 nm处吸收度, 以650 nm处吸收度进行校正。
E2HSA对水溶性胆固醇诱导NIT-1细胞损伤后细胞凋亡的影响 将NIT-1细胞接种至6孔板(3.6×105个/孔), 37℃、5.0% CO2条件下培养24 h, 然后加入水溶性胆固醇(0.125 mmol·L-1), 1 h后再加入E2HSA (500 nmol·L-1), 设置正常对照孔、模型对照组孔和阳性对照孔(exendin-4, 500 nmol·L-1), n = 3。继续培养15 h, 收集细胞并加入PBS缓冲液清洗, 接着缓慢滴加冷无水乙醇, 混匀, 4 ℃固定细胞至少2 h。1 000 r·min-1离心8 min, 弃去固定液, 清洗细胞2次, 加入PI染液, 并于37 ℃水浴放置30 min, 灭活RNA。用300目滤网过滤后进行流式细胞仪检测。
蛋白表达检测 将NIT-1细胞接种至新培养瓶(1.5×106个/孔), 37 ℃、5.0% CO2条件下培养24 h, 然后更换含有0.125 mmol·L-1水溶性胆固醇的培养基(设置正常培养基对照孔), 1 h后再加入E2HSA (500 nmol·L-1), 设置模型对照孔和阳性对照孔(exendin-4, 500 nmol·L-1), n = 4~5。继续培养15 h, 收集细胞, 加入RIPA蛋白裂解液(预先加入蛋白酶抑制剂和复合磷酸酶抑制剂), 提取胞内总蛋白。采用BCA法进行蛋白定量后, 加入5×上样缓冲液, 于沸水浴中煮沸10 min, 使蛋白变性。采用Western blot方法考察PDX-1和PKB的蛋白表达。
四氧嘧啶小鼠模型的形成及药物处理 正常ICR小鼠尾静脉注射四氧嘧啶(70 mg·kg-1), 6天后首先禁食2.5 h (自由饮水), 接着尾尖采血并记录体重, 测定空腹血糖。然后以体重和空腹血糖将小鼠分为5组:模型对照组、E2HSA (2.5、5和10 mg·kg-1)组和exendin-4 (2 μg·kg-1)组, n = 10。E2HSA各剂量组每天皮下注射给药1次, exendin-4组每天皮下注射给药2次, 模型对照组每天皮下注射给予相同体积的生理盐水。
E2HSA长期给药对四氧嘧啶小鼠血糖的影响 分别于给药第3、10、16、23、30和38天, 尾尖采血, 测定各组小鼠非禁食血糖。然后禁食2 h (自由饮水), 接着皮下注射给药或生理盐水, 0.5 h后再次尾尖采血, 测定空腹血糖。
E2HSA长期给药对四氧嘧啶小鼠血清和胰岛内胰岛素含量的影响 给药41天后处死小鼠, 分离血清, 测定血清胰岛素水平; 分离胰腺组织, 固定于Bouin氏液, 经石蜡包埋和切片后, 按照以下步骤进行免疫组织化学染色:组织切片于60 ℃恒温箱中烘烤2 h, 二甲苯中脱蜡, 100%、95%、80%和70%乙醇、蒸馏水和PBS缓冲液中复水, 滴加3%过氧化氢溶液, 避光孵育5 min, PBS溶液洗片, 置于Tris-EDTA抗原修复液(pH 9.0)中, 采用热煮沸法进行抗原修复, 冷却, 洗片后滴加羊血清, 室温孵育25 min, 滴加小鼠胰岛素抗体(1:50), 4 ℃孵育过夜, 取出切片平衡至室温, 洗片后滴加生物素标记的山羊抗小鼠二抗, 37 ℃孵育25 min, 洗片后滴加辣根过氧化物酶标记的链酶卵白素, 37 ℃孵育25 min, 洗片后滴加显色剂(diaminobezidin, DAB), 室温避光孵育2 min, 蒸馏水洗片, 滴加Harris苏木素, 染色10 s, 蒸馏水洗片后于盐酸乙醇中分化15 s, 反蓝10 min, 80%、95%、95%、100%和100%乙醇脱水, 二甲苯透明, 中性树胶封片, 60 ℃烘烤10 min并冷却, 于倒置显微镜下观察并拍照。
数据处理 实验数据以x±s表示, 组间差异采用t检验, P < 0.05表示差异具有统计学意义。采用IPP6.0软件分析胰腺内胰岛素免疫组化染色阳性区域的面积, 采用凝胶分析软件分析Western blot蛋白条带的灰度值。
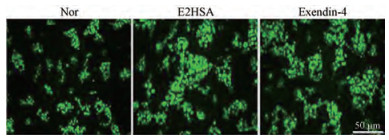
结果 1 E2HSA对NIT-1细胞增殖的影响与空白对照组(negative control, Nor)相比, E2HSA在0.1~1 000 nmol·L-1浓度范围内与NIT-1细胞共同孵育均能够明显增加细胞活力, 并具有一定的量效关系; exendin-4在100 nmol·L-1下也可显著增加NIT-1细胞的活力(表 1)。与Nor组相比, E2HSA和exendin-4在100 nmol·L-1均能够增加NIT-1细胞内绿色荧光蛋白的表达, 表现为绿色荧光的亮度和聚集程度增加(图 1)。结果表明E2HSA具有促进胰岛β细胞增殖的作用。
| Table 1 Effect of the injectable recombinant protein of exendin-4 and human serum albumin (E2HSA) on the viability of NIT-1 cells. n = 6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs negative control (Nor) |
|
Figure 1 Effects of E2HSA on the amount of bromodeoxyuridine (BrdU) incorporated in NIT-1 cells. BrdU was incorporated in the cells and determined with BrdU primary antibody and fluorescein isothiocyanate (FITC)-labeled second antibody. The photos were taken with 100 × magnification and the cells of the negative control (Nor) group were treated with equal volume of phosphate buffered saline (PBS) |
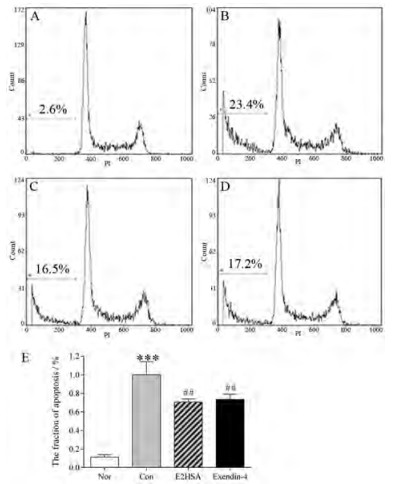
与Nor组相比, 模型对照组(control, Con)细胞的活力明显降低(P < 0.001), 表明水溶性胆固醇明显诱导NIT-1细胞发生损伤。与Con组相比, E2HSA在1~1 000 nmol·L-1浓度可明显增加NIT-1细胞的活力(P < 0.05); exendin-4在100 nmol·L-1下也可显著增加NIT-1细胞的活力(表 2)。此外, 与Nor组相比, Con组细胞显著发生凋亡, 出现明显的亚二倍体凋亡峰, 凋亡发生率为23.4% (P < 0.001)。与Con组相比, E2HSA和exendin-4在500 nmol·L-1浓度下可在一定程度上抑制亚二倍体峰的产生, 减少细胞的凋亡发生率, 分别为16.5%和17.2% (P < 0.01, 图 2)。结果表明E2HSA具有抑制胰岛β细胞凋亡的作用。
| Table 2 Effect of E2HSA on the viability of NIT-1 cells injured by water soluble cholesterol. n = 6, x±s. ***P < 0.001 vs Nor; #P < 0.05, ##P < 0.01, ###P < 0.001 vs Con. Nor: Cells cultured in normal conditions; Con: Cells cultured in the presence of 0.125 mmol·L-1 cholesterol |
|
Figure 2 Effects of E2HSA on the apoptosis of NIT-1 cells induced by water soluble cholesterol (CHO). A: Cells cultured in normal conditions (Nor); B: Cells cultured in the presence of 0.125 mmol·L-1 water soluble CHO (Con); C: Cells cultured in the presence of 0.125 mmol·L-1 water soluble CHO and 500 nmol·L-1 E2HSA (E2HSA); D: Cells cultured in the presence of 0.125 mmol·L-1 water soluble CHO and 500 nmol·L-1 exendin-4 (Exendin-4); E: Analysis of the apoptosis fraction and the value of the Con group was defined as 100%. n= 3, x±s. ***P < 0.001 vs Nor, ##P < 0.01 vs Con. PI: Propidium iodide |
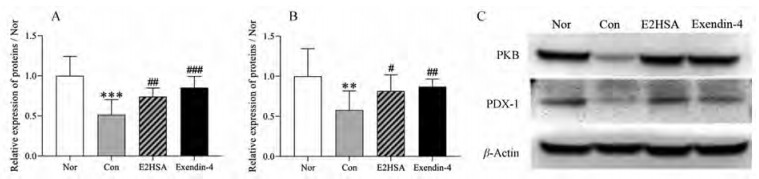
与Nor组相比, Con组细胞内PKB和PDX-1蛋白的表达均明显降低(PKB, P < 0.001; PDX-1, P < 0.01), 表明水溶性胆固醇诱导NIT-1细胞损伤与降低胞内PKB和PDX-1蛋白表达有关。与Con组相比, E2HSA在500 nmol·L-1浓度下可明显增加细胞内PKB和PDX-1蛋白的表达(PKB, P < 0.01; PDX-1, P < 0.05); exendin-4在500 nmol·L-1浓度下也可明显增加2种蛋白的表达(PKB, P < 0.001; PDX-1, P < 0.01) (图 3)。结果表明E2HSA抑制胰岛β细胞凋亡的作用与增加胞内PKB和PDX-1蛋白的表达有关。
|
Figure 3 Effect of E2HSA on the expression of protein kinase B (PKB) and pancreatic duodenal homeobox-1 (PDX-1) in NIT-1 cells injured by water soluble cholesterol. A: Relative expression of PKB; B: Relative expression of PDX-1; C: Representative blots of PKB, PDX-1, and β-actin. Nor: Cells cultured in normal conditions; Con: Cells cultured in the presence of 0.125 mmol·L-1 cholesterol; All data were normalized to β-actin and the value of the Nor group was defined as 1. n = 4-5, x±s. **P < 0.01, ***P < 0.001 vs Nor; #P < 0.05, ##P < 0.01, ###P < 0.001 vs Con |
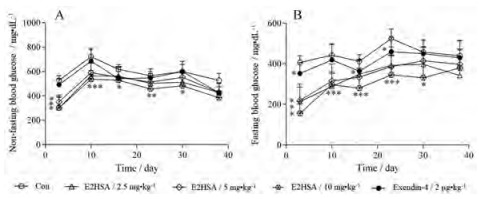
与Con组相比, 每天皮下注射E2HSA (2.5、5和10 mg·kg-1)可显著降低四氧嘧啶高血糖小鼠的非禁食血糖和空腹血糖, 但随着给药时间的延长, 该作用有所减弱, 表明E2HSA长期给药可控制T1DM小鼠的血糖波动, 其作用减弱可能与抗体生成有关[3]。每天皮下注射exendin-4 (2 μg·kg-1)也可降低四氧嘧啶高血糖小鼠的空腹血糖, 但作用强度随着给药时间延长亦有所减弱; exendin-4对四氧嘧啶小鼠的非禁食血糖无明显影响(图 4)。
|
Figure 4 Effects of repeated administration of E2HSA on the variation of blood glucose in alloxan-induced hyperglycemic mice. A: Non-fasting blood glucose; B: Fasting blood glucose. Con: The hyperglycemic mice treated with vehicle. n = 8-10, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs Con |
与Con组相比, 每天皮下注射E2HSA (2.5、5和10 mg·kg-1)可增加四氧嘧啶高血糖小鼠的血清胰岛素水平, 并具有良好的量效关系, 但组内个体差异较大; 每天皮下注射exendin-4 (2 μg·kg-1)也可增加小鼠血清胰岛素水平(图 5A)。此外, 与Con组相比, E2HSA (5和10 mg·kg-1)还可不同程度地增加四氧嘧啶高血糖小鼠胰岛内的胰岛素含量, 其中10 mg·kg-1剂量组的作用具有统计学意义, 但是组内个体差异较大(图 5B~E)。该结果表明E2HSA可能保护T1DM小鼠胰岛β细胞, 增加胰岛素的生物合成和分泌。
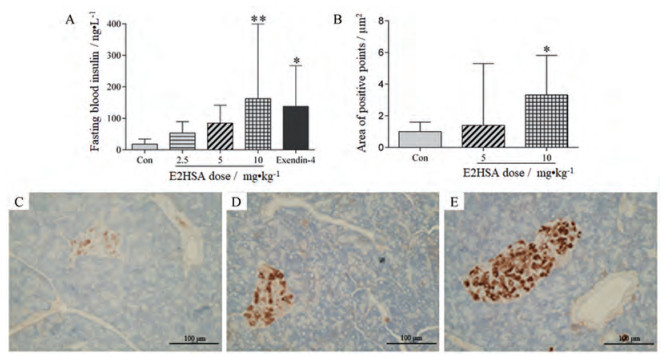
|
Figure 5 Effects of repeated administration of E2HSA on fasting blood insulin and insulin content in the islets of alloxan-induced hyperglycemic mice. A: Fasting blood insulin; B: Area of insulin-positive points in the islets. Con: The hyperglycemic mice treated with vehicle. C: Immunohistochemical staining of insulin in the control mice; D: Immunohistochemical staining of insulin in mice treated with E2HSA at 5 mg·kg-1; E: Immunohistochemical staining of insulin in mice treated with E2HSA at 10 mg·kg-1. Magnification, 200×. n = 8-10 for A and n = 8 for B-E. x±s. *P < 0.05, **P < 0.01 vs Con |
糖尿病是一种复杂的代谢性疾病, 发病率极高, 且呈现年轻化趋势。因此, 深入研究其发病机制和研发新型的抗糖尿病药物迫在眉睫[5]。上世纪初, Moore等[6]发现十二指肠存在能够刺激胰腺的化学物质, 随后La Barre等[7]将这种物质命名为肠降糖素“incretin”。随着研究的深入, 2种肠降糖素, 即葡萄糖依赖性促胰岛素分泌多肽(glucose-dependent insulinotropic polypeptide, GIP)和GLP-1被先后分离鉴定。有研究发现, T2DM患者体内GIP水平正常, 而GLP-1水平有所降低, 且给予外源性GLP-1能够明显诱导胰岛素分泌并调节糖代谢。不仅如此, 健康人进食后约2/3的胰岛素分泌都与肠降糖素有关, 而T2DM患者中肠降糖素介导的胰岛素分泌明显减少, 提示GLP-1可能作为糖尿病治疗的重要靶点。尽管如此, GLP-1进入血液循环后很快被二肽基肽酶IV和中性内肽酶24.11等降解, 半衰期仅有1~2 min, 无法直接应用于临床。因此, 对GLP-1进行结构修饰、合成可耐受酶解的GLP-1类似物[8]以及建立GLP-1受体激动剂筛选模型以筛选活性化合物[9], 成为研发抗糖尿病药物的重要途径。
目前国外已先后有艾塞那肽、利拉鲁肽、阿必鲁肽、度拉鲁肽和利西拉来等多种GLP-1类药物被批准上市, 并且度拉鲁肽和阿必鲁肽可每周皮下注射1次, 而国内在GLP-1类药物研发方面尚属空白。E2HSA是我国自主研发的一类长效GLP-1类药物, 由2分子艾塞那肽和1分子人血清白蛋白融合表达获得, 目前处于临床研究阶段, 每周皮下注射1次, 用于治疗T2DM。临床前研究发现, E2HSA可显著改善2型糖尿病小鼠的糖代谢, 同时增强β细胞对葡萄糖刺激的反应性, 并抑制β细胞凋亡[2]。这不仅表明E2HSA可通过维持β细胞数量而阻止T2DM的恶化, 更使人们推测它可能有助于T1DM患者的血糖控制。
T1DM是一种以自身免疫损伤介导胰岛β细胞损伤且造成胰岛素绝对缺乏为主要特征的糖尿病, 患者主要依赖外源性胰岛素维持血糖稳态。尽管许多整体动物水平的研究表明, GLP-1可促进β细胞增殖和化生, 抑制其发生凋亡, 但GLP-1类药物尚未被批准用于治疗T1DM[10]。Janzen等[11]对9项有关GLP-1受体激动剂治疗T1DM的临床试验进行综合分析, 提出GLP-1受体激动剂可被考虑用于超重或肥胖、且使用胰岛素治疗效果不佳的T1DM患者, 但需注意观察药物的耐受性。因此, 研究E2HSA对胰岛β细胞的保护作用可评价其对T1DM小鼠糖代谢的影响, 将为其用于治疗T1DM提供实验依据。
胰岛内β细胞数量主要依靠细胞的增殖、新生与凋亡、坏死来维持, 而各种影响细胞增殖与凋亡的因素均会引起β细胞功能障碍。PDX-1不仅是调节胰岛素基因表达和胰岛素分泌的重要转录因子, 还参与维持胰岛β细胞数量[12]。Pdx-1基因常染色体显性突变可引起MODY4 (maturity-onset diabetes of the young 4)[13]。此外, 有研究发现, 胰岛素可促进PDX-1定位于细胞核, 并通过调节Pdx-1基因表达而抑制胰岛发生凋亡, 提示PDX-1具有抗凋亡作用[14]。Li等[15]发现PDX-1是GLP-1受体信号通路中重要的转录因子, 不仅参与GLP-1受体激动剂调节α细胞分泌胰高血糖素, 还参与其调节β细胞分化、生长和存活。此外, 磷脂酰肌醇3激酶-蛋白激酶B (phosphoinositide-3-kinase-PKB, PI3K-PKB)信号通路也参与调节细胞生长、增殖、分化和凋亡等过程, 研究表明激活该通路可促进β细胞增殖, 抑制其发生凋亡[16]。
虽然目前尚未明确引起T1DM患者胰岛β细胞数量减少的原因是坏死、凋亡、还是二者兼有, 但是越来越多的研究表明, 凋亡在β细胞自身免疫损伤中具有重要作用, 而多种因素, 如高糖、高脂、炎症等引起的β细胞活性氧元件生成增多是介导β细胞凋亡的一大“凶手”[17]。水溶性胆固醇可诱导细胞膜上的自由基成为氧自由基, 并使其浓度增加, 同时又抑制或损伤细胞本身的抗氧化酶类防御系统, 降低其清除自由基的能力, 最终导致细胞内脂质过氧化产物堆积增加而引起细胞损伤。本研究首先在体外水平分别从增殖和凋亡2个方面评价E2HSA对β细胞的保护作用, 并初步探索其作用机制, 结果显示E2HSA可促进小鼠胰岛素瘤细胞株NIT-1增殖, 抑制氧化损伤引起的细胞凋亡, 且该作用与调节PDX-1和PKB表达有关, 表明E2HSA具有一定的胰岛β细胞保护作用。
四氧嘧啶高血糖小鼠是一种常用的T1DM动物模型, 四氧嘧啶及其还原产物可以在体内形成氧化还原循环, 产生超氧自由基, 进而快速破坏胰岛β细胞, 使胰岛素的合成减少, 造成胰岛素绝对缺乏, 最终引起实验动物发生类似人类T1DM的高血糖[18]。E2HSA长期给药不仅显著降低四氧嘧啶小鼠血糖, 还明显增加其胰岛内的胰岛素含量及血清胰岛素水平, 表明E2HSA能够阻止T1DM小鼠胰岛β细胞数量的减少, 保护其功能。
综上所述, 在体外水平, E2HSA可促进小鼠胰岛素瘤细胞株NIT-1增殖, 抑制氧化损伤诱导的细胞凋亡; 在整体动物水平, E2HSA可降低T1DM小鼠的血糖, 并增加其胰岛内和血清中胰岛素水平, 初步表明E2HSA能够保护胰岛β细胞功能, 为其在T1DM患者中的应用提供了实验依据。
| [1] |
Lee YS, Jun HS. Anti-diabetic actions of glucagon-like peptide-1 on pancreatic beta-cells[J]. Metabolism, 2014, 63: 9-19. DOI:10.1016/j.metabol.2013.09.010 |
| [2] |
Hou S, Li C, Huan Y, et al. Effects of E2HSA, a long-acting glucagon like peptide-1 receptor agonist, on glycemic control and beta cell function in spontaneous diabetic db/db mice[J]. J Diabetes Res, 2015, 2015: 817839. |
| [3] |
Li C, Hou S, Liu S, et al. The albumin-exendin-4 recombinant protein E2HSA improves glycemic control and β-cell function in spontaneous diabetic KKAy mice[J]. BMC Pharmacol Toxicol, 2017, 18: 48. DOI:10.1186/s40360-017-0143-8 |
| [4] |
Li CN, Hou SC, Sun SJ, et al. Effects of E2HSA on the glycolipid metabolism and β-cell function in aged obese mice[J]. Chin J New Drugs (中国新药杂志), 2017, 26: 44-50. |
| [5] |
Li X, Ma HY, Li LP, et al. Progress in metabolomics research of diabetes[J]. Acta Pharm Sin (药学学报), 2019, 54: 828-837. |
| [6] |
Moore B, Edie ES, Abram JH. On the treatment of the diabetes mellitus by acid extract of duodenal mucous membrane[J]. Biochem J, 1906, 1: 28-38. DOI:10.1042/bj0010028 |
| [7] |
La Barre J, Still EU. Studies on the physiology of secretin. Ⅲ. further studies on the effects of secretin on the blood sugar[J]. Am J Physiol, 1930, 91: 649-653. DOI:10.1152/ajplegacy.1930.91.2.649 |
| [8] |
Zheng YC. Preparation and the biological effect of fusion protein GLP-1-exendin-4/IgG4(Fc) fusion protein as long acting GLP-1 receptor agonist[J]. Acta Pharm Sin (药学学报), 2015, 50: 1668-1672. |
| [9] |
Huan Y, Shen ZF. A novel cell model targeted on GLP-1 receptor for application to anti-diabetic candidates screening[J]. Acta Pharm Sin (药学学报), 2009, 44: 309-313. |
| [10] |
Popovic DS, Stokic E, Popovic SL. GLP-1 receptor agonists and type 1 diabetes - where do we stand?[J]. Curr Pharm Des, 2015, 21: 5292-5298. DOI:10.2174/0929867322666151006142224 |
| [11] |
Janzen KM, Steuber TD, Nisly SA. GLP-1 agonists in type 1 diabetes mellitus[J]. Ann Pharmacother, 2016, 50: 656-665. DOI:10.1177/1060028016651279 |
| [12] |
Subramanian M, Thotakura B, Chandra Sekaran SP, et al. Naringin (4', 5, 7-trihydroxyflavanone 7-rhamnoglucoside) attenuates β-cell dysfunction in diabetic rats through upregulation of PDX-1[J]. Cells Tissues Organs, 2018, 206: 133-143. DOI:10.1159/000496506 |
| [13] |
Kushner JA, Ye J, Schubert M, et al. Pdx1 restores β cell function in Irs2 knockout mice[J]. J Clin Invest, 2002, 109: 1193-1201. DOI:10.1172/JCI0214439 |
| [14] |
Johnson JD, Bernal-Mizrachi E, Alejandro EU, et al. Insulin protects islets from apoptosis via Pdx1 and specific changes in the human islet proteome[J]. Proc Natl Acad Sci, 2006, 103: 19575-19580. DOI:10.1073/pnas.0604208103 |
| [15] |
Li Y, Cao X, Li LX, et al. Beta-cell Pdx-1 expression is essential for the glucoregulatory, proliferative, and cytoprotective actions of glucagon-like peptide-1[J]. Diabetes, 2005, 54: 482-491. DOI:10.2337/diabetes.54.2.482 |
| [16] |
Wei D, Cui W, Wang HF. PI3K-Akt/PKB signal pathway and the function of pancreatic β-cell[J]. Int J Endocrinol Metab (国际内分泌代谢杂志), 2007, 2: 109-111. |
| [17] |
Yuan T, Wang H. Type 1 diabetes mellitus and β-cell apoptosis[J]. Section Endocrinol Foreign Med Sci (国外医学•内分泌学分册), 2002, 22: 28-31. |
| [18] |
Szkudelski T. The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas[J]. Physiol Res, 2001, 50: 537-546. |
 2020, Vol. 55
2020, Vol. 55


