心力衰竭与全球临床实质性负担和医疗经济成本直接相关。目前全世界心力衰竭患者大约有2 600万人, 心衰引起的入院治疗是目前医院主要收治患者之一, 约占住院率的1%~2%。心衰确诊后, 约83%心衰患者每年至少住院1次, 43%心衰患者每年住院4次以上, 目前医疗机构床位紧张, 心衰引起的常年住院患者更是加重了这一问题的严重性, 已然成为了一种全球性健康经济负担[1]。
对于心衰的诊疗研究, 全球范围内每年投入大量的人力与经费, 即使在心衰确诊后采用最佳的治疗手段, 5年内死亡率仍较高, 出院后60~90天内的死亡率和入院再治疗率分别15%和35%, 尽管采用了循证治疗, 近20年里心衰生存率几乎没有明显改变甚至出现恶化趋势[2, 3]。目前流行病学调查显示, 成年人的心力衰竭患病率为1%~3%, 随着年龄的增加, 心衰患病率迅速升高, 65岁以上人群患病率上升至5%~9%[4]。尽管心衰的治疗已取得一定进展, 但依然是21世纪心血管领域的热点问题之一。
1 心力衰竭的病理特征及分型心力衰竭是各种心脏疾病发展至终末期引起的一种复杂临床综合征。多种原因导致心脏结构或功能发生改变, 使心脏收缩或舒张功能障碍, 主要表现为呼吸困难、运动障碍和体液潴留等症状。最新临床指南表示, 根据左心室射血分数(left ventricular ejection fraction, LVEF), 心衰分为射血分数降低的心衰(heart failure with reduced ejection fraction, HFrEF)、射血分数保留的心衰(heart failure with preserved ejection fraction, HFpEF)和射血分数中间值的心衰(heart failure with mid range ejection fraction, HFmrEF), 目前HFpEF的发病率占心力衰竭总数40%~70%[5], 随着现代社会老龄化加重, 慢性病发病率持续升高, 医疗水平的提高使心血管疾病患者的寿命延长, 心力衰竭发病率势必进一步上升。
2 抗心衰药物治疗现况目前临床常用的抗心衰药物对某些症状的缓解效果显著, 但通常没有完全解决左心室功能障碍这一根本病因。当前, 心衰的治疗方法主要是减少衰竭心脏的做功负荷, 并力求达到一定水平上的能量供需平衡[6]。心衰治疗通常以化学药物为主, 从传统的“利尿、强心、扩血管”, 发展到以利尿剂、血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor, ACEI)类药物和β受体阻滞剂为基础的组合治疗方案, 常规治疗手段中ACEI/血管紧张素受体阻滞剂的使用率为61%, β受体阻滞剂为67%, 盐皮质激素受体拮抗剂的使用率为33%[7]。
通过降低心肌耗氧量, 减少心肌能量消耗, 化学药物治疗可以快速提高心衰患者的血流动力学指标, 缓解心衰症状, 并在最初的2~3年内改善心衰患者的生存率, 但电解质紊乱、低血压和心动过缓等并发症频发, 不良预后和较低的生活质量给患者及家属造成极大的负担。中国等发展中国家的心衰发病患者相对发达国家具有更加年轻化的特点, 因此, 对未来抗心衰药物的探究应更加注重综合治疗, 力求逆转心肌异常重构, 恢复能量供需平衡, 以达到降低死亡率提高生存质量的治疗目标[8]。
3 天然药物开发优势天然药物含有多种化学成分, 研究发现生物碱、多糖、糖苷、黄酮和酶等皆可能是具有治疗价值的活性化合物。天然药物及其活性化合物治疗具有多靶点综合疗效的特点。多通路、多靶点的优势可避免当前西药疗法靶点单一缺陷引起的多种代偿性不良反应, 以及药物代谢导致的药理作用减弱等问题。附子、川芎及黄芪等许多天然药物及其活性化合物, 具有增强心肌收缩力、扩张血管、利尿和减轻心室重构等作用[9], 在心力衰竭的治疗中应用广泛, 历史悠久(图 1)。目前制药公司已经上市了几种抗心衰专利药物, 一项多中心、随机双盲、平行安慰剂对照临床研究发现, 芪苈强心胶囊可以显著降低血清脑钠肽前体(N-terminal pro-brain natriuretic peptide, NT-proBNP)的水平、改善LVEF和6分钟步行试验距离(6 minutes walking distance, 6MWD), 并改善患者的纽约心脏病协会(New York heart association, NYHA)心功能分级[10-13]。研究表明, 天然活性化合物具有抗纤维化、抗炎、抗氧化应激、抗凋亡、改善脂肪酸氧化和代谢调节作用[14, 15]。与化学药物相比, 天然药物及其活性化合物治疗心力衰竭具有多种优势。首先, 它可以改善临床症状和生活质量[16-21]; 其次, 新型天然活性成分的研究可以提供新的抗心衰治疗靶点与思路, 突破当前心衰治疗瓶颈; 第三, 分离筛选得到的高效低毒天然活性化合物不良反应小、安全性高, 可以长期综合调节心功能, 防止心力衰竭复发, 增强治疗的效果。通过对患者的身体机能、免疫功能和自身适应能力的综合调节, 减少各种不良反应诱发因素对机体的损伤, 从而减少因慢性心力衰竭急性期发作而导致的再次住院或死亡。一些研究人员认为, 天然药物及其活性化合物的早期辅助治疗可以减少洋地黄类、利尿药和抗心律不齐药物的使用量, 并减少由于长期使用西药引发的不良反应。
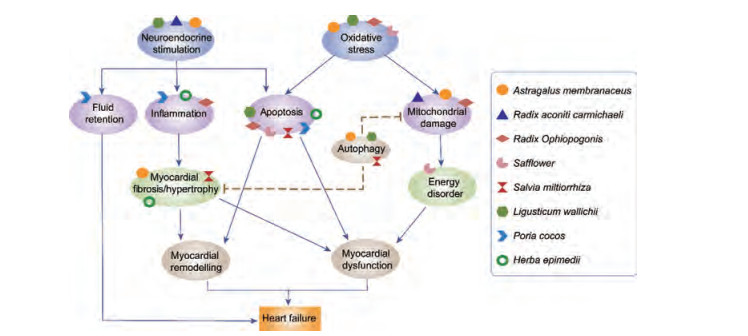
|
Figure 1 Schematic diagram of pharmacological effects of natural medicines in the treatment of heart failure. RAAS: Renin-angiogenin-aldosterone system. Various icons represent different natural medicines, and the positions of the icons represent possible drug targets |
传统中药疗法在心力衰竭的临床诊疗中积累了丰富经验, 其中补益心气法最为常用。黄芪始载于《神农本草经》, 列为上品, 为豆科植物膜荚黄芪Astragalus membranaceus (Fisch.) Bge.或蒙古黄芪A.membranaceus (Fisch.) Bge. var. mongholicus Bge. Hsiao的干燥根。作为著名的补益类中药, 黄芪以补虚为主, 具有补中益气, 固表利水, 托毒生肌之功效[22]。黄芪对心血管系统疾病的治疗有广泛的临床经验, 如张锡纯以其为君药用于“大气下陷症”的治疗, 《备急千金要方》中用于治疗“心中憧憧, 阴阳气衰”的补心汤等。研究发现, 黄芪的有效活性成分主要有黄芪黄酮类、黄芪皂苷类和黄芪多糖类等。现代医学研究表示, 黄芪及其活性组分能增强机体免疫功能, 延缓细胞衰老进程; 扩张血管、降低血压、增加心肌收缩力和心排血量; 改善心肌细胞的电生理, 减少心肌细胞凋亡, 抑制氧化损伤, 显示出确切的心血管保护作用[23-25]。
4.1.1 黄芪甲苷黄芪作为一种外源性抗氧化剂, 在多种氧化应激疾病模型中具有显著的保护作用。黄芪甲苷和异黄酮被认为是黄芪中发挥抗氧化作用的主要活性成分。研究发现, 黄芪水提取物黄芪甲苷对氧化应激损伤的心肌细胞具有显著的抗氧化活性和保护作用, 这种保护作用主要通过增加应激损伤细胞的储备呼吸能力和线粒体三磷酸腺苷(adenosine triphosphate, ATP)生成量实现[26]。心脏作为体内新陈代谢最为活跃的器官, 线粒体含量在各组织中最高。通过对临床患者样本的多样化分析, 有学者认为心力衰竭的进展可能与能量生成储备能力的进行性损伤相关, 损伤一旦达到临界阈值, 内源性反馈机制难以代偿失衡的能量需求, 心衰进一步发展[27]。作为经典的补气中药, 黄芪在临床抗心衰应用的进一步开展, 还需要对其抗氧化、促ATP生成能力的体内机制进行深入研究。
4.1.2 环黄芪醇环黄芪醇(cycloastragenol, CAG)是黄芪中分离的一种天然化合物, 具有抗衰老、抗炎、抗纤维化、抗菌、肝脏和内皮保护等多种药理作用。在异丙肾上腺素(isoprenaline, ISO)诱导的心肌损伤模型中, CAG明显改善异常的心脏血流动力学参数, 降低血清脑钠肽(brain natriuretic peptide, BNP)和血管紧张素Ⅱ等多种神经内分泌因子的水平。机制研究发现, CAG通过抑制大鼠心脏基质金属蛋白酶-2 (matrix metalloproteinase-2, MMP-2)和基质金属蛋白酶-9 (matrix metalloproteinase-9, MMP-9)的表达, 改善心功能不全和心肌重构; 心肌细胞自噬障碍是导致心脏重构和心力衰竭的重要病理性因素, CAG通过抑制Akt1-RPS6KB1信号通路, 促进心肌细胞自噬, 进而减轻ISO诱导的大鼠心力衰竭, 研究提示CAG可能成为治疗充血性心力衰竭的候选治疗药物之一[28]。
4.2 附子及其天然活性成分附子在我国传统医学中应用广泛、历史悠久, 被称为“回阳救逆第一品”。附子为毛茛科植物乌头Aconitum carmichaclii Debx.的子根加工品, 味辛、甘, 性大热, 有毒, 归心、肾、脾经。具有回阳救逆、补火助阳和散寒止痛之功效。现代药理学研究显示, 附子主要活性成分为生物碱类化合物, 具有强心、抗心衰、抗休克、抗心肌缺血和抗心律失常等广泛的心血管系统保护作用[29, 30]。附子配伍生姜治疗心力衰竭在我国已有几千年的历史, 是我国治疗心血管病的经典配伍。采用网络药理学和分子生物学相结合方法对其抗心衰作用进行探究, 发现附子与生姜配伍具有增加心肌收缩力、降低心肌耗氧量和扩张心血管等功效, 其机制可能与过氧化物酶体增殖物激活受体(peroxidosome proliferators activate receptors, PPAR)介导的能量代谢途径有关, 通过激活PPARα/PGC-1α/Sirt3通路, 增强脂肪酸氧化产能, 直接改善左心室能量供应[31]。近年来研究发现, 交感神经系统的慢性激活, 是心力衰竭的主要标志之一, 心衰治疗在改善能量生成的基础上, 还需平衡异常紊乱的神经内分泌系统。附子通过抑制肾素-血管生成素-醛固酮系统(renin-angiogenin-aldosterone system, RAAS)的活性, 下调神经细胞因子的水平, 明显改善腹主动脉缩窄法致心力衰竭大鼠的神经内分泌紊乱, 减轻心室重构, 改善心衰症状[32]。根据NYHA心功能分级评定的高质量临床数据显示, 附子治疗复合型心衰的疗效和附加效益值得肯定[33]。
去甲乌药碱(higenamine, HG)是从乌头中分离得到的一种天然苄基异喹啉类生物碱, 具有正性肌力、扩张血管、抗炎和抗氧化等作用, 是一种活性强心剂组分[34-36]。利用多柔比星诱导大鼠和H9c2细胞心肌毒性模型对去甲乌药碱与姜辣素联合应用治疗慢性心力衰竭效果进行评价, 结果显示联合治疗具有改善心功能、降低血清心肌酶水平和减轻心肌组织损伤的作用; 细胞能量代谢分析仪对线粒体能量表型和糖酵解速率进行测定, 结果显示, 联合治疗明显提高线粒体耗氧率和细胞外酸化率, 提高H9c2细胞存活率, 改善多柔比星诱导线粒体功能障碍。
此外, 代谢组学分析表明, 去甲乌药碱与姜辣素联合抗心衰作用主要与调节脂肪酸代谢和能量代谢产物相关。在哺乳类动物体内, 线粒体约占细胞体积的25%~30%, 心肌细胞中其含量仅次于肌丝, 丰富的线粒体满足了心肌收缩舒张过程的高能需求。“心肌能量网”由线粒体生成ATP供能, 通过胞内的磷酸酶转运体传递能量至整个细胞。衰竭心脏的一个典型特征就是线粒体损伤, 能量供应不足, 去甲乌药碱与姜辣素联合治疗通过LKB1/AMPKα/Sirt1信号通路促进线粒体能量代谢, 加快心肌能量生成, 保护心肌抵抗损伤刺激, 从而减轻多柔比星所致的心脏毒性[37, 38]。目前, 去甲乌药碱已被国家食品药品监督管理局批准用于临床研究, 3期临床试验已经完成并取得良好效果。对去甲乌药碱的进一步机制研究有利于探索发现心衰治疗的潜在靶点和新的作用机制[39]。
4.3 川芎及其天然活性成分川芎为伞形科植物川芎Ligusticum chuanxiong Hort.的干燥根茎。性辛、温, 归肝、胆、心包经。具有活血行气、祛风止痛的功效, 被称为血中之气药。随着医疗技术不断发展, 近年来发现川芎的有效成分主要有挥发油、酚酸及有机酸、生物碱和三萜类化合物等, 川芎的活性成分可以有效地扩张心脑血管、增加血流量、防止冠脉及主动脉痉挛、镇静镇痛、抑制血小板聚集和氧自由基释放等[40, 41]。
4.3.1 阿魏酸阿魏酸是川芎的主要有机酸活性成分, 在川芎中阿魏酸是以结合型和游离型共同存在, 结合型为主, 以总阿魏酸含量发挥药效, 所以通常用总阿魏酸含量作为川芎质量评价的指标[42]。阿魏酸可明显改善腹主动脉缩窄所致心肌肥厚大鼠的心功能, 降低血管紧张素Ⅱ和内皮素-1的浓度, 抑制蛋白激酶C-β (protein kinase C-β, PKC-β)和细胞外信号调节激酶1/2 (extracellular signal-regulated kinase, ERK1/2)等蛋白的过表达。机制研究认为阿魏酸的显著抗心肌肥厚作用可能与PKC/MAPK信号通路直接相关[43]。研究发现, 川芎的有机酸活性成分可以通过调节自噬发挥对心肌缺血损伤大鼠保护作用。自噬功能失调与心肌缺血损伤等一系列心血管疾病密切相关。有机酸可以剂量依赖性地减少心肌梗死面积和血清乳酸脱氢酶(lactic dehydrogenase, LDH)、肌酸激酶(creatine kinase, CK)和心肌肌钙蛋白的水平, 改善损伤心肌的组织学特征, 机制研究认为有机酸的心肌保护作用可能与激活PI3K/Akt/mTOR信号通路, 恢复自噬通量直接相关[44]。
4.3.2 川芎嗪川芎嗪(tetramethylpyrazine, TMP)是从川芎根茎中分离得到的主要生物碱活性成分。TMP具有显著的心脏保护作用, 目前人工合成的TMP已经是治疗心血管疾病的著名药物。供氧不足可能是缺血性心脏病心肌细胞损伤的重要病理机制之一。TMP可一定程度上减轻缺氧引起的心肌细胞活力丧失和凋亡, 通过下调微小RNA-499a(micro RNA-499a, miR-499a), 上调Sirtuin1, 逆转缺氧导致的PI3K/Akt通路失活, 减轻缺氧所致的心肌细胞凋亡和氧化应激损伤[45]。心衰后供氧不足所致的氧化应激损伤对心肌细胞造成了极大的伤害, 川芎的生物碱成分通过减轻氧化损伤, 发挥直接的心肌保护作用, 有望进一步用于心衰抗氧化损伤治疗的临床研究。
川芎嗪二醇(liguzinediol, LZDO)是从中药川芎中分离得到的一种新的川芎嗪衍生物, 对心脏有明显的正性肌力作用。研究发现, LZDO可剂量依赖性地改善多柔比星所致心衰大鼠的心功能, 电镜观察发现, LZDO可明显减轻多柔比星诱导的心肌细胞损伤, 减少凋亡小体数量。在机制研究中发现, LZDO可以显著降低心衰大鼠心脏中Bcl-2相关X蛋白(Bcl-2-associated X protein, Bax)水平, 上调B淋巴细胞瘤-2 (B-cell lymphoma-2, Bcl-2)蛋白水平, 使Bcl-2/Bax比值升高, 通过调节Bcl-2、Bax、特异性半胱氨酸蛋白酶-3 (cysteine aspartate-specific protease-3, caspase-3)和核因子κB (nuclear factor kappa-B, NF-κB)等凋亡相关蛋白的表达, 抑制心肌细胞凋亡, 发挥心肌保护作用[46]。
川芎作为经典的心血管疾病治疗中药, 其多成分多靶点的心血管保护机制, 表现出巨大的抗心衰潜力, 明确体内机制是疾病治疗的基础, 川芎的抗心衰临床应用, 亟需科研工作者的进一步深入机制研究, 在保证安全性的基础上, 为心衰治疗提供一些新的探究思路与治疗方法。
4.4 茯苓及其天然活性成分茯苓为多孔菌科真菌茯苓Poria cocos (Schw.) Wolf的干燥菌核。味甘、淡、平。归心、肺、脾、肾经。具有渗湿利水, 益脾和胃, 宁心安神之功效, 临床有“十药九茯苓”之说。茯苓化学成分主要为多糖和三萜类化合物, 还含有树胶、蛋白质、脂肪酸和甾醇等成分。现代药理研究表示, 茯苓可有效提升心肌收缩力, 具有利尿、抗炎、抗氧化和调节免疫等多种作用[47]。
4.4.1 茯苓酸茯苓酸(pachymic acid, PA)是一种羊毛甾烷型三萜类化合物, 是茯苓中提取的天然活性成分, 具有抗炎、抗氧化和抗凋亡等多种药理作用。大量研究表明, 持续或蓄积性非感染性心肌炎症与心力衰竭的发展直接相关, 可由多种损伤引起, 包括缺血、缺氧、血流动力学超载和化疗药物刺激等[48]。PA可减弱炎症导致的肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、白细胞介素-1 (interleukin-1, IL-1)和白细胞介素-6 (interleukin-6, IL-6)的mRNA表达水平升高, 抑制脂多糖诱导的心肌细胞凋亡, 调节凋亡相关蛋白caspase-3、caspase-8和caspase-9的表达水平。研究认为其抗炎、抗凋亡作用机制可能与抑制ERK1/2和p38信号通路相关[42, 49]。
4.4.2 茯苓多糖利尿药作为心力衰竭治疗的临床常用药, 其多种不良反应限制了心衰患者的临床使用, 开发新型利尿药, 减少相关不良反应, 是当下利尿药的研究重点。中药茯苓皮具有利尿功效, 在亚洲传统医学中一直是经典的利尿剂。近年来研究发现, 茯苓多糖是其发挥利尿和心血管保护作用的主要天然活性成分。给药治疗后慢性心力衰竭大鼠尿液排出量明显增加, 血浆BNP水平明显下降, 对比阳性药速尿, 茯苓多糖治疗大鼠的电解质紊乱明显减轻。进一步机制研究发现, 大鼠的肾脏水通道蛋白-2 (aquaporins-2, AQP-2)明显下调、血浆精氨酸抗利尿激素(arginine vasopressin, AVP)水平降低、抗利尿激素2型受体(vasopressin type 2 receptor, V2R) mRNA表达下调。因此, 认为茯苓多糖可能通过AVP-V2R-AQP2轴发挥利尿、心肌保护的作用[50]。
4.5 淫羊藿及其天然活性成分本品为小檗科植物淫羊藿Epimedium brevicomu Maxim.的干燥叶, 始载于神农本草经。性辛、甘, 温。归肝、肾经。具有补肾阳、强筋骨和祛风湿等功效。其主要活性成分包括黄酮类化合物和多糖, 此外还有生物碱、木脂素、棕榈酸、硬脂酸、油酸、亚麻酸、酚苷类、紫罗酮类和乙醇苷类等[51]。现代药理学研究表明, 淫羊藿能增加心脑血管血流量, 促进造血功能、调节免疫功能及骨代谢。近来, 淫羊藿苷作为心神宁制剂的主要活性成分, 已被用于治疗心血管疾病[52]。
淫羊藿苷Ⅱ型(icariside Ⅱ, ICA Ⅱ)是从淫羊藿中提取的黄酮类化合物, 具有抗氧化、抗炎和抗凋亡等多种生物学活性。氧化应激是许多疾病发生细胞损伤的主要原因, 抑制或清除过量的活性氧可以有效保护细胞功能或减少细胞死亡。ICA Ⅱ具有抗心脏重构的潜在活性, 超声结果显示, ICA Ⅱ可减轻心脏收缩和舒张功能障碍, 改善心衰小鼠的心肌肥大和纤维化, ICA Ⅱ激活腺苷酸活化蛋白激酶α (adenosine monophosphate activated protein kinase α, AMPKα)的活性作用优于白藜芦醇, 通过调节AMPK/mTOR信号转导通路, ICA Ⅱ对心肌肥大和组织重构具有显著保护作用[53]。
ICA Ⅱ灌胃给药可以降低自发性高血压大鼠的血压, 促进心功能的恢复, 改善心室重构。此外, 还能减轻心肌纤维化, 抑制心肌细胞凋亡, 减少活性氧产生, 提高超氧化物歧化酶活性。机制研究中发现, ICA Ⅱ抑制氧化应激相关ASK1-JNK/p38信号通路的活化, 抑制线粒体凋亡途径中p53、Bax和caspase-3的表达, 上调Bcl-2的表达[54]。心肌重构是慢性心力衰竭发生发展的基本生理病理过程, 是许多心血管疾病最终发展为心力衰竭的典型病理学改变, 国内外许多学者对心肌重构的发病基础和防治方法进行了大量的研究[55], 但对于心肌重构治疗的特效药物较少, 淫羊藿抗心肌重构作用具有多靶点、效果显著和不良反应低并同时提高人体免疫力等特点, 有望成为治疗恶性心脏重构的候选治疗药物[56]。
ICA Ⅱ被证实可降低糖尿病性心肌病大鼠血清CK和LDH的表达水平, 降低心肌氧化应激、炎症和细胞凋亡水平。进一步研究发现ICA Ⅱ的心肌保护作用可能是通过激活Akt/NOS/NF-κB信号通路发挥作用[57]。急性心肌梗死后心功能不全是致死和致残的主要原因, 其本质是心肌细胞坏死。因此, 减少心肌细胞死亡数量、补充再生功能性心肌细胞到坏死区域是减少心室重塑、改善心脏功能和减轻再灌注损伤的关键。ICA Ⅱ预防性给药可显著缩小心脏缺血再灌注(cardiac ischemia/reperfusion, I/R)所致的大鼠心肌梗死范围、减少I/R诱导的细胞凋亡、降低CK、LDH和缺血修饰白蛋白等生化指标的异常水平。进一步的机制研究认为ICA Ⅱ通过激活PI3K/Akt/eNOS信号通路对大鼠心肌缺血再灌注损伤发挥显著保护作用, 是一种潜在的促血管新生、改善心肌微环境、减轻心肌损伤和发挥心肌保护作用的天然活性化合物[58]。
4.6 麦冬及其天然活性成分麦冬是临床常用中药, 为百合科植物麦冬Ophiopogon japonicas (L. f) Ker-Gawl.的干燥块根。味甘、微苦、微寒。归心、肺、胃经。其主要功效为养阴生津、润肺清心。现代研究发现麦冬的化学成分主要包括甾体皂苷类、高异黄酮类和多糖类等, 具有降血糖、保护心血管、免疫调节、抗氧化、抗炎和抗糖尿病等多种药理活性[59]。
4.6.1 麦冬多糖麦冬多糖(polysaccharide of Ophiopogon japonicus, OJP1)是从麦冬根茎中提取的一种著名的治疗心血管疾病的天然活性化合物。Fan等[60]和Zhang等[61, 62]研究发现OJP1对ISO诱导的大鼠心肌缺血损伤具有明显保护作用; OJP1预处理能显著降低ISO诱导的ST段抬高和心脏指数, 降低血清心肌酶水平, 显著提高ATP合酶活性。此外, OJP1预处理不仅能提高血清和心肌中超氧化物歧化酶、谷胱甘肽过氧化物酶和氧化氢酶的活性, 还能降低丙二醛的水平。因此, 认为OJP1减轻ISO所致心肌损伤的机制可能是通过提高内源性抗氧化因子来实现的。OJP1通过调节抗氧化酶水平, 改善心功能, 对糖尿病性心肌病具有一定的保护作用。
4.6.2 麦冬皂苷类麦冬中提取的甾体皂苷类天然活性成分, 具有抑制氧化应激和炎症因子的活性, 明显改善心衰大鼠的异常血流动力学参数, 对多柔比星所致慢性心力衰竭具有保护作用。甾体皂苷的抗氧化活性可以减轻线粒体膜电位损伤, 改善线粒体产能障碍, 平衡心肌能量稳态; 甾体皂苷通过调节线粒体自噬活性, 清除损伤致炎因子, 从而发挥综合心肌保护作用[62, 63]。
4.6.3 麦冬异黄酮类麦冬素A (methylophiopogonanone A, MO-A)是麦冬中分离的一种异黄酮类化合物, 被认为是麦冬治疗心肌缺血和血栓的主要活性成分。有研究显示MO-A预处理可明显减少I/R后的心肌梗死面积(减少60.7%)和心肌细胞凋亡(减少56.8%), 减轻心肌缺血再灌注损伤。机制研究认为, MO-A通过激活PI3K/Akt/eNOS信号通路, 减轻I/R诱导的小鼠心肌细胞凋亡, 减小梗死面积, 发挥抗心肌缺血的保护作用[64]。
4.7 红花及其天然活性成分红花为菊科植物红花Carthamus tinctorius L.的干燥花, 其性温、味辛, 归心、肝经。具有活血化瘀之功效。临床主要用于心脑血管疾病的治疗。红花的化学成分主要有查耳酮类(色素类成分)、黄酮类、生物碱类、聚乙炔类、烷二醇类、脂肪酸、类固醇和木脂素类等[65, 66]。
羟基红花黄色素A (hydroxyl safflower yellow pigment A, HSYA)是红花中最具代表性的天然活性成分, 在我国长期用于治疗心血管疾病, 具有显著的抗凝、抗氧化应激和促血管生成活性。研究表明, HSYA能明显改善缺血心肌的血流动力学参数, 减轻心肌损伤, 通过上调核仁素水平, 转录后调节缺血心肌中血管内皮生长因子-A和MMP-9的表达, 发挥促血管生成作用; HSYA可以显著降低I/R损伤心脏中LDH和caspase-3的水平, 减轻氧化应激损伤和细胞凋亡, 通过激活PI3K/Akt信号通路, 改善线粒体能量代谢障碍, 发挥一定的心肌保护作用[67-69]。
4.8 丹参及其天然活性成分丹参为唇形科植物丹参Salvia miltiorrhiza Bge.的干燥根和根茎。味苦, 性微寒, 归心、肝经。具有活血祛瘀、通经止痛、清心除烦、凉血消痈之功效。现代药理学研究显示, 丹参对心血管系统具有非常广泛的药理作用, 如:清除缺血部位自由基、改善微循环和减轻心肌缺血损伤; 提高心肌的耐缺氧能力、扩张冠状动脉、增加冠脉流量和保护心脏功能等[70]。丹参中含多种天然活性成分, 主要分为两大类:一类是以丹参酮型二萜为主的二萜类脂溶性成分; 另一类是以酚酸为主的水溶性成分。
4.8.1 丹参酮IIA丹参酮IIA (tanshinone IIA, TSA)是丹参中的代表性有效成分之一, 在心力衰竭等疾病的治疗中具有显著的心肌保护作用。采用多柔比星造模诱导斑马鱼、小鼠心力衰竭模型对TSA的心脏保护作用进行评价。结果显示, TSA处理可显著改善心功能。Western blot结果显示, TSA处理明显上调微管相关蛋白1轻链3 (microtubule-associated protein 1 light chain 3, LC3)、自噬底物受体SQSTM1 (sequestosome 1)、溶酶体相关膜蛋白1 (lysosomal associated membrane protein 1, LAMP1)和Beclin1等自噬相关蛋白的表达, 激活自噬信号通路, 通过促进自噬溶酶体降解和自噬小体形成来清除损伤蛋白, 逆转心肌病变。雷帕霉素靶蛋白(mammalian Target of Rapamycin, mTOR)激动剂MHY1485可以阻断TSA的心肌保护作用[71]。丹参酮IIA还能抑制细胞凋亡, 调节关键凋亡蛋白的表达, 包括Bcl-2和Bax以及caspase-3和caspase-7等。机制研究认为, TSA通过激活AMPK-mTOR信号通路抑制心肌细胞凋亡, 促进自噬清除, 从而保护心肌细胞, 改善心功能[72]。
4.8.2 丹酚酸A心肌纤维化是高血压患者的常见表现, 进一步发展则可能为心力衰竭, MMP-9升高是心肌纤维化发生的主要机制之一。研究发现, 丹酚酸A (salvianolic acid A, Sal A)对MMP-9蛋白具有非常强的竞争性抑制作用。在新生心脏成纤维细胞中, Sal A可以抑制成纤维细胞迁移, 阻断肌成纤维细胞转化, 抑制细胞间黏附因子、IL-6、可溶性血管细胞黏附分子-1及胶原等致纤维化因子的分泌。作为一种新型MMP-9抑制剂, Sal A具有显著地抑制心肌纤维化, 减轻心肌肥厚作用, 在心脏保护方面的潜在临床价值需要进一步研究[73]。研究发现, Sal A预处理对I/R心肌损伤具有显著的保护作用。采用Langendorff心脏灌流装置观察Sal A对I/R心肌的保护作用。结果表明, Sal A预处理可降低LDH水平, 减小心肌梗死面积, 减轻心肌细胞凋亡, 改善血流动力学各项指标。机制研究认为, Sal A通过抑制双特异性蛋白磷酸酶(dualspecificityphosphatase, DUSP) 2介导的c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)去磷酸化和激活DUSP4/16介导的ERK1/2磷酸化, 发挥抗心肌缺血损伤和抗凋亡作用[74, 75]。
5 结语与展望在过去10年里, 绝大多数抗心衰研究都未取得突破性的进展, 心衰死亡率居高不下。理想的抗心衰疗法应具有血流动力学不良反应小、安全性高和多靶点综合性保护心肌的作用机制。来自临床前模型和临床研究的大量数据显示, 天然药物及其活性化合物抗心衰治疗在稳定病情、改善心脏功能和提高生活质量等方面具有明显的优势。通过开发针对天然药物的新型抗心衰治疗药物, 有望从根本上减少心衰的发病和死亡率, 提高心衰患者的生活质量, 缓解心衰治疗瓶颈。
近些年天然药物的研究为抗心衰治疗领域带来了新的契机, 但天然药物的研究依然存在一些局限性: ①天然药物成分十分复杂且很多珍贵的有效活性成分含量很低, 活性组分的分离鉴定工作技术要求高; ②天然药物的显著疗效可能是几种活性组分综合作用的效果, 组分配比失调可能无法发挥最佳效果; ③传统中药药效受道地药材、炮制工艺影响较大, 需要结合现代科学技术, 进一步加强中药质量控制; ④尽管天然药物在保护心血管疾病方面的效果令人振奋, 但是仍有许多相关的尚未阐明的分子机制需要验证和发现。作用机制不完善直接限制天然药物的临床应用, 更重要的是, 研究者们应在机制阐明的基础上, 着重考虑如何利用天然活性化合物的体内作用机制发现新的或最佳的抗心衰治疗靶点, 从而把研究的理论成果有效地应用到临床上去, 开发更加有效的抗心衰治疗药物和合理的治疗策略。
| [1] |
Dunlay SM, Redfield MM, Weston SA, et al. Hospitalizations after heart failure diagnosis a community perspective[J]. J Am Coll Cardiol, 2009, 54: 1695-1702. DOI:10.1016/j.jacc.2009.08.019 |
| [2] |
Heidenreich PA, Albert NM, Allen LA, et al. Forecasting the impact of heart failure in the United States:a policy statement from the American Heart Association[J]. Circ Heart Fail, 2013, 6: 606-619. DOI:10.1161/HHF.0b013e318291329a |
| [3] |
Ambrosy AP, Fonarow GC, Butler J, et al. The global health and economic burden of hospitalizations for heart failure:lessons learned from hospitalized heart failure registries[J]. J Am Coll Cardiol, 2014, 63: 1123-1133. DOI:10.1016/j.jacc.2013.11.053 |
| [4] |
Roger VL, Go AS, Lloyd-Jones DM, et al. Heart disease and stroke statistics——2011 update:a report from the American Heart Association[J]. Circulation, 2011, 123: e18-e209. |
| [5] |
Heart Failure Group, Chinese Society of Cardiology, Professional Committee of Heart failure of Chinese Physicians Association, Editorial Board of Chinese Journal of Cardiovascular Diseases. Chinese heart failure diagnosis and treatment guide 2018[J]. Chin J Cardiol (中华心血管病杂志), 2018, 46: 760-780. |
| [6] |
Wilcox JE, Fonarow GC, Ardehali H, et al. "Targeting the heart" in heart failure:myocardial recovery in heart failure with reduced ejection fraction[J]. JACC Heart Fail, 2015, 3: 661-669. DOI:10.1016/j.jchf.2015.04.011 |
| [7] |
Greene SJ, Butler J, Albert NM, et al. Medical therapy for heart failure with reduced ejection fraction:the CHAMP-HF registry[J]. J Am Coll Cardiol, 2018, 72: 351-366. DOI:10.1016/j.jacc.2018.04.070 |
| [8] |
Tromp J, Ferreira JP, Janwanishstaporn S, et al. Heart failure around the world[J]. Eur J Heart Fail, 2019, 21: 1187-1196. DOI:10.1002/ejhf.1585 |
| [9] |
Meng Y, Du Z, Li Y, et al. Integration of metabolomics with pharmacodynamics to elucidate the anti-myocardial ischemia effects of combination of notoginseng total saponins and safflower total flavonoids[J]. Front Pharmacol, 2018, 9: 667. DOI:10.3389/fphar.2018.00667 |
| [10] |
Li X, Zhang J, Huang J, et al. A multicenter, randomized, double-blind, parallel-group, placebo-controlled study of the effects of Qili Qiangxin capsules in patients with chronic heart failure[J]. J Am Coll Cardiol, 2013, 62: 1065-1072. DOI:10.1016/j.jacc.2013.05.035 |
| [11] |
Wang X, Zhao Z, Mao J, et al. Randomized, double-blinded, multicenter, placebo-controlled trial of Shenfu injection for treatment of patients with chronic heart failure during the acute phase of symptom aggravation (Yang and Qi deficiency syndrome)[J]. Evid Based Complement Alternat Med, 2019, 2019: 9297163. |
| [12] |
Chang M, Cheng L, Shen Y, et al. Qishenyiqi dripping pill improves ventricular remodeling and function in patients with chronic heart failure:a pooled analysis[J]. Medicine (Baltimore), 2019, 98: e13906. DOI:10.1097/MD.0000000000013906 |
| [13] |
Ma X, Lv B, Li P, et al. Identification of "multiple components-multiple targets-multiple pathways" associated with Naoxintong capsule in the treatment of heart diseases using UPLC/Q-TOF-MS and network pharmacology[J]. Evid Based Complement Alternat Med, 2016, 2016: 9468087. |
| [14] |
Xiao J, Deng SB, She Q, et al. Traditional Chinese medicine Qili Qiangxin inhibits cardiomyocyte apoptosis in rats following myocardial infarction[J]. Exp Ther Med, 2015, 10: 1817-1823. DOI:10.3892/etm.2015.2759 |
| [15] |
Li C, Wang Y, Qiu Q, et al. Qishenyiqi protects ligation-induced left ventricular remodeling by attenuating inflammation and fibrosis via STAT3 and NF-kappaB signaling pathway[J]. PLoS One, 2014, 9: e104255. DOI:10.1371/journal.pone.0104255 |
| [16] |
Lu X, Zhang L, Wang J, et al. Clinical efficacy and safety of Xinmailong injection for the treatment of chronic heart failure:a meta-analysis[J]. Front Pharmacol, 2018, 9: 810. DOI:10.3389/fphar.2018.00810 |
| [17] |
Tan D, Wu JR, Zhang XM, et al. Sodium tanshinone Ⅱ A sulfonate injection as adjuvant treatment for unstable angina pectoris:a meta-analysis of 17 randomized controlled trials[J]. Chin J Integr Med, 2018, 24: 156-160. DOI:10.1007/s11655-017-2424-x |
| [18] |
Mao S, Li X, Wang L, et al. Rationale and design of sodium tanshinone Ⅱ A sulfonate in left ventricular remodeling secondary to acute myocardial infarction (STAMP-REMODELING) trial:a randomized controlled study[J]. Cardiovasc Drugs Ther, 2015, 29: 535-542. DOI:10.1007/s10557-015-6625-2 |
| [19] |
Jia Q, Wang L, Zhang X, et al. Prevention and treatment of chronic heart failure through traditional Chinese medicine:role of the gut microbiota[J]. Pharmacol Res, 2020, 151: 104552. DOI:10.1016/j.phrs.2019.104552 |
| [20] |
Sun J, Zhang K, Xiong WJ, et al. Clinical effects of a standardized Chinese herbal remedy, Qili Qiangxin, as an adjuvant treatment in heart failure:systematic review and meta-analysis[J]. BMC Complement Altern Med, 2016, 16: 201. DOI:10.1186/s12906-016-1174-1 |
| [21] |
Ge MX, Feng YL, Zhang XX, et al. Meta-analysis of Salvia Miltiorrhiza Ligustrazine injection combined with conventional medication in treatment of chronic heart failure[J]. Drug Eval Res (药物评价研究), 2019, 42: 2084-2091. |
| [22] |
Li R, Yin M, Yang M, et al. Developmental anatomy of anomalous structure and classification of commercial specifications and grades of the Astragalus membranaceus var. mongholicus[J]. Microsc Res Tech, 2018, 81: 1165-1172. DOI:10.1002/jemt.23111 |
| [23] |
Wei W, Li ZP, Bian ZX, et al. Astragalus polysaccharide RAP induces macrophage phenotype polarization to M1via the Notch signaling pathway[J]. Molecules, 2019, 24: 2016. DOI:10.3390/molecules24102016 |
| [24] |
Fu S, Zhang J, Menniti-Ippolito F, et al. Huangqi injection (a traditional Chinese patent medicine) for chronic heart failure:a systematic review[J]. PLoS One, 2011, 6: e19604. |
| [25] |
Liu Y, Xu W, Xiong Y, et al. Evaluations of the effect of Huang Qi against heart failure based on comprehensive echocardiography index and metabonomics[J]. Phytomedicine, 2018, 50: 205-212. DOI:10.1016/j.phymed.2018.04.027 |
| [26] |
Huang Y, Kwan KKL, Leung KW, et al. The extracts and major compounds derived from Astragali Radix alter mitochondrial bioenergetics in cultured cardiomyocytes:comparison of various polar solvents and compounds[J]. Int J Mol Sci, 2018, 19: 1574. DOI:10.3390/ijms19061574 |
| [27] |
Abozguia K, Phan TT, Shivu GN, et al. Reduced in vivo skeletal muscle oxygen consumption in patients with chronic heart failure——a study using near infrared spectrophotometry (NIRS)[J]. Eur J Heart Fail, 2008, 10: 652-657. DOI:10.1016/j.ejheart.2008.05.009 |
| [28] |
Wang J, Wu ML, Cao SP, et al. Cycloastragenol ameliorates experimental heart damage in rats by promoting myocardial autophagy via inhibition of AKT1-RPS6KB1 signaling[J]. Biomed Pharmacother, 2018, 107: 1074-1081. DOI:10.1016/j.biopha.2018.08.016 |
| [29] |
Lu X, Zhang L, Li P, et al. The protective effects of compatibility of Aconiti Lateralis Radix Praeparata and Zingiberis Rhizoma on rats with heart failure by enhancing mitochondrial biogenesis via Sirt1/PGC-1alpha pathway[J]. Biomed Pharmacother, 2017, 92: 651-660. DOI:10.1016/j.biopha.2017.05.117 |
| [30] |
Wang L, Ding JY, Liu XX, et al. Identification of aminoalcohol-diterpenoid alkaloids in Aconiti Lateralis Radix Praeparata and study of their cardiac effects[J]. Acta Pharm Sin (药学学报), 2014, 49: 1699-1704. |
| [31] |
Wen J, Zou W, Wang R, et al. Cardioprotective effects of Aconiti Lateralis Radix Praeparata combined with Zingiberis Rhizoma on doxorubicin-induced chronic heart failure in rats and potential mechanisms[J]. J Ethnopharmacol, 2019, 238: 111880. DOI:10.1016/j.jep.2019.111880 |
| [32] |
Wang R, Yan XM, Wang Y, et al. Effect of Fuzi Decoction based on chronic heart failure rats model and its mechanism[J]. Chin Arch Tradit Chin Med (中华中药学刊), 2019, 37: 788-792. |
| [33] |
Yang MQ, Song YM, Gao HY, et al. Efficacy and safety of Fuzi Formulae on the treatment of heart failure as complementary therapy:a systematic review and meta-analysis of high-quality randomized controlled trials[J]. Evid Based Complement Alternat Med, 2019, 2019: 9728957. |
| [34] |
Tsukiyama M, Ueki T, Yasuda Y, et al. Beta 2-adrenoceptor-mediated tracheal relaxation induced by higenamine from Nandina domestica Thunberg[J]. Planta Med, 2009, 75: 1393-1399. DOI:10.1055/s-0029-1185743 |
| [35] |
Bai X, Ding W, Yang S, et al. Higenamine inhibits IL-1beta-induced inflammation in human nucleus pulposus cells[J]. Biosci Rep, 2019, 39: BSR20190857. DOI:10.1042/BSR20190857 |
| [36] |
Wang YH, Li C, Jiang S, et al. Advances in pharmacological effects of higenamine on cardiovascular system[J]. Acta Pharm Sin (药学学报), 2020, 55: 392-397. |
| [37] |
Wen J, Zhang L, Wang J, et al. Therapeutic effects of higenamine combined with[J]. J Cell Mol Med, 2020. DOI:10.1111/jcmm.15041 |
| [38] |
Chen YL, Zhuang XD, Xu ZW, et al. Higenamine combined with[J]. Evid Based Complement Alternat Med, 2013, 2013: 970490. |
| [39] |
Wang Y, Geng J, Jiang M, et al. The cardiac electrophysiology effects of higenamine in guinea pig heart[J]. Biomed Pharmacother, 2019, 109: 2348-2356. DOI:10.1016/j.biopha.2018.10.022 |
| [40] |
Zhang CY, Zhang H, Qi QH, et al. Advance on active ingredients and pharmacological action of Chuanxiong Rhizoma[J]. Liaoning J Tradit Chin Med (辽宁中医杂志), 2014, 41: 2264-2266. |
| [41] |
Lv M, Wang TY, Tian XX, et al. Interaction of anti-thrombotic and anti-inflammatory activities of commonly used traditional Chinese medicine for promoting blood circulation and removing blood stasis revealed by network pharmacology analysis[J]. Acta Pharm Sin (药学学报), 2015, 50: 1135-1141. |
| [42] |
Zhao YX, Ding MY, Liu DL. Phenolic acids analysis in ligusticum chuanxiong using HPLC[J]. J Chromatogr Sci, 2005, 43: 389-393. DOI:10.1093/chromsci/43.8.389 |
| [43] |
Luo M, Chen PP, Yang L, et al. Sodium ferulate inhibits myocardial hypertrophy induced by abdominal coarctation in rats:involvement of cardiac PKC and MAPK signaling pathways[J]. Biomed Pharmacother, 2019, 112: 108735. DOI:10.1016/j.biopha.2019.108735 |
| [44] |
Wang G, Dai G, Song J, et al. Lactone component from Ligusticum chuanxiong alleviates myocardial ischemia injury through inhibiting autophagy[J]. Front Pharmacol, 2018, 9: 301. DOI:10.3389/fphar.2018.00301 |
| [45] |
Zhang X, Dong H, Liu Y, et al. Tetramethylpyrazine partially relieves hypoxia-caused damage of cardiomyocytes H9c2 by downregulation of miR-449a[J]. J Cell Physiol, 2019, 234: 15098-15107. DOI:10.1002/jcp.28151 |
| [46] |
Li Y, Song P, Zhu Q, et al. Liguzinediol improved the heart function and inhibited myocardial cell apoptosis in rats with heart failure[J]. Acta Pharmacol Sin, 2014, 35: 1257-1264. DOI:10.1038/aps.2014.75 |
| [47] |
Huang L, Cai H, Zhuang J, et al. Fuling Sini decoction for patients with chronic heart failure:a protocol for a systematic review and meta-analysis[J]. Medicine (Baltimore), 2018, 97: e13692. DOI:10.1097/MD.0000000000013692 |
| [48] |
Zhang Y, Bauersachs J, Langer HF. Immune mechanisms in heart failure[J]. Eur J Heart Fail, 2017, 19: 1379-1389. DOI:10.1002/ejhf.942 |
| [49] |
Li FF, Yuan Y, Liu Y, et al. Pachymic acid protects H9c2 cardiomyocytes from lipopolysaccharide-induced inflammation and apoptosis by inhibiting the extracellular signal-regulated kinase 1/2 and p38 pathways[J]. Mol Med Rep, 2015, 12: 2807-2813. DOI:10.3892/mmr.2015.3712 |
| [50] |
Wu ZL, Ren H, Lai WY, et al. Sclederma of Poria cocos exerts its diuretic effect via suppression of renal aquaporin-2 expression in rats with chronic heart failure[J]. J Ethnopharmacol, 2014, 155: 563-571. DOI:10.1016/j.jep.2014.05.054 |
| [51] |
Su XD, Li W, Ma JY, et al. Chemical constituents from Epimedium koreanum Nakai and their chemotaxonomic significance[J]. Nat Prod Res, 2018, 32: 2347-2351. DOI:10.1080/14786419.2017.1405412 |
| [52] |
Yang XH, Li L, Xue YB, et al. Flavonoids from Epimedium pubescens:extraction and mechanism, antioxidant capacity and effects on CAT and GSH-Px of drosophila melanogaster[J]. PeerJ, 2020, 8: e8361. DOI:10.7717/peerj.8361 |
| [53] |
Liu XY, Liao HH, Feng H, et al. Icariside Ⅱ attenuates cardiac remodeling via AMPKalpha2/mTORC1 in vivo and in vitro[J]. J Pharmacol Sci, 2018, 138: 38-45. DOI:10.1016/j.jphs.2018.08.010 |
| [54] |
Wu Y, Qian Z, Fu S, et al. Icariside Ⅱ improves left ventricular remodeling in spontaneously hypertensive rats by inhibiting the ASK1-JNK/p38 signaling pathway[J]. Eur J Pharmacol, 2018, 819: 68-79. DOI:10.1016/j.ejphar.2017.11.035 |
| [55] |
Schultheiss HP, Fairweather D, Caforio ALP, et al. Dilated cardiomyopathy[J]. Nat Rev Dis Primers, 2019, 5: 32. DOI:10.1038/s41572-019-0084-1 |
| [56] |
Song YH, Li BS, Chen XM, et al. Ethanol extract from Epimedium brevicornum attenuates left ventricular dysfunction and cardiac remodeling through down-regulating matrix metalloproteinase-2 and -9 activity and myocardial apoptosis in rats with congestive heart failure[J]. Int J Mol Med, 2008, 21: 117-124. |
| [57] |
Yang L, Peng C, Xia J, et al. Effects of icariside Ⅱ ameliorates diabetic cardiomyopathy in streptozotocin-induced diabetic rats by activating Akt/NOS/NF-kappaB signaling[J]. Mol Med Rep, 2018, 17: 4099-4105. |
| [58] |
Zhai M, He L, Ju X, et al. Icariin acts as a potential agent for preventing cardiac ischemia/reperfusion injury[J]. Cell Biochem Biophys, 2015, 72: 589-597. DOI:10.1007/s12013-014-0506-3 |
| [59] |
Chen MH, Chen XJ, Wang M, et al. Ophiopogon japonicus——a phytochemical, ethnomedicinal and pharmacological review[J]. J Ethnopharmacol, 2016, 181: 193-213. DOI:10.1016/j.jep.2016.01.037 |
| [60] |
Fan S, Zhang J, Xiao Q, et al. Cardioprotective effect of the polysaccharide from Ophiopogon japonicus on isoproterenol-induced myocardial ischemia in rats[J]. Int J Biol Macromol, 2020, 147: 233-240. DOI:10.1016/j.ijbiomac.2020.01.068 |
| [61] |
Zhang J, Fan S, Mao Y, et al. Cardiovascular protective effect of polysaccharide from Ophiopogon japonicus in diabetic rats[J]. Int J Biol Macromol, 2016, 82: 505-513. DOI:10.1016/j.ijbiomac.2015.09.069 |
| [62] |
Wu Z, Zhao X, Miyamoto A, et al. Effects of steroidal saponins extract from Ophiopogon japonicus root ameliorates doxorubicin-induced chronic heart failure by inhibiting oxidative stress and inflammatory response[J]. Pharm Biol, 2019, 57: 176-183. DOI:10.1080/13880209.2019.1577467 |
| [63] |
Zhang YY, Meng C, Zhang XM, et al. Ophiopogonin D attenuates doxorubicin-induced autophagic cell death by relieving mitochondrial damage in vitro and in vivo[J]. J Pharmacol Exp Ther, 2015, 352: 166-174. DOI:10.1124/jpet.114.219261 |
| [64] |
He F, Xu BL, Chen C, et al. Methylophiopogonanone A suppresses ischemia/reperfusion-induced myocardial apoptosis in mice via activating PI3K/Akt/eNOS signaling pathway[J]. Acta Pharmacol Sin, 2016, 37: 763-771. DOI:10.1038/aps.2016.14 |
| [65] |
Bacchetti T, Morresi C, Bellachioma L, et al. Antioxidant and pro-oxidant properties of Carthamus Tinctorius, hydroxy safflor yellow A, and safflor yellow A[J]. Antioxidants (Basel), 2020, 9: 119. DOI:10.3390/antiox9020119 |
| [66] |
Bunbupha S, Pakdeechote P, Maneesai P, et al. Carthamus Tinctorius L. extract attenuates cardiac remodeling in L-NAME-induced hypertensive rats by inhibiting the NADPH oxidase-mediated TGF-beta1 and MMP-9 pathway[J]. Ann Anat, 2019, 222: 120-128. DOI:10.1016/j.aanat.2018.12.006 |
| [67] |
Zou J, Wang N, Liu M, et al. Nucleolin mediated pro-angiogenic role of hydroxysafflor yellow A in ischaemic cardiac dysfunction:post-transcriptional regulation of VEGF-A and MMP-9[J]. J Cell Mol Med, 2018, 22: 2692-2705. DOI:10.1111/jcmm.13552 |
| [68] |
Min J, Wei C. Hydroxysafflor yellow A cardioprotection in ischemia-reperfusion (I/R) injury mainly via Akt/hexokinase Ⅱ independent of ERK/GSK-3beta pathway[J]. Biomed Pharmacother, 2017, 87: 419-426. DOI:10.1016/j.biopha.2016.12.113 |
| [69] |
Hu T, Wei G, Xi M, et al. Synergistic cardioprotective effects of Danshensu and hydroxysafflor yellow A against myocardial ischemia-reperfusion injury are mediated through the Akt/Nrf2/HO-1 pathway[J]. Int J Mol Med, 2016, 38: 83-94. DOI:10.3892/ijmm.2016.2584 |
| [70] |
Chen WZ, Wang ZM, Dong YL, et al. Studies on tolerance toward hypoxia and cardiac hemodynamics of salvia miltiorrhza composita in animals[J]. Acta Pharm Sin (药学学报), 1979, 14: 326-332. |
| [71] |
Wang X, Li C, Wang Q, et al. Tanshinone ⅡA restores dynamic balance of autophagosome/autolysosome in doxorubicin-induced cardiotoxicity via targeting Beclin1/LAMP1[J]. Cancers (Basel), 2019, 11: 910. DOI:10.3390/cancers11070910 |
| [72] |
Zhang X, Wang Q, Wang X, et al. Tanshinone ⅡA protects against heart failure post-myocardial infarction via AMPKs/mTOR-dependent autophagy pathway[J]. Biomed Pharmacother, 2019, 112: 108599. DOI:10.1016/j.biopha.2019.108599 |
| [73] |
Jiang B, Li D, Deng Y, et al. Salvianolic acid A, a novel matrix metalloproteinase-9 inhibitor, prevents cardiac remodeling in spontaneously hypertensive rats[J]. PLoS One, 2013, 8: e59621. DOI:10.1371/journal.pone.0059621 |
| [74] |
Li XL, Fan JP, Liu JX, et al. Salvianolic acid A protects neonatal cardiomyocytes against hypoxia/reoxygenation-induced injury by preserving mitochondrial function and activating Akt/GSK-3beta signals[J]. Chin J Integr Med, 2019, 25: 23-30. DOI:10.1007/s11655-016-2747-z |
| [75] |
Xu T, Wu X, Chen Q, et al. The anti-apoptotic and cardioprotective effects of salvianolic acid a on rat cardiomyocytes following ischemia/reperfusion by DUSP-mediated regulation of the ERK1/2/JNK pathway[J]. PLoS One, 2014, 9: e102292. DOI:10.1371/journal.pone.0102292 |
 2020, Vol. 55
2020, Vol. 55


