2. 中国医学科学院、北京协和医学院药物研究所药物晶型研究中心, 晶型药物研究北京市重点实验室, 北京 100050
2. Beijing Key Laboratory of Polymorphic Drugs, Center of Pharmaceutical Polymorphs, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
维甲酸X受体(RXR)有3种亚型(RXRα、RXRβ和RXRγ), 属于核受体[1]。它们是配体激活转录因子, 可以与其他核激素受体结合形成异二聚体调控细胞的生长与分化[2]。蓓萨罗丁(BEX)是一种新型维甲酸类似物[2], 可与RXR特异性结合。1999年, BEX口服软胶囊和外用凝胶剂被FDA批准主要治疗皮肤T细胞淋巴瘤。近年来, 大量研究报道它在其他癌症中存在治疗效果, 例如非小细胞肺癌[3]、多形性胶质母细胞瘤[4]、三阴性乳腺癌[5]和甲状腺癌[6]等。此外, BEX可改善AD小鼠空间认知[7], 在脑卒中模型中起神经保护作用[8]。同时, BEX在脑损伤模型中具有改善神经功能[9]、抑制神经毒性[10]并促进神经元发育[11]等功能。BEX属于生物药物分类系统(BSC) Ⅱ类化合物[12], 低的溶解度导致其生物利用度很差, 其药物研发和临床应用受到限制[13, 14]。
目前报道提高BEX生物利用度的技术只有制备纳米晶体[13, 14], 此技术还需要很长的成熟过程。作为提高BSC Ⅱ类化合物溶解度及生物利用度的一种有效方法[15], 化合物无定型状态制备技术目前还没有应用于改善BEX的溶解度及生物利用度的研究。无定型状态药物的制备一般以高分子材料作为载体材料制备成固体分散体。药物固体分散系统是活性药物分子与共无定型配体以一定比例, 通过分子间相互作用形成的无定型物质。其通过将粒径减小到微晶或分子水平来增加水溶性差的药物溶解度和口服生物利用度[16, 17]。化合物通过形成共无定型物, 一方面可以改善其理化性质, 提高临床治疗效果, 另一方面可以丰富其结晶形式。甘油三酯通过与聚乙烯吡咯烷酮(PVP)和聚乙二醇4000 (PEG4000)制备成固体分散体, 纯化合物的体外溶出度提高了4.35倍[18]。另一项研究发现白藜芦醇制备成固体分散体可使其在SD大鼠体内的生物利用度由0.9% ± 0.1%提高至10.5% ± 0.9%[19]。
本文首次得到BEX与PVP-K30共无定型物, 并通过粉末X射线衍射和红外光谱分析的方法对其结构进行表征, 溶出度实验结果显示共无定型物的溶解性优于BEX。通过建立LC-MS检测方法, 对SD大鼠分别固体灌胃给予30 mg·kg-1 BEX原药晶Ⅰ型和BEX-PVP-K30共无定型物后的血浆及心、肝、脾、肺、肾、脑(皮层/其他)中药物含量差异检测。研究结果对BEX新剂型的开发提供指导。
材料与方法仪器 球磨机(Pulverisette 6, Fritsch, 德国); Rigaku D/max-2550粉末X射线衍射仪; 傅立叶变换红外-近红外光谱仪(美国Perkin Elmer Spectrum 400); TDTF-RC8MD溶出实验仪; Agilent 1200高效液相色谱仪; Agilent 6110单四极杆质谱仪; 电子分析天平(梅特勒-托利多仪器有限公司)。
化学试剂 BEX购自北京偶合科技有限公司(北京, 中国) (批号: 20190916); PVP-K30购自博爱新开源制药股份有限公司(河南, 中国) (批号: P170315012);熊果酸(纯度 > 98%)作为内标(IS)购自北京百灵威科技有限公司(批号: LE20R48);乙腈和甲醇都是LC-MS级(J. T. Baker, USA); 氨水(HPLC级)购自J & K科技公司(北京, 中国); 纯净水购自娃哈哈有限公司(北京, 中国); Milli-Q Reagent water system纯水机(MA, USA)用来净化水。其他所有试剂至少满足分析纯。
实验动物 SPF级SD大鼠84只, 雌雄各半, 200~220 g, 购自北京维通利华实验动物技术有限公司(生产批号: 2016-0006)。实验动物福利及流程遵循中国医学科学院、北京协和医学院实验动物伦理委员会批准。
共无定型物样品制备 通过前期大量筛选, 选择水溶性好、稳定性好、无毒副作用的PVP-K30作为共无定型物辅料。在蓓萨罗丁和PVP-K30质量比分别为5:1、3:1、3:2和1:1四个条件下, 筛选出1:1的质量比, 其具有工艺稳定性好, 消耗时间短及样品稳定特征。制备方法为球磨法。将BEX (1.5 g)和PVP-K-30 (1.5 g)的混合物在球磨机中以400 r·min-1条件研磨约6 h, 球料比5:1, 得到BEX-PVP-K30共无定型物。
X射线粉末衍射 对BEX、PVP-K30以及二者的物理混合物和共无定形物进行粉末X射线衍射检测, 检测条件为: CuKα辐射, 石墨单色器, 管压40 kV, 管流150 mA, 2θ扫描范围3°~80°, 扫描速度8°/分, 步长0.02°。
红外光谱检测 对BEX、PVP-K30和共无定形物样品进行红外吸收光谱检测, 采用衰减全反射技术直接测定, 波长范围为4 000~650 cm-1。
溶出度检测 实验以纯水为溶出介质, 每篮900 mL纯水, 分别加入BEX 60 mg, 或共无定型物120 mg, 在37 ℃、50 r·min-1条件下溶出。于0、15、30、60、90、120、180、240、360和480 min取滤液, 待测。HPLC检测条件: Eclipse Plus-C18色谱柱(2.1 mm×100 mm, 3.5 µm, 美国安捷伦公司), 柱温30 ℃, 流动相乙腈:水(90:10), 检测波长255 nm, 以恒定流速1 mL·min-1等度洗脱。
LC-MS条件 美国Agilent 1200高效液相色谱仪选择Eclipse Plus-C18色谱柱(2.1 mm×100 mm, 3.5 µm), 柱温30 ℃。流动相为乙腈:水(0.1%氨水) = 30:70, 以恒定流速0.3 mL·min-1洗脱。样品进样量10 µL。高效液相色谱仪通过ESI源连接到Agilent 6110质谱仪上。质谱仪采用负离子监测模式运行。离子源参数设置如下:喷雾器压力35.0 psig, 毛细管压力3 kV, 干燥器温度350 ℃, 干燥气流10.0 L·min-1。BEX和IS的荷质比(m/z)分别为347和455, 破碎电压分别优化至130 V和140 V。
BEX及IS溶液配置 精密称取BEX和IS, 分别用甲醇配成500 μg·mL-1储备溶液, 并储存在-40 ℃。将BEX储备溶液通过甲醇梯度稀释至0.25、0.5、1、2、3、5、10、12.5和15 μg·mL-1工作浓度。IS储备溶液通过甲醇稀释至10 μg·mL-1工作浓度。
标准曲线制备 标准曲线浓度范围: 0.025~1.5 μg·mL-1。选择0.05、0.3和1.0 μg·mL-1 3个浓度作为质控样品浓度。分别取样品工作溶液10 μL和IS工作溶液(10 μg·mL-1)加至80 μL空白血浆中。依次加入乙腈300 μL和乙酸乙酯500 μL到混合液中并充分振荡5 min, 1.34×104 r·min-1离心10 min以提取BEX和IS。将上清液880 μL转移到新的离心管中, 氮吹仪吹干。加入流动相100 μL并充分振荡进行复溶, 1.34×104 r·min-1离心10 min, 取上清液10 μL进样, LC-MS系统检测。
血浆和组织样品的制备 取IS工作溶液(10 μg·mL-1) 10 μL加至100 μL血浆或组织样品中, 依次加入乙腈300 μL和乙酸乙酯500 μL以提取分析物。混合物被充分振荡并以1.34×104 r·min-1离心10 min。将上清液880 μL转移到新的离心管中, 氮吹仪吹干。加入流动相100 μL振荡复溶, 1.34×104 r·min-1离心10 min, 取上清液10 μL注入LC-MS系统检测。
药物代谢动力学检测方法验证
方法特异性 验证特异性的目的是确保生物样品中没有内源性干扰。通过检测6个独立的空白血浆样品色谱图、空白血浆样品加入BEX和IS工作溶液色谱图以及大鼠给药后血浆样品色谱图来实现。
方法线性、精密度和准确性 通过分析标准曲线获得线性。标准曲线由峰面积比(BEX/IS)与BEX的标准浓度进行加权最小二乘线性回归得到。标准曲线的相关系数(r2)满足0.99或更高。此外, 定量下限满足信噪比至少为10:1, 要求日内和日间准确度(RE%)和精密度(RSD%)分别小于20%。通过一天对3个浓度质控样品进行5次测定来获得日内准确度和精密度。通过连续5天测定3个浓度质控样品来确定日间准确度和精密度[20]。
方法回收率和基质效应 BEX回收率是指质控样品中BEX峰面积值与直接溶解在空白血浆制备的上清液中的峰面积值之比。基质效应是指在制备的空白血浆上清液中溶解的BEX峰面积值与在流动相中溶解的峰面积值之比。回收率和基质效应应保持在100% ± 20%[21]。
方法稳定性 在以下条件下对3个低、中和高浓度质控样品进行5次重复分析:处理前将新鲜血浆样品在冰上放置6 h; 在-40 ℃和25 ℃之间反复冻融3个循环; 在-40 ℃冻存30天; 将处理好的血浆样品在自动进样器中放置24 h; 使用高于定量上限的浓度检测稀释稳定性(稀释因子为10)。样品可接受准确度和精密度分别在±15%和15%之内。
药代动力学研究 12只SD大鼠随机分为两组, 雌雄各半, 自由饮水, 实验前12 h禁食, 给药4 h后恢复进食。两组大鼠分别通过固体灌胃针给予30 mg·kg-1 BEX原药晶Ⅰ型和BEX-PVP-K30共无定型(以BEX的含量计算)。BEX给药组在给药前及给药后0.25、0.75、1、1.5、2、3、4、6、7、12、24、36和48 h, BEX-PVP-K30给药组在给药前及给药后0.25、0.75、1、1.5、2、3、4、6、7、12和24 h于大鼠眼底静脉丛取血置于含有肝素的离心管中, 4 ℃以5 000 r·min-1离心10 min, 收集血浆并储存在-40 ℃条件, 待LC-MS分析。
组织分布研究 72只SD大鼠随机分为两组, 雌雄各半, 自由饮水, 实验前12 h禁食, 给药4 h后恢复进食。两组大鼠分别通过固体灌胃针给予30 mg·kg-1 BEX原药晶Ⅰ型和BEX-PVP-K30共无定型(以BEX的含量计算)。各组给药1、2、4、6、12和24 h后, 脱颈处死大鼠, 快速分离主要器官, 包括心、肝、脾、肺、肾、脑(皮层/其他)。使用生理盐水轻轻冲洗组织以减少血液干扰并立即吸干组织表面的水分, 同时在显微镜下轻轻剥离脑血管。所有组织样品均存储在-40 ℃条件, 待LC-MS分析。
统计分析 使用DAS2.0软件进行非房室药代动力学参数分析, 包括峰浓度(Cmax)、达峰时间(tmax)、药时曲线下面积(AUC)、消除半衰期(t1/2)和平均滞留时间(MRT)。所有参数均表示为平均值±SD。统计分析和比较使用Graph Pad软件进行。P < 0.05结果被认为具有统计学差异。
结果与讨论 1 1共无定型粉末X射线衍射分析经前期共无定型物辅料的筛选及BEX与PVP-K30质量比的确定, 通过球磨法制备了BEX-PVP-K30共无定型物。粉末X射线衍射分析结果如图 1所示, BEX-PVP-K30共无定型物为无定型, 在3°~40°内存在2个弥散衍射峰, 位置分别为14.9°和18.5°; BEX原料药为晶态, 在4.9°、11.5°、12.6°、14.7°、17.2°、23.3°、27.9°和29.7°等处存在特征峰; PVP-K30图谱在3°~40°内存在2个弥散衍射峰, 位置分别为11.7°和19.9°。物理混合样品图谱为两者叠加图谱。共无定型物图谱与BEX、PVP-K30及物理混合物均存在明显区别。
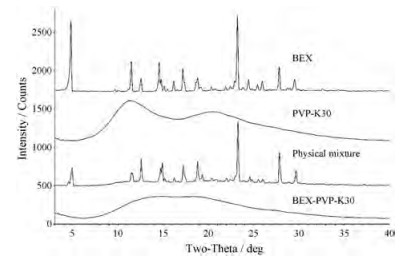
|
Figure 1 Powder X-ray diffraction (PXRD) patterns of bexarotene (BEX), polyvinylpyrrolidone K30 (PVP-K30), physical mixture of BEX and PVP-K30 and BEX-PVP-K30 co-amorphous |
红外光谱图谱结果如图 2所示, 共无定型物与BEX及PVP-K30的红外光谱图存在明显差异, 羰基的伸缩振动峰频率降低, 在1 500~600 cm-1指纹区存在明显差异。
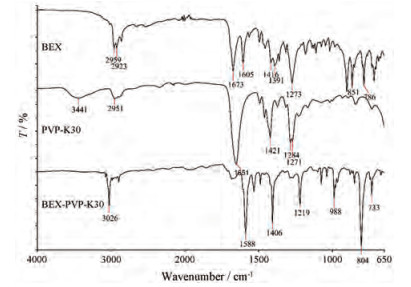
|
Figure 2 Comparison of the infrared spectroscopy of BEX, PVP-K30 and BEX-PVP-K30 co-amorphous |
体外溶出度结果表明(图 3), BEX的溶出度较低, 8 h溶出浓度约为0.24 μg·mL-1。共无定型样品明显提高BEX溶出速率, 提高BEX溶出度4.17倍。
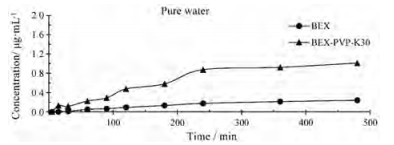
|
Figure 3 Comparison of the vitro dissolution profile of pure BEX and BEX-PVP-K30 co-amorphous |
BEX和IS在负离子检测模式比在正离子检测模式具有更好的特异性和灵敏度。在全扫描模式下, BEX的质谱图分别在m/z 347处指示[M-H]-离子, 而IS在455处指示[M-H]-离子(图 4)。
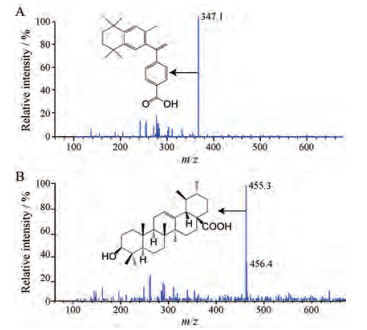
|
Figure 4 Full-scan mass spectrometry of BEX with [M-H]- ion at m/z 347 (a) and ursolic acid (internal standard, IS) with an [M-H]- ion at 455 (b) |
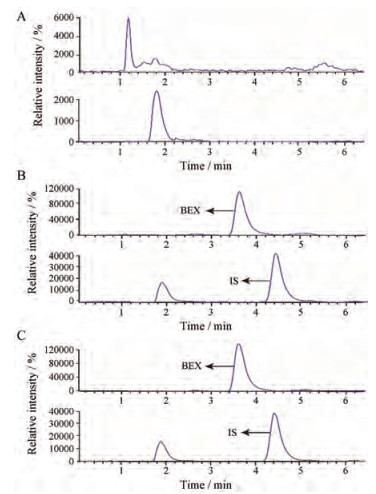
结果表明, BEX和IS的保留时间分别为3.7和4.5 min (图 5)。在保留时间范围内, 空白血浆样品中未检测到明显的峰, 没有明显的内源性干扰, 可满足定量测定的要求。
|
Figure 5 BEX and IS ion monitoring chromatogram. a: Blank rat plasma samples; b: Blank plasma samples added BEX (1 μg·mL-1) and spiked with IS; c: Plasma sample of rat orally administrated with BEX (30 mg·kg-1) and spiked with IS |
标准曲线浓度范围为25 ng·mL-1~1.5 µg·mL-1。表 1列出了每种生物样品的回归方程。最低定量下限的偏差在±20%以内, 其他标准浓度的偏差均在±15%以内。日内和日间精密度分别 < 9%和7%, 标准浓度的准确度分别在±11%和±7%以内。结果提示该方法可靠, 可重复用于定量测定和分析。
| Table 1 Typical equations of plasma and tissues calibration curves (n = 5) |
BEX在3个质控浓度下的回收率分别为91.1% ± 8.38%、89.7% ± 7.89%、95.26% ± 3.62%, 基质效应分别为100.56% ± 8.07%、107.32% ± 9.57%和105.55% ± 3.71%。表明此提取方法稳定, 样品中的基质对BEX检测无干扰。
5.4 方法稳定性BEX的3个质控浓度在考察条件下的RE介于-12.03%~10.45%, RSD介于0.92%~6.11%, 表明BEX样品储存和处理过程稳定, 此方法能够满足SD大鼠血浆及组织中BEX的测定。
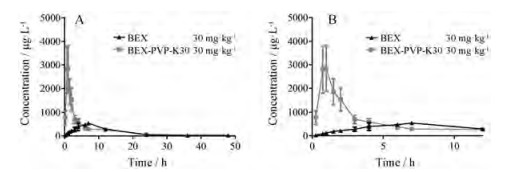
6 药代动力学研究两组药时曲线如图 6所示, 血浆样品中BEX的药代动力学参数列于表 2。与BEX给药组相比, BEX-PVP-K30给药组的AUC0-t由7 034.89 μg·L-1·h提升至10 158.14 μg·L-1·h, 通过t检验发现AUC虽有提高但没有显著性差异, 提示体外溶出度提高不等同于体内吸收增强。但BEX-PVP-K30给药组的达峰时间由7.33 h显著提前至0.9 h, Cmax由627.76 μg·L-1显著提高至3 011.88 μg·L-1, 同时MRT由11.33 h显著缩短至6.34 h, 提示化合物分子在胃肠道吸收参数受其空间构象及排列规律影响。BEX-PVP-K30改变了BEX原有的吸收特征, 能迅速提高药物在生物体内的血药浓度, 从而发挥药物的治疗作用。结果提示, 可进一步探究开发BEX缓控释制剂, 使血药浓度持续处于有效浓度范围。
|
Figure 6 The mean plasma concentration-time curve of BEX in SD rats orally administrated with BEX (30 mg·kg-1) and BEX-PVP-K30 (equivalent to 30 mg·kg-1 BEX, A), the magnification of the drug time curve before 12 h (B) |
| Table 2 Pharmacokinetic parameters of BEX in SD rats orally administrated with BEX (30 mg·kg-1) and BEX-PVP-K30 (equivalent to 30 mg·kg-1 BEX). n = 6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs BEX |
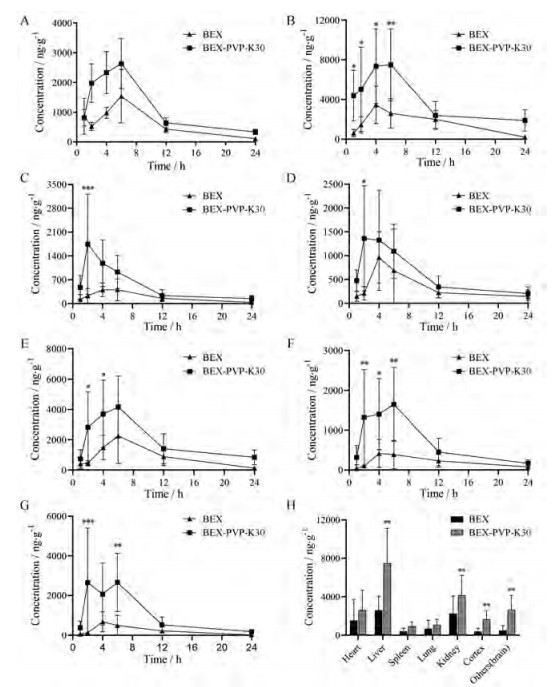
BEX组织分布结果如图 7所示, 与BEX给药组相比, BEX-PVP-K30共无定型物给药组显著提高BEX在脑、肝和肾中含量, 其中以脑组织中含量提升最为显著。BEX-PVP-K30改变了原料药在组织中分布的特征, 各个组织中BEX的浓度变化趋势与在血浆中的浓度变化趋势一致。肝脏和肾脏中BEX浓度显著性提高可能受血浆中浓度的影响。值得注意的是, BEX在脑组织分布情况为本文首次报道, 其中BEX-PVP-K30显著提高脑组织中BEX含量, 提示表征的BEX-PVP-K30共无定型物增加血脑屏障通透性, 又或者限制BEX在脑中的排出速率并提高BEX的浓度, 具体相关机制有待进一步探究。同时, 此结果进一步提示BEX-PVP-K30共无定型物有治疗脑部疾病的可能。
|
Figure 7 The mean concentration of BEX in tissues of SD rats orally administrated with BEX (30 mg·kg-1), BEX-PVP-K30 (equivalent to 30 mg·kg-1 BEX) at 1, 2, 4, 6, 12, 24 h. A: Heart; B: Liver; C: Spleen; D: Lung; E: Kidney; F: Cortex; G: Others (brain); H: The mean concentration of BEX in tissues for 6 h after oral administration BEX (30 mg·kg-1), BEX-PVP-K30 (equivalent to 30 mg·kg-1 BEX) in rats. n = 6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs BEX |
本文首次制备BEX-PVP-K30共无定型物, 其具有提高BEX溶解度及改善BEX药物代谢动力学的特征。本研究对BEX新剂型开发及临床治疗脑部疾病起到指导作用。
BEX与PVP-K30通过分子间相互作用形成共无定型物, 使BEX体外溶出度提高了4.17倍。进一步通过X射线衍射及红外光谱分析表征显示两种结构存在明显的差别。
同时本研究建立了一种特异性强、线性良好、精密度和准确度可满足测定要求的LC-MS检测方法, 可用于比较在给予SD大鼠BEX和共无定型物后, BEX的生物利用度和组织分布的差异。共无定型物使BEX在SD大鼠体内生物利用度提高了44%, 同时可能受分子间排列顺序变化影响导致原药原有的组织分布特征发生改变, 各组织中药物含量都有提升。结果表明BEX-PVP-K30既改善了BEX理化性质, 同时也丰富了BEX晶体形式。
基于本文的研究结果仍需要对共无定型物分子间排列顺序和粒径的特征以及产生的药物代谢动力学差异机制做进一步探究。
| [1] |
Shen D, Yu X, Wu Y, et al. Emerging roles of bexarotene in the prevention, treatment and anti-drug resistance of cancers[J]. Expert Rev Anticancer Ther, 2018, 18: 487-499. DOI:10.1080/14737140.2018.1449648 |
| [2] |
Qu L, Tang X. Bexarotene:a promising anticancer agent[J]. Cancer Chemother Pharmacol, 2010, 65: 201-205. DOI:10.1007/s00280-009-1140-4 |
| [3] |
Ai X, Mao F, Shen S, et al. Bexarotene inhibits the viability of non-small cell lung cancer cells via slc10a2/PPARgamma/PTEN/mTOR signaling pathway[J]. BMC Cancer, 2018, 18: 407-417. DOI:10.1186/s12885-018-4224-x |
| [4] |
Heo JC, Jung TH, Lee S, et al. Effect of bexarotene on differentiation of glioblastoma multiforme compared with ATRA[J]. Clin Exp Metastasis, 2016, 33: 417-429. DOI:10.1007/s10585-016-9786-x |
| [5] |
Chen L, Long C, Nguren J, et al. Discovering alkylamide derivatives of bexarotene as new therapeutic agents against triple-negative breast cancer[J]. Bioorg Med Chem Lett, 2018, 28: 420-424. DOI:10.1016/j.bmcl.2017.12.033 |
| [6] |
Haugen BR, Larson LL, Pugazhenthi U, et al. Retinoic acid and retinoid X receptors are differentially expressed in thyroid cancer and thyroid carcinoma cell lines and predict response to treatment with retinoids[J]. J Clin Endocrinol Metab, 2004, 89: 272-280. DOI:10.1210/jc.2003-030770 |
| [7] |
Zhang T, Lu H. Effect of bexarotene on spatial cognition, impairment in memory and learning and hippocampal nerve regeneration of Aβ25-35 mice[J]. Chin J Neuromed (中华神经医学杂志), 2014, 13: 478-483. |
| [8] |
Huuskonen MT, Loppi S, Dhungana H, et al. Bexarotene targets autophagy and is protective against thromboembolic stroke in aged mice with tauopathy[J]. Sci Rep, 2016, 6: 33176-33190. DOI:10.1038/srep33176 |
| [9] |
Zhong J, Cheng C, Liu H, et al. Bexarotene protects against traumatic brain injury in mice partially through apolipoprotein E[J]. Neuroscience, 2017, 343: 434-448. DOI:10.1016/j.neuroscience.2016.05.033 |
| [10] |
He J, Liu H, Zhong J, et al. Bexarotene protects against neurotoxicity partially through a PPARγ-dependent mechanism in mice following traumatic brain injury[J]. Neurobiol Dis, 2018, 117: 114-124. DOI:10.1016/j.nbd.2018.06.003 |
| [11] |
Mounier A, Georgiev D, Nam KN, et al. Bexarotene-activated retinoid X receptors regulate neuronal differentiation and dendritic complexity[J]. J Neurosci, 2015, 35: 11862-11876. DOI:10.1523/JNEUROSCI.1001-15.2015 |
| [12] |
Branchu S, Rogueda PG A. P., Plumb AP, et al. A decision-support tool for the formulation of orally active, poorly soluble compounds[J]. Eur J Pharm Sci, 2007, 32: 128-139. DOI:10.1016/j.ejps.2007.06.005 |
| [13] |
Chen L, Wang Y, Zhang J, et al. Bexarotene nanocrystal-oral and parenteral formulation development, characterization and pharmacokinetic evaluation[J]. Eur J Pharm Biopharm, 2014, 87: 160-169. DOI:10.1016/j.ejpb.2013.12.005 |
| [14] |
Li L, Liu Y, Wang J, et al. Preparation, in vitro and in vivo evaluation of bexarotene nanocrystals with surface modification by folate-chitosan conjugates[J]. Drug Deliv, 2014, 23: 1-9. |
| [15] |
Kawakami K. Modification of physicochemical characteristics of active pharmaceutical ingredients and application of supersaturatable dosage forms for improving bioavailability of poorly absorbed drugs[J]. Adv Drug Deliv Rev, 2012, 64: 480-495. DOI:10.1016/j.addr.2011.10.009 |
| [16] |
Bothiraja C, Shinde MB, Rajalakshmi S, et al. Evaluation of molecular pharmaceutical and in-vivo properties of spray-dried isolated and rographolide-PVP[J]. J Pharm Pharmacol, 2009, 61: 1465-1472. DOI:10.1211/jpp.61.11.0005 |
| [17] |
Mustapha O, Kim KS, Shafique S, et al. Comparison of three different types of cilostazol-loaded solid dispersion:physicochemical characterization and pharmacokinetics in rats[J]. Colloids Surf B Biointerfaces, 2017, 154: 89-95. DOI:10.1016/j.colsurfb.2017.03.017 |
| [18] |
Shuai S, Yue S, Huang Q, et al. Preparation, characterization and in vitro/vivo evaluation of tectorigenin solid dispersion with improved dissolution and bioavailability[J]. Eur J Drug Metab Pharmacokinet, 2016, 41: 413-422. DOI:10.1007/s13318-015-0265-6 |
| [19] |
Chang CW, Wong CY, Wu YT, et al. Development of a solid dispersion system for improving the oral bioavailability of resveratrol in rats[J]. Eur J Drug Metab Pharmacokinet, 2016, 42: 239-249. |
| [20] |
Zhou QM, Song JK, Xing C, et al. Pharmacokinetics of two kinds of nimodipine crystal tablets in rhesus monkey[J]. Acta Pharm Sin (药学学报), 2017, 52: 1918-1923. |
| [21] |
Song JK, Zhang W, Zhang WK, et al. Pharmacokinetics of salvianolic acid A after single intravenous administration in Rhesus monkey[J]. Acta Pharm Sin (药学学报), 2015, 50: 1142-1147. |
 2020, Vol. 55
2020, Vol. 55


