动物药是指动物的整体或某一部分、动物体的生理或病理产物、动物体的加工品等供药用的一类中药, 具有来源广、活性强、疗效高等特点, 药用价值大[1, 2]。地龙是我国常用的动物药, 《神农本草经》记载“地龙性味寒、咸, 归肺、肾、肝经”, 常用于高热、神昏、惊痫抽搐、肺热喘咳等症状[3]。目前, 国内外学者对于地龙的研究主要集中在其活性成分及药理作用的开发, 随着抗肿瘤、抗血栓、抗心律失常、免疫调节等新功效的不断发现, 其临床应用也越发广泛。然而, 对地龙中的有害物质的研究却鲜有报道。
镉(Cd)和砷(As)属于重金属, 是国际公认的环境污染物, 难以被降解。由于地龙喜好在土壤中生活, 从而导致环境及土壤中的重金属易在地龙体内蓄积, 通过食物链最终对人体产生严重的生理毒性, 包括生殖毒性、肾功能损伤、糖尿病、骨质疏松症等[4-6]。因此, 对于地龙中重金属的残留以及对人体健康风险的研究很有必要。
重金属的毒性评价不仅与其绝对量有关, 更与实际被吸收而发挥作用的含量密切相关[7, 8]。若将中药中本身重金属的含量用于评估其风险, 可能会高估其对人体的危害, 造成产业资源浪费。重金属的生物可给性(bioaccessibility)是重金属在胃肠环境中可以溶出的比例, 是评价其最大经口生物利用度(bioavailability)的指标[9-12]。动物模型是评价重金属生物可给性最有效的手段, 然而动物实验复杂繁琐、实验周期长、费用高。近年来发展起来的体外试验(in vitro)方法, 可以在一定程度上评价生物体对物质的吸收状况。并且体外模拟试验结果可重复性好, 具有高通量、省时、经济、不受医学研究伦理桎棝的优势。
犬肾小管上皮细胞系(MDCK)源自犬肾脏上皮细胞, 最初是由Madin SH和Darby NB从成年雄性西班牙猎犬的肾脏中获得, 这种细胞系是典型的分泌型上皮细胞株, 除了用于肾小管上皮细胞的形态和功能的研究外, MDCK细胞是美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)等权威机构广泛认可的评价药物吸收代谢特性的体外模型[13]。实验比对证明MDKC细胞系在预测药物小肠通透方面具有较好的人体相关性, 并具有高通量、低成本、高效等特点而被广泛应用[14]。本实验采用Transwell培养技术, 以我国传统动物药地龙为研究对象, 首次建立MDCK肠吸收模型, 并通过in vitro PBET (physiologically based extraction test)模拟胃、肠消化的二步消化法[9]建立体外消化/MDCK细胞模型, 并采用ICP-MS法测定地龙中Cd和As的生物可给性, 以期为科学、客观地评价中药中重金属的健康风险以及限量标准的制修定提供依据。
材料与方法仪器与试剂 Agilent 7700X ICP-MS (美国Agilent公司); Mars5微波消解仪(美国CEM公司); Millipore Mill-Q超纯水机、Transwell小室(美国Millipore公司); CK2型倒置显微镜(日本Olympus公司); 细胞培养箱(美国MMM公司); Millicell ERS跨膜电阻仪(美国WPI公司)。Cd和As单元素标准溶液购于国家标准物质研究中心, 浓度为100 μg·mL-1; 内标溶液为100 μg·mL-1的Li、Sc、Ge、Rh、In、Tb、Lu、Bi的混合内标溶液(稀释100倍使用)、调谐溶液为1 μg·L-1 Li、Y、Ce、Tl、Co的混合标准溶液(美国Agilent公司); 硝酸(微电子级)、胃蛋白酶、胆酸钠和苹果酸钠为分析纯(Sigma公司); 胰酶、碳酸氢钠、柠檬酸钠、乳酸、冰醋酸、氢氧化钠均为分析纯(国药集团); 胎牛血清(FBS)、DMEM高糖培养基、0.25%胰酶-EDTA (美国Gibco公司)。
材料 MDCK细胞系由中国科学院上海生命科学研究院细胞资源中心提供; 地龙购买于药材市场和零售药店, 由中国食品药品检定研究院余坤子副研究员鉴定, 样品信息如表 1所示。
| Table 1 Sample collection information in the study |
质谱条件 等离子气流量: 15.0 L·min-1; 雾化室温度: 2 ℃; 蠕动泵0.20 r·s-1; 辅助气流量: 0.8 L·min-1; 载气流量: 0.8 L·min-1; He气流量: 5 mL·min-1; 射频功率: 1 550 W; 采样深度: 10 mm; 重复次数: 3次; 扫描次数: 100次。
供试品溶液和空白对照溶液的制备 取药材粉碎, 精密称取药材粉末0.5 g, 过三号筛, 置微波消解罐中, 加硝酸8.0 mL, 按《中华人民共和国药典》2015年版四部通则“2321铅、镉、砷、汞、铜测定法”消解样品, 制备供试品溶液, 同法同时制备试剂空白溶液。
检测方法的确认 由于所采用的方法为《中华人民共和国药典》2015年版四部通则通用方法, 因此仅以随行质量控制(包括精密度实验、同位素内标实验及随行回收实验)来确认方法的适用性, 结果均符合残留检测的要求。
体外模拟胃肠消化
提取胃液的制备以及地龙中Cd和As溶出率的考察样品粉碎, 过50目筛, 分别精密称取6批地龙, 每批2份, 每份0.5 g, 加入模拟胃液(由胃蛋白酶1.25 g、柠檬酸钠0.5 g、苹果酸钠0.5 g、乳酸420 μL和乙酸500 μL配制而成, 溶解后定容至1 L, 并用盐酸调节至pH 2.0) 50 mL。通氩气1~2 min, 模拟胃肠中的厌氧环境。在37 ℃的恒温水浴中振荡1 h (100 r·min-1), 离心5 min (4 000 r·min-1), 精密量取上清液25 mL, 电热板低温浓缩至约3 mL, 冷却后加入硝酸5 mL, 置微波消解仪中消解。待消解液冷却后用超纯水定容至50 mL量瓶中, 待测。同法同时制备试剂空白溶液。
提取肠液的制备以及地龙中Cd和As溶出率的考察胃液提取结束后, 向残渣中加入50 mL模拟肠液(由0.5 g胰酶和1.75 g胆酸钠配制而成, 溶解后定容至1 L, 再用NaOH溶液将pH值调至7.0)。在37 ℃的恒温水浴中振荡4 h (100 r·min-1), 离心5 min (4 000 r·min-1), 精密量取上清液25 mL, 电热板低温浓缩至3 mL左右, 冷却后加入硝酸5 mL, 置微波消解仪中进行消解。待消解液冷却后用超纯水定容至50 mL量瓶中, 待测。同法同时制备试剂空白溶液。
基于MDCK细胞模型的Cd和As生物可给性的考察
MDCK细胞培养 将MDCK细胞置于T75培养瓶内, 以含10% FBS的DMEM高糖培养液, 于37 ℃、5% CO2、相对湿度90%的培养箱中培养, 培养液隔天更换。
MDCK细胞Transwell模型的建立 当MDCK细胞生长融合至80%以上时, 以0.25% EDTA-胰酶消化, 调整细胞密度至4×105·mL-1, 接种于Transwell聚碳酸酯膜于24孔板中培养。在肠腔室(apical, AP)每孔加入细胞悬液0.5 mL, 基底室(basolateral, BL)每孔加入0.5 mL新鲜培养液, 培养4天后给药, 给药前24 h换液。
跨膜电阻(transepithelial electrical resistance, TEER)值的测定 从培养箱中取出Transwell 24孔板, 在室温条件下平衡0.5 h, 将用培养液平衡过的电极垂直插入细胞培养小室内, 待示数稳定时记录读数。
Cd和As生物可给性的测定 吸弃Transwell 24孔板中的培养液, 取“提取肠液”0.5 mL, 加入到肠腔室中, 基底室加入培养液0.5 mL。将Transwell 24孔板在37 ℃、5% CO2、相对湿度90%的恒温培养箱中培养2 h。吸出培养液过膜后引入ICP-MS分析。
风险评估
危害识别和危害特征描述 食品添加剂联合专家委员会(JECFA)第73次会议将Cd的每月可耐受摄入量(PTMI)修改为每千克体重25 μg·kg-1 [15]。As的每周可耐受摄入量(PTWI)被JECFA撤销, JECFA提出由无机砷导致肺癌发病率比背景值增长0.5%的基准剂量下限(BMDL0.5)为每千克体重3.0 µg·kg-1。
暴露评估 每千克体重Cd或As日暴露量的计算公式:
风险特征描述 采用危害指数(HI)法对于Cd进行风险特征描述。按照下列公式计算HI: HI = Exp×10/HBGV (2)。公式(2)中HI为危害指数; Exp为公式(1)计算得到的日暴露量(μg·kg-1); 10为安全因子[17], 表示每日由中药材及其制品中摄取的重金属的量不大于日总暴露量(包括食物和饮用水)的10%; HBGV为Cd的健康指导值(μg·kg-1), HBGV = PTMI/30。若HI≤1, 中药材中重金属的健康风险较低; 若H > 1, 风险应予以关注。采用暴露限制(MOE)法对于As进行风险特征描述, 按照下列公式计算: MOE = BMDL/(Exp×10) (3)。公式(3)中MOE为暴露限值; Exp为公式(1)计算得到的日暴露量(μg·kg-1); 10为安全因子; BMDL为As的基准剂量下限。若MOE > 1, 中药材中重金属的健康风险较低; 若MOE≤1, 风险应予以关注。
结果 1 MDCK Transwell细胞模型的评价MDCK细胞种植到Transwell培养板后4天后, TEER值> 200 Ω·cm2, 说明细胞单层的紧密性良好, 可用于下一步的实验。
2 Cd和As的残留总量、生物可给量和生物可给性结果提取前以及采用PBET法模拟胃肠消化提取后地龙中Cd和As的残留总量和胃相生物可给浓度结果如表 2所示。地龙中Cd和As的残留总量分别为8.319~33.606 mg·kg-1和0.532~16.412 mg·kg-1。模拟胃相消化后, 6批地龙在胃相中Cd和As的生物可给浓度分别为4.168~12.624 mg·kg-1和0.150~5.481 mg·kg-1。经MDCK细胞转运后, 地龙中Cd的生物可给浓度为1.334~21.562 mg·kg-1; As的生物可给浓度为0.021~7.644 mg·kg-1 (表 2)。经MDCK细胞转运后, 6批地龙中Cd的生物可给性在10.13%~64.16%; As的生物可给性在2.72%~46.57% (图 1)。
| Table 2 The total and bioaccessible contents of Cd and As in Pheretima aspergillum (E, . Perrier). n = 2, x±s |
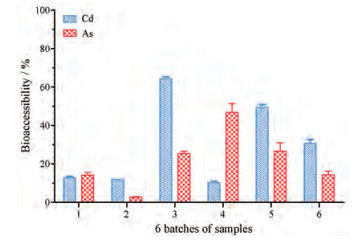
|
Figure 1 The bioaccessibility results of Cd and As in Pheretima aspergillum (E, . Perrier). n = 2, x±s |
根据公式(1), C分别取地龙中Cd和As的总量和生物可给量用于计算相应的暴露量, 进一步计算相应的HI和MOE的值(表 3)。由表 3结果可知, 以生物可给浓度计算得到的暴露量均小于以地龙中Cd的初始浓度计算得到的结果。提取前, 所有批次地龙中As的MOE值均大于1, 说明采用总量进行评估得到As对于人体的健康风险可以接受; 然而所有批次地龙中Cd的HI值均大于1, 说明采用总量进行评估得到Cd对于人体的健康风险不可忽视。经过MDCK细胞转运后, 除了1批地龙外, 其余5批地龙中Cd的HI值均小于1, 风险降低至安全范围内。可见, 地龙的Cd和As可能不能被人体完全吸收, 采用生物可给量结果用于人体健康风险评估, 得到的结果更加接近实际情况, 科学合理。
| Table 3 The risk assessment results of Cd and As in Pheretima aspergillum (E, . Perrier). MOE: Margin of exposure; HI: Hazard index |
近年来, 采用体外的方法研究人体通过食品、土壤等途径暴露有害物质的经口生物利用率引起了各国学者的关注, 模拟污染物经胃和小肠消化过程的体外消化模型也成为探究污染物生物可给性和代谢的热点[18, 19]。国际上较为公认的体外消化模型包括PBET法、英国地质调查局推荐的SBET法、荷兰公共卫生学院推荐的RIVM法等。其中PBET法由Ruby提出[9], 该方法在模拟胃相消化时加入有机酸和胃蛋白酶, 模拟肠相消化时加入胰酶和胆汁, 非常接近人体胃肠道生理环境, 并在动物体内验证的结果较为理想, 因此本研究选择PBET法作为体外消化的前处理方法。
MDCK、Caco-2、HT-29-H、LLC-PK1等细胞作为肠道体外通透性模型, 应用广泛[20, 21]。尽管MDCK细胞系来源于犬肾小管上皮细胞, 但是MDCK细胞模型作为研究药物转运和代谢的体外模型, 具有独特的优势, 是理想的单层上皮细胞模型:首先, MDCK细胞株生长速度快, 培养周期短, 从接种开始至达到稳定融合期再到形成完整的柱状细胞单层一般只3~4天; 其次, 跨上皮电阻低, 其值接近人体小肠[22]; 再次, MDCK细胞易于培养, 无需特殊细胞培养条件, 试验重复性好。因此本研究选择MDCK细胞进行培养, 建立该细胞模型。
适宜的接种密度对于细胞的生长状态具有至关重要的作用。若接种细胞密度过低, 会影响细胞的生长速度, 导致细胞活力下降, 不利于细胞单层的形成。反之, 若接种细胞密度过高, 细胞之间会因培养液中营养成分等的竞争而导致细胞倍增速度减弱, 使细胞分裂停止, 甚至死亡。本研究MDCK细胞在多微孔膜上的接种密度是其增殖分化形成单层并达到紧密联结所需时间的决定性因素, 通过实验比对, 最终选择4×105 mL-1的接种密度。
细胞单层的完整性是决定药物转运和吸收能否成功的关键因素, 通常采用测定细胞单层TEER值的方法来判断细胞单层的完整性。TEER值会随着细胞生长天数的增加而增大, 最后达到一个相对恒定值, TEER值越高说明细胞单层的紧密性即完整性越好。文献报道若MDCK细胞的TEER值大于90 Ω·cm2, 则认为细胞单层的紧密性良好[23]。本研究MDCK细胞接种到Transwell培养板4天后, TEER值大于200 Ω·cm2, 符合实验要求。
目前对污染物(包括重金属)暴露量的计算大多是基于污染物的摄入量(外暴露)而非与污染物毒性密切相关的体内暴露量[24, 25]。然而, 消化过程中并非所有物质全部从基质中释放, 因此生物可给量小于外暴露剂量, 生物可给性小于100%。若将中药中本身的重金属的总量用于评估中药重金属对人体的健康风险, 往往会高估其对人体的危害, 导致政府采取不必要的干预措施, 造成资源浪费。因此, 人体生物可给性的研究对于准确评价中药中重金属对于人体的健康风险具有重要的意义。本研究首次建立了体外模拟消化/MDCK细胞模型测定动物药地龙中Cd和As生物可给性的方法, 并评估其对人体的健康风险。体外模拟消化/MDCK细胞模型是测定中药中重金属生物可给性的一种新的、有效的技术手段。本研究为客观、科学地评价中药中重金属对人体的健康风险提供新的思路, 为制定科学、合理的重金属限量标准提供重要的科学依据, 并促进中药产业发展, 最大程度地节约资源。
| [1] |
Wu T, Zhao Y, Liu MM, et al. Research progress in antitumor activities of traditional animal medicines[J]. Asia-Pacific Tradit Med (亚太传统医药), 2017, 13: 81-85. |
| [2] |
Zhang J, Li JF, Du YJ, et al. Recent advances in animal medicine pharmacology research in last five years[J]. Jilin J Tradit Chin Med (吉林中医药), 2016, 36: 1136-1150. |
| [3] |
Huang JW, Gao HW, Duan JF. Research on chemical composition and pharmacological effects of geosaurus[J]. Guid J Tradit Chin Med Pharm (中医药导报), 2018, 24: 104-107. |
| [4] |
Chen X, Wang K, Wang Z, et al. Effects of lead and cadmium co-exposure on bone mineral density in a Chinese population[J]. Bone, 2014, 63: 76-80. DOI:10.1016/j.bone.2014.02.017 |
| [5] |
Tchounwou PB, Yedjou CG, Patlolla AK, et al. Heavy metals toxicity and the environment[J]. EXS, 2012, 101: 133-164. |
| [6] |
Zuo TT, Li YL, Chen P, et al. Determination and preliminary risk assessment of heavy metals and harmful elements in American ginseng, the fruit of Chinese wolfberry and hawthorn[J]. Chin J Pharm Anal (药物分析杂志), 2016, 36: 2016-2021. |
| [7] |
Peng Q, Nunes LM, Greenfield BK, et al. Are Chinese consumers at risk due to exposure to metals in crayfish? A bioaccessibility-adjusted probabilistic risk assessment[J]. Environ Int, 2016, 88: 261-268. DOI:10.1016/j.envint.2015.12.035 |
| [8] |
Cheng JL, Zhang XH, Tang ZW, et al. Concentrations and human health implications of heavy metals in market foods from a Chinese coal-mining city[J]. Environ Toxicol Pharmacol, 2017, 50: 37-44. DOI:10.1016/j.etap.2017.01.011 |
| [9] |
Ruby MV, Schoof R, Brattin W, et al. Advances in evaluating the oral bioaccessibility of inorganics in soil for use in human health risk assessment[J]. Environ Sci Technol, 1999, 33: 3697-3705. DOI:10.1021/es990479z |
| [10] |
Koch I, Mcpherson K, Smith P, et al. Arsenic bioaccessibility and speciation in clams and seaweed from a contaminated marine environment[J]. Mar Pollut Bull, 2007, 54: 586-594. DOI:10.1016/j.marpolbul.2006.12.004 |
| [11] |
Oomen AG, Hach A, Minekus M, et al. Comparison of five in vitro digestion models to study the bioaccessibility of soil contaminants[J]. Environ Sci Technol, 2002, 36: 3326-3334. DOI:10.1021/es010204v |
| [12] |
Ruby MV, Davis A, Link TE, et al. Development of an in vitro screening test to evaluate the in vivo bioaccessibility of ingested mine-waste lead[J]. Environ Sci Technol, 1993, 27: 2870-2877. DOI:10.1021/es00049a030 |
| [13] |
Dan M, Wen RH, Wen N, et al. Protective effects of diammonium glycyrrhizinate on permeability increasing and chromosome breakage induced by triptolide[J]. Chin New Drug J (中国新药杂志), 2015, 24: 750-770. |
| [14] |
Volpe DA. Variability in Caco-2 and MDCK cell-based intestinal permeability assays[J]. J Pharm Sci, 2008, 97: 712-725. DOI:10.1002/jps.21010 |
| [15] |
Summary Report of the Seventy-Third Meeting of JECFA[EB/OL]. Geneva: Joint FAO/WHO Expert Committee on Food Additives, 2010[2012-06-09]. http://www.who.int/foodsafety/publications/jecfa-reports/en/.
|
| [16] |
Wang YBN, Liu AD, Li JW, et al. The survey of traditional Chinese medicine consumption among adult residents in 11 provinces and cities[J]. Chin Pharm Aff (中国药事), 2017, 31: 666-672. |
| [17] |
International NSF. Dietary Supplement-Standard 173: Metal Contaminant Accepted levels[S]. Michigan, USA: NSF International, 2003: 3.
|
| [18] |
Aziz R, Rafiq MT, He ZL, et al. In vitro assessment of cadmium bioavailability in Chinese cabbage grown on different soils and its toxic effects on human health[J]. BioMed Res Int, 2015, 2015: 285351-285363. |
| [19] |
Hu JL, Wu FY, Wu SC, et al. Bioaccessibility, dietary exposure and human risk assessment of heavy metals from market vegetables in Hong Kong revealed with an in vitro gastrointestinal model[J]. Chemosphere, 2013, 91: 455-461. DOI:10.1016/j.chemosphere.2012.11.066 |
| [20] |
Hidalgo IJ. Assessing the absorption of new pharmaceuticals[J]. Curr Top Med Chem, 2001, 1: 385-401. DOI:10.2174/1568026013395010 |
| [21] |
Shah P, Jogani V, Bagchi T, et al. Role of Caco 2 cell monolayers in prediction of intestinal drug absorption[J]. Biotechnol Prog, 2006, 22: 186-198. DOI:10.1021/bp050208u |
| [22] |
Li J, Wang Y, Hidalgo IJ. Kinetic analysis of human and canine Pglycoprotein mediated drug transport in MDR1-MDCK cell model:approaches to reduce false negative substrate classification[J]. J Pharm Sci, 2013, 98: 423-435. |
| [23] |
Xu Z, Zhang C, Zhang Y, et al. Europium complexes as novel indicators of paracellular diffusion[J]. Chem Biodivers, 2012, 9: 1916-1922. DOI:10.1002/cbdv.201100439 |
| [24] |
Ngo DM, Hough RL, Le TT, et al. Assessing dietary exposure to cadmium in a metal recycling community in Vietnam:age and gender aspects[J]. Sci Total Environ, 2012, 416: 164-171. DOI:10.1016/j.scitotenv.2011.11.068 |
| [25] |
Zuo TT, Li YL, He HZ, et al. Refined assessment of heavy metal-associated health risk due to the consumption of traditional animal medicines in humans[J]. Environ Monit Assess, 2019, 191: 171. DOI:10.1007/s10661-019-7270-1 |
 2020, Vol. 55
2020, Vol. 55


