2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850;
3. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193
2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China;
3. Institute of Medicinal Plant Development, Chinese Academy of Medical Science, Peking Union Medical College, Beijing 100193, China
淫羊藿作为我国传统中药已有上千年的药用历史, 始载于《神农本草经》, 具有补肾阳、强筋骨、祛风湿的作用, 常用于治疗肾阳虚衰、阳痿遗精、筋骨萎软、风湿麻痹等[1]。现代药理学研究表明, 淫羊藿在调节免疫、改善心血管功能、抗癌、抗骨质疏松、抗衰老等方面均有很好的疗效[2-6]。除2015版《中国药典》淫羊藿项下收录的4种淫羊藿外, 该属植物还有其他种作为药材商品在市场上流通[7, 8], 其中天平山淫羊藿于1998年由Stearn[9]从箭叶淫羊藿变种宽序淫羊藿Epimedium sagittatum var. pyramidale (Franch) Stearn提升为独立种, 被《贵州省中药材、民族药材质量标准》收载作为“黔淫羊藿”药用来源之一, 因其优异的质量而受到广泛关注[10-12]。该物种和箭叶淫羊藿关系非常密切, 药材性状难以区分, 在贵州、重庆、湖南、湖北等地资源量很大, 常被作为箭叶淫羊藿应用。由于淫羊藿属植物种内变异大, 关系复杂, 一直有物种分类过细的问题, 部分物种经分类学研究后被合并[13], 天平山淫羊藿可能作为箭叶淫羊藿的一个变种更为合适, 分类学工作正在进行中。
目前, 淫羊藿药材需求日益增加[14, 15], 野生资源的过度采挖, 已经导致资源严重短缺, 价格不断飙升, 而淫羊藿属植物含有的有效成分, 淫羊藿苷类化合物在不同种类, 甚至同一个物种的不同居群中变异极大[12]。因此, 选择优良种质大规模栽培是解决淫羊藿药材需求的有效途径之一[16-18]。本实验前期对野生箭叶、天平山、柔毛淫羊藿进行了全国范围内的资源调查和优良种质遴选, 最终分别确定了箭叶、天平山、柔毛淫羊藿质量较优异的野生种质进行栽培。但生长方式变化对栽培后淫羊藿化学成分组成的影响以及规模化种植后淫羊藿化学成分的含量变化还有待研究。因此, 本文以箭叶、天平山、柔毛淫羊藿的栽培种质、相应野生种质以及来自国内其他野生种质为研究对象, 采用UHPLC-PDA-Q-TOF/MSE结合UNIFI数据分析平台和主成分分析(PCA)方法对栽培淫羊藿进行了较全面的质量研究, 旨在为淫羊藿药材栽培推广以及资源合理开发利用提供科学依据。
材料与方法仪器 Waters ACQUITY I-Class超高效液相色谱系统(Waters公司, Milford, MA, 美国); VION-IMS-QTOF质谱系统(Waters公司, Wilmslow, 英国); UNIFI 1.9.4软件、Umetrics Ezinfo 3.0软件(Waters公司, Manchester, 英国); Waters ACQUITYTM超高效液相色谱系统和Waters ACQUITYTM PDA检测器(Waters公司, Milford, MA, 美国); Heatmap Illustrator软件。色谱柱: Waters ACQUITYTM HSS T3 C18 (2.1 mm×100 mm, 1.8 μm, Waters, 爱尔兰); Sartorius BP211D 1/10万电子天平(美国Sartorius公司); 舒美KQ-600E数控超声波清洗器(江苏昆山市超声仪器有限公司); 0.22 μm微孔滤膜(上海兴亚净化材料厂)。
试剂与样品 乙腈(色谱纯, Fisher, 美国); 甲酸(色谱纯, Acros Co. Ltd., NJ, 美国); 屈臣氏蒸馏水(广州屈臣氏蒸馏水有限公司)。其他试剂均为市售分析纯。对照品朝藿定AI、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、3′′′-羰基-2′′-β-L-喹诺糖基淫羊藿苷、淫羊藿次苷Ⅱ、2′′-O-鼠李糖基淫羊藿次苷Ⅱ、箭藿苷A、箭藿苷B均为本实验室自制, HPLC面积归一化法测定纯度大于98%。
样品包括箭叶、天平山、柔毛淫羊藿的栽培种质、相应野生种质以及国内其他野生种质, 详见表 1, 其中栽培箭叶淫羊藿样本引种年限为8年, 种源来自湖南新宁; 栽培天平山淫羊藿样本引种年限为7年, 种源来自贵州沿河; 栽培柔毛淫羊藿样本引种年限为5年, 种源来自四川乐山。各样本均由中国医学科学院药用植物研究所郭宝林研究员鉴定为小檗科植物箭叶淫羊藿Epimedium sagittatum (Sieb. et Zucc.) Maxim.、天平山淫羊藿Epimedium myrianthum Stearn、柔毛淫羊藿Epimedium pubescens Maxim.的干燥叶。
| Table 1 Summary of analyzed samples |
色谱条件 色谱柱: Waters ACQUITYTM HSS T3 C18 (2. 1 mm×100 mm, 1.8 μm); 流动相: 0.1%甲酸水溶液(A)-乙腈(B); 梯度洗脱(0~1.5 min, 21%~24% B; 1.5~3 min, 24%~25% B; 3~4 min, 25%~29% B; 4~5 min, 29% B; 5~6.5 min, 29%~32% B; 6.5~7 min, 32%~44% B; 7~8 min, 44%~45% B; 8~9 min, 45%~46% B; 9~11 min, 46%~95% B; 流速0.6 mL·min-1; 柱温40 ℃; 进样量2 μL; PDA检测波长270 nm。
质谱条件 电喷雾电离离子源(ESI), 离子化模式为正、负离子模式, 离子源温度为110.0 ℃, 脱溶剂气体为氮气, 流速为850 L·h-1, 温度为450 ℃。正离子模式下毛细管电压为3 kV, 负离子模式下毛细管电压为2.5 kV, 锥孔电压为50 V, 扫描范围为100~1 600 Da。低能量扫描时能量为4 eV, 高能量扫描时能量为30~50 eV。准确质量数用leucineenk ephalin作校正液。
混合对照品溶液的制备 称取朝藿定AI、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、3′′′-羰基-2′′-β-L-喹诺糖基淫羊藿苷、淫羊藿次苷Ⅱ、2′′-O-鼠李糖基淫羊藿次苷Ⅱ、箭藿苷A、箭藿苷B各0.3 mg, 分别加入70%甲醇1 mL溶解, 摇匀, 制得各对照品储蓄液。再分别取各对照品储蓄液100 μL, 混匀即得。
供试品溶液的制备 取淫羊藿药材粉末0.2 g (过40目筛), 精密称定, 置于100 mL具塞锥形瓶中, 精密加入50%乙醇溶液20 mL, 密塞, 摇匀, 称重, 超声处理1 h, 冷却至室温, 用50%乙醇补足失重, 0.22 μm针式过滤器滤过, 取续滤液, 即得。
UNIFI数据库及分析方法的建立 应用UNIFI 1.9.4软件的数据库管理系统, 建立淫羊藿药材全化学成分数据库(249个化合物), 包括化合物中英文名称、分子式、化学结构式和碎片离子信息等, 并导入UNIFI软件中, 构建淫羊藿化学成分专属数据库。分析方法中设定3D峰检测参数的强度阈值(高能量为25计数, 低能量为200计数), 加合离子峰的种类(负离子模式为[M-H]-、[M+HCOO]-, 正离子模式为[M+H]+、[M+Na]+、[M+H-H2O]+)。
PCA分析 利用Umetrics Ezinfo 3.0软件对采集到的所有淫羊藿样品在0~11 min内的UHPLC-Q-TOF/MSE指纹图谱进行主成分分析, 得到PCA得分图以便更直观的了解栽培与野生箭叶、天平山、柔毛淫羊藿样本间的差异情况。
结果 1 淫羊藿化学成分的鉴定采用所建立的UHPLC-Q-TOF/MSE方法快速分析箭叶、天平山、柔毛淫羊藿, 样品BPI图见图 1。在UNIFI软件中创建分析方法并对采集数据进行分析, 软件自动标识经处理后的可信数据, 给出保留时间、化学式、质量数误差、标识的高能量碎片数目等信息。通过与对照品总结得出的裂解规律及相关文献[19-23]的匹配与确证, 共利用UNIFI鉴定箭叶、天平山、柔毛淫羊藿中化合物32个, 见表 2。
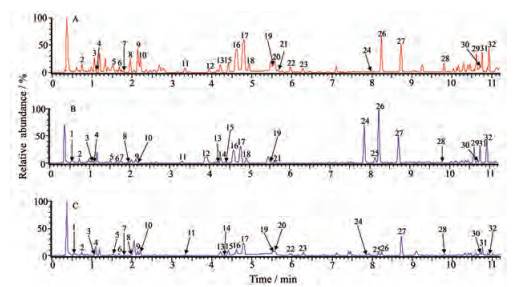
|
Figure 1 BPI chromatograms of three Epimedium species in negative ion mode by UHPLC-Q-TOF/MSE analysis. A: E. sagittatum (JY-ZP-1); B: E. myrianthum (TPS-ZP-1); C: E. pubescens (RM-ZP-1). The peak numbers hereby are consistent with those in Table 2 |
| Table 2 Identification results of chemical constituents in three Epimedium species by UHPLC-Q-TOF/MSE. *Compound identified by comparing with reference standard. E. s: E. sagittatum; E. m: E. myrianthum; E. p: E. pubescens. (-): Negative ion mode; (+): Positive ion mode |
淫羊藿中主要化学成分多为8-异戊烯基取代的黄酮苷类成分, 在C-3位和C-7位多连有糖基, 糖基种类多为葡萄糖、鼠李糖和木糖。通过对照品的裂解碎片可知, 在负离子模式下出现[M-H]-的准分子离子峰, 且大多数化合物会伴随较高丰度的[M+HCOO]-以及[M+2H2O-H]-加合离子峰。此外在负离子模式下先丢失7位所连糖基, 而在正离子模式下更倾向于丢失3位上的糖基。
色谱峰10在负离子模式下存在m/z 661.214 3 [M-H]-、707.219 4 [M+HCOO]-和697.189 5 [M+2H2O-H]-的母离子以及碎片离子m/z 499.159 9 [M-H-162]-和353.103 5 [M-H-162-146]-。正离子模式下显示m/z 663.226 8 [M+H]+的准分子离子峰以及碎片离子m/z 517.168 9 [M+H-146]+和355.117 4 [M+H-146-162]+, 推测其3位连有1个甲基五碳糖(鼠李糖), 7位连有1个六碳糖(葡萄糖), 与文献核对后认为其为epimedoside A, 同时与UNIFI自动鉴定结果一致, 最终确定色谱峰10为epimedoside A。
在负离子模式下, 色谱峰20存在m/z 819.271 5 [M-H]-、865.276 9 [M+HCOO]-和855.245 7 [M+2H2O-H]-的准分子离子峰, 负离子高能量时依次出现碎片离子m/z 657.218 7 [M-H-162]-、513.175 9 [M-H-162-144]-和367.118 4 [M-H-162-144-146]-以及母核4'位上甲基断裂后碎片离子m/z 352.093 6 [M-H-162-144-146-CH3]-。正离子模式下显示母离子m/z 821.285 9 [M+H]+以及碎片离子m/z 531.184 9 [M+H-144-146]+和369.132 0 [M+H-144-146-162]+以及母核8位上异戊烯基断裂后碎片离子m/z 313.070 5 [M+H-144-146-162-C4H7]+, 推测该化合物7位连有一个葡萄糖, 3位连有一个鼠李糖和与3′′′-羰基-2′′-β-L-喹诺糖分子量相同的基团。该化合物母离子及碎片裂解信息与峰19相同, 因此判断该化合物与峰19互为同分异构体。
2 栽培与相应野生淫羊藿指纹图谱与PCA分析采用所建立的UHPLC-Q-TOF/MSE方法快速分析所有淫羊藿样品, 并将采集的所有样品在0~11 min内指纹图谱进行PCA分析, 所得PCA得分图见图 2。图中的点代表不同的样品, 较为聚集表示其化学成分组成相似, 反之, 则差异较大。PCA结果表明栽培与相应野生的箭叶、天平山、柔毛淫羊藿化学成分差异较小, 说明栽培环境和生长方式等因素的改变并没有对栽培后淫羊藿化学成分组成产生较大影响。
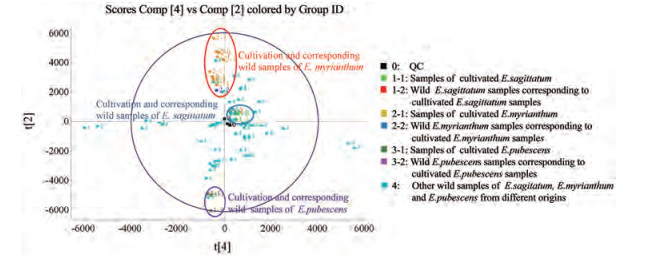
|
Figure 2 PCA/Scores plot of three Epimedium species |
采用所建立的UHPLC-PDA方法对所有淫羊藿样品在紫外(λ=270 nm)下有较高响应的12个黄酮类化合物进行相对定量(以12个化合物峰面积值代表其相对含量), 这12个化合物分别为峰10 (epimedoside A)、峰12 (epimedin A I)、峰13 (epimedin A)、峰14 (isomer of epimedin B)、峰15 (epimedin B)、峰16 (epimedin C)、峰17 (icariin)、峰19 (3'''-carbonyl-2''-β-L-quinovosyl-icariin)、峰24 (sagittatoside A)、峰25 (sagittatoside B)、峰26 (2''-O-rhamnopyranosyl icariside Ⅱ)、峰27 (icariside Ⅱ), 所得UHPLC-PDA图见图 3。将箭叶、天平山、柔毛淫羊藿的栽培与相应野生以及其他野生样本中12个黄酮类化合物相对含量结果分别以热图形式呈现, 其中黄色字编号代表栽培淫羊藿, 紫色字编号代表与栽培相应的野生淫羊藿, 黑色字编号代表其他野生淫羊藿, 结果见图 4。
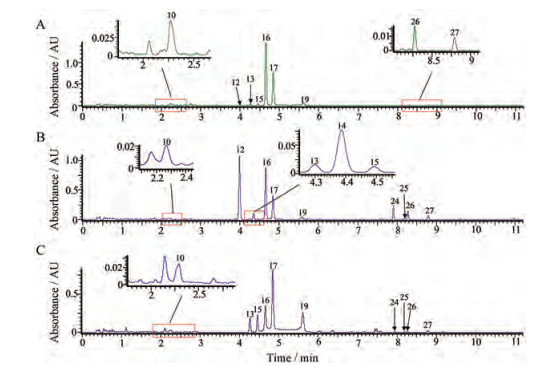
|
Figure 3 UHPLC-PDA chromatograms of three cultivated Epimedium species. A: E. sagittatum (JY-ZP-1); B: E. myrianthum (TPS-ZP-1); C: E. pubescens (RM-ZP-1); Peak numbers are consistent with Table 2 |
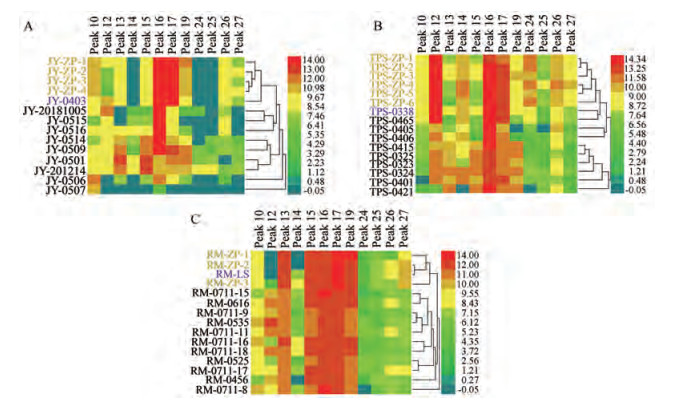
|
Figure 4 Heatmap of relative content distribution of 12 flavonoids in three Epimedium species. A: E. sagittatum; B: E. myrianthum; C: E. pubescens (Sample number and peak number are consistent with Table 1 and Table 2, respectively) |
由于选择栽培的相应野生箭叶、天平山、柔毛淫羊藿样本是从大量野生样本中遴选出的较优种质, 其淫羊藿苷(Peak17)相对含量较其他野生样本高。由图 4可知, 栽培与相应野生的箭叶、天平山、柔毛淫羊藿分别聚为一类, 说明二者有着相似的化合物含量分布。其次栽培样本的淫羊藿苷相对含量也较高, 说明人工栽培及生长方式等因素的改变并未对栽培淫羊藿化学成分含量产生较大变化, 且相应野生样本的高含量特性可以遗传和延续。
4 栽培与野生淫羊藿总黄酮相对含量分析将12个黄酮类成分的相对含量相加得到总黄酮相对含量[24, 25], 栽培与相应野生以及其他野生箭叶、天平山、柔毛淫羊藿总黄酮相对含量如图 5所示, 其中黄色代表栽培样本, 紫色代表与栽培相应的野生样本, 蓝色代表其他野生样本。
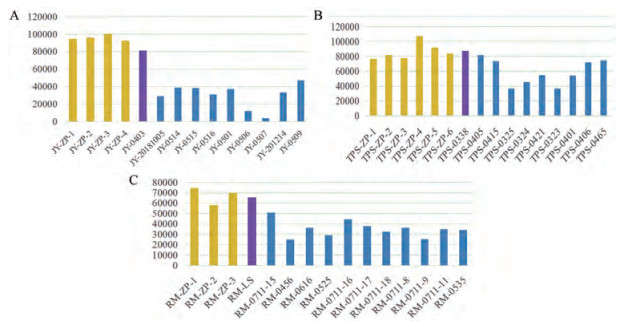
|
Figure 5 The relative content of total flavonoids in three Epimedium species. A: E. sagittatum; B: E. myrianthum; C: E. pubescens. Sample numbers are consistent with Table 1 |
由于选择栽培的相应野生淫羊藿为较优种质, 其总黄酮相对含量均高于其他野生箭叶、天平山、柔毛淫羊藿。将该野生种质进行大规模栽培后, 栽培箭叶、天平山、柔毛淫羊藿样本总黄酮相对含量与相应野生样本较接近, 且与其他野生箭叶、天平山、柔毛淫羊藿相比, 栽培淫羊藿样本质量稳定性较好。
讨论UHPLC是一种具高分离度和高速度特性的现代分离技术, 具有良好的分离效果和更高的峰容量; Q-TOF/MSE作为检测器具有高灵敏度的特点, 在优化的条件下可以使中药中大多数结构类型的化合物均有响应, 并通过测定精确分子量推测化合物的元素组成及分子式, 还可通过解析其中碎片离子信息了解化合物裂解的碎片结构, 从而进行化合物的结构鉴定。UHPLC-Q-TOF/MSE技术可以更好地用于中药指纹图谱的表征与化学成分的快速鉴定, UHPLC-Q-TOF/MS指纹图谱具有表征全成分的特点, 进行质量分析可以体现中药成分组成的整体性; 结合PCA分析方法可以全面了解多基原、多产地等中药所含化学成分的差异性问题[26, 27]。再将其与UHPLC-PDA相结合, 对中药化学成分进行相对定量, 从而对药材进行较全面的质量分析和控制[28]。
本文基于UHPLC-PDA-Q-TOF/MSE从定性和相对定量两方面成功建立了栽培淫羊藿药材的质量分析方法, 实现了对栽培箭叶、天平山、柔毛淫羊藿化学成分的整体性评价。结果表明栽培后箭叶、天平山、柔毛淫羊藿化学成分组成及含量与相应野生淫羊藿较相似, 从而说明栽培环境和生长方式等因素的改变并未对大规模栽培后淫羊藿样本化学成分组成及含量产生较大影响, 且通过大量野生样本遴选出的优质种质的高含量特性可以遗传和延续, 因此对箭叶、天平山、柔毛淫羊藿的栽培是成功的。本实验为淫羊藿药材栽培推广及资源合理开发利用提供了科学依据, 同时也为其他中药材的质量评价提供了一种方法和模式。
致谢: 本论文的栽培样品来自于国药集团同济堂(贵州)药业有限公司贵州雷山基地和四川乐山基地, 由杨相波、李砾、姜志海和金华提供。
| [1] |
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2015: 327-328.
|
| [2] |
Indran IR, Zhang SJ, Zhang ZW, et al. Selective estrogen receptor modulator effects of Epimedium extracts on breast cancer and uterine growth in nude mice[J]. Planta Med, 2014, 80: 22-28. |
| [3] |
Peng S, Zhang G, Zhang BT, et al. The beneficial effect of icaritin on osteoporotic bone is dependent on the treatment initiation timing in adult ovariectomized rats[J]. Bone, 2013, 55: 230-240. DOI:10.1016/j.bone.2013.02.012 |
| [4] |
Liang HR, Vuorela P, Vuorela H, et al. Isolation and immunomodulatory effect of flavonol glycosides from Epimedium hunanense[J]. Planta Med, 1997, 63: 316-319. DOI:10.1055/s-2006-957690 |
| [5] |
Yap SP, Shen P, Li J, et al. Molecular and pharmacodynamic properties of estrogenic extracts from the traditional Chinese medicinal herb, Epimedium[J]. J Ethnopharmacol, 2007, 113: 218-224. DOI:10.1016/j.jep.2007.05.029 |
| [6] |
Jiang J, Cui L, Sun E, et al. Material basis for anti-osteoporosis efficacy of Epimedium flavonoids based on their in vivo metabolism[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 721-729. |
| [7] |
Qin WH, Liu X, Zhang J, et al. Quality evaluation of fifteen varieties of Epimedii Folium from different growing areas[J]. Chin Tradit Pat Med (中成药), 2017, 39: 1889-1895. |
| [8] |
He SZ, Xu WF, Wang YY, et al. Epimedium medicinal plant germplasm resources[J]. Guizhou Sci (贵州科学), 2012, 30: 9-14. |
| [9] |
Stearn WT. Four more Chinese species of Epimedium (Berberidaceae)[J]. Kew Bull, 1998, 53: 213-223. DOI:10.2307/4110461 |
| [10] |
He SZ, Wang YY, Xu WF, et al. Research on flavonoids in leave of Epimedium myrianthum and Epimedium acuminatum in Guizhou for different growth phase[J]. Guizhou Sci (贵州科学), 2008, 26: 34-37. |
| [11] |
Guo BL, Xiao PG. Review on the main types of Chinese herbal medicine Epimedium[J]. China J Chin Mater Med (中国中药杂志), 2003, 28: 303-306. |
| [12] |
Pei LK, Huang WH, He TG, et al. Systematic study on the quality of the main resources of Chinese herbal medicine Epimedium[J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 2217-2222. |
| [13] |
Zhang YJ, Dang HS, Li SY, et al. Five new synonyms in Epimedium (Berberidaceae) from China[J]. PhytoKeys, 2015, 49: 1-12. DOI:10.3897/phytokeys.49.8768 |
| [14] |
Xu YQ, Chen JJ, Ge F, et al. Status and thoughts on quality assessment of Herba Epimedii[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 661-666. |
| [15] |
Zhang HF, Yang XH, Guo YR, et al. Current status and prospects of sustainable utilization of medicinal plant Epimedium resources[J]. Acta Bot Sin (植物学报), 2009, 44: 363-368. |
| [16] |
Guo BL, Huang WH, Sun E, et al. Epimedium medicinal herbs and decoction market survey[J]. China J Chin Mater Med (中国中药杂志), 2010, 35: 1687-1689. |
| [17] |
He SZ, Guo BL. Study on the Quality of Epimedium in Guizhou[J]. Chin J Pharm Anal (药物分析杂志), 1996, 16: 291-294. |
| [18] |
Xu Y, Shi HJ, Liu SX, et al. Quality evaluation of Epimedium sagittatum in different populations based on icariin contents[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 2284-2290. |
| [19] |
Yu XE, Qin JP, Li JC, et al. Rapid analysis on chemical constituents in Yinyanghuo Zonghuangtong capsule by UPLC/Q-TOF-MS/MS[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 4587-4597. |
| [20] |
Ma WJ, Yao GZ, Jia Q, et al. Qualitative analysis on chemical constituents from Epimedium brevicornu by UPLC-Q-TOF MS/MS[J]. Chin Med Mat (中药材), 2019, 22: 1554-1558. |
| [21] |
Sun XG, Zhang J, Zhao Y, et al. Comprehensive analysis and quality assessment of Herba Epimedii from multiple botanical origins based on ultra-high performance supercritical fluid chromatography coupled with quadrupole time-of-flight mass spectrometry and photodiode array detector[J]. J Supercrit Fluid, 2019, 149: 1-9. DOI:10.1016/j.supflu.2019.03.017 |
| [22] |
Zhao HY, Sun JH, Fan MX, et al. Analysis of phenolic compounds in Epimedium plants using liquid chromatography coupled with electrospray ionization mass spectrometry[J]. J Chromatogr A, 2008, 1190: 157-181. DOI:10.1016/j.chroma.2008.02.109 |
| [23] |
Gan JS, Ma Y, Wang ZY, et al. Analysis on chemical constituents in Epimedii Herba by UPLC/Q-TOF-MS[J]. Drugs Clin (现代药物与临床), 2014, 29: 349-352. |
| [24] |
Chen XJ, Zhang QW, Ji H, et al. Comparison of UV spectrophotometry and HPLC on quantitative determination of total flavonoids of Herba Epimedii[J]. Chin J Pharm Anal (药物分析杂志), 2007, 27: 625-630. |
| [25] |
Gao SY, Li K, Xiong YF, et al. Identification of growth years of Hengshan imitative wild culture Astragali Radix and investigation into the accumulation rules of flavonoids and saponins[J]. Acta Pharm Sin (药学学报), 2018, 53: 147-154. |
| [26] |
Guo LX, Li R, Liu K, et al. Structural characterization and discrimination of Chinese medicinal materials with multiple botanical origins based on metabolite profiling and chemometrics analysis:Clematidis Radix et Rhizoma as a case study[J]. J Chromatogr A, 2015, 1425: 129-140. DOI:10.1016/j.chroma.2015.11.013 |
| [27] |
Zheng W, Wang FX, Sun XG, et al. Analysis of chemical markers in sulfur-fumigated Anemarrhenae Rhizoma[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 3530-3536. |
| [28] |
Wang J, Zhang J, Zhang CN, et al. The qualitative and quantitative analyses of Gelsemium elegans[J]. J Pharm Biomed Anal, 2019, 172: 329-338. DOI:10.1016/j.jpba.2019.05.015 |
 2020, Vol. 55
2020, Vol. 55


