2. 浙江省肿瘤医院, 浙江省肿瘤研究所, 浙江 杭州 310022
2. Department of Cancer Research Institute, Zhejiang Cancer Hospital, Hangzhou 310022, China
结直肠癌是消化系统恶性肿瘤之一, 近年来其发病率不断增加。根据2018年调查显示, 结直肠癌的发病率高居恶性肿瘤的第4位, 并且死亡率已经上升至恶性肿瘤的第2位, 对人类健康造成严重威胁[1]。
紫草素(shikonin)是一种从中药紫草(Lithospermum erythrorhizon Sieb. et Zucc.)的干燥根中提取分离的萘醌类化合物, 具有抗炎、抗病毒、抗肿瘤、抗多药耐药等多种生物活性[2]。已有多篇文章报道紫草素在肝癌[3]、肺癌[4]、结肠癌[5]等实体肿瘤中具有抑制肿瘤细胞增殖、诱导细胞凋亡、抗肿瘤血管生成及增加肿瘤细胞对放化疗的敏感性[6]等作用。然而目前研究主要是从分子生物学的角度阐释在体外实验中被影响的单一信号通路, 缺乏从整体代谢层面探究体内紫草素抗肿瘤机制的研究报道。
细胞的异常代谢是肿瘤的十大特征之一[7]。与基因和蛋白质的功能受表观遗传调控及翻译后修饰的影响不同, 代谢物作为生化活动的直接标志能够直接反映生物表型。代谢组学是一种对内源性代谢物变化进行全面定量的揭示的方法, 其具有样品用量少、分析时间短和方法重现性好等优势[8]。因此, 从代谢的角度探究药物作用靶点及作用机制, 在肿瘤药物研究中具有重要的应用潜力。
本研究通过测定紫草素作用后4种结直肠癌细胞系的IC50值来评价紫草素体外抗肿瘤活性, 同时建立SW620异体移植瘤小鼠模型, 通过代谢组学技术进一步考察紫草素抗肿瘤作用机制, 以期为紫草素抗肿瘤新药的开发及其在临床治疗上提供更充分的理论基础。
材料与方法仪器与试剂 Dionex Ultimate 3000超高效液相色谱仪(美国Thermo公司); Q ExactiveTM四极杆-静电场轨道阱高分辨质谱系统(美国Thermo公司); Micro 17R型低温离心机(美国Thermo公司); BS210S型电子天平(德国Sartorius公司); FD5-4B冷冻干燥机(美国SIM公司); RPMI1640培养基和胎牛血清(美国Gibco公司); 紫草素购于杭州达诚生物技术有限公司(纯度 > 98%, 批号: RA56418);乙腈和甲醇均为HPLC级(美国Tedia公司)。
体外抗肿瘤活性测定 SW620结肠癌细胞培养于含10%胎牛血清的RPMI1640培养基中, 取对数生长期细胞, 并调整细胞密度为每孔3 000个, 按照每孔100 μL接种于96孔板中, 置于含5% CO2的饱和湿度培养箱中37 ℃静置培养。24 h后加入系列浓度紫草素培养基100 μL, 每个浓度设定3个复孔。静置培养48 h, 吸去培养基, 于每孔加入0.5 mg·mL-1噻唑蓝(MTT) 50 μL, 继续于培养箱放置4 h。吸去MTT, 每孔加入二甲基亚砜(DMSO) 150 μL, 振荡60 s至结晶溶解, 用酶标仪于492 nm处测定吸光度并用Prism软件计算IC50值。
动物与人结肠癌裸鼠异体移植瘤模型的制备 SPF级雌性Balb/c裸鼠24只, 5周龄, 购于杭州杭斯生物科技有限公司, 许可证号: SCXK (沪) 2017-0005。所有动物饲养于温度(25 ± 1) ℃、湿度(50 ± 10) %以及12 h光照循环的环境下, 期间自由摄食、饮水, 适应一周后进行建模实验。该实验获得浙江省肿瘤医院动物伦理委员会批准(批准号: 2019-03-076)。
取处于对数生长期的SW620人结肠癌细胞, 细胞悬液离心, 取沉淀(约含4×106细胞)接种于裸鼠左前腋部皮下, 培养约30天后裸鼠成瘤, 取瘤组织再次传代。本实验取经体内传代2次的瘤块, 将其剪成约2 mm×2 mm×2 mm大小, 用套管针接种实验裸鼠右腋部皮下, 建立SW620人结肠癌裸鼠异体移植瘤模型, 最终以模型组瘤体积大于3 mm×3 mm×3 mm视为造模成功。
动物分组和给药方式 将24只裸鼠随机分为对照组, 紫草素高、低剂量(2 mg·kg-1、1 mg·kg-1)组, 用20%羟丙基环糊精溶液配制, 每组8只动物。采用腹腔注射给药, 给药体积为10 mL·kg-1, 对照组同时腹腔注射等体积20%羟丙基环糊精溶液, 每天1次, 连续给药8天后歇停7天, 实验期为15天。动物实验所有程序均获得浙江省肿瘤医院伦理委员会批准。初次给药15天后, 小鼠眼球取血至1.5 mL的离心管, 室温放置45 min后离心(3 000 r·min-1, 15 min, 4 ℃), 分装上层血清50 μL置于-80 ℃冰箱中保存。
肿瘤体积测定和抑瘤率计算 各组自给药后第3天开始用游标卡尺测量裸鼠瘤径, 每3天测量一次, 记录瘤长(a)和瘤宽(b), 计算瘤体积(V = a×b2)。实验结束后, 裸鼠颈部脱臼处死, 剥下完整瘤块, 称取瘤重, 并计算抑瘤率。瘤体拍照后液氮速冻后于-80 ℃冰箱保存备用。其中抑瘤率计算公式如下:
抑瘤率= (对照组平均瘤体质量-给药组平均瘤体质量) /对照组平均瘤体质量。
代谢组学样品制备 取分装裸鼠血清50 μL, 共计24管, 冰上解融, 每管加入乙腈150 μL, 精密量取, 震荡涡旋60 s后离心15 min (13 000 r·min-1, 4 ℃), 取上清液150 μL, 冻干机冷冻干燥3 h。以0.1%甲酸-水:乙腈(4:1)混合溶剂复溶样品, 每管加入80 μL, 振荡涡旋60 s, 离心15 min (13 000 r·min-1, 4 ℃), 取上清液60 μL进样分析。另取上清液15 μL混合均匀制备质量控制样品(quality control, QC)均匀插入序列中检测。
色谱和质谱条件 色谱柱采用Waters ACQUITY UPLC HSS T3柱(2.1 mm×100 mm, 1.8 μm), 流动相由0.1%甲酸-水(A)和乙腈(B)组成。采用梯度洗脱模式, 程序如下: 0~2 min, 2% B; 2~21 min, 2%~100% B; 21~25 min, 2% B。流速为0.3 mL·min-1, 始终保持恒定。设定自动进样器温度4 ℃, 柱温40 ℃, 进样量5 μL。实验分别采用电喷雾正、负离子扫描模式进行质谱分析, 参数如下:喷雾电压, 3.5 kV (+)和2.5 kV (-); 毛细管温度, 350 ℃ (+)和320 ℃ (-); 鞘气(N2)流量, 35 arb (+)和40 arb (-); 辅助气体(N2)流量, 10 arb (+)和8 arb (-); 质量扫描范围m/z为70~1 000;在MS/MS模式下以10、20和40 eV的3种碰撞能量获得二级数据。
数据分析 原始文件转化为mzXML格式, 转换后的数据进一步通过R软件XCMS包和MetaX包进行峰信号检测及峰面积积分, 并依据80%规则去除缺失值。得到的数据进一步利用QC进行峰校正, 最终得到包括峰保留时间、峰强度和质荷比在内的三位数据矩阵。对得到的数据矩阵进行面积归一化处理, 利用SIMCA 14.1软件进行主成分分析(principal component analysis, PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA), 通过载荷图代谢物的变量权重重要性排序(variable importance in the projection, VIP), 筛选VIP > 1.5的离子, 并结合单因素方差分析差异比较结果(P < 0.05)双重标准筛选最终差异代谢离子。筛选出的离子通过METLIN (https://metlin.scripps.edu)、HMDB (http://www.hmdb.ca/metabolites)在线数据库进行结构鉴定, 其中部分离子还通过标准品进行结构确证。最后运用MetaboAnalyst 4.0 (http://www.metaboanalyst.ca/faces/home.xhtml)平台对差异代谢物进行代谢通路富集, 获取紫草素抗结肠癌的作用机制。
统计学分析 采用SPSS 24.0软件进行单因素方差分析及t检验进行各组间差异比较, 结果用x±s表示, P < 0.05为差异有统计学意义。
结果 1 紫草素对4种结直肠癌细胞抗肿瘤活性的影响如图 1所示, 紫草素对4种结直肠癌细胞系均有明显的增殖抑制作用, 其对SW480、SW620、HCT-116和HCT-8细胞系的IC50值分别为0.95、0.68、0.62和0.97 μmol·L-1。从结果可以看出, 紫草素能够对不同结直肠癌细胞系具有相似的细胞增殖抑制作用, 抗肿瘤效果优异。
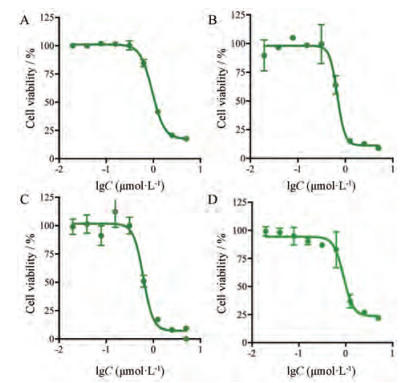
|
Figure 1 Cytotoxic effect of Shikonin on human colorectal cancer cells. A: SW480; B: SW620; C: HCT-116; D: HCT-8 |
荷瘤小鼠经不同剂量的紫草素给药后, 瘤体积较对照组均有明显下降(图 2)。此外, 高、低剂量组瘤质量与对照组比较差异显著(P < 0.05), 抑瘤率分别为42.16%和38.35%, 抑瘤作用呈剂量依赖关系。
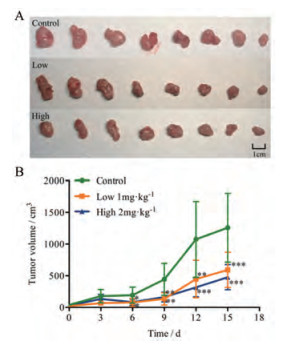
|
Figure 2 Effect of shikonon on tumor volume (A) and tumor inhibitory (B) rate of SW620 xenograft in nude mice (x±s, n = 8). *P < 0.05, **P < 0.01, ***P < 0.001 vs control group only |
代谢组学数据的稳定可重现是影响代谢组学研究的关键因素。本研究通过预先等体积混合每只小鼠的血清制备质控样品, 并采用与实际样品相同的前处理方法处理样品, 平均分布在实测样品序列中进样, 共进样5针。选择其中7个共有色谱峰(图 3), 考察了其在5次重复分析中保留时间和峰面积的稳定性。结果显示色谱峰保留时间RSD < 0.57%, 峰面积RSD < 2.99%, 表明该分析系统稳定可靠。
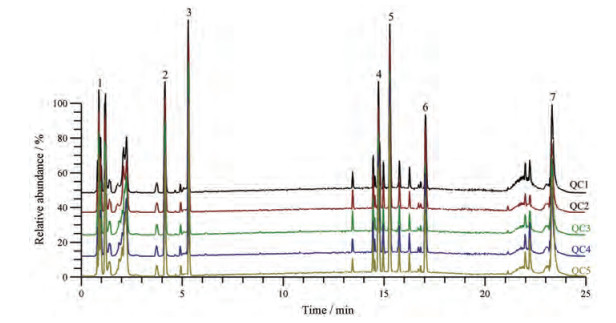
|
Figure 3 Representative total ion chromatograms of mice serum. QC 1-5: Five quality control samples; Peaks 1-7: Seven major peaks at different retention time shared in five QC samples |
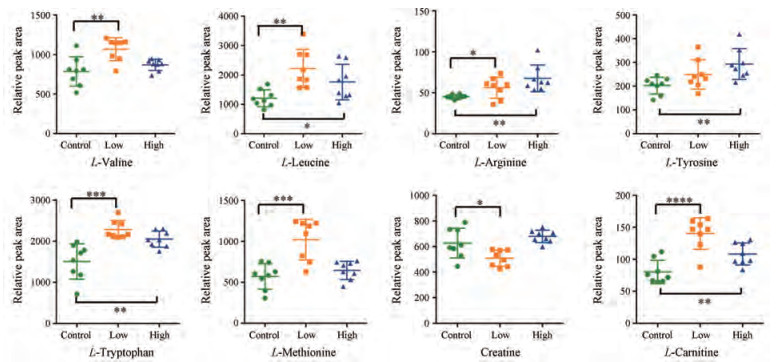
数据经过处理后, UPLC-MS数据集共得到7 681个离子。PCA作为一种无监督的模式识别方法, 能够反映数据的原始状态, 因此, 首先采用PCA识别方法对所有组血清样本的代谢轮廓进行整体分析。结果发现, 对照组与紫草素加药组能够分开, 说明紫草素干预后结肠癌移植瘤小鼠体内代谢物发生显著改变, 抗肿瘤作用明显(图 4A)。进一步采用有监督的OPLS-DA方法对三组数据进行有监督分析, 如图 4B所示, 结果显示对照组和紫草素加药组在所建立的数据模型中表现出良好的拟合度和预测能力(正离子: R2X = 0.49, R2Y = 0.99, Q2 = 0.50;负离子: R2X = 0.43, R2Y = 0.82, Q2 = 0.42)。采用置换检验来进行模型验证, 经200次置换检验后正离子模型的截距R2 = 0.99, Q2 = -0.38 (图 4C), 负离子模型的截距R2 = 0.72, Q2 = -0.63 (图 4D), 说明模型具有良好的预测能力和可靠性。此外VIP值反映了各变量在模型建立中的重要性, 本研究以VIP > 1.5和单因素方差分析(P < 0.05)作为截断标准, 共筛选鉴定了38个与紫草素抗结肠癌相关的代谢产物, 结果如表 1所示。与对照组比较, 经紫草素干预后小鼠血清中肌酸和肉碱水平上升, 同时大量氨基酸被显著上调, 包括缬氨酸、精氨酸、色氨酸、甲硫氨酸、苯丙氨酸、酪氨酸等, 同时精氨酸和酪氨酸高剂量作用更明显, 呈现浓度依赖性(图 5)。
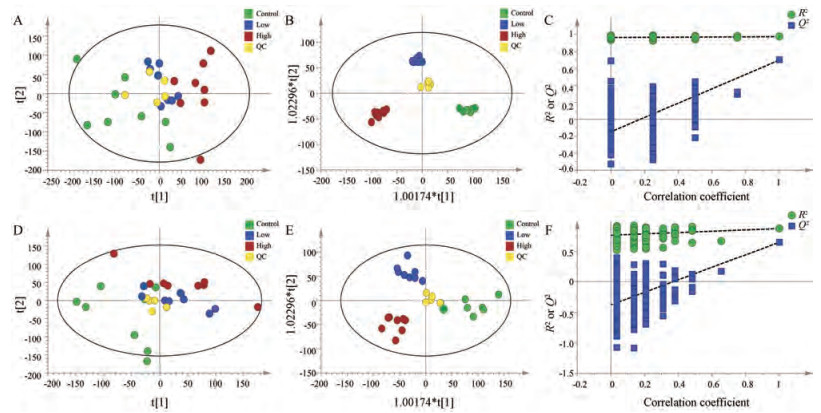
|
Figure 4 PCA scores plot (A: Positive; D: Negative) of serum from all mice, OPLS-DA scores plot (B: Positive; E: Negative), corresponding validation plot (C: Positive; F: Negative) from control and shikonin-treated groups. QC: Quality control |
| Table 1 Identificaton results of significant differential metabolites in mice serum. aRepresents metabolites that were identified by authentic standards. bRepresents metabolites that were identified by the accurate MS/MS spectrum |
|
Figure 5 Typical differential expression of metabolites in shikonin-treated serum of mice. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs control group only |
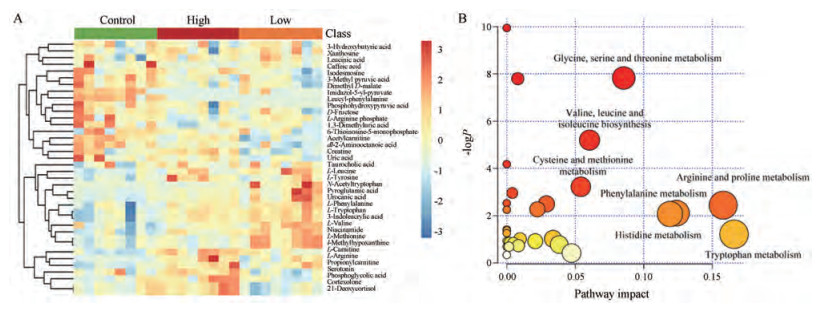
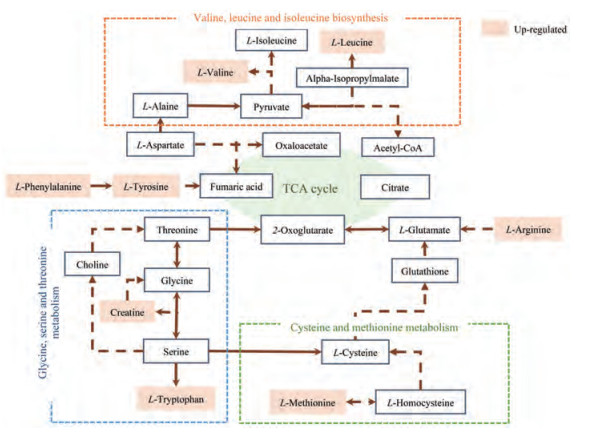
将筛选出的差异代谢物进行热图分析和利用metaboanalyst (http://www.Metaboanalyst.ca)数据库中进行代谢通路分析。如图 6A所示, 38种代谢物能够显著区分对照组、低剂量和高剂量给药组。图 6B则展示了紫草素显著影响的代谢通路。横纵坐标分别表示由拓扑分析计算所得代谢通路重要性值和代谢通路的显著性水平。本研究中以P < 0.05作为截断标准筛选紫草素抗肿瘤靶标代谢通路, 最终共得到7条代谢通路, 分别为甘氨酸、丝氨酸和苏氨酸代谢; 缬氨酸、亮氨酸和异亮氨酸的生物合成; 半胱氨酸和蛋氨酸代谢; 精氨酸和脯氨酸代谢; 组氨酸代谢; 苯丙氨酸代谢; 色氨酸代谢。其中色氨酸代谢通路的影响最为显著。氨基酸代谢网络如图 7所示。
|
Figure 6 Metabolomic analysis results of mice serum. A: Heatmap analysis of the differential metabolites in three groups; B: The summary of pathway analysis |
|
Figure 7 The schematic representation of the amino acid metabolism |
能量代谢异常是肿瘤细胞最显著的特征之一。肿瘤细胞的恶性增殖需要摄取大量的能量来维持其生长[9]。氨基酸作为构成蛋白质的基本物质, 是生物体必需的营养成分之一, 能够广泛的参与许多生理过程。本实验研究表明, 紫草素能够通过干预多条氨基酸代谢通路抑制肿瘤的生长, 包括精氨酸和脯氨酸代谢, 亮氨酸、异亮氨酸和缬氨酸合成, 甘氨酸、丝氨酸和苏氨酸代谢等。紫草素干预后小鼠甘氨酸、丝氨酸和苏氨酸代谢通路发生改变, 且差异最为显著。该通路与一碳基团的生成直接相关[10], 细胞嘌呤及嘧啶合成、氧化还原平衡和甲基化反应等重要的代谢过程都需要一碳基团参与[11]。说明紫草素给药后小鼠一碳基团的生成减少, 核酸生成受到抑制, 最终抑制肿瘤的生长。
正常情况下, 支链氨基酸(BACC)主要参与释放胰岛素、生长激素来促进脂类代谢、蛋白质合成和细胞的合成代谢, 同时具有维持机体氮平衡的作用。在肿瘤生长过程中, 支链氨基酸能够作为能源物质参与三羧酸循环, 为肿瘤细胞的快速增值提供更多能量, 促进肿瘤的生物合成[12]。本实验发现亮氨酸、异亮氨酸和缬氨酸等支链氨基酸在紫草素给药组中, 生酮氨基酸亮氨酸和缬氨酸的含量较结肠癌肿瘤对照组显著升高, 说明紫草素能够减缓支链氨基酸的代偿性能量供给, 调节氨基酸代谢紊乱, 减缓负氮平衡。
肿瘤细胞不仅代谢异常活跃, 在某些情况下还能通过多种机制逃避机体免疫系统识别和攻击, 实现在体内迅速增殖[13]。肿瘤微环境尤其是机体免疫力也是影响肿瘤的发生和治疗的重要因素, 氨基酸可以通过影响免疫微环境来抑制肿瘤的生长[14]。免疫细胞在静止与激活状态下对于能量的需求具有明显差异, 氨基酸作为蛋白质合成的基本物质, 能够为免疫细胞、免疫反应和反应酶的合成提供营养支持和生物合成基础。在肿瘤发展过程中, 激活的T细胞需要消耗大量的精氨酸来增加抗肿瘤免疫应答[15]。紫草素干预后, 小鼠血清中精氨酸含量增加, 并呈现剂量依赖性, 表明紫草素能够增强机体免疫系统, 抑制肿瘤的增殖。此外, 肿瘤微环境中的色氨酸对T细胞增殖至关重要。色氨酸代谢产物犬尿氨酸及其衍生物的积累能够抑制先天性和适应性的免疫细胞应答[16]。此前研究发现在多发性骨髓瘤中色氨酸分解代谢犬尿氨酸途径的显著上调, 同时抑制犬尿氨酸途径和免疫检查点PD-L1能够增强的抗肿瘤免疫和细胞毒性[17]。本实验发现紫草素干预后小鼠血清中的色氨酸含量显著升高, 说明催化色氨酸的分解代谢的限速酶吲哚胺2, 3-双加氧酶1 (indoleamine 2, 3-dioxygenase 1, IDO1)可能受到了抑制, 促进宿主细胞对肿瘤细胞的免疫排斥。
此外, 肿瘤细胞中活性氧(ROS)水平普遍升高。甲硫氨酸作为脂肪族含硫必需氨基酸, 是合成肌酸和肉碱的前体物质, 研究证明其能够通过干预脂质代谢、内源性抗氧化酶的活化和谷胱甘肽的生物合成来抵消氧化应激, 减少DNA损伤[18]。实验发现, 紫草素给药后小鼠血清中甲硫氨酸的含量显著增加, 说明紫草素具有调节免疫、改善氧化的作用。同时肌酸和肉碱, 分别是细胞膜保护[19]和脂肪酸氧化供能[20]关键物质, 紫草素干预后含量都略有升高, 表明紫草素能够通过减轻细胞膜过氧化损伤, 增加细胞膜的完整性改善机体免疫功能, 发挥抗肿瘤作用。
综上, 紫草素在体内外都具有良好的抗结直肠癌作用。通过建立UPLC-MS代谢组学方法, 系统揭示了紫草素抗结肠癌的作用机制。结果发现, 治疗组小鼠血清中共有38种代谢物含量发生改变, 通路富集分析表明紫草素主要通过调节多种氨基酸代谢途径发挥抗肿瘤作用。本研究为紫草素进一步开发及临床应用提供实验依据。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Papageorgiou VP, Assimopoulou AN, Couladouros EA, et al. The chemistry and biology of alkannin, shikonin, and related naphthazarin natural products[J]. Angew Chem, 1999, 38: 270-301. DOI:10.1002/(SICI)1521-3773(19990201)38:3<270::AID-ANIE270>3.0.CO;2-0 |
| [3] |
Wang H, Liu Z, Li XC, et al. Shikonin causes apoptosis by disrupting intracellular calcium homeostasis and mitochondrial function in human hepatoma cells[J]. Exp Ther Med, 2018, 15: 1484-1492. |
| [4] |
Yeh YC, Liu TJ, Lai HC. Shikonin induces apoptosis, necrosis, and premature senescence of human A549 lung cancer cells through upregulation of p53 expression[J]. Evid Based Complement Alternat Med, 2015, 2015: 620383. DOI:10.1155/2015/620383 |
| [5] |
Liang WQ, Cui JX, Zhang KC, et al. Shikonin induces ROS-based mitochondria-mediated apoptosis in colon cancer[J]. Oncotarget, 2017, 8: 109094-109106. DOI:10.18632/oncotarget.22618 |
| [6] |
He GD, He GL, Zhou RY, et al. Enhancement of cisplatin-induced colon cancer cells apoptosis by shikonin, a natural inducer of ROS in vitro and in vivo[J]. Biochem Biophys Res Commun, 2016, 469: 1075-1082. DOI:10.1016/j.bbrc.2015.12.100 |
| [7] |
Hanahan D, Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144: 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [8] |
Schrimpe-Rutledge AC, Codreanu SG, Sherrod SD, et al. Untargeted metabolomics strategies-challenges and emerging directions[J]. J Am Soc Mass Spectrom, 2016, 27: 1897-1905. DOI:10.1007/s13361-016-1469-y |
| [9] |
Pavlova NN, Thompson CB. The emerging hallmarks of cancer metabolism[J]. Cell Metab, 2016, 23: 27-47. DOI:10.1016/j.cmet.2015.12.006 |
| [10] |
Amelio I, Cutruzzolá F, Antonov A, et al. Serine and glycine metabolism in cancer[J]. Trends Biochem Sci, 2014, 39: 191-198. DOI:10.1016/j.tibs.2014.02.004 |
| [11] |
Newman AC, Maddocks ODK. One-carbon metabolism in cancer[J]. Br J Cancer, 2017, 116: 1499-1504. DOI:10.1038/bjc.2017.118 |
| [12] |
Ananieva EA, Wilkinson AC. Branched-chain amino acid metabolism in cancer[J]. Curr Opin Clin Nutr Metab Care, 2018, 21: 64-70. DOI:10.1097/MCO.0000000000000430 |
| [13] |
Desrichard A, Snyder A, Chan TA. Cancer neoantigens and applications for immunotherapy[J]. Clin Cancer Res, 2016, 22: 807-812. DOI:10.1158/1078-0432.CCR-14-3175 |
| [14] |
Pearce EL, Pearce EJ. Metabolic pathways in immune cell activation and quiescence[J]. Immunity, 2013, 38: 633-643. DOI:10.1016/j.immuni.2013.04.005 |
| [15] |
Geiger R, Rieckmann JC, Wolf T, et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity[J]. Cell, 2016, 167: 829-842. DOI:10.1016/j.cell.2016.09.031 |
| [16] |
Santhanam S, Alvarado DM, Ciorba MA. Therapeutic targeting of inflammation and tryptophan metabolism in colon and gastrointestinal cancer[J]. Transl Res, 2016, 167: 67-79. DOI:10.1016/j.trsl.2015.07.003 |
| [17] |
Ray A, Song Y, Du T, et al. Targeting tryptophan catabolic kynurenine pathway enhances antitumor immunity and cytotoxicity in multiple myeloma[J]. Leukemia, 2019, 19: 1-11. |
| [18] |
Martínez Y, Li X, Liu G, et al. The role of methionine on metabolism, oxidative stress, and diseases[J]. Amino Acids, 2017, 49: 2091-2098. DOI:10.1007/s00726-017-2494-2 |
| [19] |
Campos-Ferraz PL, Gualano B, das Neves W, et al. Exploratory studies of the potential anti-cancer effects of creatine[J]. Amino Acids, 2016, 48: 1993-2001. DOI:10.1007/s00726-016-2180-9 |
| [20] |
Hoppel C. The role of carnitine in normal and altered fatty acid metabolism[J]. Am J Kidney Dis, 2003, 41: S4-12. |
 2020, Vol. 55
2020, Vol. 55


