2. 江苏省中西医结合老年病防治重点实验室, 江苏 扬州 225001;
3. 江苏里下河地区农业科学研究所, 江苏 扬州 225007
2. Jiangsu Key Laboratory of Integrated Traditional Chinese and Western Medicine for Prevention and Treatment of Senile Diseases, Yangzhou 225001, China;
3. Jiangsu Lixiahe Institute of Agricultural Science, Yangzhou 225007, China
球毛壳菌Chaetomium globosum是一类重要的资源微生物, 其广泛分布于空气、土壤和动植物中。C. globosum能产生多种结构类型的新活性化合物, 如:从海鱼Mugil cephalus共生菌C. globosum OUPS-T106B-6发酵产物中分离得到的具有显著选择性细胞毒活性的含氯azaphilone类化合物chaetomugilins A-F[1, 2]; 植物内生菌C. globosum IFB-E019发酵产生的新骨架azaphilone二聚体化合物chaetoglobin A对人乳腺癌细胞株MCF-7和人结肠腺癌细胞株SW1116具有较好的体外抗肿瘤活性[3]; 从Christmas cactus根际C. globosum中分离得到的具有显著细胞毒活性的新dihydroxanthenone衍生物globosuxanthone A, 其能诱导人肺癌细胞株NCI-H460和人前列腺癌细胞株PC-3M细胞周期阻滞, 还能促进NCI-H460细胞凋亡[4]; 动物共生菌C. globosum产生的对多株人肿瘤细胞株具有较强细胞毒活性的新骨架细胞松弛素类化合物armochaeglobine B[5]; 以及C. globosum和A. flavipes共培养产生的具有2H-1, 4-thiazine结构的merocytochalasan化合物cytochathiazine B, 其能抑制人白血病细胞株NB4和HL-60增殖并诱导细胞凋亡[6]等。
细胞松弛素类化合物是C. globosum产生的一类特征次生代谢产物, 因丰富的结构与多样的生物活性而备受关注[7, 8]。Chaetomium globosum WQ是从传统药用植物白茅(Imperata cylindrical)中分离获得的一株内生真菌, 前期实验已从其固体发酵产物中分离得到14个化合物, 包括11个细胞松弛素类化合物[9, 10]。以1H NMR谱和TLC为指导, 进一步对C. globosum WQ固体发酵产物乙酸乙酯相化学成分进行分离纯化, 结果又分离得到1个新细胞松弛素化合物20-iso-chaetoglobosin E (1) (图 1)。
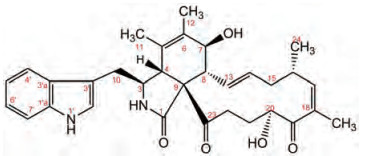
|
Figure 1 Structure of 20-iso-chaetoglobosin E (1) |
化合物1为白色粉末。其正源HR-ESI-MS显示准分子离子峰m/z 553.267 7 [M+Na]+, 说明其分子量为530, 分子式为C32H38N2O5 (C32H38N2O5Na, 计算值: 553.267 3), 不饱和度为15。化合物1的1H NMR谱显示吲哚环的特征氢信号, 即: δH-4' 7.52 (d, J = 7.8 Hz)、δH-5' 7.15 (t, J = 7.8 Hz)、δH-6' 7.22 (t, J = 7.8 Hz)、δH-7' 7.39 (d, J = 7.8 Hz)和δH-2' 7.00 (s)。进一步分析其1H和13C NMR谱, 可推测化合物1可能是10-吲哚基-细胞松弛素化合物。化合物1的分子式与细胞松弛素化合物chaetoglobosin E[9, 11]、penochalasin H[12]和chaetoglobosin O[13]相同, 且与它们具有相同的碳谱特征。仔细比较化合物1与penochalasin H[12]和chaetoglobosin O[13]的13C NMR谱可发现, 这3个化合物从C-1到C-16以及C-1'到C-7'的化学位移基本相同, 但化合物1从C-17到C-21的化学位移与penochalasin H和Chaetoglobosin O存在明显差异, 提示化合物1与penochalasin H[12]和chaetoglobosin O[13]可能仅存在C-19和C-20位的结构差异, 即其C-19位是羰基、C-20位连接羟基。再与chaetoglobosin E[9]相比, 化合物1的C-20向低场移动(Δδ = 2.6 ppm)、C-21向高场移动(Δδ = -5.8 ppm), 表明该化合物可能是chaetoglobosin E的C-20位异构体。随后进行的一系列二维核磁共振谱[HSQC、HMBC、1H-1H COSY (图 2)和NOESY (图 3)]分析证实了这个结构推测。
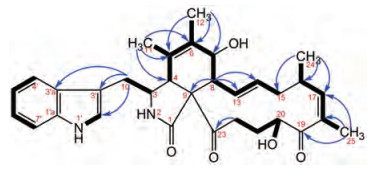
|
Figure 2 Key 1H-1H COSY (  |
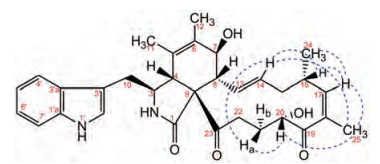
|
Figure 3 Key NOESY ( |
化合物1的1H-1H COSY谱显示H-8到H-15、H-24到H-25、H-22与20-OH的相关, 同时, HMBC谱中存在H-8与C-9、C-13和C-14的相关; H-24与C-15、C-16和C-17的相关; H-25与C-17、C-18和C-19的相关; 以及H-22与C-23的相关, 说明结构中存在十三元碳环。从H-4到H-8的COSY相关, 以及H-11与C-4、C-5和C-6的HMBC相关, H-12与C-5、C-6和C-7的HMBC相关, 说明化合物1结构中存在六元环(C4-C5-C6-C7-C8-C9)。此外, 1H-1H COSY谱中1'-NH与H-2'、H-3与H-10、H-4'到H-7'的相关, 以及HMBC谱中H-10与C-2'、C-3'和C-3'a的相关, 证实吲哚基通过C-10与C-3相连。综上可确定化合物1的平面结构如图 1所示。在此基础上, 进一步利用NOESY谱确定化合物1的C-20位的立体构型。Chaetoglobosin E的NOESY谱可观察到H-17与H-16、H-17与H-20、H-17与H-21a、H-17与H-22a、H-20与H-21ab、H-20与H-22ab的NOE相关, 表明其H-20与H-17在异侧, H-20在α位[9, 12]。而化合物1的NOESY谱中存在H-17与H-16、H-17与H25、H-20与H-25、H-20与H-21ab存在NOE相关, 说明H-20、H-16、H-17与H-25在同侧, H-20在β位, C-20位构型为S型。10-吲哚基-细胞松弛素化合物一般具有相同的色氨酸合成途径[11, 14], 且化合物1与chaetoglobosin E、penochalasin H和Chaetoglobosin O具有基本相同的C1到C16化学位移, 因此, 化合物1其余手性中心的构型确定为3S, 4R, 7S, 8R, 9R, 16S。最终化合物1被鉴定为20-iso-chaetoglobosin E (1), 该结构尚未见文献报道, 其1H和13C NMR数据归属列于表 1。
| Table 1 1H and 13C NMR data of 20-iso-chaetoglobosin E (1) in CDCl3 (J in Hz) |
Bruker AVANCE 600核磁共振波谱仪和Bruker UHR-TOF-Maxis超高分辨飞行时间质谱仪(德国Bruker公司); Jasco J-810圆二色光谱仪(日本分光公司); Hitachi Primaide高效液相色谱仪和Hitachi LaChrom C-18 (4.6 mm×150 mm, 5 μm)液相色谱柱(日本日立公司); 柱色谱硅胶(200~300目) (青岛海洋化工厂分厂); Merck Silica gel 60 F254铝板(20 cm×20 cm) (德国Merck公司); Sephadex LH-20 (瑞典Pharmacia Biotech公司); CDCl3 (美国Sigma-Aldrich公司); 色谱甲醇(美国TEDIA公司); 其他试剂均为分析纯。
菌株WQ是从药用植物白茅Imperata cylindrical中分离得到的一株内生真菌, 南京大学宋勇春副教授根据形态学特征鉴定其为球毛壳菌Chaetomium globosum。该菌株现存放于南京大学功能生物分子研究所。C. globosum WQ采用固体发酵法[15]。固体发酵产物粉碎阴干后, 用氯仿/甲醇(1:1)混合溶剂浸提3次, 减压去除溶剂得粗浸膏, 该浸膏水悬液经乙酸乙酯萃取得乙酸乙酯相浸膏26 g。
C. globosum WQ固体发酵产物乙酸乙酯相浸膏经硅胶柱色谱分离, CHCl3:CH3OH梯度洗脱(100:1→0:100)得到7个组分Fr.1~Fr.7 (100:0, 2.6 g; 100:1, 3.82 g; 100:2, 1.43 g; 100:4, 5.2 g; 100:8, 8.2 g; 100:16, 1.44 g; 0:100, 2.0 g)。其中, Fr.2 (3.82 g)先后经硅胶柱色谱和Sephadex LH-20凝胶柱色谱进一步分离得到Fr.2-2-3-2, Fr.2-2-3-2再经HPLC纯化(MeOH:H2O v/v 52:48, 0.75 mL·min-1)得到化合物1 (0.63 mg)。
20-iso-chaetoglobosin E (1):白色粉末, 分子式C32H38N2O5。HR-ESI-MS: m/z 553.267 7 [M+Na]+ (C32H38N2O5Na, 计算值: 553.267 3)。UV (CH3OH): λmax (logε) = 221 (4.51) nm; CD (CH3OH): λmax (Δε) = 205 (15.30), 242 (-4.23), 284 (1.05), 303 (0.31), 318 (1.08) nm。1H和13C NMR数据见表 1。
| [1] |
Yamada T, Doi M, Shigeta H, et al. Absolute stereostructures of cytotoxic metabolites, chaetomugilins A-C, produced by a Chaetomium species separated from a marine fish[J]. Tetrahedron Lett, 2008, 49: 4192-4195. DOI:10.1016/j.tetlet.2008.04.060 |
| [2] |
Yasuhide M, Yamada T, Numata A, et al. Chaetomugilins, new selectively cytotoxic metabolites, produced by a marine fish-derived Chaetomium species[J]. J Antibiot, 2008, 61: 615-622. DOI:10.1038/ja.2008.81 |
| [3] |
Ge HM, Zhang WY, Ding G, et al. Chaetoglobins A and B, two unusual alkaloids from endophytic Chaetomium globosum culture[J]. Chem Commun, 2008(45): 5978-5980. DOI:10.1039/b812144c |
| [4] |
Wijeratne EMK, Turbyville TJ, Fritz A, et al. A new dihydroxanthenone from a plant-associated strain of the fungus Chaetomium globosum demonstrates anticancer activity[J]. Bioorg Med Chem, 2006, 14: 7917-7923. DOI:10.1016/j.bmc.2006.07.048 |
| [5] |
Chen C, Zhu H, Li XN, et al. Armochaeglobines A and B, two new indole-based alkaloids from the arthropod-derived fungus Chaetomium globosum[J]. Org Lett, 2015, 17: 644-647. DOI:10.1021/ol503666b |
| [6] |
Wang WJ, Zeng FR, Bie Q, et al. Cytochathiazines A-C:three merocytochalasans with a 2H‑1, 4-thiazine functionality from coculture of Chaetomium globosum and Aspergillus flavipes[J]. Org Lett, 2018, 20: 6817-6821. DOI:10.1021/acs.orglett.8b02942 |
| [7] |
Scherlach K, Boettger D, Remme N, et al. The chemistry and biology of cytochalasans[J]. Nat Prod Rep, 2010, 27: 869-886. DOI:10.1039/b903913a |
| [8] |
Elizabeth S. The biosynthesis of cytochalasans[J]. Nat Prod Rep, 2017, 34: 1252-1263. DOI:10.1039/C7NP00036G |
| [9] |
Shen L, Zhu L, Wei ZQ, et al. Chemical constituents from endophyte Chaetomium globosum in Imperata cylindrical[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4645-4649. |
| [10] |
Chen LM, Zhu L, Liu Q, et al. Research of cytochalasan compounds from endophyte Chaetomium globosum WQ in Imperata cylindrical[J]. J Yangzhou Univ (Agric Life Sci Ed) (扬州大学学报农业与生命科学版), 2019, 40: 101-106. |
| [11] |
Sekita S, Yoshihira K, Natori S. Chaetoglobosins, cytotoxic 10-(indol-3-yl)-[13] cytochalasans from Chaetomium spp. IV. 13C-nuclear magnetic resonance spectra and their application to a biosynthetic study[J]. Chem Pharm Bull, 1983, 31: 490-498. DOI:10.1248/cpb.31.490 |
| [12] |
Iwamoto C, Yamada T, Ito Y, et al. Cytotoxic cytochalasans from a Penicillium species separated from a marine alga[J]. Tetrahedron, 2001, 57: 2997-3004. DOI:10.1016/S0040-4020(01)00153-3 |
| [13] |
Ichihara A, Katayama K, Teshima H, et al. Chaetoglobosin O and other phytotoxic metabolites from Cylindrocladium floridanum, a causal fungus of alfalfa black rot disease[J]. Biosci Biotechnol Biochem, 1996, 60: 360-361. DOI:10.1271/bbb.60.360 |
| [14] |
Probst A, Tamm C. Biosynthesis of the cytochalasans. Biosynthetic studies on chaetoglobosin A and 19-O-acetylchaetoglobosin A[J]. Helv Chim Acta, 1981, 64: 2065-2077. DOI:10.1002/hlca.19810640711 |
| [15] |
Shen L, Jiao RH, Ye YH, et al. Absolute configuration of new cytotoxic and other bioactive trichothecene macrolides[J]. Chem Eur J, 2006, 12: 5596-5602. DOI:10.1002/chem.200600084 |
 2020, Vol. 55
2020, Vol. 55


