2. 中国医学科学院北京协和医学院医药生物技术研究所, 北京 100050
2. Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
结直肠癌(colorectal cancer, CRC)的发病率和死亡率历来高居我国消化系统恶性肿瘤之首, 严重危害居民健康, 其五年生存率仅为65%[1, 2]。目前, 尽管有手术治疗、放疗、化疗和分子靶向药物等多种治疗手段, 但CRC的复发和转移仍是导致其高死亡率的重要原因。在CRC复发和转移的过程中, 结直肠癌干细胞(colorectal cancer stem cell, CCSC)通过Wnt/β-catenin信号通路的活化进行自我更新与分化, 形成肿瘤起始细胞(tumor initiating cells, TICs), 极大促进了CRC的转移与恶化[3-5]。
在经典Wnt信号通路中, β-catenin作为核心转录调控因子, 通过犰狳蛋白重复片段(armadillo repeats)结构域与核转录调控因子TCF4 (T-cell factor 4)或LEF1 (lymphoid enhancer factor 1)的βBD结构域(β-catenin binding domain, βBD)相互作用形成核转录调控因子复合物, 调控原癌基因表达与CCSC恶性转化, 促进CRC的复发与转移。因此, β-catenin/TCF4相互作用已成为CRC分子靶向治疗的重要靶标之一[6, 7]。
目前, 已报道的靶向β-catenin/TCF4相互作用小分子抑制剂筛选方法主要包括酶联免疫吸附实验(enzyme-linked immunosorbent assay, ELISA)筛选法、4T1细胞荧光素酶报告基因筛选法、果蝇细胞化学遗传学筛选法和虚拟筛选法。其中, ELISA筛选法虽然较大程度模拟了β-catenin与核转录调控因子TCF4的生理相互作用, 但操作步骤繁琐, 筛选过程中需要孵育抗体且多次洗涤, 筛选成本较高, 耗时较长; 4T1细胞荧光素酶报告基因筛选法和果蝇细胞化学遗传学筛选法主要基于化学发光和RNA干扰原理设计, 操作难度较大, 筛选成本较高, 假阳性率也较高; 虚拟筛选法基于靶标分子对接原理设计, 虽然较大程度降低了筛选的实验成本, 但假阳性化合物的有效排除仍是虚拟筛选的核心问题, 必须与实验筛选技术有机结合。基于上述筛选方法已成功筛选到了PKF115-584、PKF222-815、PKF118-744、CGP049090、ZTM000990、iCRT-3/5/14、CWP232228、LF3、PNU-74654等靶向β-catenin/TCF4相互作用的小分子抑制剂, 在结直肠癌、乳腺癌、肝癌等肿瘤的实验治疗中展现出良好的应用前景[8-14]。但上述报道的筛选方法存在的固有缺点和较高的筛选成本, 极大地限制了其在大规模高通量筛选中的推广和应用。
本研究旨在利用荧光偏振(fluorescence polarization, FP)原理, 根据β-catenin/TCF4相互作用的结构生物学信息, 将异硫氰酸荧光素(fluorescence isothiocyanate, FITC)标记的TCF4多肽(FITC-TCF4)作为核转录调控因子TCF4的模拟物[15, 16], 建立并应用荧光偏振高通量筛选模型筛选苗头化合物。荧光偏振高通量筛选模型的建立对靶向β-catenin/TCF4相互作用的新型Wnt抑制剂高效化与理性化发现具有重要意义。
材料与方法 材料与试剂重组人β-catenin (138~781 aa)表达工程菌由皖南医学院药物筛选与评价研究所刘晓平教授课题组构建; 蛋白质标准分子量(Transgen公司); 蛋白胨、酵母粉和琼脂粉(Oxide公司); 卡那霉素和异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG) (Sigma公司); HisTrapTM层析柱(GE公司); 二辛可宁酸(bicinchoninic acid, BCA)蛋白质浓度测定试剂盒(Thermo公司); 牛血清白蛋白(bull serum albumin, BSA)和辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗大鼠IgG (Biosharp公司); MaxiLuminTM化学发光液(Tanon公司); 四甲基联苯胺(3, 3', 5, 5'-tetramethylbenzidine, TMB)溶液(TianGen公司); 384孔板和酶标板(Corning公司); 异硫氰酸荧光素(fluorescence isothiocyanate, FITC)标记的TCF4多肽荧光探针(FITC-TCF4: FITC-GGDDLGANDELISFKDEGEQEEK- OH)和TCF4多肽(TCF4: GGDDLGANDELISFKDE GEQEEK-OH)由China Peptides公司合成; 天然产物化合物库(ChemDiv公司); 血根碱、白屈菜红碱和化合物S720 (TargetMol公司); 大鼠抗人β-catenin多克隆抗体、谷胱甘肽转移酶(glutathione S-transferase, GST)和GST-LEF1 βBD (1~76 aa)由皖南医学院药物筛选与评价研究所刘晓平教授课题组制备和保存; 其他生化试剂为国产分析纯试剂。
仪器细菌震荡培养箱(上海知楚仪器有限公司); 超声波细胞粉碎机(SCIENTZ公司); 高速冷冻离心机(Eppendorf公司); AKTA Pure层析系统(GE公司); 蛋白质电泳仪与转膜仪(Bio-Rad公司); 凝胶成像系统(Clinx公司); 多功能酶标仪(BioTek公司)。
重组人β-catenin原核表达与分离纯化按照参考文献[17]所述的方法进行重组人β-catenin原核表达与分离纯化。首先, 将工程菌以固体平板划线法进行复壮。随机挑取单菌落接种于LB液体培养基(含50 μg·mL-1卡那霉素), 以0.2 mmol·L-1 IPTG, 25 ℃诱导10 h, 离心收集菌体。菌体以超声波法破碎后, 上清液再以HisTrapTM亲和柱分离纯化。纯化的重组人β-catenin以Western blot实验进行鉴定, 经浓缩和透析后, 再以BCA法定量。
重组人β-catenin生物学活性鉴定按照参考文献所述的ELISA方法进行重组人β-catenin生物学活性鉴定[17]。首先, 将GST与GST-LEF1 β BD (10 μg·mL-1)包被96孔酶标板, 每孔100 μL, 4 ℃过夜。次日, 酶标板经10% BSA封闭2 h后, 各孔依次加入0、1、2、3、4、5、6、7、8、9、10 μg·mL-1 β-catenin, 每孔100 μL, 每组设置3组复孔, 室温孵育1 h。依次加入大鼠抗人β-catenin多克隆抗体(1:10 000)和HRP-羊抗大鼠IgG (1:4 000)后, TMB溶液显色, 多功能酶标仪检测A450值。
荧光探针FITC-TCF4最佳反应浓度的确定将2 mmol·L-1 FITC-TCF4以荧光偏振反应液(50 mmol·L-1 Tris、10 mmol·L-1 NaCl、1 mmol·L-1 EDTA pH 8.0)稀释至终浓度分别为5、10、20、30、40、50、60、70、80、90、100 nmol·L-1, 依次加入到384孔板中, 每孔60 μL, 每组设置3组复孔, 室温孵育15 min, 以多功能酶标仪检测mP值(millipolarization units, mP)。
β-Catenin/FITC-TCF4结合稳定性实验将40 nmol·L-1 FITC-TCF4加入到384孔板中, 每孔30 μL, 再依次加入0、10、50、100、200、300、400、500、600、700、800、900、1 000 nmol·L-1 β-catenin, 每孔30 μL, 每组设置3组复孔, 室温孵育15、30 min和1、2、3、4、5和6 h, 以多功能酶标仪检测mP值。
同法, 将上述结合反应分别在4、25、37 ℃孵育15 min, 再以多功能酶标仪检测mP值。以GraphPad Prism5.0软件拟合结合曲线, 计算β-catenin/FITC-TCF4结合反应的解离平衡常数(dissociation constant) Kd值和ΔmP值。
β-Catenin最佳反应浓度的确定将2 mmol·L-1 TCF4多肽以200 nmol·L-1 β-catenin进行2倍倍比稀释(起始浓度20 μmol·L-1, 共稀释10个浓度梯度)后, 加入到384孔板中, 每孔30 μL, 每组设置3组复孔, 室温孵育45 min。再将40 nmol·L-1 FITC-TCF4依次加入, 每孔30 μL, 室温孵育15 min, 多功能酶标仪检测mP值。以GraphPad Prism5.0软件拟合TCF4多肽抑制曲线, 计算半数抑制浓度(half maximal inhibitory concentration, IC50)值和ΔmP值。再分别以400和800 nmol·L-1 β-catenin同法稀释TCF4多肽, 计算IC50值和ΔmP值。本实验中设定含2% DMSO孔为阴性对照孔, 只含20 nmol·L-1 FITC-TCF4孔为阳性对照孔。
DMSO耐受性实验在药物高通量筛选中, DMSO是经常使用的有机溶剂, 因此需要评价实验体系对DMSO的耐受程度。将40 nmol·L-1 FITC-TCF4加入到384孔板中, 每孔30 μL, 再将0、10、50、100、200、300、400、500、600、700、800、900、1 000 nmol·L-1 β-catenin依次加入到384孔板中, 每孔30 μL。反应体系中含DMSO终浓度分别为0、2%、4%、6%、8%、10%、20%, 每组设置3组复孔, 室温孵育15 min, 以多功能酶标仪检测mP值。用GraphPad Prism5.0软件拟合结合曲线, 计算β-catenin/FITC-TCF4结合反应在各DMSO浓度中的Kd值和ΔmP值。
Z'因子及其他主要技术参数的测定将40 nmol·L-1 FITC-TCF4和200 nmol·L-1 β-catenin加入到384孔板中, 每孔各加入30 μL, 其中A板1#~50#孔反应体系中含2% DMSO, B板1#~50#孔反应体系中含10 μmol·L-1 TCF4多肽, 室温孵育15 min, 以多功能酶标仪检测mP值。设定A板1#~50#孔为阴性对照孔, B板1#~50#孔为阳性对照孔, 按照BioTek操作系统的相关程序进行Zx因子计算。
另外, 对本筛选模型的信号本底比值(signal to background, S/B)、信号窗(signal window, SW)、信噪比(signal to noise, S/N)和信号本底变异系数(coefficient of variation of signal/background, CV)进行计算分析。
苗头化合物的高通量筛选天然产物化合物库(约5 000库容)以DMSO稀释至浓度为1.0 mg·mL-1即为次级库。首先, 将200 nmol·L-1 β-catenin加入到384孔板中, 每孔29 μL, 再依次加入小分子化合物, 每孔1 μL, 室温孵育45 min。再将40 nmol·L-1 FITC-TCF4加入到384孔板中, 每孔30 μL, 室温继续孵育15 min, 多功能酶标仪检测mP值, 计算小分子化合物的抑制率。阴性对照孔和阳性对照孔的设定如上所述。苗头化合物(hit)初判标准:抑制率 > 50%的小分子化合物。
苗头化合物IC50值测定将10 mmol·L-1血根碱(sanguinarine, SAN)、白屈菜红碱(chelerythrine, CHE)和化合物S720以200 nmol·L-1 β-catenin进行2倍倍比稀释(起始浓度100 μmol·L-1, 共稀释12个浓度梯度), 加入到384孔板中, 每孔30 μL, 每组设置3组复孔, 室温孵育45 min。再将40 nmol·L-1 FITC-TCF4依次加入到384孔板中, 每孔30 μL, 室温继续孵育15 min, 多功酶标仪检测mP值。以GraphPad Prism5.0软件拟合苗头化合物的抑制曲线, 计算IC50值。
数据处理与分析采用GraphPad Prism5.0软件拟合β-catenin/FITC-TCF4结合反应曲线和Hit抑制曲线, 分别计算Kd值和IC50值, 其中Hit抑制率计算公式如下所述:
| $ {\rm{Hit抑制率}}\left( \% \right) = \frac{{{\rm{m}}{{\rm{P}}_{阴性对照}} - {\rm{m}}{{\rm{P}}_{\rm{Hit}}}}}{{{\rm{m}}{{\rm{P}}_{阴性对照}} - {\rm{m}}{{\rm{P}}_{阴性对照}}}} \times 100\% $ |
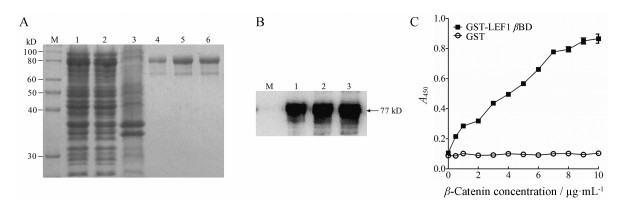
工程菌经诱导培养后, 菌体裂解上清液以HisTrapTM亲和层析柱分离纯化。考马斯亮蓝染色结果显示, 诱导的工程菌在分子质量77 kD位置有明显的蛋白质表达条带, 上清液中含有大量目的蛋白质, 表明重组人β-catenin在大肠杆菌中以胞内可溶形式表达。纯化的重组人β-catenin仅有单一蛋白质条带, 说明具有较高的纯度(图 1A)。Western blot实验结果表明, 在分子质量77 kD位置同样有单一蛋白质条带。随着重组人β-catenin剂量的增加, 蛋白质条带逐渐增粗, 证实了重组人β-catenin的正确表达(图 1B)。GST-LEF1 βBD介导的ELISA实验结果表明, 重组人β-catenin能与GST-LEF1 βBD发生特异性结合反应, 结合反应具有良好的量效关系和浓度依赖性(图 1C)。上述实验结果表明, 成功进行了重组人β-catenin原核表达与分离纯化, 纯化的重组人β-catenin具有良好的生物学活性。纯化的重组人β-catenin经浓缩、透析和BCA定量后, 浓度为1.5 mg·mL-1。
|
图 1 Bacterial expression, purification, and identification of recombinant human β-catenin. A: Bacterial expression and purification of recombinant human β-catenin. M: Marker; 1: Total cell proteins; 2: Supernatant; 3: Pellet; 4-6: Purified β-catenin band. B: Identification of recombinant human β-catenin using Western blot assay. M: Marker; 1: 0.5 μg β-catenin band; 2: 1 μg β-catenin band; 3: 2 μg β-catenin band. C: Bioactivity analysis of purified β-catenin binding to GST-LEF1 βBD using enzyme-linked immunosorbent assay (ELISA). GST: Glutathione S-transferase; LEF1 βBD: Lymphoid enhancer factor 1 β-catenin binding domain |
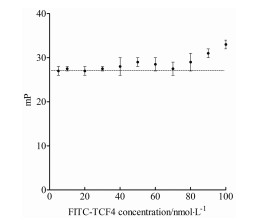
将不同浓度的FITC-TCF4置于384孔板中, 以多功能酶标仪检测mP值。实验结果表明, 从100 nmol·L-1开始, 不同浓度的FITC-TCF4在实验体系中的mP值基本保持一致, 在5~50 nmol·L-1浓度时, mP值波动最小, 基本保持在25~30之间, 具有相对较低且平稳的mP值(图 2)。为了保持实验体系的良好灵敏度和较低的本底值, 选用FITC-TCF4最佳反应浓度为20 nmol·L-1。
|
图 2 Determination of the optimal working concentration of FITC-TCF4 in FP screening assay. FITC: Fluorescence isothiocyanate; TCF4: T-cell factor 4; FP: Fluorescence polarization |
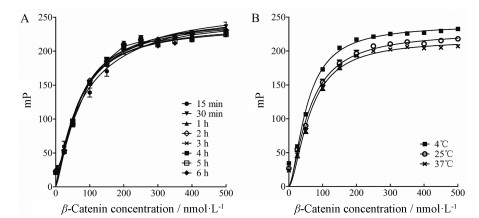
采用饱和曲线法, 测定不同孵育时间和反应温度条件下β-catenin/FITC-TCF4结合反应的Kd值和ΔmP值。荧光偏振实验结果表明, 室温孵育15、30 min和1、2、3、4、5和6 h时, 结合反应的Kd值和ΔmP值基本保持稳定(图 3A、表 1)。室温孵育15 min时, 结合反应基本达到平衡, Kd值约为(68.11 ± 4.08) nmol·L-1, ΔmP值约为(185.87 ± 3.44) (表 1)。另外, 结合反应在4、25、37 ℃孵育15 min时, 结合反应的Kd值和ΔmP值也基本保持稳定, Kd值约为(62.76 ± 3.27) nmol·L-1, ΔmP值约为(184.66 ± 4.92) (图 3B、表 2)。上述实验结果表明, β-catenin/FITC-TCF4结合反应具有良好的稳定性。
|
图 3 The stability analysis of β-catenin/FITC-TCF4 complex. A: Saturation binding curves at 15 min, 30 min, 1 h, 2 h, 3 h, 4 h, 5 h, and 6 h; B: Saturation binding curves at 4, 25, and 37 ℃ |
| 表 1 Kd and ΔmP values at different incubation durations. Kd: Dissociation constant; ΔmP: Dynamic range of millipolarization units |
| 表 2 Kd and ΔmP values at different incubation temperatures |
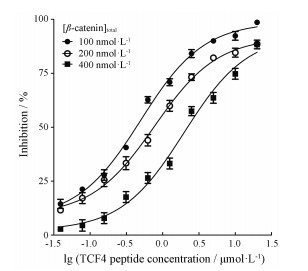
在荧光偏振实验中, 通常认为参与反应的配体蛋白浓度至少为Kd值的1.5倍才能满足高通量筛选需求[18, 19]。为了确定β-catenin最佳反应浓度, 分别采用1.5、3、6倍Kd值, 即100、200、400 nmol·L-1 β-catenin与20 nmol·L-1 FITC-TCF4反应建立荧光偏振反应体系, 并利用该反应体系检测TCF4多肽的竞争性抑制作用, 计算IC50值和ΔmP值。实验结果表明, 随着β-catenin浓度的增加, TCF4多肽的IC50值逐渐升高。1.5倍Kd值, 即100 nmol·L-1 β-catenin反应体系中, TCF4多肽具有较低的IC50值, ΔmP值稳定在165左右, 具有较大的信号窗(图 4、表 3)。另外, 本实验也证实了所建立的荧光偏振实验体系具有良好的特异性。为了保证实验体系的高灵敏度和较大的信号窗, 选用β-catenin最佳反应浓度为100 nmol·L-1。
|
图 4 The inhibitory curves of TCF4 peptide in the competitive FP assay |
| 表 3 IC50 and ΔmP values of TCF4 peptide in the competitive FP assay. IC50: Half maximal inhibitory concentration |
通过分析DMSO对β-catenin/FITC-TCF4结合反应饱和曲线Kd值和ΔmP值的影响, 判断荧光偏振实验体系对DMSO的耐受性。当DMSO浓度在0~20%时, 饱和曲线的Kd值为(64.66 ± 0.68) nmol·L-1, ΔmP值为(183.92 ± 4.12), 波动极小(图 5、表 4)。上述实验结果表明, 当DMSO浓度在20%以内时, 其对β-catenin/FITC-TCF4结合反应没有显著影响, 实验体系对DMSO具有良好的耐受性。
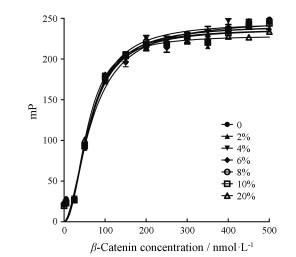
|
图 5 DMSO tolerance analysis in FP-based high-throughput screening (HTS) assay |
| 表 4 Kd and ΔmP values in DMSO tolerance analysis |
Z'因子是评价药物高通量筛选体系稳定性的核心参数。通过综合分析和计算, 本筛选模型Z'因子值为0.88, 满足高通量筛选中Z'因子大于0.5的基本要求(图 6)。另外, 本筛选模型S/B、SW、S/N和CV等参数也完全满足高通量筛选的基本要求(表 5)。
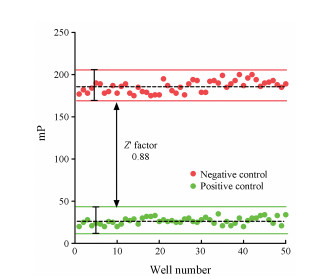
|
图 6 Determination of Z' factor in FP-based HTS assay |
| 表 5 General indicators in FP-based HTS assay. S/B: Signal to background; S/N: Signal to noise; SW: Signal window; CV: Coefficient of variation of signal/background |
应用上述已建立的荧光偏振高通量筛选模型, 对本室天然产物化合物库进行了高通量筛选, 成功筛选到血根碱(SAN)、白屈菜红碱(CHE)和化合物S720具有良好的抑制活性, 其IC50值分别为(1.22 ± 0.08)、(2.58 ± 0.25)、(18.67 ± 1.08) μmol·L-1 (图 7)。
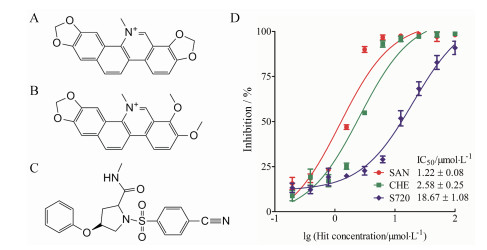
|
图 7 Three hits were validated in FP-based HTS assay. A: The chemical structure of sanguinarine (SAN); B: The chemical structure of chelerythrine (CHE); C: The chemical structure of compound S720; D: The inhibitory curves of three hits in FP screening assay |
Wnt/β-catenin信号通路是调控肿瘤干细胞形成与分化的关键信号通路, 与肿瘤生长、复发、转移和耐药密切相关。在正常细胞中, 胞质中β-catenin通过泛素化途径降解, 因此不存在Wnt/β-catenin信号通路。但在肿瘤细胞中, 胞质中累积的β-catenin大量进入细胞核与核转录调控因子TCF4或LEF1相互作用, 形成核转录调控因子复合物, 活化Wnt/β-catenin信号通路, 启动原癌基因的大量表达[6, 7]。所以, 靶向β-catenin介导的核转录调控(β-catenin responsive transcription, CRT), 尤其是β-catenin/TCF4相互作用, 是新型高选择性Wnt抑制剂开发的重要策略之一。
高活性的β-catenin制备是荧光偏振高通量筛选模型建立的重要基础。本研究采用大肠杆菌原核表达技术, 成功进行了重组人β-catenin原核表达、分离纯化与活性鉴定。由于大肠杆菌表达的重组人β-catenin融合有His标签, 故此直接采用HisTrapTM亲和层析柱进行一步法分离纯化。GST-LEF1 βBD介导的ELISA实验证实了纯化的重组人β-catenin能与GST-LEF1 βBD特异结合, 结合反应具有良好的量效关系, 这表明纯化的重组人β-catenin具有良好的生物学活性。
荧光偏振技术具有均相反应、操作简便、检测灵敏、成本低廉等优点, 被广泛应用于药物筛选、蛋白质活性鉴定、药物分析与疾病诊断[19-23]。本研究以β-catenin/TCF4相互作用为靶标, 将荧光探针FITC-TCF4作为核转录调控因子TCF4的模拟物, 基于偏振荧光强弱与荧光分子大小正相关的原理建立了小分子抑制剂荧光偏振高通量筛选模型[15, 16, 24]。如果小分子化合物为非活性化合物, 那么分子量较大的β-catenin将与分子量较小的FITC-TCF4发生特异性结合反应, 荧光复合物的分子量将增大, 旋转速度较慢, 荧光偏振实验中表现较高的mP值; 反之, 活性化合物能够特异性阻断β-catenin与FITC-TCF4的相互作用, 荧光复合物分子量将明显减小, 旋转速度较快, 荧光偏振实验中则表现较低的mP值。
相比已报道的靶向β-catenin/TCF4相互作用小分子抑制剂的ELISA筛选法、4T1细胞荧光素酶报告基因法、果蝇细胞化学遗传学筛选法和虚拟筛选法, 本研究建立的荧光偏振筛选模型具有化合物用量少、操作简便、耗时较短、灵敏度高、重复性好、成本低廉等优点, 不仅可以快速实现小分子化合物的高通量筛选, 还可以用于天然产物体外抑制活性的初步评价, 因此本模型具有良好的实用性和推广性。但在本荧光偏振高通量筛选模型中, 荧光探针FITC-TCF4仅是一条短肽, 还不足以完全模拟作为生物大分子的核转录调控因子TCF4的真实理化性质和空间结构, 所以苗头化合物还需要再以基于真实蛋白质相互作用建立的ELISA实验或GST Pull-down实验深入进行体外抑制活性评价, 进一步确证苗头化合物的潜在分子靶标。
本研究基于荧光偏振原理建立高通量筛选模型时, 选择20 nmol·L-1作为FITC-TCF4最佳工作浓度, 因为此时FITC-TCF4具有较低且平稳mP值。饱和曲线测定实验结果表明, 建立的以β-catenin/FITC-TCF4结合反应为基础的荧光偏振筛选体系具有良好的稳定性。TCF4多肽的竞争性抑制实验结果说明, 实验体系中的β-catenin浓度选择对抑制剂的药理活性评价影响较大。为了保证实验体系的适宜信号窗和高灵敏度, 选择100 nmol·L-1作为β-catenin最佳工作浓度。DMSO耐受实验结果显示, 当DMSO浓度控制在20%以内时, 其对β-catenin/FITC-TCF4结合反应没有显著影响, 实验体系对DMSO具有良好的耐受性。Z'因子是高通量筛选模型稳定性评价的核心参数, 本研究建立的荧光偏振筛选模型Z'因子为0.88, 满足了高通量筛选模型Z'因子大于0.5的基本要求。另外, 本筛选模型S/B、S/N、SW和CV值也完全满足了高通量筛选的基本要求, 这表明所建立的荧光偏振筛选模型具有良好的稳定性、灵敏性和特异性。本文成功运用所建立的荧光偏振筛选模型对本室天然产物化合物库进行高通量筛选, 首次发现了血根碱、白屈菜红碱和化合物S720对β-catenin/TCF4相互作用具有良好的抑制活性。
血根碱和白屈菜红碱是传统中药博落回和白屈菜的主要药效成分之一, 具有抗肿瘤、抗菌、抗病毒、抗炎等药理活性[25-27]。研究表明, 血根碱可通过抑制Wnt/β-catenin信号通路的原癌基因表达, 进而抑制肺癌干细胞的生长与分化发挥抗肿瘤活性, 但血根碱在Wnt/β-catenin信号通路中的潜在分子靶标迄今尚未明确[28]。综合上述筛选结果, 本研究初步证实了β-catenin/TCF4相互作用可能是血根碱抗肿瘤活性的潜在分子靶标之一。
综上所述, 本研究成功建立了基于β-catenin/TCF4相互作用为靶标的荧光偏振高通量筛选模型, 为靶向β-catenin/TCF4相互作用的小分子抑制剂高通量筛选和药理学活性评价奠定了实验基础。
致谢: 衷心感谢中国科学院大学存济医学院袁莉教授、军事科学院军事医学研究院军事兽医研究所全军人兽共患病预防与控制重点实验室张国利教授和岳玉环教授在重组人β-catenin原核表达和活性鉴定方面给予的悉心指导和无私帮助!
| [1] |
Du LB, Li HZ, Wang YQ, et al. Report of colorectal cancer incidence and mortality in China, 2013[J]. Chin J Oncol (中华肿瘤杂志), 2017, 39: 701-706. |
| [2] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68: 7-30. DOI:10.3322/caac.21442 |
| [3] |
Iqbal W, Alkarim S, AlHejin A, et al. Targeting signal transduction pathways of cancer stem cells for therapeutic opportunities of metastasis[J]. Oncotarget, 2016, 7: 76337-76353. DOI:10.18632/oncotarget.10942 |
| [4] |
Sebio A, Kahn M, Lenz HJ. The potential of targeting Wnt/β-catenin in colon cancer[J]. Exp Opin Ther Targets, 2014, 18: 611-615. DOI:10.1517/14728222.2014.906580 |
| [5] |
Ma HY, He M, Wei MJ. Research progress on targeting effect and regulating mechanisms of the stemness of cancer stem cells[J]. Acta Pharm Sin (药学学报), 2016, 51: 189-196. |
| [6] |
Anastas JN, Moon RT. WNT signalling pathways as therapeutic targets in cancer[J]. Nat Rev Cancer, 2013, 13: 11-26. DOI:10.1038/nrc3419 |
| [7] |
Zhan T, Rindtorff N, Boutros M. Wnt signaling in cancer[J]. Oncogene, 2017, 36: 1461-1473. DOI:10.1038/onc.2016.304 |
| [8] |
Lepourcelet M, Chen YN, France DS, et al. Small-molecule antagonists of the oncogenic Tcf/beta-catenin protein complex[J]. Cancer Cell, 2004, 5: 91-102. DOI:10.1016/S1535-6108(03)00334-9 |
| [9] |
Gonsalves FC, Klein K, Carson BB, et al. An RNAi-based chemical genetic screen identifies three small-molecule inhibitors of the Wnt/wingless signaling pathway[J]. Proc Natl Acad Sci U S A, 2011, 108: 5954-5963. DOI:10.1073/pnas.1017496108 |
| [10] |
Jang GB, Hong IS, Kim RJ, et al. Wnt/β-catenin small-molecule inhibitor CWP232228 preferentially inhibits the growth of breast cancer stem-like cells[J]. Cancer Res, 2015, 75: 1691-1702. DOI:10.1158/0008-5472.CAN-14-2041 |
| [11] |
Fang L, Zhu Q, Neuenschwander M, et al. A small-molecule antagonist of the β-catenin/TCF4 interaction blocks the self-renewal of cancer stem cells and suppresses tumorigenesis[J]. Cancer Res, 2016, 76: 891-901. DOI:10.1158/0008-5472.CAN-15-1519 |
| [12] |
Trosset JY, Dalvit C, Knapp S, et al. Inhibition of protein-protein interactions:the discovery of druglike beta-catenin inhibitors by combining virtual and biophysical screening[J]. Proteins, 2006, 64: 60-67. DOI:10.1002/prot.20955 |
| [13] |
Yan M, Li G, An J. Discovery of small molecule inhibitors of the Wnt/β-catenin signaling pathway by targeting β-catenin/Tcf4 interactions[J]. Exp Biol Med, 2017, 242: 1185-1197. DOI:10.1177/1535370217708198 |
| [14] |
Cheng X, Xu X, Chen D, et al. Therapeutic potential of targeting the Wnt/β-catenin signaling pathway in colorectal cancer[J]. Biomed Pharmacother, 2019, 110: 473-481. DOI:10.1016/j.biopha.2018.11.082 |
| [15] |
Poy F, Lepourcelet M, Shivdasani RA, et al. Structure of a human Tcf4-beta-catenin complex[J]. Nat Struct Biol, 2001, 8: 1053-1057. DOI:10.1038/nsb720 |
| [16] |
Fasolini M, Wu X, Flocco M, et al. Hot spots in Tcf4 for the interaction with beta-catenin[J]. J Biol Chem, 2003, 278: 21092-21098. DOI:10.1074/jbc.M301781200 |
| [17] |
Chen YY, Niu XY, Li Y, et al. Development of an ELISA-based high throughput screening method for novel anticancer agents targeting β-catenin/Lef1 interaction[J]. Chin J Biotech (生物工程学报), 2019, 35: 707-717. |
| [18] |
Nikolovska-Coleska Z, Wang R, Fang X, et al. Development and optimization of a binding assay for the XIAP BIR3 domain using fluorescence polarization[J]. Anal Biochem, 2004, 332: 261-273. DOI:10.1016/j.ab.2004.05.055 |
| [19] |
Zhu MR, Du DH, Hu JC, et al. Development of a high-throughput fluorescence polarization assay for the discovery of EZH2-EED interaction inhibitors[J]. Acta Pharmacol Sin, 2018, 39: 302-310. DOI:10.1038/aps.2017.59 |
| [20] |
Jiang YH, Zhang J, Chen YY, et al. Screening of small molecule inhibitors for PLK1 PBD and evaluation of antitumor activities[J]. Acta Pharm Sin (药学学报), 2017, 52: 409-415. |
| [21] |
Chen YY, Liu G, Zhang J, et al. Bacterial expression, purification and biological activity evaluation of Plk1 PBD protein[J]. J Chongqing Med Univ (重庆医科大学学报), 2018, 43: 1453-1457. |
| [22] |
Yang XH, Xu GJ, Zhang XY, et al. A fluorescence polarization immunoassay for the detection of aflatoxins in herbal teas[J]. Acta Pharm Sin (药学学报), 2017, 52: 620-624. |
| [23] |
He Q, Cui X, Shen D, et al. Development of a simple, rapid and high-throughput fluorescence polarization immunoassay for glycocholic acid in human urine[J]. J Pharm Biomed Anal, 2018, 158: 431-437. DOI:10.1016/j.jpba.2018.06.023 |
| [24] |
Zhang H, Wu Q, Berezin MY, et al. Fluorescence anisotropy (polarization):from drug screening to precision medicine[J]. Expert Opin Drug Discov, 2015, 10: 1145-1161. DOI:10.1517/17460441.2015.1075001 |
| [25] |
Achkar IW, Mraiche F, Mohammad RM, et al. Anticancer potential of sanguinarine for various human malignancies[J]. Future Med Chem, 2017, 9: 933-950. DOI:10.4155/fmc-2017-0041 |
| [26] |
Almeida IV, Fernandes LM, Biazi BI, et al. Evaluation of the anticancer activities of the plant alkaloids sanguinarine and chelerythrine in human breast adenocarcinoma cells[J]. Anticancer Agents Med Chem, 2017, 17: 1586-1592. |
| [27] |
Fu C, Guan G, Wang H. The anticancer effect of sanguinarine:a review[J]. Curr Pharm Des, 2018, 24: 2760-2764. DOI:10.2174/1381612824666180829100601 |
| [28] |
Yang J, Fang Z, Wu J, et al. Construction and application of a lung cancer stem cell model:antitumor drug screening and molecular mechanism of the inhibitory effects of sanguinarine[J]. Tumor Biol, 2016, 37: 13871-13883. DOI:10.1007/s13277-016-5152-5 |
 2020, Vol. 55
2020, Vol. 55


