2. 北京中医药大学中药现代研究中心, 北京 100029
2. Modern Research Center for Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
心血管疾病日渐成为现代社会主要死亡原因[1], 其中, 高血脂是导致多种心血管疾病的诱因[2]。高脂血症对身体的损害是隐匿、逐渐、进行性和全身性的, 其主要危害是导致动脉粥样硬化, 进而引起冠心病、脑卒中、心肌梗死、心脏猝死、肾功能衰竭等众多的相关疾病; 也是促进高血压、糖耐量异常、糖尿病的一个重要危险因素[3]。因此, 寻找有效的降血脂药物, 对于降低动脉粥样硬化和心血管疾病的发生具有重要的意义。脂肪酶在脂肪水解中起着关键作用[4], 抑制消化道中脂肪酶的活性, 可有效抑制脂肪吸收和水解, 有助于发现有效的降脂和抗动脉粥样硬化的药物[5]。
现有的以脂肪酶为靶的筛选体系通常采用溶液化酶法[6]和固定化酶法[7]。溶液化酶法可以保持酶的原始构型状态, 但缺点是需要离心等复杂的操作步骤, 而且小分子化合物可能会吸附到膜上导致假阳性结果。化学固定化酶法可能会降低活性位点的暴露, 导致靶酶的生物活性改变甚至失活。聚丙烯中空纤维是一种过滤器中的常用材料, 其内外壁具有丰富的孔道结构, 有较大的比表面积, 被广泛应用于各类样品的前处理[8]和活性成分筛选中。如Balcao等[9]利用物理吸附原理在中空纤维表面固定多种胰脂肪酶, 其固定率最大可达到70%。Tao等[8]利用静态浸泡的方法在中空纤维中吸附脂肪酶, 从荷叶中筛选出脂肪酶抑制剂。基于物理吸附原理的脂肪酶固定方法简便有效, 无需使用键合剂, 经济方便。但是已报道的中空纤维吸附酶靶方法都是采用静态浸泡, 传质效率低, 而且进样、淋洗、洗脱等操作步骤繁琐。因此, 开发基于中空纤维吸附酶靶的集成流体灌注系统有望解决传统方法的技术瓶颈。
苦丁茶是我国和东南亚各国重要的饮用茶之一, 其正品来源是冬青属植物苦丁茶冬青Ilex kudingcha C. J. Tseng的叶[10]。苦丁茶除作为茶饮用外, 也是我国南部及西南部民间传统的药用植物, 具有清热解毒、杀菌消炎、健胃消积、止咳化痰、生津止渴、提神醒脑、明目益智和抗辐射、抗衰老、活血脉、调节血脂等功效[11]。研究表明, 苦丁茶提取物主要含有三萜类皂苷成分, 具有降低肥胖大鼠血脂水平、抑制大鼠动脉粥样硬化病程进展的活性[10]。但迄今为止, 关于苦丁茶中降脂、抗动脉粥样硬化的活性成分尚不明确。
本研究开发了一种基于中空纤维吸附靶酶的集成流体灌注系统, 并将酶靶筛选和生物模型活性评价相结合, 用于苦丁茶总皂苷中活性化合物的快速发现。首先, 利用中空纤维作为载体, 建立基于中空纤维吸附靶酶的集成流体灌注系统。进而, 对酶靶筛选的方法学进行考察, 包括中空纤维对脂肪酶的吸附和溶剂洗脱条件。然后, 采用优化后的条件, 对苦丁茶总皂苷中的脂肪酶抑制剂进行快速筛选。最后, 通过脂肪酶抑制活性实验和低密度脂蛋白聚集体(aggregate low-density lipoprotein, aggLDL)诱导泡沫细胞形成模型对活性成分进行验证。本研究构建的基于中空纤维吸附靶酶的集成流体灌注系统具有功能集成、传质速率快、操作步骤简单、分析通量和效率更高、成本低廉等优点, 并且有望与色谱和质谱系统在线联用, 快速发现中药药效物质。
材料与方法仪器与材料 岛津高效液相色谱(HPLC)分析系统(Shimadzu, 日本), 包括LC-20AT液相系统、SIL-20A自动进样器、SPD-20A紫外检测器、CTO-20A柱温箱; PHD/ULTRA注射泵(Harvard Apparatus, 美国); Opretta CLSTM高内涵分析仪(PerkinElmer, 美国); 聚丙烯中空纤维(杭州恒滤膜技术工程有限公司); 聚四氟乙烯套管(上海汇荆机电设备有限公司); 脂肪酶(100~300 U·mg-1, Lot#SLBZ7254)、对硝基苯棕榈酸酯(BR, Lot#SLBP2897V)、佛波酯(BR, Lot#231C7023) (Sigma Aldrich, 美国); 奥利司他(BR, Harvey Bio, 美国, Lot#51129C125);甲醇(HPLC级, Lot#192642)、乙腈(HPLC级, Lot#194036) (北京百灵威科技有限公司); 磷酸(AR, Lot#20180228)、醋酸钠(AR, Lot#20020327) (北京化工厂); 蛋白定量试剂盒(北京全式金生物技术有限公司, Lot#N31126); Tris-HCl缓冲液(中科迈晨科技有限公司, Lot#0708A19);苦丁茶总皂苷、苦丁茶皂苷A、苦丁茶皂苷C均为本实验室前期实验中制备。
基于中空纤维的流体灌注系统的设计和制造 剪取8段均为30 cm的中空纤维, 将纤维分别装入8根等长的聚四氟乙烯套管内, 注入无水乙醇清洗活化1 h, 70 ℃烘干。在内有中空纤维的聚四氟乙烯套管一端安装1 mL注射器。以50 mmol·L-1的Tris-HCl (pH 6.8)为溶剂, 配制2.0 mg·mL-1的胰脂肪酶溶液。分别用注射器吸取0.3 mL蛋白溶液, 推动注射泵使蛋白溶液充满整个套管, 室温下静置后, 用Tris-HCl缓冲液润洗, 去除游离的脂肪酶。
中空纤维对脂肪酶吸附条件优化 为了确定脂肪酶在中空纤维上吸附的最佳孵育时间, 使用BCA蛋白定量法对灌流过程中溶液蛋白浓度随时间变化进行测定。依上述方法将脂肪酶溶液灌流充满中空纤维后, 每20 min取出蛋白溶液2.5 μL, 稀释20倍测定其浓度, 并补入蛋白溶液2.5 μL继续孵育, 如此至第300 min。得到的蛋白溶液样本依BCA试剂盒要求检测溶液中脂肪酶的浓度, 绘制蛋白浓度-时间曲线, 通过曲线两端的蛋白浓度差计算脂肪酶在中空纤维上的吸附浓度。
洗脱条件优化 将苦丁茶总皂苷粉末溶解于pH 6.8的Tris-HCl中, 得到0.8 mg·mL-1苦丁茶总皂苷溶液。如图 1a组装连续灌流系统, 鲁尔换向阀的四个端口一端连接装有Tris-HCl缓冲液的注射器, 一端连接装有甲醇溶液的注射器, 一端连接装有苦丁茶总皂苷溶液的注射器, 一端连接内有中空纤维的聚四氟乙烯套管。首先将皂苷溶液以30 μL·min-1的速度持续灌流10 min, 后切换为Tris-HCl缓冲液, 以30 μL·min-1的速度灌流10 min, 清洗未与脂肪酶结合的物质, 再切换至甲醇溶液, 以30 μL·min-1的速度灌流10 min, 将与中空纤维结合的物质洗脱, 收集每支套管中甲醇洗脱下的液体, 进入HPLC分析。本实验分别使用50%与100%甲醇溶液进行洗脱, 并对其洗脱物的物质组成进行了比较, 比较两种不同浓度甲醇溶液的洗脱效果。之后采用优化的条件进行洗脱, 比较吸附脂肪酶与未吸附脂肪酶的中空纤维洗脱液中物质组成的区别。
高效液相色谱(HPLC)分析条件 色谱柱为Agilent SB-Aq C18 Column (5 μm, 150 mm×4.6 mm, Agilent, US); 柱温为35 ℃; 检测波长为226 nm; 流动相A (0.1%磷酸水溶液): B (乙腈), 梯度洗脱程序: 0~18 min, 18%~32% B; 18~26 min, 32%~37% B; 26~40 min, 37% B; 40~45 min, 37%~95% B; 45~47 min, 95%~100% B; 47~48 min, 100% B; 48~52 min, 100%~18% B; 52~62 min, 18% B; 流速为0.6 mL·min-1; 进样量为20 μL。
脂肪酶抑制活性验证 称取4-硝基苯基棕榈酸酯8 mg, 用TritonX-100溶液0.1 mL完全润湿后加入醋酸钠4.0 mg, 超纯水稀释至50 mL, 沸水浴加热溶解, 制得底物溶液。配制不同浓度的苦丁茶皂苷, 取苦丁茶皂苷溶液100 μL与脂肪酶溶液(2 mg·mL-1) 50 μL混匀, 溶剂均为50 mmol·L-1的Tris-HCl (pH = 6.8)。37 ℃水浴10 min后, 加入底物溶液50 μL启动反应, 用紫外分光光度计在405 nm每10 s读出一次吸光度值, 以不加药物的溶液为对照组, 通过公式(1)计算抑制率。
| $ 抑制率 = \left( {{R_0} - R} \right)/{R_0}{\rm{ \times }}100\% $ | (1) |
式(1)中, R0为无抑制剂时的吸光度随时间变化的斜率; R为在含有不同浓度抑制剂的体系中的吸光度随时间变化的斜率。以得到的每个浓度药物对脂肪酶的抑制率为纵轴, 苦丁茶皂苷的对数浓度为横轴绘制曲线, 即可计算出苦丁茶皂苷的半数抑制浓度(IC50)。
抗动脉粥样硬化活性成分的筛选 THP-1细胞使用含有10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养基培养于37 ℃、5% CO2的孵箱中。实验时, 将细胞稀释为每毫升4×105个, 每孔200 μL种入96孔板内。培养过夜后, 加入160 nmol·L-1的佛波酯(phorbol ester, PMA) 200 μL并于37 ℃下孵育48 h。细胞分化贴壁后, 将溶解于DMSO中的苦丁茶皂苷分别用含有10 mg·L-1 Dil标记的低密度脂蛋白聚集体的细胞培养液稀释, 终浓度分别为100、200和400 μmol·L-1, 每孔200 μL与分化贴壁的THP-1细胞37 ℃避光共孵24 h。弃去上清并将细胞用含有0.2% BSA (w/v)的冷PBS清洗3次, PBS清洗1次, 用4%多聚甲醛固定2 min, PBS清洗3次, 加入5 μg·mL-1 DAPI染液100 μL避光孵育10 min, PBS清洗3次后于Operetta CLSTM高内涵分析仪上检测红色荧光。药物对THP-1吞噬低密度脂蛋白的抑制率用给药组荧光强度与阴性对照组荧光强度的比值表示。
数据处理及分析 所有数据均以(x ± SD)的形式展示, 使用GraphPad Prism 8.0软件进行处理。组间数据的比较采用单因素方差分析法(One-way ANOVA), P < 0.05时即为有统计学差异。
结果 1 基于中空纤维的集成流体灌注系统的设计和吸附靶酶筛选原理如图 1a所示, 基于中空纤维的集成流体灌注系统分为两部分, 即流体控制部分和中空纤维部分。流体控制部分通过注射泵精确输送和控制流体, 鲁尔换向阀进行不同流体的切换。中空纤维部分将中空纤维装载入聚四氟乙烯套管内, 连续灌流系统的连接管道均为聚四氟乙烯(PTFE)材质, 这种材质具有高度的疏水性和低黏附性[12], 可减少管道上的非特异性粘附造成过多的样品损耗。该流体灌注系统可与多通道注射泵联用, 提高样品分析通量和效率, 如图 1b所示。与传统中空纤维吸附酶靶筛选方法相比, 该系统的优势体现在以下两点。第一, 通过鲁尔换向阀, 可实现进样、淋洗、洗脱步骤的集成和灵活切换, 极大地简化了实验步骤; 第二, 通过注射泵控制连续灌流的流速, 与静态浸泡方式相比, 传质速率更快, 传质可控性更强, 无需多次洗脱步骤。静态浸泡法需要3次洗脱去除与脂肪酶未结合和小分子化合物[8], 流体灌注系统仅需1次10 min洗脱即可。灌流中空纤维吸附酶靶筛选方法流程如图 1c所示: ①脂肪酶通过物理吸附原理吸附到中空纤维表面; ②向吸附脂肪酶的中空纤维内灌注中药提取物; ③灌注法洗去与脂肪酶活性位点未结合的小分子化合物; ④灌注有机溶剂使脂肪酶变性, 释放出与脂肪酶活性位点有亲和力结合的小分子化合物, 进行HPLC分析鉴定, 最后进行生物活性验证。
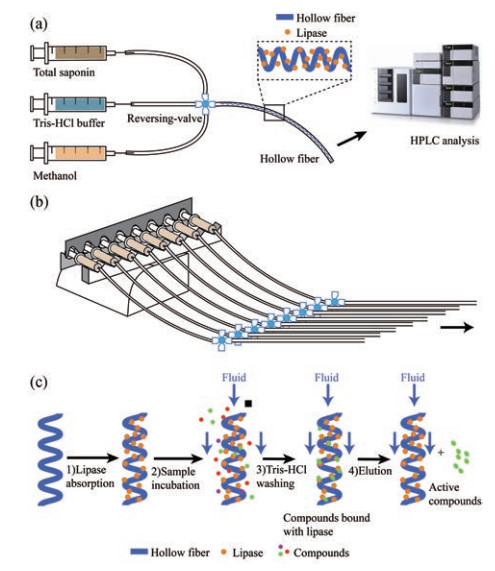
|
Figure 1 Schematic diagram of the integrated perfusion enzyme affinity selection system based on hollow fiber. a: The integrated perfusion system with fluid control and hollow fiber; b: The perfusion system with eight paralleled units for improving throughput; c: Steps of the enzyme affinity selection method |
首先优化脂肪酶吸附条件。利用中空纤维材料本身固有的多孔结构, 脂肪酶可以通过物理吸附的方式固着于中空纤维上。主要考察吸附时间, 脂肪酶的吸附量通过对与中空纤维接触前后的溶液态脂肪酶浓度变化进行评价, 如图 2所示。蛋白浓度的测定使用BCA蛋白定量法实现, 其标准曲线如图 2a所示, 标准曲线表达式为Y = 0.002 78X + 0.038 72, R2 = 0.989 5。将浓度为2.0 mg·mL-1的脂肪酶溶液与中空纤维共孵育, 溶液态脂肪酶浓度随时间的变化如图 2b所示。结果显示, 溶液态脂肪酶浓度随着与中空纤维接触的时间延长而逐渐降低, 并在约100 min后逐渐平缓, 在约200 min达到平衡[13]。因此, 最终选定脂肪酶的吸附时间为200 min, 计算可得最终中空纤维中吸附的脂肪酶浓度约为1 500 μg·mL-1。
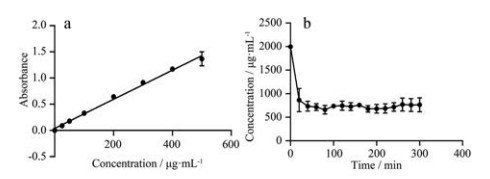
|
Figure 2 Optimization of lipase adsorption on hollow fibers. a: The standard curve of lipase protein by BCA method; b: The amount of lipase adsorption on the hollow fibers with time |
接着优化洗脱条件。选用的分析物为由本课题组制备的苦丁茶总皂苷提取物, 具有良好的水溶性, 可直接溶解于Tris-HCl缓冲液中, 第一次吸附灌流后, 使用Tris-HCl缓冲液灌流清洗一次即可将中空纤维上游离的皂苷洗净。为了尽可能完全地将与脂肪酶结合的苦丁茶活性成分洗脱下来, 同时减少中空纤维对活性成分的非特异性吸附, 本实验对文献中常见的两种洗脱溶剂50%甲醇和100%甲醇进行了对比。结果显示, 100%甲醇洗脱得到的主成分峰面积明显大于50%甲醇。故选取100%甲醇作为后续实验的洗脱溶剂。
综上所述, 基于中空纤维吸附酶靶的方法学优化条件如下:吸附时间为200 min, 洗脱溶剂为100%甲醇。
3 苦丁茶总皂苷中脂肪酶抑制剂筛选苦丁茶是一种广泛流行于亚洲地区的常见饮用茶。研究表明, 苦丁茶具有显著的抗动脉粥样硬化、降脂、消肥作用, 可以减少营养性肥胖大鼠皮下脂肪的堆积[11], 且有研究报道其总皂苷具有脂肪酶抑制活性, 但关于苦丁茶皂苷中具有降脂、抗动脉粥样硬化的活性单体成分尚不明确, 故本研究针对苦丁茶总皂苷开展研究。
采用优化后的条件, 对苦丁茶总皂苷中脂肪酶抑制剂进行快速活性筛选。由于中空纤维的多孔结构本身可非特异性吸附总皂苷混合物中的物质, 因此本实验设置了不加入脂肪酶的中空纤维作为对照组, 用于排除非特异性吸附的干扰。实验组和对照组的HPLC对比结果如图 3a所示; 对比实验组与对照组主成分峰面积(图 3b)可见, 峰5、6在实验组中的响应峰面积明显高于对照组, 二者具有显著性差异, 说明这两种成分可能是与脂肪酶具有潜在结合的活性成分。通过与文献及标准品比对, 这两种化合物分别被鉴定为苦丁茶皂苷C (KuC)和A (KuA)[14]。
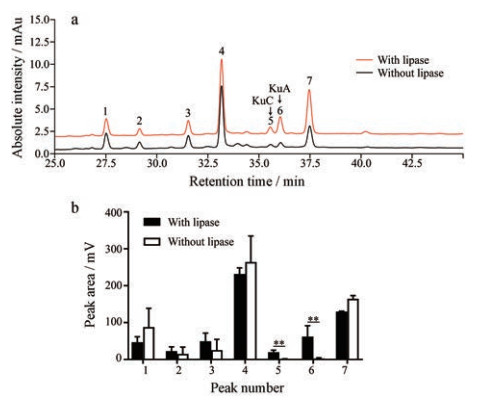
|
Figure 3 Screening of lipase inhibitors from total saponins of Kudingcha by the integrated perfusion enzyme affinity selection system. Comparison of HPLC chromatograms (a) and peak areas (b) of the elution from the hollow fibers with or without lipase absorption. **P < 0.01 |
为验证中空纤维筛选体系的可靠性, 对两种苦丁茶皂苷对脂肪酶的抑制活性进行评价。脂肪酶可水解4-硝基苯棕榈酸酯(PNPP)产生4-硝基苯酚(PNP)和棕榈酸, PNP在水溶液中显黄色, 在405 nm有最大的光吸收, 通过测定PNP在405 nm处的光吸收即可换算得脂肪酶的活力[15]。结果苦丁茶皂苷A和C的IC50值分别361.3和1 029 μmol·L-1, 阳性对照药奥利司他, 一种临床常用的脂肪酶抑制剂类减肥药[16]的IC50为934.2 μmol·L-1。上述结果显示, 两种苦丁茶皂苷的脂肪酶抑制活性均与阳性药相当。
本实验进一步采用低密度脂蛋白聚集体(aggLDL)诱导泡沫细胞形成模型评价了两种苦丁茶皂苷的抗动脉粥样硬化活性。动脉粥样硬化是一个多因素共同调节的复杂病理过程[3]。其中泡沫细胞的形成多少是其主要诊断特征, 也是其病程进展的核心环节[17]。巨噬细胞吞噬大量aggLDL, 从而形成泡沫细胞并沉积于动脉壁上[18]。基于以上认识, 在THP-1细胞吞噬脂质的细胞模型中, 能够抑制aggLDL在细胞中积累并抑制泡沫细胞形成的化合物被认为具有潜在的抗动脉粥样硬化活性。在验证了其脂肪酶抑制活性后, 对苦丁茶皂苷A和C抑制巨噬细胞吞噬aggLDL的活性进行了进一步验证。其中, aggLDL被红色荧光染料Dil标记, 便于在荧光显微镜下观察其是否进入细胞。由图 4可知, 苦丁茶皂苷A和C均能剂量依赖地抑制细胞内的aggLDL积累。说明苦丁茶皂苷A和C能够剂量依赖地抑制THP-1分化的巨噬细胞吞噬aggLDL, 有望通过抑制泡沫细胞形成起到抗动脉粥样硬化的作用。上述研究结果证实了本研究建立的基于中空纤维吸附靶酶的流体灌注系统具有较好的可靠性。
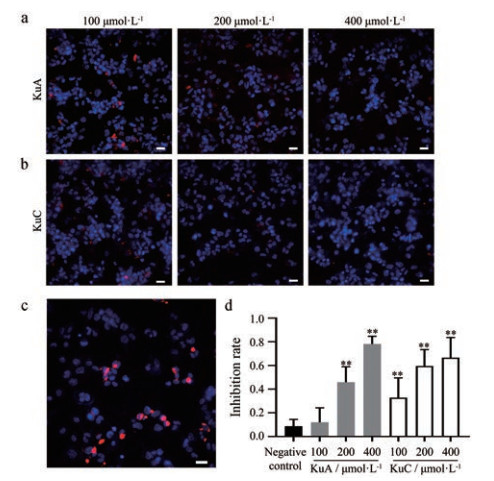
|
Figure 4 Evaluation of inhibition of kudinosides C (KuC) on the phagocytosis of Dil-aggregate low-density lipoprotein (Dil-aggLDL) by THP-1 cells. Nuclei were stained in blue by DAPI. Dil-aggLDL was stained in red by Dil. a: Distribution of Dil-aggLDL in cells under different concentrations KuA; b: Distribution of Dil-aggLDL in cells under different concentrations KuC; c: Distribution of Dil-aggLDL in cells without compound treatment; d: Quantitation of the inhibition of KuA and KuC against phagocytosis of Dil-aggLDL by THP-1 cells. **P < 0.01 vs negative control |
本研究为发现降脂和抗动脉粥样硬化的活性化合物, 构建了基于中空纤维吸附靶酶的集成流体灌注系统, 系统分为流体控制部分和中空纤维部分。首先对酶靶筛选的方法学进行考察, 优化吸附时间为200 min, 洗脱溶剂为100%甲醇。接着采用优化后的条件对苦丁茶总皂苷中的脂肪酶抑制剂进行筛选, 发现两种与脂肪酶结合的小分子化合物, 即苦丁茶皂苷A和C。最后, 通过生物活性模型进行了活性验证, 确认苦丁茶皂苷A和C具有脂肪酶抑制活性和抑制巨噬细胞吞噬aggLDL形成泡沫细胞的活性。
与溶液酶法、化学固定法、中空纤维酶靶静态浸泡法相比, 本研究构建的基于中空纤维吸附靶酶的集成流体灌注系统具有功能集成、传质速率快、操作步骤简单、分析通量和效率更高、成本低廉、可靠性高等优点, 特别适合中药复杂体系的快速活性筛选。该技术平台扩展性较强, 可更换不同的靶标蛋白、与色谱和质谱系统在线联用, 快速发现中药药效物质。
| [1] |
Xie M, Xing JG, Wang L, et al. The hypolipidemic and anti-atherosclerotic effects of acacetin and its mechanism of action in mice[J]. Acta Pharm Sin (药学学报), 2019, 54: 846-853. |
| [2] |
Schaftenaar F, Frodermann V, Kuiper J, et al. Atherosclerosis: the interplay between lipids and immune cells[J]. Curr Opin Lipidol, 2016, 27: 209-215. DOI:10.1097/MOL.0000000000000302 |
| [3] |
Torres N, Guevara-Cruz M, Velazquez-Villegas L, et al. Nutrition and atherosclerosis[J]. Arch Med Res, 2015, 46: 408-426. DOI:10.1016/j.arcmed.2015.05.010 |
| [4] |
Patel N, Rai D, Shivam, et al. Lipases: sources, production, purification, and applications[J]. Recent Pat Biotechnol, 2019, 13: 45-56. |
| [5] |
Bialecka-Florjanczyk E, Fabiszewska A, Krzyczkowska J, et al. Synthetic and natural lipase inhibitors[J]. Mini Rev Med Chem, 2018, 18: 672-683. DOI:10.2174/1389557516666160630123356 |
| [6] |
Califano V, Bloisi F, Perretta G, et al. Frozen microemulsions for MAPLE immobilization of lipase[J]. Molecules, 2017, 22: 2153. DOI:10.3390/molecules22122153 |
| [7] |
Wang H, Zhao X, Wang S, et al. Fabrication of enzyme-immobilized halloysite nanotubes for affinity enrichment of lipase inhibitors from complex mixtures[J]. J Chromatogr A, 2015, 1392: 20-27. DOI:10.1016/j.chroma.2015.03.002 |
| [8] |
Tao Y, Zhang Y, Wang Y, et al. Hollow fiber based affinity selection combined with high performance liquid chromatography-mass spectroscopy for rapid screening lipase inhibitors from lotus leaf[J]. Anal Chim Acta, 2013, 785: 75-81. |
| [9] |
Balcao V, Vieira M, Malcata F. Adsorption of protein from several commercial lipase preparations onto a hollow-fiber membrane module[J]. Biotechnol Prog, 1996, 12: 164-172. DOI:10.1021/bp950070n |
| [10] |
Zheng J, Wang X, Li H, et al. Improving abnormal hemorheological parameters in ApoE-/- mice by Ilex kudingcha total saponins[J]. Clin Hemorheol Microcirc, 2009, 42: 29-36. DOI:10.3233/CH-2009-1183 |
| [11] |
Chen G, Xie M, Dai Z, et al. Kudingcha and Fuzhuan brick tea prevent obesity and modulate gut microbiota in high-fat diet fed mice[J]. Mol Nutr Food Res, 2018, 62: e1700485. DOI:10.1002/mnfr.201700485 |
| [12] |
Sajid M, Ilyas M. PTFE-coated non-stick cookware and toxicity concerns: a perspective[J]. Environ Sci Pollut Res Int, 2017, 24: 23436-23440. DOI:10.1007/s11356-017-0095-y |
| [13] |
Saleh A, Larsson E, Yamini Y, et al. Hollow fiber liquid phase microextraction as a preconcentration and clean-up step after pressurized hot water extraction for the determination of non-steroidal anti-inflammatory drugs in sewage sludge[J]. J Chromatogr A, 2011, 1218: 1331-1339. |
| [14] |
Zheng J, Zhou H, Zhao Y, et al. Triterpenoid-enriched extract of Ilex kudingcha inhibits aggregated LDL-induced lipid deposition in macrophages by downregulating low density lipoprotein receptor-related protein 1 (LRP1)[J]. J Funct Foods, 2015, 18: 643-652. DOI:10.1016/j.jff.2015.08.018 |
| [15] |
Chang Y, Ge A, Jiang Y, et al. A bioactivity-based method for screening, identification of lipase inhibitors, and clarifying the effects of processing time on lipase inhibitory activity of Polygonum multiflorum[J]. Evid Based Complement Alternat Med, 2016, 2016: 5965067. |
| [16] |
Hopcroft P, Fisher D. Development of a medium-throughput targeted LCMS assay to detect endogenous cellular levels of malonyl-CoA to screen fatty acid synthase inhibitors[J]. J Biomol Screen, 2016, 21: 111-116. DOI:10.1177/1087057115617894 |
| [17] |
Wei ZY, Xu WJ, Dong JJ, et al. Hydroxysafflor yellow A repairing the metabolic disturbances of early atherosclerosis based on fatty acid profiling[J]. Acta Pharm Sin (药学学报), 2018, 53: 1680-1688. |
| [18] |
Chistiakov D, Melnichenko A, Myasoedova V, et al. Mechanisms of foam cell formation in atherosclerosis[J]. J Mol Med (Berl), 2017, 95: 1153-1165. DOI:10.1007/s00109-017-1575-8 |
 2020, Vol. 55
2020, Vol. 55


