寡核苷酸药物(oligonucleotides, ONs)是由人工化学合成的12~30个核糖寡核苷酸单链或双链组成的一类药物, 通过Watson-Crick碱基配对原则作用于目标信使RNA (mRNA)[1], 主要分为反义寡核苷酸药物(antisense oligonucleotides, ASOs)和小干扰RNA药物(small interference RNA, siRNA)两大类。
虽然人工合成寡核苷酸调节靶向基因表达的概念在40年前就被提出[2], 但是因为核酸的药动学成药性差、脱靶毒性、递药系统等技术瓶颈没有解决, 主要用于细胞或动物科研实验中的基因敲除[3]。随着过去20年化学和生物技术的发展, 一些关键技术难题被攻克, 全球迎来核酸类药物研发热潮。
2016至2019短短3年间, 美国FDA就批准了4个反义寡核苷酸类药物(Defibrotide、Eteplirsen、Nusinersenand和Inotersen)和2个siRNA药物(Patisiran、Givosiran), 其调节转录翻译的机制引起制药行业关注。一些罕见、疑难疾病, 如遗传性转甲状腺素蛋白淀粉样变性、杜氏肌萎缩症、乙型肝炎等仍然不能得到有效治愈, 核酸类药物通过基因敲除或者剪接调控机制有望填补小分子药物和单克隆抗体药物的空白治疗领域[4]。目前全球有50多个寡核苷酸药物处于不同的临床研究阶段[5], 覆盖罕见病、难治愈疾病多个治疗领域。中国寡核苷酸药物的研发公司多处于起步阶段, 主要集中在昆山小核酸产业基地[6]。
本文主要从寡核苷酸药物的技术发展、临床药理学(包括作用机制、药代动力学、药效和安全性)的角度综述其特征。
1 成药性改造面临的挑战 1.1 化学修饰未经化学修饰的寡核苷酸药物成药性通常不理想。它们具有较差的PK特性, 比如稳定性差, 易被核酸酶降解; 极性大, 很难进入细胞, 分布特性差; 对目标mRNA的结合亲和力不佳。为了达到临床效用, 寡核苷酸必须经过化学改造(图 1)。目前广为使用的结构改造的基础骨架是磷硫(PS)修饰, 即将非桥接的磷酸二酯氧替换成硫原子。PS骨架的修饰减少了寡核苷酸的亲水性、增加了对核酸酶降解的抵抗力以及增加了其与血浆蛋白结合[5], 进而使得寡核酸稳定性增加, 减少肾小球滤过到尿液中排泄[7, 8]。PS骨架的改造虽然改善了部分PK特性, 使其系统暴露增加进而增加细胞摄取和转运, 但是单一的PS骨架修饰不能保障寡核苷酸不被酶降解, 并且在高浓度时这种修饰降低了寡核苷酸和靶标的亲和力, 使机体产生炎症反应[5, 7, 9]。为了进一步增加靶标结合亲和力、抵抗核酸酶降解、减少促炎症反应, 在20世纪90年代出现了具有糖基修饰的二代寡核苷酸药物[5, 8, 10]。二代寡核苷酸是在PS骨架修饰的基础上将2′-羟基(2′-hydroxyl, 2′-OH)替换成2′-甲氧基(2′-O-methyl, 2′-O-Me)、2′-甲氧乙氧基(2′-O-methoxyethyl, 2′-MOE)、2′-氟(2′-fluoro, 2′-F)或者引入构象约束结构, 比如锁核酸(locked nucleic acid, LNA)以及它的甲基化衍生物即约束乙基(constrained ethyl, cEt)[7]。2′-F或者2′-O-Me 20世纪60年代就合成了, 但是30年后才应用到临床治疗中。2′-O-Me的修饰提高了靶标亲和力、核酸酶降解的抵抗力以及减弱PS骨架引起的免疫刺激性[9]。在2′-O-Me基础上, 2′-MOE可以进一步增加靶标结合亲和力和抵抗核酸酶降解。而相对于2′-MOE, LNA、cEt结构降低了构象灵活性, 与靶标亲和性增加了5~10倍[5, 7]。然而LNA和cEt报道和肝毒性有关, 这种肝毒性可能由脱靶降解不匹配的RNA造成[7]。目前仍在探索其他的结构化学改造方式, 2′-MOE在反义寡核苷酸药物中应用最多。上市的Mipomersen、Nusinersen和Inotersen均是这种化学修饰, 同时还有20多个同类药处于临床不同研究阶段。但是对于siRNA而言, 2′-MOE改造应用有限, siRNA广泛应用2′-F或者2′-O-Me, 如上市的Patisiran, 同时应用了2′-F和2′-O-Me修饰[5]。
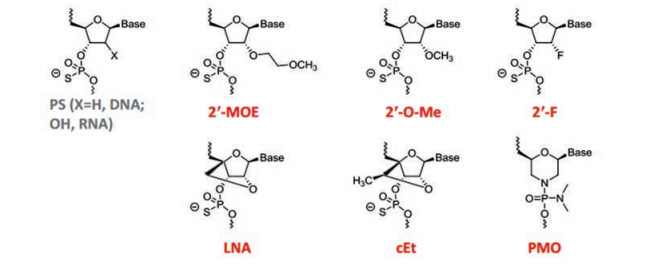
|
Figure 1 Common chemical modifications for the ASOs and siRNAs approved and in clinical trials |
单克隆抗体药物通常和细胞外的可溶性靶标或者细胞表面的靶标结合发挥治疗作用, 而寡核苷酸药物必须进入细胞才能产生药理活性[8, 11]。和小分子相比, 寡核苷酸药物的分子质量较大(6~14 kDa), 高度带负电, 亲水性高, 不易透过脂质双分子层和血脑屏障[12, 13]。
没有递送系统的ASOs (~7 kDa), 大多数通过网格蛋白或者小窝蛋白介导的胞饮作用摄取进细胞。寡核苷酸的细胞内化分为“有效途径”和“无效途径”[14, 15]。“有效途径”有依赖于非巨胞饮作用和内含体的细胞内分布, 寡核苷酸从内含体逃逸出来, 进入细胞质或细胞核内发挥药理作用[16], 而“无效途径”也就是巨胞饮途径, 导致寡核苷酸聚集在溶酶体中被降解或清除出细胞[16]。在内含体中有很多和先天免疫相关的Toll样受体(Toll like receptors, TLRs), 当TLRs识别进入内含体的ONs可能会引起干扰素和其他细胞因子的激活[17]。这个问题在第一代核酸类药物中比较常见, 第二代核酸经过核糖骨架的2′-O-甲基等修饰很大程度上解决了这个问题[18]。
和分子质量~7 kDa的ASOs相比, 分子质量~14 kDa的双链siRNA因为较大分子体积和亲水性, 经细胞摄取有限。为了增加细胞摄取, siRNA通常连接靶向配体, 比如N-乙酰半乳糖胺(N-acetylgalactosamine, GalNAc)[19]或包裹在脂质纳米粒中[20, 21]:
1.2.1 siRNA-GalNac和siRNA连接的GalNac可以被去肝细胞表面唾液酸糖蛋白受体(asialoglycoprotein receptor, ASGPR)识别, 并将其摄取进靶向的肝细胞中。ASGPR是一种C类凝集素, 肝脏细胞表面高度特异表达, 在肝肾以外的组织中表达低于5%[22], 主要功能是清除血液中的去唾液酸化的糖蛋白, 每个肝细胞表达0.5~1百万个拷贝的ASGPR, 在种属间具有高度保守性[23], 它内化迅速, 约15 min即可循环到肝细胞表面, 是靶向肝脏的理想受体。ASGPR的最佳识别配体是3个N-乙酰半乳糖胺[24], 利用这一点, 在siRNA正义链的(sense strand, SS) 3′端连接三触角的GalNac可以实现siRNA向肝细胞的靶向运载(图 2)。当siRNA-GalNac进入肝细胞内含体中, 其较低的pH使得ASGPR与siRNA-GalNac解离, ASGPR循环至肝细胞表面, 而siRNA-GalNac逃逸至细胞质或转运至溶酶体中[20]。

|
Figure 2 siRNA conjugation with a trivalent GalNAc ligand at the 3′ end of the sense strand allows for targeting to the ASGPR on hepatocytes. SS: sense strand, AS: antisense strand |
脂质纳米粒递送系统的基础是阳离子脂质体, 经过多年的发展, 目前应用的脂质多具有低毒、生物可降解、pH敏感等特性。构建这种递送系统需要3种物质[21](图 3), 按照从里到外层的顺序依次是: ①阳离子脂质, 可电离的阳离子脂质体纳米粒可以通过静电作用封装具有聚阴离子中心的siRNA (带负电荷)以形成LNPs/siRNA复合物[25]; ②辅助脂质即促融合磷脂, 通过破坏细胞膜脂质双层结构, 增加LNPs的转染活性; ③聚乙二醇(polyethylene glycol, PEG)脂类, 通过增加胶体稳定性和保护LNPs免受巨噬细胞的侵袭而降低免疫反应, 过多的PEG脂质会阻碍LNPs的细胞内化。填充以上3种脂质间空隙的一般是胆固醇, 用于稳定LNPs。脂质种类的选择、比例、浓度、生成温度、pH等工艺都要经过严格优化。
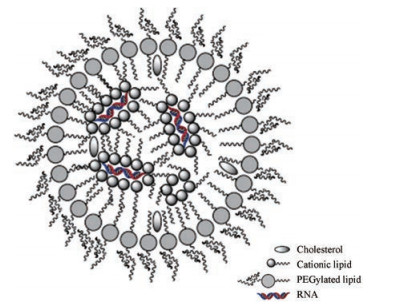
|
Figure 3 Schematic structures of lipid nanoparticles |
和上面提到ONs的内吞一样, LNPs也经组织细胞内吞进入内含体中, 然后释放出来。实现LNPs细胞靶向的方法常用的有, 在脂质纳米粒上连接配体如GalNac靶向肝细胞表面的ASGPR受体[26]或连接配体透明质酸特异结合CD44受体[27]等, 也可和单抗结合后, 引导LNPs进入感兴趣的靶组织[28, 29]。
第一个上市的siRNA药物Patisiran就是通过脂质纳米粒(lipid nanoparticles, LNPs)包裹递送到肝脏。然而Patisiran脂质纳米粒制剂会引起促炎症反应, 在治疗前需要输注皮质类固醇、对乙酰氨基酚和抗组胺药物减缓给药后的炎症反应[30]。因此直接连接靶向配体的siRNA递药策略似乎更有发展前景。寻找靶向除肝脏之外组织的共轭配体仍是十分活跃的研究领域[7, 11]。目前, 临床在研的siRNAs有10多个采取纳米颗粒包裹运载, 更多的是采取siRNA-GalNac技术[5]。共轭配体技术和LNPs同样也适用于ASOs[31]。
1.3 非预期的寡核苷酸毒性细胞内递送提到ONs在内含体中被Toll样受体识别, 激活先天免疫的问题已经通过核糖骨架结构改造改善。临床试验显示LNPs包裹的寡核苷酸药物赋形剂随时间发生降解, 引起剂量限制性毒性, 选择安全低毒的材料是关键[32]。除此之外, LNPs还会引发静脉输注的免疫反应, 需要在给药前给予糖皮质激素和抗过敏药物治疗(见1.2)。
尽管RNAi可以特异性地针对目标基因, 但一些脱靶RNAi沉默(off-target RNAi silencing)偶有发生[33, 34], 解决的办法如选择疾病高特异性RNA作为靶标、靶向递送, 并在多个种属中开展临床前实验, 开展人体试验之前, 在灵长非人类动物中的筛选显得尤为关键。近期有证据显示过大的剂量的ONs可能是引起脱靶效应的原因之一[33], 因此不能为了追求最大药效而忽略毒性问题, 剂量优化是临床试验的主要任务之一。Alnylam最近还研发了专门的ASOs, 用于逆转siRNA在体内的活性[35]。
2 寡核苷酸类药物的作用机制寡核苷酸药物通过Waston-Crick配对, 以高选择性、亲和性和目标RNA结合, 利用内源性核酸酶降解目标RNA或通过立体阻断核糖体机制调节RNA剪接和翻译过程(图 4)。
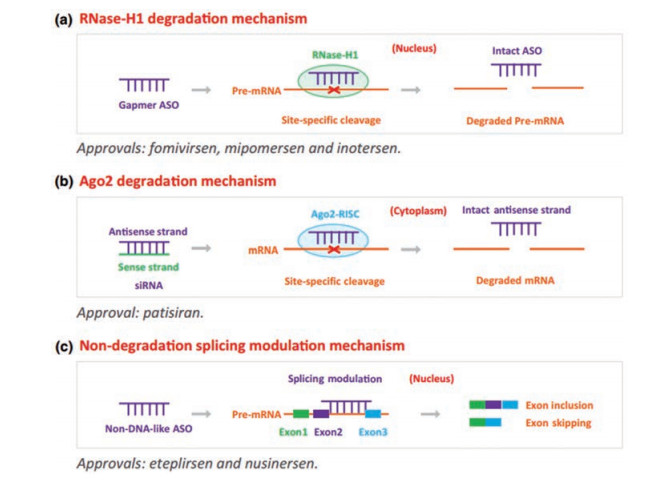
|
Figure 4 Schematic illustration of three common mechanisms adopted by the approved ASOs and siRNA |
RNase H1酶是内源性核酸酶家族的一种。利用这种机制, 沉默目标RNA的ASOs药物的一端至少要连接5个连续的DNA脱氧核糖核苷酸序列(gapmer ASO), 7~10个最佳[1]。ASOs和目标mRNA结合以后, RNA-DNA异源双链核酸序列就会被RNase H1所识别, 引起mRNA链被特异性剪切, 而含有DNA序列的ASOs仍然被完整保留, 继续作用于其他目标mRNA。目标mRNA沉默以后进而使和疾病相关的蛋白表达减少[8]。已经上市的Fomivirsen、Mipomersen和Inotersen均是利用这种机制[4]。
2.2 Ago2酶降解机制这个过程是利用了体内普遍存在的内源性microRNA调控基因表达的机制。人工合成的siRNA包括正义链(SS)和反义链(AS), 进入细胞质以后加载到RNA干扰蛋白(Dicer and TAR RNA-binding protein, TRBP)并和Argonaute 2 (Ago2)形成RISC (RNA-induced silencing complex, RISC)加载复合物, 之后, 正义链被舍弃, 反义链被留下来用于配对识别目标RNA, Ago2发挥剪切作用[36]。从siRNA的双链中选择其中一条作为反义链并不是随机的。这种不对称链选择取决于siRNA每条链末端的前1~4个碱基的相对热力学稳定性, 5′端不太稳定的链作为反义链, 而另一条链被丢弃[37]。反义链5′端的磷酸基团衍生化形式也会影响正义链丢弃或裂解效率[5, 38]。
2.3 非降解机制大多数哺乳动物蛋白编码RNA经历一系列复杂的加工过程:添加5′-cap结构, 去除大段RNA序列、剪拼到一起, 并在RNA的3′端添加聚腺苷酸(polyadenylate polyA, polyA)尾巴[1]。不同于2.1与2.2中酶降解机制, 可以设计各式各样的ASOs作为空间阻滞剂调控mRNA成熟翻译的过程, 包括调控拼接去降低疾病蛋白质的翻译、恢复功能蛋白、阻碍目标RNA和关键蛋白相互作用[39], 如治疗杜氏肌营养不良Eteplirsen设计为引起外显子跳读或治疗脊髓性肌萎缩Nusinersen促进包含外显子7而形成完整的存活运动神经元1样mRNA。利用这个作用机制的ONs在设计结构时, 应避免成为RNase H1和Ago2的降解底物[4]。
3 药代动力学(PK)特征寡核苷酸药物的PK特征和核苷酸的一般理化性质、化学修饰、载药系统、偶联物性质密切相关, 大多与核苷酸序列无关, 比如2′-MOE修饰的反义寡核苷酸药物的理化性质相近, PK行为在大鼠、犬、猴、人中较为一致[4, 40, 41]。化学小分子、寡核苷酸及单抗药物的主要PK特性见表 1。
| Table 1 Comparison of key properties of small molecules, oligonucleotides and mAbs. mAbs: Monoclonal antibodies; MW: Molecule weight; BA: Bioavailability; CL: Clearance |
大多需要全身暴露的ASOs通过皮下(sc)或者静脉输注(iv)给药, 有少量报道核酸药物经口服给药, 但生物利用度不足10%[42, 43]。ASOs经皮下给药的生物利用度一般较高, 在猴中报道达到80%~100%[13, 40], 吸收迅速, 3~4 h达到峰浓度(Cmax)。ASOs还可以从玻璃体内或鞘内等局部注射实现局部治疗, 鞘内给药后可以广泛分布在中枢神经系统(脊髓和大脑), 如治疗脊髓性肌萎缩的Nusinersen是直接鞘内注射(Nusinersen, Pharmacology Review, FDA 2016)。
无论是静脉注射还是皮下注射, 血浆浓度以多相的方式从Cmax迅速下降, 并在几分钟到几小时内从血浆快速分布到组织, 随后是一个或多个较慢的处置阶段, 长达4周至2个月的最终消除半衰期[13]。血浆中较长的末端消除半衰期代表了组织向血浆室的再分布, 反映了组织细胞向细胞外液和血浆室的缓慢转移。在组织向血浆再分布的阶段, 血浆和肝脏的药物浓度一般成相对固定比例, 如2′-MOE ASOs的血浆:肝脏浓度比约为1:5 000, 这一比例在不同种属间保持一致[44, 45], 提示可以用检测到的血浆药物浓度来推算肝脏部位蓄积的药物浓度。
ASOs随血流循环至全身, 分布肝脏和肾脏的药物超过80%[13], 主要经血液和组织中的核酸外切酶和内切酶代谢, 因此ASOs半衰期和2′化学修饰的代谢稳定性相关。原型和核酸酶代谢产物主要经尿液排泄[41]。除了吗啉代ASOs, 其他ASO含有的PS骨架使其能够和白蛋白发生广泛结合[5], 血浆蛋白结合率大于85%, 高蛋白结合率有效减少肾小球滤过和尿排泄[13]。批准上市的吗啉代ASO药物Eteplirsen的蛋白结合率6.1%~16.5%, 尽管经过化学修饰具有良好的代谢稳定性, 其24 h内肾脏排泄清除率达60%~70% (Eteplirsen, Clinical Pharmacology and Biopharmaceutics Review FDA 2016)。
3.2 小干扰RNA (siRNA)几乎所有需要全身暴露的siRNA都通过皮下(sc)或者静脉输注(iv), 没有报道核酸药物经口服给药。包裹在脂质纳米粒的siRNA只能采取静脉注射的方式给药, 如Patisiran[46]。目前在研的GalNac-siRNA多采用皮下给药方式[47, 48], 生物利用度未见报道, 吸收迅速, 给药后2~6 h可以达到Cmax[47]。siRNA也可以实现玻璃体内或鞘内等局部注射治疗, 如终止研发的Bevasiranib是靶向VEGFR的siRNA, 玻璃体内注射治疗湿性黄斑变性[49]。
不同于大多数的ASOs药物, siRNA蛋白结合率较低, 主要分布器官同样为肝脏和肾脏。上市的Patisiran蛋白结合率小于2.1%, 从血浆室快速清除, 血浆末端半衰期3天(Patisiran, Highlights of Prescribing Information 2018, FDA)。因此, siRNA药物除了需要化学修饰避免核酸酶降解, 还需要递药系统的庇护进入靶器官, 免于被肾脏排泄和核酸酶降解。Patisiran做成脂质纳米粒增加肝细胞的内吞摄取, 而GalNac-siRNA通过肝细胞表面的ASGPR快速摄取进肝细胞(见1.2), 肝脏清除半衰期可达数周, 支持以数周或季度频率给药[5], 如降低心血管高危患者LDL-C水平的InclisiranⅡ期临床试验结果提示间隔6个月给药方案的可行性[48]。
3.3 PK方面的药物相互作用(drug-drug interaction, DDI)因为寡核酸类药物主要经核酸外切酶或内切酶代谢, 不太可能是细胞色素P450酶和转运体的底物、抑制剂和诱导剂[50, 51]。和单抗药物类似, 一般情况下, 寡核苷酸药物不是必须要开展常规的药物相互作用临床研究[13, 41]。PS骨架修饰的ASOs具有较高的血浆蛋白结合率, 但是它和非极性的化学小分子与血浆蛋白结合的位点并不相同[52], 再考虑到血浆蛋白在人体中含量丰富, 不太可能因血浆蛋白结合位点的竞争而引起药物相互作用[12]。如果寡核苷酸药物靶向的mRNA涉及CYP酶形成的转录翻译上游过程, 那就需要开展相应的DDI临床研究。例如FDA于2019年11月审批通过治疗急性肝卟啉症的siRNA药物Givosiran, 靶向氨基乙酰丙酸合成酶1 (ALAS1) mRNA的降解。虽然在体外没有显示有CYPs的诱导和抑制作用, 但在体内Givosiran可以影响肝血红素生物合成途径, 因此体内具有降低CYPs酶活性的可能, Givosiran开展了与CYP1A2、2D6、2C9等多个CYPs底物联用的相互作用研究(Givosiran, Highlights of Prescribing Information, FDA 2019)。
4 寡核苷酸药物对心脏安全性的影响FDA审评资料里显示最新批准寡核苷酸药物均豁免全面QT研究, 包括ASOs (Nusinersen and Inotersen)和siRNA (Patisiran and Givosiran)。非临床[53]和临床数据[54, 55]提示寡核苷酸高极性、带电的特性使它不太可能和hERG钾通道发生直接相互作用[56]而改变QT间期校正值。Kim等[53]开展了7个ASOs对hERG离子通道影响的体外研究, 结果没有发现对hERG通道有意义的改变。在猴中植入的遥测装置, 该体内实验也同样没有显示与药物相关的血压、心率、心电图等相关参数的变化(QRS间期)[53]。去纤维蛋白多核苷酸是一个含有90%单链和10%双链的磷酸二酯-寡核苷酸天然产物, 它开展了全面QT临床研究, 在推荐剂量的2.4倍用量下没有观察到和QT间期校正值相关的临床改变(Defibrotide Sodium, Highlights of Prescribing Information, FDA 2016)。上述与这类药物总体上不存在心律失常的可能性是一致的。
5 药政部门对核酸类药物的考虑中国国家药品监督管理局(NMPA)、欧洲药品管理局(EMA)和美国食品药品监督管理局(FDA)均尚无专门针对寡核苷酸药物的指导原则和技术指南, NMPA提出寡核苷酸是化学合成药物, 虽然具备生物制品的属性, 但按新化学实体进行监管[57]。2017年11月EMA研讨会上(EMA Prior Knowledge Workshop: Case Study: Oligonucleotide Control Strategy)提出, 寡核苷酸药物虽然落在小分子和蛋白药物相关文件的“法外之地”, 但可以借鉴化学小分子控制生产环节保证用药的安全性。
6 结论与展望化学、生物技术难题的攻克使寡核苷酸药物研发进入新时期, 与小分子和单克隆抗体药物相比, 寡核苷酸药物通过降解和非降解方式特异性调控疾病目标RNA表达翻译过程。已经上市的7个反义寡核苷酸药物和2个siRNA药物给罕见、难治愈疾病患者增加用药选择。希望以后有更多的寡核苷酸药物上市填补化学小分子和蛋白药物不能覆盖的治疗领域。然而寡核苷酸药物高极性、带电特性使得它在载药系统、药代动力学特性、药效方面和化学小分子与单抗药物有明显的区别, 为临床药理学研究带来挑战, 充分理解该类药物的PK/PD特性, 有助于早期临床试验设计更合理, 加快该类药物的尽早上市。
| [1] |
Bennett CF. Therapeutic antisense oligonucleotides are coming of age[J]. Annu Rev Med, 2019, 70: 307-321. |
| [2] |
Stephenson ML, Zamecnik PC. Inhibition of rous sarcoma viral RNA translation by a specific oligodeoxyribonucleotide[J]. Proc Natl Acad Sci U S A, 1978, 75: 285-288. |
| [3] |
Han H. RNA interference to knock down gene expression[J]. Methods Mol Biol, 2018, 1706: 293-302. |
| [4] |
Yin W, Rogge M. Targeting RNA:a transformative therapeutic strategy[J]. Clin Transl Sci, 2019, 12: 98-112. |
| [5] |
Crooke ST, Witztum JL, Bennett CF, et al. RNA-targeted therapeutics[J]. Cell Metab, 2018, 27: 714-739. |
| [6] |
An LW. The role of local government in the cultivation of emerging industries-inspiration from Kunshan small nucleic acid industry cultivation model[J]. Ind Econ Res (产业经济研究), 2013(01): 33-40. |
| [7] |
Khvorova A, Watts JK. The chemical evolution of oligonucleotide therapies of clinical utility[J]. Nat Biotechnol, 2017, 35: 238-248. |
| [8] |
Shen X, Corey DR. Chemistry, mechanism and clinical status of antisense oligonucleotides and duplex RNAs[J]. Nucleic Acids Res, 2018, 46: 1584-1600. |
| [9] |
Schoch KM, Miller TM. Antisense oligonucleotides:translation from mouse models to human neurodegenerative diseases[J]. Neuron, 2017, 94: 1056-1070. |
| [10] |
Bennett CF, Baker BF, Pham N, et al. Pharmacology of antisense drugs[J]. Annu Rev Pharmacol Toxicol, 2017, 57: 81-105. |
| [11] |
Lieberman J. Tapping the RNA world for therapeutics[J]. Nat Struct Mol Biol, 2018, 25: 357-364. |
| [12] |
Geary RS, Norris D, Yu R, et al. Pharmacokinetics, biodistribution and cell uptake of antisense oligonucleotides[J]. Adv Drug Deliv Rev, 2015, 87: 46-51. |
| [13] |
Geary RS. Antisense oligonucleotide pharmacokinetics and metabolism[J]. Expert Opin Drug Metab Toxicol, 2009, 5: 381-391. |
| [14] |
Sharma VK, Watts JK. Oligonucleotide therapeutics:chemistry, delivery and clinical progress[J]. Future Med Chem, 2015, 7: 2221-2242. |
| [15] |
Ming X. Cellular delivery of siRNA and antisense oligonucleotides via receptor-mediated endocytosis[J]. Expert Opin Drug Deliv, 2011, 8: 435-449. |
| [16] |
Wang S, Sun H, Tanowitz M, et al. Intra-endosomal trafficking mediated by lysobisphosphatidic acid contributes to intracellular release of phosphorothioate-modified antisense oligonucleotides[J]. Nucleic Acids Res, 2017, 45: 5309-5322. |
| [17] |
Robbins M, Judge A, Maclachlan I. siRNA and innate immunity[J]. Oligonucleotides, 2009, 19: 89-102. |
| [18] |
Robbins M, Judge A, Liang L, et al. 2'-O-Methyl-modified RNAs act as TLR7 antagonists[J]. Mol Ther, 2007, 15: 1663-1669. |
| [19] |
Nair JK, Willoughby JL, Chan A, et al. Multivalent N-acetylgalactosamine-conjugated siRNA localizes in hepatocytes and elicits robust RNAi-mediated gene silencing[J]. J Am Chem Soc, 2014, 136: 16958-16961. |
| [20] |
Juliano RL. The delivery of therapeutic oligonucleotides[J]. Nucleic Acids Res, 2016, 44: 6518-6548. |
| [21] |
Zatsepin TS, Kotelevtsev YV, Koteliansky V. Lipid nanoparticles for targeted siRNA delivery-going from bench to bedside[J]. Int J Nanomed, 2016, 11: 3077-3086. |
| [22] |
Janas MM, Harbison CE, Perry VK, et al. The nonclinical safety profile of GalNAc-conjugated RNAi therapeutics in subacute studies[J]. Toxicol Pathol, 2018, 46: 735-745. |
| [23] |
Willoughby J, Chan A, Sehgal A, et al. Evaluation of GalNAc-siRNA conjugate activity in pre-clinical animal models with reduced asialoglycoprotein receptor expression[J]. Mol Ther, 2018, 26: 105-114. |
| [24] |
Baenziger JU, Fiete D. Galactose and N-acetylgalactosamine-specific endocytosis of glycopeptides by isolated rat hepatocytes[J]. Cell, 1980, 22(2Pt2): 611-620. |
| [25] |
Wang JP, Wang S, Shen X, et al. Synthesis of cationic lipids DLin-MC3-DMA[J]. Chem Reagents (化学试剂), 2016, 38: 361-363. |
| [26] |
Kumar V, Qin J, Jiang Y, et al. Shielding of lipid nanoparticles for siRNA delivery:Impact on physicochemical properties, cytokine induction, and efficacy[J]. Mol Ther Nucleic Acids, 2014, 3: e210. |
| [27] |
Cohen ZR, Ramishetti S, Peshes-Yaloz N, et al. Localized RNAi therapeutics of chemoresistant grade Ⅳ glioma using hyaluronan-grafted lipid-based nanoparticles[J]. ACS Nano, 2015, 9: 1581-1591. |
| [28] |
Ramishetti S, Kedmi R, Goldsmith M, et al. Systemic gene silencing in primary T lymphocytes using targeted lipid nanoparticles[J]. ACS Nano, 2015, 9: 6706-6716. |
| [29] |
Weinstein S, Toker IA, Emmanuel R, et al. Harnessing RNAi-based nanomedicines for therapeutic gene silencing in B-cell malignancies[J]. Proc Natl Acad Sci U S A, 2016, 113: E16-E22. |
| [30] |
Adams D, Gonzalez-Duarte A, O'Riordan WD, et al. Patisiran, an RNAi therapeutic, for hereditary transthyretin amyloidosis[J]. N Engl J Med, 2018, 379: 11-21. |
| [31] |
Huang Y. Preclinical and clinical advances of GalNAc-decorated nucleic acid therapeutics[J]. Mol Ther Nucleic Acids, 2017, 6: 116-132. |
| [32] |
Zuckerman JE, Davis ME. Clinical experiences with systemically administered siRNA-based therapeutics in cancer[J]. Nat Rev Drug Discov, 2015, 14: 843-856. |
| [33] |
Janas MM, Schlegel MK, Harbison CE, et al. Selection of GalNAc-conjugated siRNAs with limited off-target-driven rat hepatotoxicity[J]. Nat Commun, 2018, 9: 723. |
| [34] |
Soucek L, Whitfield JR, Sodir NM, et al. Inhibition of Myc family proteins eradicates KRas-driven lung cancer in mice[J]. Genes Dev, 2013, 27: 504-513. |
| [35] |
Zlatev I, Castoreno A, Brown CR, et al. Reversal of siRNA-mediated gene silencing in vivo[J]. Nat Biotechnol, 2018, 36: 509-511. |
| [36] |
Setten RL, Rossi JJ, Han SP. The current state and future directions of RNAi-based therapeutics[J]. Nat Rev Drug Discov, 2019, 18: 421-446. |
| [37] |
Kawamata T, Tomari Y. Making RISC[J]. Trends Biochem Sci, 2010, 35: 368-376. |
| [38] |
Matranga C, Tomari Y, Shin C, et al. Passenger-strand cleavage facilitates assembly of siRNA into Ago2-containing RNAi enzyme complexes[J]. Cell, 2005, 123: 607-620. |
| [39] |
Rinaldi C, Wood M. Antisense oligonucleotides:the next frontier for treatment of neurological disorders[J]. Nat Rev Neurol, 2018, 14: 9-21. |
| [40] |
Yu RZ, Grundy JS, Geary RS. Clinical pharmacokinetics of second generation antisense oligonucleotides[J]. Expert Opin Drug Metab Toxicol, 2013, 9: 169-182. |
| [41] |
Mustonen EK, Palomaki T, Pasanen M. Oligonucleotide-based pharmaceuticals:non-clinical and clinical safety signals and non-clinical testing strategies[J]. Regul Toxicol Pharmacol, 2017, 90: 328-341. |
| [42] |
Tillman LG, Geary RS, Hardee GE. Oral delivery of antisense oligonucleotides in man[J]. J Pharm Sci, 2008, 97: 225-236. |
| [43] |
Raoof AA, Chiu P, Ramtoola Z, et al. Oral bioavailability and multiple dose tolerability of an antisense oligonucleotide tablet formulated with sodium caprate[J]. J Pharm Sci, 2004, 93: 1431-1439. |
| [44] |
Yu RZ, Kim TW, Hong A, et al. Cross-species pharmacokinetic comparison from mouse to man of a second-generation antisense oligonucleotide, ISIS 301012, targeting human apolipoprotein B-100[J]. Drug Metab Dispos, 2007, 35: 460-468. |
| [45] |
Crooke ST, Geary RS. Clinical pharmacological properties of mipomersen (Kynamro), a second generation antisense inhibitor of apolipoprotein B[J]. Br J Clin Pharmacol, 2013, 76: 269-276. |
| [46] |
Hoy SM. Patisiran:first global approval[J]. Drugs, 2018, 78: 1625-1631. |
| [47] |
Zimmermann TS, Karsten V, Chan A, et al. Clinical proof of concept for a novel Hepatocyte-targeting GalNAc-siRNA conjugate[J]. Mol Ther, 2017, 25: 71-78. |
| [48] |
Ray KK, Landmesser U, Leiter LA, et al. Inclisiran in patients at high cardiovascular risk with elevated LDL cholesterol[J]. N Engl J Med, 2017, 376: 1430-1440. |
| [49] |
Garba AO, Mousa SA. Bevasiranib for the treatment of wet, age-related macular degeneration[J]. Ophthalmol Eye Dis, 2010, 2: 75-83. |
| [50] |
Yu RZ, Warren MS, Watanabe T, et al. Lack of interactions between an antisense oligonucleotide with 2'-O-(2-methoxyethyl) modifications and major drug transporters[J]. Nucleic Acid Ther, 2016, 26: 111-117. |
| [51] |
Yu RZ, Geary RS, Flaim JD, et al. Lack of pharmacokinetic interaction of mipomersen sodium (ISIS 301012), a 2'-O-methoxyethyl modified antisense oligonucleotide targeting apolipoprotein B-100 messenger RNA, with simvastatin and ezetimibe[J]. Clin Pharmacokinet, 2009, 48: 39-50. |
| [52] |
Watanabe TA, Geary RS, Levin AA. Plasma protein binding of an antisense oligonucleotide targeting human ICAM-1(ISIS 2302)[J]. Oligonucleotides, 2006, 16: 169-180. |
| [53] |
Kim TW, Kim KS, Seo JW, et al. Antisense oligonucleotides on neurobehavior, respiratory, and cardiovascular function, and hERG channel current studies[J]. J Pharmacol Toxicol Methods, 2014, 69: 49-60. |
| [54] |
Yu RZ, Gunawan R, Li Z, et al. No effect on QT intervals of mipomersen, a 2'-O-methoxyethyl modified antisense oligonucleotide targeting ApoB-100 mRNA, in a phase Ⅰ dose escalation placebo-controlled study, and confirmed by a thorough QT (tQT) study, in healthy subjects[J]. Eur J Clin Pharmacol, 2016, 72: 267-275. |
| [55] |
Yu RZ, Gunawan R, Geary RS, et al. Lack of QT prolongation for 2'-O-methoxyethyl-modified antisense oligonucleotides based on retrospective exposure/response analysis of ten Phase 1 dose-escalation placebo-controlled studies in healthy subjects[J]. Nucleic Acid Ther, 2017, 27: 285-294. |
| [56] |
Stansfeld PJ, Sutcliffe MJ, Mitcheson JS. Molecular mechanisms for drug interactions with hERG that cause long QT syndrome[J]. Expert Opin Drug Metab Toxicol, 2006, 2: 81-94. |
| [57] |
Yu SS, Hu XM, Wang HX, et al. Overview of non-clinical research evaluation of therapeutic single-stranded oligonucleotide drugs[J]. Chin J New Drug (中国新药杂志), 2018, 27: 1122-1129. |
 2020, Vol. 55
2020, Vol. 55


