2. 中国中医科学院中药研究所, 北京100700
2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
疟疾作为一种重大传染病, 仍然严重威胁着人类的健康与生命。尽管世界卫生组织(World Health Organization, WHO)在减轻全球疟疾负担方面取得了阶段性成功, 但据WHO疟疾负担分析报告显示, 2015年至2017年, 全球抗疟形势停滞不前, 2017年全球约有2.19亿疟疾病例, 与2015年2.14亿例相比并未取得显著进展, 疟疾死亡人数达43.5万人, 5岁以下儿童的疟疾死亡人数占疟疾死亡总人数的61%[1]。其中约1%~2%的恶性疟原虫感染引起脑型疟(cerebral malaria, CM), 即使经过治疗, 死亡率仍达15%~25%[2]。
CM是恶性疟最严重的并发症, 5岁以下的儿童是最易受到伤害的群体。CM临床表现为贫血、低血压、抽搐、偏瘫、昏迷、癫痫甚至死亡[3], 虽然青蒿素的发现已挽救了数百万人的生命, 但随着CM临床一线用药青蒿琥酯的广泛应用, CM的高病死率现象并未得到有效的改善, 且幸存患儿中1/3可出现长期认知障碍和神经功能缺陷[4], 如学习和记忆障碍、语言障碍和其他神经后遗症, 包括小脑共济失调、肌张力减退、麻痹、失语症、行为障碍和注意力缺陷多动障碍、认知、听觉、视觉障碍、癫痫等, 甚至终身残疾。
CM的发病机制尚未完全明了, 但血管内皮在其发生、发展过程中至关重要的作用始终备受关注。在脑微血管中发现阻塞的感染疟原虫的红细胞(parasitized red blood cells, pRBC)是CM的标志性病理特征[5]。一方面, pRBC黏附在脑微血管内皮, 并进一步引发了pRBC与pRBC之间、pRBC与未感染红细胞之间的凝集反应和玫瑰花结效应, 微血管阻塞导致脑组织局部血液灌注减少, 也使pRBC躲避了脾脏的清除作用[6]。另一方面, pRBC黏附介导的炎性介质释放可促进白细胞在脑微血管中的滞留, 局部级联放大的炎症过程参与CM发病过程。此外, 内皮细胞活化、血管通透性增加、血脑屏障破坏、乳酸酸性中毒等, 进一步加重了疾病的严重程度[7, 8]。
辅助治疗是指改变疟疾引起的病理生理过程的不同疗法, 这些疗法能直接改变疟疾相关的生物学途径或生理过程[9]。基于青蒿素类药物的耐药性和CM的高致死致残率, 以改善临床结果和/或降低死亡率、预防长期神经认知缺陷为目标的辅助治疗的研究, 数十年来始终是CM研究者探索的重要方向[8]。有效的辅助治疗必须是与单独使用抗疟药物相比有显著的益处, 且作为一种有效的干预手段, 必须安全、微创、价廉, 或神经保护作用明显, 且在医疗资源贫乏的环境中方便使用。
但目前为止, 大多数试图提高抗疟疗效的辅助治疗药物都失败了, 曾有研究者利用实验脑型疟(experimental cerebral malaria, ECM)模型评估了48种辅助治疗药物, 其中有44种(92%)有效, 然而同期17项临床试验中评估了11种干预措施发现, 只有1种在降低死亡率方面有优势[10], 涉及神经保护的药物如抗肿瘤坏死因子(tumor necrosis factor, TNF)和铁螯合剂等的抗CM疗效同样令人失望[11]。因此, 临床上迫切需要调节疟疾病理生理过程的不同辅助疗法, 以期改善临床结果、提高生存率、并减少幸存者的神经损伤。本文系统总结了2015~2019年CM辅助疗法的研究进展, 为相关研究提供参考。
1 CM的病理生理学基础寄生虫和宿主是导致CM发病的两大决定因素。宿主对感染的先天免疫反应, 如重要器官(如大脑)微血管系统中pRBC的黏附与阻塞, 导致机体的炎症反应, 内皮激活, 微血管闭塞, 代谢紊乱, 最终导致血脑屏障的破坏和功能障碍, 这是CM发病的重要机制。CM患者尸检结果pRBC阻塞导致灌注异常, 出血, 水肿, 组织缺血和血脑屏障的破坏被发现与疾病严重程度相关。血管闭塞区域出现的轴索损伤和脱髓鞘现象有助于解释CM幸存者中神经功能障碍的发生[12, 13]。
近年来发现的内皮细胞蛋白C受体(endothelial protein C receptor, EPCR)是一种参与抗凝和内皮细胞保护作用的宿主受体, 已被鉴定为恶性疟原虫关键毒力蛋白红细胞膜蛋白1 (P. falciparum erythrocyte membrane protein 1, PfEMP1)的受体, EPCR与PfEMP1的结合参与CM的病理过程, 表明CM病变的发生与凝血功能障碍之间存在一定的联系[14]。此外, 血凝素途径失调被发现与CM较差的临床结果和疾病的严重程度相关[15]。血小板可参与pRBC阻塞、免疫反应和凝血功能紊乱, 研究报道血小板可以作为这三种机制之间联系的桥梁[16-18]。当然, 还有很多因素参与了CM的病理过程, 如宿主和寄生虫遗传多态性、疟原虫感染时的初始量、种群动态、疟原虫化学敏感性、抗疟疾免疫力的强度、合并其他感染、营养状况及年龄、合并症, 是否能够获得医疗服务和可获得的医疗保健资源等[19], 这些CM发病机制的新见解为其治疗干预提供了新的线索(图 1)。
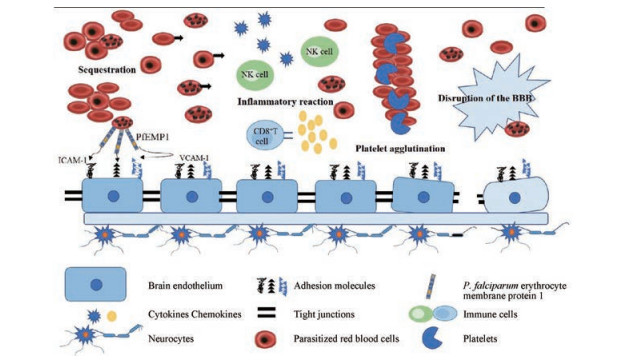
|
Figure 1 Mechanisms for CM pathogenesis including sequestration, inflammatory reaction, platelet agglutination and destruction of the blood-brain barrier. PfEMP1: P. falciparum erythrocyte membrane protein 1; ICAM-1: Intercellular adhesion molecule-1; VCAM-1: Vascular cell adhesion molecule-1; BBB: Blood brain barrier |
青蒿琥酯被WHO推荐为严重疟疾的一线治疗药物, 是目前被广泛接受的CM治疗方法。静脉注射青蒿琥酯[20, 21], 与其他抗疟药物(奎宁、甲氟喹等)相比, 它几乎可以作用于红细胞内寄生虫的各个阶段, 包括早期环状体。然而, 恶性疟原虫对多种药物的耐药性越来越高, 使得重症疟的治疗情况更加复杂[22, 23], 尽管静脉注射青蒿琥酯的治疗效果优于奎宁, 但青蒿琥酯单药治疗仍不足以控制疟疾的死亡率, 在临床试验中, 儿童和成人仍分别有8%和15%的死亡率, 而就CM而言情况更加严重(儿童和成人死亡率分别为18%和30%)[24], 并且单独用强效青蒿素衍生物治疗不足以预防所有CM患者的死亡或神经功能障碍, 而在非洲疟疾高危地区极端落后的医疗条件下静脉给药也在很大程度上限制了青蒿琥酯的及时、有效应用。
基于调节宿主对感染的反应的辅助治疗可以减少疟疾相关的发病率和死亡率, 并且可以增强抗疟药的临床效用。但是由于CM临床研究需要招募大量患者, 且检测死亡率的困难性很大程度上阻碍了对辅助疗法的评估, 因此有必要在临床试验中的设计具有更充足的样本量, 更精确的临床预测和替代终点指标, 并开展规范的随机对照试验(randomized controlled trial, RCT)。
CM研究领域一直在争论动物模型ECM对人类病理生理学的适用性, 通常认为, 人类CM和ECM之间存在显着差异, ECM中未观察到大量的pRBC在脑血管壁的阻塞而仅是单个的pRBC被阻塞在狭小的血管内, 但是二者脑血管阻塞的寄生虫都仍与血流紊乱、血管渗漏和神经功能受损有关[13]。同时, 由于CM不易在儿童中进行研究, 因此小鼠ECM模型仍是鉴定CM治疗靶点和治疗方法有效性的重要工具。
3 辅助疗法在CM治疗中的作用疟疾免疫发病机制复杂, 针对单一途径可能不足以降低死亡率或改善神经学结果。通过使用多种干预措施或替代方案, 针对涉及CM病理生理学的多种途径的干预, 有望提高疗效或减少疾病相关并发症, 此外还有可能预防长期神经认知缺陷。迄今为止, 研究者从多角度进行了CM辅助疗法的研究探索, 主要包括如下几个方面。
3.1 保护血管内皮、维持血脑屏障完整性血脑屏障破坏是CM患者脑肿胀的原因, 基于保护血管内皮、维持血脑屏障完整性的辅助疗法已成为近年来的研究热点。有研究者对印度11名CM患者通过磁共振成像(magnetic resonance imaging, MRI)发现, 所有患者在基线处均有意识降低和不同程度的皮质肿胀, 发病48~72 h后, 90%以上的病例观察到可逆性脑病综合征[25]。因此针对血脑屏障发挥保护作用的药物有望用于CM临床治疗。
曾有报道, 在感染后期给予已出现血脑屏障破坏、脑肿胀、脑出血的ECM小鼠谷氨酰胺类似物6-重氮-5-氧代-L-正亮氨酸(6-diazo-5-oxo-L-norleucine, DON), 小鼠脑代谢水平趋于正常[26], 纵向MRI成像发现DON前药JHU-083治疗ECM小鼠后脑水肿消退、血脑屏障破坏程度减轻[27]。
血管生成素(angiopoietin-1, Ang)-Tie-2体系是血管功能的重要调节因子, 在一项对患有严重疟疾的乌干达儿童和ECM小鼠模型的研究中表明, Ang-1表达和可溶性Tie-2表达与疾病严重程度和预后相关, 给予Ang-1的治疗可保持血脑屏障的完整性[28]。另有研究证实, 破裂的pRBC诱导β-连环蛋白的激活, 导致人脑微血管内皮细胞间连接的破坏。抑制β-连环蛋白诱导的内皮细胞细胞核TCF/LEF转录可抑制内皮连接的破坏, 阻断血管紧张素Ⅱ 1型受体(type 1 receptor, AT1)或刺激2型受体(type 2 receptor, AT2)可消除pRBC诱导的β-连环蛋白活化, β-连环蛋白与血管紧张素Ⅱ信号通路的相互关系可为CM脑内皮完整性受损的宿主靶向治疗提供可能[29]。
众所周知, 人血脑屏障主要由微血管内皮细胞的神经胶质细胞组成, Liu等[30]使用人脑微血管内皮细胞(human brain microvascular endothelial, CMEC/D3)和M059K神经胶质细胞验证了神经调节素1β (neuregulin-1β, NRG-1β)可以预防血红素诱导的细胞凋亡, 体内研究发现NRG-1治疗后ECM小鼠死亡率的降低与蛋白激酶ErbB4和AKT的激活以及STAT3信号传导的失活有关, 确定NRG-1可以通过预防人脑微血管内皮细胞的死亡/凋亡从而保护血脑屏障的完整性。
在C57BL/6J小鼠感染致死菌株P. Yoelii 17XL和P. berghei ANKA后1、3、5和7天通过腹腔注射维生素E的衍生物α-生育酚琥珀酸酯(alpha-tocopheryl succinate, α-TOS)进行治疗, 发现小鼠寄生虫血症降低, 存活率显著提高, α-TOS可能通过氧化应激途径抑制血脑屏障的分解和CM的发展进程[31]。
此外, 新近研究发现糖萼脱落可能与疟疾的严重程度有关, 脑内皮糖萼是覆盖于血管内皮细胞顶膜表面的多糖蛋白复合物, 缺血缺氧、败血症和炎症、动脉粥样硬化、糖尿病、肾病和出血性病毒感染时可从内皮脱落[32], 炎症抑制剂、抗凝血酶等药物可以减弱糖萼脱落, 而血浆白蛋白可以稳定糖萼。皮质类固醇治疗可预防CM, 减少炎症, 防止糖萼损失。辅助性抗凝血酶-3也可以预防糖萼损失, 显著降低CM死亡率, 减轻局部炎症, 防止血脑屏障破坏[33]。因此, 糖萼损失可能与疟疾发病机制有关, 减少脑内皮糖萼脱落可以作为辅助治疗的一个切入点。
3.2 减轻黏附、阻塞效应pRBC在脑的微血管内皮细胞处滞留聚集, 进而导致黏附和阻塞的发生是CM的重要机制。PfEMP1介导pRBC对微血管内皮上的宿主受体的黏附, PfEMP1是一个大的变异体表面抗原家族, 每个变异体表面抗原家族有多达7个细胞外结构域可与多个宿主受体结合。寄生虫黏附配体可与不同的内皮细胞受体如细胞间黏附分子-1 (intercellular adhesion molecule-1, ICAM-1)、血管细胞黏附分子-1 (vascular cell adhesion molecule-1, VCAM-1)和EPCR等相互作用。因此, 针对单个内皮黏附分子的抗黏附治疗可能无效。
Gillrie等[34]证实丝氨酸蛋白酶凝血酶作为激活凝血级联的关键酶, 分裂了在pRBC表面的寄生虫黏附素, 流动条件下显著降低了黏附力, 已黏附的pRBC被分离。PfEMP1变异体的凝血酶切割具有被用作广泛抑制性抗黏附疗法的可能性。
Sevuparin是一种由肝素衍生的抗黏附多糖, 其抗凝血活性低于肝素。Saiwaew等[35]对来自泰国疟疾患者的恶性疟原虫分离株进行Sevuparin对细胞黏附的影响实验, 发现Sevuparin以剂量依赖性方式破坏恶性疟原虫玫瑰花结形成并抑制对内皮细胞的细胞黏附, 表明Sevuparin可作为严重恶性疟疾的辅助疗法, 在一项Ⅰ/Ⅱ期临床研究也发现, Sevuparin单次输注后可观察到环期pRBC的平均相对数量的下降[36]。左旋咪唑可抑制体外细胞黏附, 然而对56例孟加拉国患者进行RCT试验却发现单剂量盐酸左旋咪唑作为静脉注射青蒿琥酯的辅助疗法对成人CM没有任何益处[37]。
利用免疫荧光显微镜发现大脑中的许多血管充满含有黏附白细胞的血栓包括CD4+ T细胞和单核细胞, 活化的小胶质细胞和星形胶质细胞在具有血栓的血管附近聚集[38]。激光散斑成像仪可以检测到在P. berghei ANKA感染的小鼠中ECM发展时视网膜血流速度的整体下降, 而未感染的对照小鼠中没有观察到类似的变化[39]。MRI磁敏度加权成像发现与微出血和寄生虫隔离都发生在白质区域, 其中扩散加权成像变化与血管充血一致[40]。这些发现证明了脑血管系统中细胞因子, 白细胞聚集和凝血对CM感染所致血管功能障碍的神经病理学的贡献。
多普勒超声(Doppler ultrasound, TCD)技术可以检查疟疾患者微血管阻塞, 血管痉挛, 充血等不同血管表型, 以检测其与神经功能缺损的相关性和验证与每种表型相关的致病机制[41]。在CM中, 据推测, 由于细胞对内皮的黏附和NO生物利用度降低引起血管痉挛从而导致红细胞的黏附[42]。多普勒超声技术可以检测到大脑中动脉血流间歇性增加或缺失, 以及一些患者脑MRI的可逆变化。
3.3 调节免疫平衡宿主免疫反应在疟疾感染的发病、严重程度和病理结局中起着重要作用, 在疟疾感染早期, 宿主通过释放促炎细胞因子杀伤疟原虫, 之后在抗炎因子协调下炎症反应下降, 促炎和抗炎的调节失衡导致大量炎症因子的释放是CM发生的重要原因。在疟疾感染前采取一定的预防措施提前改变免疫系统的状态, 减缓CM的发展进程, 减轻疾病的严重程度。针对免疫调节的辅助治疗的研究始终是研究的热点。
维生素D (胆钙化醇)具有与先天和适应性免疫反应相关的调节功能, 在C57BL/6小鼠感染前给予口服维生素D处理, 可降低死亡率, 改善血脑屏障的完整性, 减弱Th1型免疫反应, 减少T细胞向大脑的转运和降低血清和脾脏的干扰素γ (interferon-γ, IFN-γ)、TNF-α、趋化因子配体9 (C-X-C motif chemokine ligand 9, CXCL9)和趋化因子配体10 (C-X-C motif chemokine ligand 10, CXCL10)水平从而调节炎症反应[43]。
有证据表明程序性死亡-1 (programmed death-1, PD-1)是最有效的免疫调节分子之一[44], 可溶性融合蛋白PDL1-IgG1Fc和PDL2-IgG1Fc, 可以增强先天性和早期的PD-1/PDL信号通路, 减轻血脑屏障的破坏, 延长ECM小鼠的生存期, 在ECM发病前的早期阶段给予PDL1-IgG1Fc对维持脑内免疫微环境稳态具有明显的作用。
合成的油酸三萜(oleanane triterpenoids, SOs)化合物作为一种新的免疫调节剂, 是一种非细胞毒性药物, 具有良好的安全性, 体外实验已经表明SOs低纳摩尔剂量下具有抑制炎症和氧化应激, 高摩尔剂量下能够阻止细胞增殖和诱导凋亡的作用[45]。以2-氰基-3, 12-二氧杂环戊烷-1, 9-二烯-28-酸(2-cyano-3, 12-dioxooleana-1, 9-dien-28-oic acid, CDDO)、CDDO-乙基酰胺(CDDO-ethyl amide, CDDOEA)为衍生物进行临床前研究发现, 与单用青蒿琥酯相比其疗效显著(P=0.009), 可以提高生存率与减少炎症, 增强血脑屏障完整性, 即使在出现神经症状后的疾病晚期服用也提高了存活率[46]。
多西环素(doxycycline, DOX)被证明可以靶向中枢神经系统的炎症过程, 通过干扰大脑中效应T细胞的爆发来保护C57BL/6野生型小鼠, 即使小鼠接受了20倍的寄生虫感染, 在感染后第4~6天接受DOX治疗, 与未接受治疗的感染小鼠相比仍具有相似的寄生虫血症水平[47]。
通过靶向哺乳动物雷帕霉素的靶点mTOR (mammalian target of rapamycin, mTOR)已被证明具有抗ECM特性, mTOR是一种在维持免疫动态平衡方面具有核心作用的激酶, 经T细胞识别抗原后, mTOR被激活并干预CD4+T细胞分化为不同的效应子群, mTOR还能调节大多数其他免疫系统细胞的功能, 包括B细胞、中性粒细胞、单核细胞等[48, 49]。已有研究证明了抑制mTOR途径的药物的抗寄生虫特性[50], mTOR抑制剂雷帕霉素在感染的前4天内给药可以防止小鼠发展成ECM。单一剂量的雷帕霉素(最迟在感染后第4天或第5天)通过调节宿主对感染的不同反应来保护小鼠, 延长生存期并抑制ECM相关神经病理学症状的产生。雷帕霉素通过降低CD36的表达, 抗细胞黏附, 减少活化T细胞的数量, 增加局部细胞毒性T细胞的活化来改变脾脏免疫反应, 同时降低脑内皮ICAM-1的表达。总之, 雷帕霉素有助于增加寄生虫的消除, 同时减少CD8+ T细胞向大脑的迁移, 可作为一种潜在的CM辅助治疗方法[51]。
另有研究发现通过过继性转移鉴定的特异性靶向Ly6ClO单核细胞前体—免疫修饰颗粒(immune-modifying particles, IMP)在感染早期治疗时可预防50%被伯氏疟原虫感染的小鼠发展成ECM, 且在出现ECM临床症状后IMP和抗疟药物青蒿琥酯联合使用可使存活率达88%[52]。
3.4 杀灭疟原虫, 干扰疟原虫代谢疟原虫的清除率也是评估辅助治疗作用效果的重要评价指标, 聚乙二醇化maduramicin脂质体制剂是一种最近从配子体杀伤性化合物筛选出来的离子载体, 具有很强的抗疟活性, 令人兴奋地是聚乙二醇化maduramicin脂质体1.5 mg·kg-1连续给药4次可完全治愈鼠疟且未见明显的毒性作用, 而且Raza等[53]还证明了脂质体maduramicin对寄生虫存活的不利影响是通过增加活性氧的生成、干扰寄生虫线粒体膜电位介导的, 这为人类成功干预疟疾治疗带来了新的希望。
青蒿素类药物在体内都被代谢成双氢青蒿素(dihydroxyartemisinin, DHA), 稳定性较差。Golenser等[54]使用一种不转化为DHA的青蒿素衍生物缓释药青蒿酮, 在ECM小鼠发病晚期以80 mg·kg-1进行治疗性给药治愈率可达60% (对照小鼠在24 h内死亡率100%), 且在发病晚期接受治疗延迟死亡1周, 为准确诊断和给予其他治疗提供了相当长的时间窗口。此外, 有临床前研究发现, 轻度低温疗法可抑制恶性疟原虫的体外生长并增强青蒿素衍生物的药效学活性, 进一步探索临床轻度低温疗法作为青蒿琥酯治疗ECM的辅助治疗具有潜在的前景[55]。
3.5 神经保护近年来已有不少针对CM神经后遗症的研究, 包括促红细胞生成素(erythropoietin, EPO)、氧化物酶体增殖物激活受体γ (peroxisome proliferators-activated receptor gamma γ, PPARγ)等药物。
EPO是一类可调控细胞增殖、免疫调节、维持代谢稳态的造血生长因子[56, 57], 近年来, 引起了对包括CM在内的神经退行性疾病治疗领域研究者的广泛兴趣。使用青蒿琥酯和重组人促红细胞生成素(recombinant human erythropoietin, rhEPO)进行实验研究[58]发现, 青蒿琥酯和rhEPO联合应用可减少内皮细胞活化, 保护血脑屏障的完整性, 下调P. berghei ANKA感染期间的Th1反应, 减少TNF-α, IFN-γ, 白介素12 (interleukin, IL-12), 白介素18 (interleukin, IL-18), CXCL9和CXCL10水平表达。然而, 在2016年对来自印度奥里萨邦的患者EPO水平与生物学参数关联分析却发现, EPO水平随疟疾严重程度显著增加, 尤其是在CM期间[59]。此外, 使用rhEPO作为治疗其他神经退行性疾病(如急性脑卒中)的神经保护策略也仍存在相当大的不确定性。
PPARγ治疗被证实可以ECM小鼠提高长期认知能力, 延长生存期[60], 通过抗炎、抗氧化、促进神经元修复机制等多种途径发挥神经保护作用, 是较有吸引力的辅助治疗方法[61, 62], 在mozambican进行的一项随机、双盲、安慰剂对照的临床Ⅱa期试验证明, PPARγ激动剂罗格列酮用于小儿单纯性疟疾感染的安全性和耐受性良好[63]。
另有研究发现用真菌Trichoderma stromaticum粗乙醇提取物处理ECM小鼠, 发现能够提高感染小鼠生存率, 减少寄生虫血症和预防神经系统症状, 减轻脑、肝、肺的病变, 保护血脑屏障的完整性[64]。
3.6 提高NO生物利用度提高一氧化氮(nitric oxide, NO)利用度将有利于发挥药物对CM的保护作用。CM的一个重要标志是严重的低精氨酸血症及NO生物利用度降低[65], 此外, 游离血红蛋白和低四氢生物蝶呤水平也是导致NO低生物利用度的重要原因。NO水平降低可激活内皮细胞增加黏附分子ICAM-1和VCAM-1的表达水平, 并增加促炎细胞因子的表达[66]。
Martins等[67]发现, 感染后期将NO作为辅助疗法与抗寄生虫药物联合用药, 可为机体提供保护并部分降低死亡率, 但并无充足的依据支持其成为有效的辅助疗法。一项Ⅱ期临床研究发现, 吸入NO作为儿童CM辅助治疗并不影响死亡率, 但可降低神经认知障碍[68], 通过非循环呼吸面罩给予80 ppm的NO安全可行[69]。研究经皮给予三硝酸甘油酯与蒿甲醚联合治疗预防ECM的作用时发现, 以0.025 mg·h-1预防性给予三硝酸甘油酯可使ECM死亡率从67%降至11%, 且下调脑中诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)表达, 两药合用后ECM小鼠软脑膜小动脉血管收缩持续逆转, 而单用蒿甲醚没有观察到这种效果[70]。四氢生物蝶呤作为一种NOS的辅因子, 可将精氨酸转化为瓜氨酸和NO, 瓜氨酸可抑制精氨酸酶, 从而提高血液精氨酸水平。最新研究发现, 感染后立即注射瓜氨酸作为预防措施可通过改善低精氨酸血症、尿素循环损害和血脑屏障破坏从而发挥CM保护作用, 但并未减少寄生虫血症。此外, 通过饮食增加瓜氨酸或精氨酸可降低ECM死亡率, 瓜氨酸联合聚乙二醇化超氧化物歧化酶、聚乙二醇化过氧化氢酶可通过清除超氧化物改善低精氨酸血症, 降低ECM死亡率[71]。寻找增强内皮细胞NO生物利用度的替代方法, 增加NO水平, 如通过静脉内给药增加血浆精氨酸水平或增加NOS活性所需的辅因子, 对于NO作为CM辅助治疗是合理而有效的干预措施[4]。
有研究发现, 在ECM中脑血管收缩导致脑血流减少和缺氧, 与低水平的NO和低血浆L-精氨酸相关, Ong等[72]研究了直接灌流脑表面或全身给予L-精氨酸治疗后对CM小鼠脑血管的影响, 不同浓度给药后发现软脑膜血管呈剂量依赖性扩张, 而在皮下注射生理盐水后24 h内ECM小鼠表现出明显的脑血管收缩且50和100 mg·kg-1 L-精氨酸可暂时性诱导软脑膜血管收缩逆转。
3.7 影响能量代谢器官代谢对CM的发展过程有着特定影响, 不同的炎症状态需要与之相应的代谢程序协调以启动组织保护机制, 因此针对能量代谢过程的药物可能发挥对CM的保护作用。
使用2-脱氧葡萄糖(2-deoxy glucose, 2DG)抑制糖酵解可以保护P. berghei ANKA感染的小鼠, 使之存活并最终死于贫血但不发展成CM, 尽管经过检测发现与未给药组相比, 大脑炎性细胞浸润和血脑屏障通透性无显著差异, 但2DG防止血栓形成和血栓并发症的发生, 提示葡萄糖代谢参与炎症诱导的止血可能成为CM的潜在治疗靶标[73]。
5'-磷酸腺苷激活蛋白激酶(adenosine 5'-monophosphate-activated protein kinase, AMPK)是一种重要的代谢传感器, 被认为有助于在正常生理和病理条件下维持能量平衡, 通过研究AMPK在ECM模型中的作用发现, CM小鼠大脑中prkaa1 (α1亚单位)和prkaa2 (α2亚单位)的基因表达显著降低, 并且与未感染的对照组相比, CM中磷酸AMPK/AMPK蛋白水平的比率显著降低, 因此新的AMPK激活药物作为促进神经保护的辅助疗法具有良好的前景[74]。
3.8 减轻炎症反应炎症反应是CM的重要特征, 研究发现[75]CM患者促炎因子水平明显升高, 因此减轻炎症反应可以作为CM辅助治疗的又一切入点。姜黄素是一种源自姜黄的多酚有机分子, 具有抗炎、抗氧化、抗癌等作用[76], 研究发现其以剂量依赖性抑制已产生氯喹抗药性的恶性疟原虫生长[77]。当与蒿乙醚合用时, 可抑制炎症反应、CD8+ T细胞聚集和pRBC在脑中的滞留以及血脑屏障的破坏[78]。血管活性化合物内皮素-1是许多炎症过程的关键参与者, 可能介导CM的血管和认知功能障碍。Freeman等[79]发现内皮素A型受体(endothelin type A receptor, ETA)拮抗剂预防ECM诱导的神经认知障碍和提高存活率, 证实该血管活性肽可以作为CM辅助治疗的潜在靶标。
植物衍生的次生代谢产物, 如萜烯, 通过抑制恶性疟原虫的异戊二烯生物合成, 在体外也表现出抗疟活性, 紫苏醇(perillyl alcohol, POH) 500 mg·kg-1·d-1剂量对寄生血症没有影响, 但在预防ECM进展方面显示出显著的效果(70%的存活率, 而未经治疗的动物为30%), 这一作用与脑中白细胞数目的显著减少和脑血管炎症的下调有关, POH还下调脑和脾中IL-10、IL-6、TNF-α、IFN-γ、IL-12和单核细胞趋化蛋白1 (monocyte chemoattractant protein 1, MCP-1)的水平。遗憾的是POH虽在体外表现出抗疟活性, 但在鼻内给药后体内没有显示出抗疟活性, 但可预防脑血管炎症损伤和减少促炎性细胞因子的表达[80]。高压氧(hyperbaric oxygen, HBO)可通过抑制疟原虫和白细胞的积聚来靶向脑内皮细胞, 改善脑微循环血流, 延长生存期并减少有害的促炎反应[81]。
此外, Hoffmann等[82]利用双-5-羟基-色胺-二乙烯三胺五乙酸钆(myeloperoxidase-Gd, MPO-Gd)和交联氧化铁纳米颗粒的组合(cross-linked iron oxide nanoparticle, CLIO-NP)成像研究ECM模型, CLIO显示在ECM模型中微血管中具有强烈的炎症参与, MPO-Gd成像描绘了实质和脑室内炎症, 这种组合的分子成像方法将血管炎症与血脑屏障和血脑脊液屏障的破坏联系起来, 为疾病诊断和治疗提供了新的方法。
3.9 红细胞交换输血红细胞交换输血法能直接降低寄生虫血症, 已被证明对高寄生虫血症的重症疟和CM患者治疗的安全和有效性。尽管缺乏大规模随机试验, Genstler等[83]报道1例72岁重症疟疾女性的厚薄涂片显示53.33%的寄生虫血症, 在进行抗疟治疗后病情仍然继续恶化, 在入院后24 h内进行红细胞交换输血, 症状迅速得到改善。一名84岁的索马里妇女在接受红细胞交换输血治疗后寄生虫血症由12%降低至2%, 神经系统症状得到快速和显着的改善[84]。一位23岁的CM患者伴随黄疸、急性肾衰竭也成功地接受了血浆交换和血液透析治疗[85], 一位21岁患者接受以青蒿琥酯为基础红细胞交换输血疗法反应良好[86]。巴塞罗那大量案例报告已证明红细胞交换技术无血流动力学并发症, 耐受性良好且无死亡病例[87], 然而由于大量输血除了代价昂贵外, 也增加了艾滋病和其他血液疾病的传染机会, 故临床上并不被推荐大规模使用。
4 展望CM作为一种致命疾病, 即使得以幸存, 也可使相当比例的患儿可致永生残疾。鉴于目前抗疟药对CM病死率和神经后遗症的局限性, 除现有的抗疟药外, 临床上迫切需要更多疗效确切的辅助治疗方法和临床诊断方法来改善现有的抗疟药结果, 预防远期后遗症。
如前所述, 尽管针对CM辅助治疗的研究文献量足够大, 但是辅助治疗试验结果却普遍令人失望, 许多在ECM模型中有效的治疗方法在人类试验中被证明是无效甚至是有害的, 目前尚无一种治疗方法在多项研究中显示出明显的益处。究其原因, 临床CM辅助治疗的研究存在样本量小、不随机等缺点, 而小鼠ECM模型虽已被广泛应用于CM的发病机制和特定的病理学特点研究, 但由于CM与ECM尚存在明显的差异, 如ECM的一个关键特征小鼠脑CD8+ T细胞浸润, 但几乎没有证据支持CM患儿脑中存在CD8+ T细胞广泛活化, 而在CM患者pfEMP1高表达的典型特征, 在ECM小鼠中并不存在, 因此在较大程度上限制了现有研究基础上CM药物临床干预的有效性。
CM辅助治疗的发展需立足于对CM的病理生理学不断深化的理解和认识。针对CM发病的不可逆性, 早期发现和识别可能导致CM等重症疟疾的病例, 并对其进行早期干预至关重要, 对疾病严重程度的准确判断, 宿主对治疗反应相关的宿主生物标志物的准确识别和鉴定, 可为有效治疗方法的研究提供有力支撑。
CM发生及特点呈现一定的地域差异性, 如在非洲的疟疾流行地区, CM一般发生在5岁以下的幼儿, 其中约20%的患儿死于昏迷和癫痫发作。而在东南亚成人CM发病率要远高于非洲, 多器官衰竭是其主要死因。因此, CM的致病基因和标志物差异性研究始终是遗传学家研究的热点, 而针对成人和儿童CM之间的不同发病机制和临床特点、不同年龄患者不同药物剂量响应性的差别等针对性的进行药物干预及深入研究, 不仅更有利于对CM的全面理解, 也是进一步提高临床CM治疗有效性的途径。
同时, 目前的文献分析可见, 除CM高病死率的特点外, 幸存患儿的远期神经缺损和认知功能障碍也是重要的临床问题。但目前相关研究并不充分, 基础和临床研究数据匮乏, 成为这种严重并发症缺乏有效防治手段的最主要障碍。进一步加强CM神经损伤的基础研究, 并从目前较公认的CM发病机制入手, 针对预防CM远期后遗症、改善CM幸存者的神经损伤及认知障碍的有益探索, 是辅助治疗方面颇具前景的研究方向。
“机械阻塞”学说是CM发病较为公认的学说之一, 早在1999年, 中国著名的抗疟专家李国桥教授在吉普寨开展的一项临床研究中发现, CM患者出现昏迷或意识障碍者数小时内血涂片如发现大量大滋养体, 则后期神经损伤等并发症发生率较高, 认为可能是由于富含大滋养体和裂殖体的感染红细胞变形性差, 更易滞留甚至阻塞脑微血管, 导致了脑部缺血、缺氧, 出现可逆或不可逆的神经损伤。充分挖掘利用中医药在脑卒中等缺血性疾病干预中现有的大量成功经验, 探讨减轻pRBC致微小血管阻塞的有效方法, 针对性解决CM患者大脑等重要脏器微小血管受阻而带来的一系列不可逆损害, 探索减轻CM幸存儿童神经缺损和功能障碍的有效方法等, 可能为CM的辅助治疗带来新的突破。
| [1] |
World Health Organization. World malaria report 2018[R]. WHO, 2018.
|
| [2] |
Bruneel F. Human cerebral malaria:2019 mini review[J]. Rev Neurol (Paris), 2019, 175: 445-450. DOI:10.1016/j.neurol.2019.07.008 |
| [3] |
Abdallah TM, Elmardi KA, Elhassan AH, et al. Comparison of artesunate and quinine in the treatment of severe Plasmodium falciparum malaria at Kassala hospital, Sudan[J]. J Infect Dev Ctries, 2014, 8: 611-615. DOI:10.3855/jidc.3813 |
| [4] |
Varo R, Crowley VM, Sitoe A, et al. Adjunctive therapy for severe malaria:a review and critical appraisal[J]. Malar J, 2018, 17: 47-65. DOI:10.1186/s12936-018-2195-7 |
| [5] |
Pais TF, Penha-Goncalves C. Brain endothelium:the "innate immunity response hypothesis" in cerebral malaria pathogenesis[J]. Front Immunol, 2018, 9: 3100-3108. |
| [6] |
Hora R, Kapoor P, Thind KK, et al. Cerebral malaria——clinical manifestations and pathogenesis[J]. Metab Brain Dis, 2016, 31: 225-237. DOI:10.1007/s11011-015-9787-5 |
| [7] |
Luzolo AL, Ngoyi DM. Cerebral malaria[J]. Brain Res Bull, 2019, 145: 53-58. DOI:10.1016/j.brainresbull.2019.01.010 |
| [8] |
Mohanty S, Patel DK, Pati SS, et al. Adjuvant therapy in cerebral malaria[J]. Indian J Med Res, 2006, 124: 245-260. |
| [9] |
John CC, Kutamba E, Mugarura K, et al. Adjunctive therapy for cerebral malaria and other severe forms of Plasmodium falciparum malaria[J]. Expert Rev Anti Infect Ther, 2010, 8: 997-1008. DOI:10.1586/eri.10.90 |
| [10] |
White NJ, Turner GD, Medana IM, et al. The murine cerebral malaria phenomenon[J]. Trends Parasitol, 2010, 26: 11-15. DOI:10.1016/j.pt.2009.10.007 |
| [11] |
Riggle BA, Miller LH, Pierce SK. Do we know enough to find an adjunctive therapy for cerebral malaria in African children[J]. F 1000Res, 2017, 6: 2039-2047. |
| [12] |
Medana IM, Day NP, Hien TT, et al. Axonal injury in cerebral malaria[J]. Am J Pathol, 2002, 160: 655-666. DOI:10.1016/S0002-9440(10)64885-7 |
| [13] |
Strangward P, Haley MJ, Shaw TN, et al. A quantitative brain map of experimental cerebral malaria pathology[J]. PLoS Pathog, 2017, 13: e1006267. DOI:10.1371/journal.ppat.1006267 |
| [14] |
Shabani E, Hanisch B, Opoka RO, et al. Plasmodium falciparum EPCR-binding PfEMP1 expression increases with malaria disease severity and is elevated in retinopathy negative cerebral malaria[J]. BMC Med, 2017, 15: 183-197. DOI:10.1186/s12916-017-0945-y |
| [15] |
Elphinstone RE, Riley F, Lin T, et al. Dysregulation of the haem-haemopexin axis is associated with severe malaria in a case-control study of Ugandan children[J]. Malar J, 2015, 14: 511-521. |
| [16] |
Sierro F, Grau GER. The ins and outs of cerebral malaria pathogenesis:immunopathology, extracellular vesicles, immunometabolism, and trained immunity[J]. Front Immunol, 2019, 10: 830-841. DOI:10.3389/fimmu.2019.00830 |
| [17] |
Idro R, Jenkins NE, Newton CR. Pathogenesis, clinical features, and neurological outcome of cerebral malaria[J]. Lancet Neurol, 2005, 4: 827-840. DOI:10.1016/S1474-4422(05)70247-7 |
| [18] |
van der Heyde HC, Nolan J, Combes V, et al. A unified hypothesis for the genesis of cerebral malaria:sequestration, inflammation and hemostasis leading to microcirculatory dysfunction[J]. Trends Parasitol, 2006, 22: 503-508. DOI:10.1016/j.pt.2006.09.002 |
| [19] |
Bruneel F. Human cerebral malaria:2019 mini review[J]. Rev Neurol (Paris), 2019, 175: 445-450. DOI:10.1016/j.neurol.2019.07.008 |
| [20] |
Reyburn H. New WHO guidelines for the treatment of malaria[J]. BMJ, 2010, 340: c2637. DOI:10.1136/bmj.c2637 |
| [21] |
Klionsky DJ, Abdelmohsen K, Abe A, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition)[J]. Autophagy, 2016, 12: 1-222. DOI:10.1080/15548627.2015.1100356 |
| [22] |
Dondorp AM, Nosten F, Yi P, et al. Artemisinin resistance in Plasmodium falciparum malaria[J]. N Engl J Med, 2009, 361: 455-467. DOI:10.1056/NEJMoa0808859 |
| [23] |
Vreden SG, Bansie RD, Jitan JK, et al. Assessing parasite clearance during uncomplicated Plasmodium falciparum infection treated with artesunate monotherapy in Suriname[J]. Infect Drug Resist, 2016, 9: 261-267. DOI:10.2147/IDR.S113861 |
| [24] |
Kayano A, Dos-Santos JCK, Bastos MF, et al. Pathophysiological mechanisms in gaseous therapies for severe malaria[J]. Infect Immun, 2016, 84: 874-882. DOI:10.1128/IAI.01404-15 |
| [25] |
Mohanty S, Benjamin LA, Majhi M, et al. Magnetic resonance imaging of cerebral malaria patients reveals distinct pathogenetic processes in different parts of the brain[J]. mSphere, 2017, 2: e00193-17. |
| [26] |
Gordon EB, Hart GT, Tran TM, et al. Targeting glutamine metabolism rescues mice from late-stage cerebral malaria[J]. Proc Natl Acad Sci U S A, 2015, 112: 13075-13080. DOI:10.1073/pnas.1516544112 |
| [27] |
Riggle BA, Sinharay S, Schreiber-Stainthorp W, et al. MRI demonstrates glutamine antagonist-mediated reversal of cerebral malaria pathology in mice[J]. Proc Natl Acad Sci U S A, 2018, 115: e12024-e12033. DOI:10.1073/pnas.1812909115 |
| [28] |
Higgins SJ, Purcell LA, Silver KL, et al. Dysregulation of angiopoietin-1 plays a mechanistic role in the pathogenesis of cerebral malaria[J]. Sci Transl Med, 2016, 8: 358ra128. DOI:10.1126/scitranslmed.aaf6812 |
| [29] |
Gallego-Delgado J, Basu-Roy U, Ty M, et al. Angiotensin receptors and beta-catenin regulate brain endothelial integrity in malaria[J]. J Clin Invest, 2016, 126: 4016-4029. DOI:10.1172/JCI87306 |
| [30] |
Liu M, Solomon W, Cespedes JC, et al. Neuregulin-1 attenuates experimental cerebral malaria (ECM) pathogenesis by regulating ErbB4/AKT/STAT3 signaling[J]. J Neuroinflammation, 2018, 15: 104-119. DOI:10.1186/s12974-018-1147-z |
| [31] |
Kume A, Kasai S, Furuya H, et al. Alpha-tocopheryl succinate-suppressed development of cerebral malaria in mice[J]. Parasitol Res, 2018, 117: 3177-3182. DOI:10.1007/s00436-018-6016-2 |
| [32] |
Becker BF, Jacob M, Leipert S, et al. Degradation of the endothelial glycocalyx in clinical settings:searching for the sheddases[J]. Br J Clin Pharmacol, 2015, 80: 389-402. DOI:10.1111/bcp.12629 |
| [33] |
Hempel C, Sporring J, Kurtzhals JAL. Experimental cerebral malaria is associated with profound loss of both glycan and protein components of the endothelial glycocalyx[J]. FASEB J, 2019, 33: 2058-2071. DOI:10.1096/fj.201800657R |
| [34] |
Gillrie MR, Renaux B, Russell-Goldman E, et al. Thrombin cleavage of Plasmodium falciparum erythrocyte membrane protein 1 inhibits cytoadherence[J]. mBio, 2016, 7: e01120-16. |
| [35] |
Saiwaew S, Sritabal J, Piaraksa N, et al. Effects of sevuparin on rosette formation and cytoadherence of Plasmodium falciparum infected erythrocytes[J]. PLoS One, 2017, 12: e0172718. DOI:10.1371/journal.pone.0172718 |
| [36] |
Leitgeb AM, Charunwatthana P, Rueangveerayut R, et al. Inhibition of merozoite invasion and transient de-sequestration by sevuparin in humans with Plasmodium falciparum malaria[J]. PLoS One, 2017, 12: e0188754. DOI:10.1371/journal.pone.0188754 |
| [37] |
Maude RJ, Silamut K, Plewes K, et al. Randomized controlled trial of levamisole hydrochloride as adjunctive therapy in severe falciparum malaria with high parasitemia[J]. J Infect Dis, 2014, 209: 120-129. DOI:10.1093/infdis/jit410 |
| [38] |
Wilson KD, Ochoa LF, Solomon OD, et al. Elimination of intravascular thrombi prevents early mortality and reduces gliosis in hyper-inflammatory experimental cerebral malaria[J]. J Neuroinflamm, 2018, 15: 173-190. DOI:10.1186/s12974-018-1207-4 |
| [39] |
Remer I, Pierre-Destine LF, Tay D, et al. In vivo noninvasive visualization of retinal perfusion dysfunction in murine cerebral malaria by camera-phone laser speckle imaging[J]. J Biophotonics, 2019, 12: e201800098. DOI:10.1002/jbio.201800098 |
| [40] |
Potchen MJ, Kampondeni SD, Seydel KB, et al. 1.5 Tesla magnetic resonance imaging to investigate potential etiologies of brain swelling in pediatric cerebral malaria[J]. Am J Trop Med Hyg, 2018, 98: 497-504. DOI:10.4269/ajtmh.17-0309 |
| [41] |
O'Brien NF, Mutatshi Taty T, Moore-Clingenpeel M, et al. Transcranial Doppler ultrasonography provides insights into neurovascular changes in children with cerebral malaria[J]. J Pediatr, 2018, 203: 116-124. DOI:10.1016/j.jpeds.2018.07.075 |
| [42] |
Eisenhut M. The evidence for a role of vasospasm in the pathogenesis of cerebral malaria[J]. Malar J, 2015, 14: 405-414. DOI:10.1186/s12936-015-0928-4 |
| [43] |
Wu B, Du Y, Feng Y, et al. Oral administration of vitamin D and importance in prevention of cerebral malaria[J]. Int Immunopharmacol, 2018, 64: 356-363. DOI:10.1016/j.intimp.2018.08.041 |
| [44] |
Wang J, Li Y, Shen Y, et al. PDL1 fusion protein protects against experimental cerebral malaria via repressing over-reactive CD8(+) T cell responses[J]. Front Immunol, 2018, 9: 3157-3160. |
| [45] |
Liby KT, Sporn MB. Synthetic oleanane triterpenoids:multifunctional drugs with a broad range of applications for prevention and treatment of chronic disease[J]. Pharmacol Rev, 2012, 64: 972-1003. DOI:10.1124/pr.111.004846 |
| [46] |
Crowley VM, Ayi K, Lu Z, et al. Synthetic oleanane triterpenoids enhance blood brain barrier integrity and improve survival in experimental cerebral malaria[J]. Malar J, 2017, 16: 463-474. DOI:10.1186/s12936-017-2109-0 |
| [47] |
Schmidt KE, Kuepper JM, Schumak B, et al. Doxycycline inhibits experimental cerebral malaria by reducing inflammatory immune reactions and tissue-degrading mediators[J]. PLoS One, 2018, 13: e0192717. DOI:10.1371/journal.pone.0192717 |
| [48] |
Weichhart T, Hengstschlager M, Linke M. Regulation of innate immune cell function by mTOR[J]. Nat Rev Immunol, 2015, 15: 599-614. DOI:10.1038/nri3901 |
| [49] |
Donnelly S, Huston WM, Johnson M, et al. Targeting the master regulator mTOR:a new approach to prevent the neurological of consequences of parasitic infections?[J]. Parasit Vectors, 2017, 10: 581-587. DOI:10.1186/s13071-017-2528-3 |
| [50] |
Gordon EB, Hart GT, Tran TM, et al. Inhibiting the mammalian target of rapamycin blocks the development of experimental cerebral malaria[J]. mBio, 2015, 6: e00725-15. |
| [51] |
Mejia P, Trevino-Villarreal JH, Reynolds JS, et al. A single rapamycin dose protects against late-stage experimental cerebral malaria via modulation of host immunity, endothelial activation and parasite sequestration[J]. Malar J, 2017, 16: 455-467. DOI:10.1186/s12936-017-2092-5 |
| [52] |
Niewold P, Cohen A, van Vreden C, et al. Experimental severe malaria is resolved by targeting newly-identified monocyte subsets using immune-modifying particles combined with artesunate[J]. Commun Biol, 2018, 1: 227-240. DOI:10.1038/s42003-018-0216-2 |
| [53] |
Raza M, Bharti H, Singal A, et al. Long circulatory liposomal maduramicin inhibits the growth of Plasmodium falciparum blood stages in culture and cures murine models of experimental malaria[J]. Nanoscale, 2018, 10: 13773-13791. DOI:10.1039/C8NR02442A |
| [54] |
Golenser J, Buchholz V, Bagheri A, et al. Controlled release of artemisone for the treatment of experimental cerebral malaria[J]. Parasit Vectors, 2017, 10: 117-127. DOI:10.1186/s13071-017-2018-7 |
| [55] |
Rehman K, Sauerzopf U, Veletzky L, et al. Effect of mild medical hypothermia on in vitro growth of Plasmodium falciparum and the activity of anti-malarial drugs[J]. Malar J, 2016, 15: 162-166. DOI:10.1186/s12936-016-1215-8 |
| [56] |
Maiese K. Erythropoietin and diabetes mellitus[J]. World J Diabetes, 2015, 6: 1259-1273. DOI:10.4239/wjd.v6.i14.1259 |
| [57] |
Wei X, Li Y, Sun X, et al. Erythropoietin protects against murine cerebral malaria through actions on host cellular immunity[J]. Infect Immun, 2014, 82: 165-173. DOI:10.1128/IAI.00929-13 |
| [58] |
Du Y, Chen G, Zhang X, et al. Artesunate and erythropoietin synergistically improve the outcome of experimental cerebral malaria[J]. Int Immunopharmacol, 2017, 48: 219-230. DOI:10.1016/j.intimp.2017.05.008 |
| [59] |
Dalko E, Tchitchek N, Pays L, et al. Erythropoietin levels increase during cerebral malaria and correlate with heme, interleukin-10 and tumor necrosis factor-alpha in India[J]. PLoS One, 2016, 11: e0158420. DOI:10.1371/journal.pone.0158420 |
| [60] |
Serghides L, McDonald CR, Lu Z, et al. PPARgamma agonists improve survival and neurocognitive outcomes in experimental cerebral malaria and induce neuroprotective pathways in human malaria[J]. PLoS Pathog, 2014, 10: e1003980. DOI:10.1371/journal.ppat.1003980 |
| [61] |
Kapadia R, Yi JH, Vemuganti R. Mechanisms of anti-inflammatory and neuroprotective actions of PPAR-gamma agonists[J]. Front Biosci, 2008, 13: 1813-1826. DOI:10.2741/2802 |
| [62] |
Martin HL, Mounsey RB, Mustafa S, et al. Pharmacological manipulation of peroxisome proliferator-activated receptor gamma (PPARgamma) reveals a role for anti-oxidant protection in a model of Parkinson's disease[J]. Exp Neurol, 2012, 235: 528-538. DOI:10.1016/j.expneurol.2012.02.017 |
| [63] |
Varo R, Crowley VM, Sitoe A, et al. Safety and tolerability of adjunctive rosiglitazone treatment for children with uncomplicated malaria[J]. Malar J, 2017, 16: 215-223. DOI:10.1186/s12936-017-1858-0 |
| [64] |
Cariaco Y, Lima WR, Sousa R, et al. Ethanolic extract of the fungus Trichoderma stromaticum decreases inflammation and ameliorates experimental cerebral malaria in C57BL/6 mice[J]. Sci Rep, 2018, 8: 1547-1562. |
| [65] |
Yeo TW, Lampah DA, Gitawati R, et al. Impaired nitric oxide bioavailability and L-arginine reversible endothelial dysfunction in adults with falciparum malaria[J]. J Exp Med, 2007, 204: 2693-2704. DOI:10.1084/jem.20070819 |
| [66] |
De Caterina R, Libby P, Peng HB, et al. Nitric oxide decreases cytokine-induced endothelial activation. Nitric oxide selectively reduces endothelial expression of adhesion molecules and proinflammatory cytokines[J]. J Clin Invest, 1995, 96: 60-68. DOI:10.1172/JCI118074 |
| [67] |
Martins YC, Zanini GM, Frangos JA, et al. Efficacy of different nitric oxide-based strategies in preventing experimental cerebral malaria by Plasmodium berghei ANKA[J]. PLoS One, 2012, 7: e32048. DOI:10.1371/journal.pone.0032048 |
| [68] |
Mwanga-Amumpaire J, Carroll RW, Baudin E, et al. Inhaled nitric oxide as an adjunctive treatment for cerebral malaria in children:a phase ii randomized open-label clinical trial[J]. Open Forum Infect Dis, 2015, 2: ofv111. DOI:10.1093/ofid/ofv111 |
| [69] |
Hawkes MT, Conroy AL, Opoka RO, et al. Inhaled nitric oxide as adjunctive therapy for severe malaria:a randomized controlled trial[J]. Malar J, 2015, 14: 421-438. DOI:10.1186/s12936-015-0946-2 |
| [70] |
Orjuela-Sanchez P, Ong PK, Zanini GM, et al. Transdermal glyceryl trinitrate as an effective adjunctive treatment with artemether for late-stage experimental cerebral malaria[J]. Antimicrob Agents Chemother, 2013, 57: 5462-5471. DOI:10.1128/AAC.00488-13 |
| [71] |
Gramaglia I, Velez J, Chang YS, et al. Citrulline protects mice from experimental cerebral malaria by ameliorating hypoargininemia, urea cycle changes and vascular leak[J]. PLoS One, 2019, 14: e0213428. DOI:10.1371/journal.pone.0213428 |
| [72] |
Ong PK, Moreira AS, Daniel-Ribeiro CT, et al. Reversal of cerebrovascular constriction in experimental cerebral malaria by L-arginine[J]. Sci Rep, 2018, 8: 15957-15968. DOI:10.1038/s41598-018-34249-2 |
| [73] |
Wang A, Huen SC, Luan HH, et al. Glucose metabolism mediates disease tolerance in cerebral malaria[J]. Proc Natl Acad Sci U S A, 2018, 115: 11042-11047. DOI:10.1073/pnas.1806376115 |
| [74] |
Apoorv TS, Karthik C, Babu PP. AMP-activated protein kinase (AMPK) is decreased in the mouse brain during experimental cerebral malaria[J]. Neurosci Lett, 2018, 662: 290-294. |
| [75] |
Cusick SE, Opoka RO, Ssemata AS, et al. Comparison of iron status 28 d after provision of antimalarial treatment with iron therapy compared with antimalarial treatment alone in Ugandan children with severe malaria[J]. Am J Clin Nutr, 2016, 103: 919-925. DOI:10.3945/ajcn.115.117820 |
| [76] |
Pulido-Moran M, Moreno-Fernandez J, Ramirez-Tortosa C, et al. Curcumin and health[J]. Molecules, 2016, 21: 264-286. DOI:10.3390/molecules21030264 |
| [77] |
Reddy RC, Vatsala PG, Keshamouni VG, et al. Curcumin for malaria therapy[J]. Biochem Biophys Res Commun, 2005, 326: 472-474. DOI:10.1016/j.bbrc.2004.11.051 |
| [78] |
Dende C, Meena J, Nagarajan P, et al. Simultaneously targeting inflammatory response and parasite sequestration in brain to treat experimental cerebral malaria[J]. Sci Rep, 2015, 5: 12671-12685. DOI:10.1038/srep12671 |
| [79] |
Freeman BD, Martins YC, Akide-Ndunge OB, et al. Endothelin-1 mediates brain microvascular dysfunction leading to long-term cognitive impairment in a model of experimental cerebral malaria[J]. PLoS Pathog, 2016, 12: e1005477. DOI:10.1371/journal.ppat.1005477 |
| [80] |
Rodriguez AAM, Carvalho LJM, Kimura EA, et al. Perillyl alcohol exhibits in vitro inhibitory activity against Plasmodium falciparum and protects against experimental cerebral malaria[J]. Int J Antimicrob Agents, 2018, 51: 370-377. DOI:10.1016/j.ijantimicag.2017.08.025 |
| [81] |
Bastos MF, Kayano A, Silva-Filho JL, et al. Inhibition of hypoxia-associated response and kynurenine production in response to hyperbaric oxygen as mechanisms involved in protection against experimental cerebral malaria[J]. FASEB J, 2018, 32: 4470-4481. DOI:10.1096/fj.201700844R |
| [82] |
Hoffmann A, Pfeil J, Mueller AK, et al. MRI of iron oxide nanoparticles and myeloperoxidase activity links inflammation to brain edema in experimental cerebral malaria[J]. Radiology, 2019, 290: 359-367. DOI:10.1148/radiol.2018181051 |
| [83] |
Genstler JT, Abdipour A. Red blood cell exchange in treatment of severe cerebral P. falciparum malaria:a case report[J]. J Clin Apher, 2019, 34: 61-63. DOI:10.1002/jca.21667 |
| [84] |
Anani WQ, Smith GP, Irani M, et al. A report of cerebral malaria treated with automated red blood cell exchange[J]. Transfusion, 2017, 57: 985-988. DOI:10.1111/trf.14013 |
| [85] |
Ou TY, Chuang CY, Chen CD, et al. Therapeutic plasma exchange in the treatment of complicated Plasmodium falciparum malaria:a case report[J]. J Clin Apher, 2018, 33: 419-422. DOI:10.1002/jca.21586 |
| [86] |
Dongare HC, Khatib KI. Exchange transfusion in severe falciparum malaria[J]. J Clin Diagn Res, 2016, 10: OD05. |
| [87] |
Calvo-Cano A, Gomez-Junyent J, Lozano M, et al. The role of red blood cell exchange for severe imported malaria in the artesunate era:a retrospective cohort study in a referral centre[J]. Malar J, 2016, 15: 216-223. DOI:10.1186/s12936-016-1264-z |
 2020, Vol. 55
2020, Vol. 55


