纳米技术在基因治疗中的重要性日益凸显, 与当前的治疗和诊断模式相比, 它们在功效和安全性方面具有显著优势[1, 2]。目前, 人们已经开发了许多微米和纳米结构以改善全身给药的疗效。但这些结构受到许多生物屏障的阻碍, 极大地限制了它们的应用。通过自上而下策略制备的生物响应药物递送载体已成为逃避免疫系统并促进跨内皮血管壁转运的替代方法[3-6]。随着仿生学的发展, 促使人们开发新颖的策略, 以赋予纳米和微粒具有必要的多种功能以跨越生物屏障[5, 7-9]。
外泌体(exosomes)是细胞间远程交流的一种重要工具, 在正常或病理条件下, 可以携带多种脂质、蛋白质、mRNA和非编码RNA来介导细胞、组织和器官之间的信息交流[10-13]。外泌体囊泡已被用于递送包括siRNA、mRNA和蛋白在内的生物活性分子[14-16]。然而, 现有的外泌体分离方法往往步骤繁琐、分离效率低和组分不纯。更关键的问题在于, 外泌体的内容物及表面蛋白与细胞的种属、分化程度和状态等条件紧密相关。受到这些条件的限制, 很难重复性地获得结构属性一致的外泌体, 这严重限制了它的研究应用。
干性维持是干细胞医疗应用和科学研究中的难题, 该过程有多种基因参与, 其中转录因子OCT4是干性维持的关键转录因子之一。作者前期的研究结果表明, 骨髓间充质干细胞在衰老过程中伴随着全基因组甲基化的变化, Trim28 (tripartite motif containing 28)是胚胎发育过程中重要的表观调节因子, 可导致基因的甲基化沉默。
本研究采用人工合成模拟外泌体的方法, 设计和合成具有外泌体类似结构的颗粒, 采用商品化的磷脂材料和膜蛋白的仿生膜, 赋予它们类似于外泌体磷脂双分子层结构, 并有表面膜蛋白的相关功能, 包裹聚合物硬性材料形成纳米级别(200 nm以下)材料, 用于生物大分子或药物小分子的高效递送, 并实现相关生物功能的调节。人工合成磷脂便于控制药物的包裹、负载, 并可对结构修饰; 生物膜能发挥“隐身”性能, 逃避单核吞噬系统(mononuclear phagocyte system, MPS)及协助跨越各种生物屏障。期望仿生人工外泌体能发挥更重要的作用, 实现对多组分的同时递送, 将为开发新型药物递送体系提供理论依据。
材料与方法材料与试剂 无核酶水、苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)、细胞膜蛋白与细胞浆蛋白抽提试剂盒(碧云天生物技术有限公司); 醋酸纤维素膜、聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA] (Sigma-Aldrich公司); OCT4蛋白(上海吉荧生物技术有限公司); siTrim28 (Takara公司); 二油酰基三甲基铵丙烷(dioleyl trimethylammonium propane, DOTAP)、二棕榈酰磷脂酰胆碱(1, 2-dipalmitoyl-sn-glycero-3-phosphocholine, DPPC)、二硬脂酰磷脂酰胆碱(1, 2-distearoyl-sn-glycero-3-phosphocholine, DSPC)、二油酰磷脂酰胆碱(1, 2-dioleoyl-sn-glycero-3-phosphocholine, DOPC)、胆固醇(Avanti Polar Lipids公司); 氯仿、甲醇、二氯甲烷、聚乙烯醇(polyvinyl alcohol, PVA) (广州化学试剂厂); 培养基、磷酸盐缓冲液(phosphate-buffered saline, PBS)、胎牛血清(fetal bovine serum, FBS)、双抗、Lyso-Tracker Red(溶酶体红色荧光探针)、Hoechst 33342 (Thermo Fisher公司)。
主要仪器 纳米粒度仪(英国Malvern公司, 型号NS-90);透射电镜(日本电子JEOL公司, 型号JEM-1400PLUS); 流式细胞仪(MECK公司, 型号Image StreamX Mark); 共聚焦显微镜(ZEISS公司, 型号LSM880);酶标仪(德国Berthold公司, 型号LB943)。
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, HucMSCs)的分离、培养及体外扩增 采用酶消化法[17, 18], 取新鲜健康新生儿近胎儿段脐带10 cm (脐带来自于广州医科大学附属第五医院足月产新生儿, 均经其父母授权同意), 放入加有0.1%双抗的PBS中; 将脐带切成相等长度的3段, 彻底洗净去除血液和血块; 用镊子剔去脐静脉和脐动脉, 剥出华氏胶组织, 剪碎至1 mm3大小, 放入离心管中; 加入0.2%胶原酶Ⅱ型, 在37 ℃下消化16~20 h, 加入含10% FBS的DMEM培养液终止消化; 随后以2 500 r·min-1离心5 min, 除去上清液, 在37 ℃下用0.1%胰蛋白酶消化30 min, 加入10% FBS的DMEM终止消化, 用100 μm的滤器过滤, 收集滤液, 以1 500 r·min-1离心10 min, 弃上清, 用PBS洗涤, 离心, 反复两次; 再用10% FBS的DMEM培养液重悬, 将细胞接种于T75培养瓶中, 在CO2培养箱中培养, 4天后换液, 在倒置显微镜下观察细胞的形态。待HucMSs长满达到80%~90%, 开始进行传代。
HucMSCs的表型鉴定 取第3代的HucMSCs, 采用0.125%胰酶处理, 加入FBS终止消化后, PBS洗涤两次, 1 200 r·min-1离心5 min, 弃去上清; PBS重悬细胞沉淀, 并将细胞平均分装到1.5 mL EP管中, 每管100 μL, 其中细胞数至少应达到每毫升1×106个; 分别加2 μL小鼠抗人荧光标记单抗CD29、CD31、CD34、CD44、CD45、CD73、CD90、CD105和CD166, 室温孵育30 min; 将混合液转移至流式管中, 采用1 mL PBS洗涤1次, 常温离心(1 200 r·min-1, 3 min), 再用100 μL PBS重悬, 加入4%多聚甲醛固定, 用流式细胞仪检测分析抗原标志的表达。
细胞膜蛋白的分离提取 使用细胞膜蛋白与细胞浆蛋白抽提试剂盒, 培养约2×107~5×107个细胞, 再按试剂盒中的试剂A、试剂B和PMSF提取细胞膜碎片, 用蛋白定量(BCA法)测量蛋白浓度, 放于-80 ℃冰箱。
siRNA序列的体外筛选 单基因套装siRNA (广州瑞博生物有限公司), 包含3对siTrim 28和通用阴性对照, 通过用Lipofectamine 3000进行转染实验; 按说明书分别用两种Lipofectamine 3000试剂1.875 μL和3.75 μL的量转染; 在37 ℃、5% CO2条件下转染48 h后, 提取mRNA, 再进行RT-PCR (real time-polymerase chain reaction)分析。
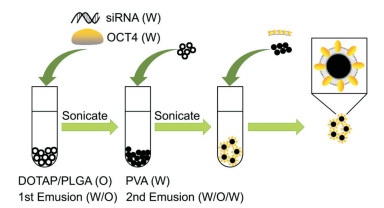
DOTAP修饰PLGA的纳米粒 通过溶剂蒸发法和水包油包水乳液法制备(图 1)如下:参考相关文献[19], DOTAP与PLGA的质量比为1:25, 将PLGA颗粒(100 mg)和DOTAP粉末(4 mg)溶于1 mL二氯甲烷中, 作为油相(O); OCT4蛋白和siRNA溶于300 μL无核酶水中, 作为水相(W)。将水相逐滴加入油相, 同时超声45 s, 功率60 W, 2 s开1 s关, 在冰上操作; 乳化后, 再将其逐滴加到7% (w/v)聚乙烯醇(PVA)水溶液中(3 mL), 同时超声1 min, 功率60 W, 2 s开1 s关, 在冰上操作; 将得到的双乳液加到1% (w/v) PVA水溶液(30 mL)中, 4 ℃下磁力搅拌(800 r·min-1) 3 h, 待二氯甲烷完全蒸发; 然后高速离心(80 000 r·min-1, 30 min, 4 ℃), 获得DOTAP/PLGA纳米粒, 再用无核酶水洗涤3次, 最后用1 mL无核酶水重悬, 或冻干保存于-20 ℃备用。
|
图 1 Schematic diagram of PLGA ball preparation. DOTAP: Dioleyl trimethylammonium propane; PLGA: Polylactic acid-glycolic acid copolymer; PVA: Polyvinyl alcohol |
人工外泌体的制备(biomimetic proteolipid vesicles-cloaked PLGA nanoparticles, Bio-PLVNP) 采用薄层蒸发(thin layer evaporation, TLE)方法制备, 将DPPC、DSPC、DOPC和胆固醇, 按照5:1:3:1摩尔比分别溶解在氯仿:甲醇混合液(3:1, v/v)中, 然后通过旋转蒸发器蒸发溶剂形成薄膜[20]。分别在DOTAP/PLGA纳米粒中加入不同比例分离的膜蛋白(脂质体:膜蛋白=100:1、200:1、300:1、400:1、500:1, m/m), 涡旋混匀, 加入到圆底烧瓶使膜水合, 组装成常规脂质体, 在45 ℃加热3个循环并涡旋, 每次3 min; 然后将脂质悬浮液在45 ℃下通过200 nm孔径的醋酸纤维素膜挤出10次, 获取的颗粒溶液储存于4 ℃备用。
考马斯亮蓝染色 将制备好的人工外泌体于10 000 r·min-1离心30 min, 变性处理后, 配制SDS-PAGE胶, 将处理好的膜蛋白和人工外泌体分别加入各加样孔, 其中一孔加入蛋白marker 6 μL。在Tris-甘氨酸缓冲液中, 以浓缩胶(80 V、30 min)和分离胶(100 V、2 h)电泳。再用考马斯亮蓝(50%甲醇、0.05%考马斯亮蓝、10%冰醋酸)染色30 min, 醋酸洗脱液(5%甲醇、7%醋酸)洗脱3次, 每次2 h。采用凝胶成像仪拍摄。
人工外泌体的激光透射粒径测试和透射电镜观察 采用纳米粒度仪, 在室温下测定人工外泌体的粒径、zeta电位及分散系数(polydispersity index, PDI)。用去离子水以1:9稀释样品, 以确保在低离子强度条件下准确测量表面电荷。稀释后, 纳米粒的终质量浓度为0.1 mg·mL-1。分别取样品10 μL滴到预先用碳膜包被好的铜网上, 静置3 min后将多余的液体用滤纸吸去, 再用3%醋酸双氧铀负染, 自然干澡后, 在透射显微镜下进行观察并拍照。
人工外泌体转染时间依赖性和溶酶体逃逸实验 检测在不同时间点人工外泌体的细胞摄入情况, 通过共聚焦进行定性分析和流式细胞术的定量分析来检测纳米材料的递送效果。
共聚焦观察 将HucMSCs接种在共聚焦小皿中, 每孔5×105个细胞, 含100 nmol·mL-1 cy3 (cyanine 3)标记10 μg·mL-1 siTrim28和FITC (fluorescein isothiocyanate)标记OCT4蛋白的人工外泌体转染细胞, 并用Opti-MEM培养基代替原培养基将细胞在pH 7.4下于37 ℃分别孵育1、3、6、9和12 h, 然后用冷PBS冲洗细胞两次, 室温下再用4%多聚甲醛甲醛固定15 min, PBS洗两次, DAPI (4', 6-diamidino-2-phenylindole)复染细胞核。共聚焦激光扫描显示纳米粒的细胞摄取情况。
流式细胞术分析 将HucMSCs接种到6孔板中, 每孔5×105个细胞, 在37 ℃、5% CO2下培养24 h, 用含100 nmol·mL-1 cy3-siTrim28和10 μg·mL-1 FITC-OCT4蛋白的人工外泌体转染细胞, 并用Opti-MEM培养基代替原培养基将细胞在pH 7.4下于37 ℃孵育6 h, 然后用冷PBS (pH 7.4)冲洗细胞两次, 消化, 冷PBS洗涤, 通过0.45 μm尼龙网过滤, 并使用流式细胞仪进行流式细胞术分析, 用IDEA软件分析结果。
溶酶体逃逸实验 将HucMSCs接种在共聚焦小皿中, 每孔5×105个细胞, 并在37 ℃, 5% CO2下孵育24 h, 用含100 nmol·mL-1 cy3-siTrim28和10 μg·mL-1 FITC-OCT4蛋白的人工外泌体进行细胞转染, 同时加入溶酶体示踪剂, 培养1、3、6和12 h后, 用PBS洗涤两次, 并在室温下用4%多聚甲醛固定15 min, PBS洗涤两次; 再根据供应商提供的方法用DAPI复染细胞核。通过共聚焦激光扫描显示纳米粒在不同时间点细胞亚细胞器的分布情况。
人工外泌体体外siRNA转入后的表达 实验设计分为6组: PBS组、纯材料组、Bio-PLVNP/OCT4组、Bio-PLVNP/siTrim28、Bio-PLVNP/OCT4/siTrim28和Liposomes/OCT4/siTrim28, siRNA用量为100 nmol·mL-1, OCT4为10 μg·mL-1。将细胞转染48 h后, 分别利用Western blot和RT-PCR评估Trim 28在基因和蛋白质水平表达情况。
统计学分析 每组实验重复3次以上, 所有数据用均数±标准差表示, 采用GraphPad Prism5统计软件分析, 两独立样本均数进行t检验, P < 0.05认为差异具有统计学意义。
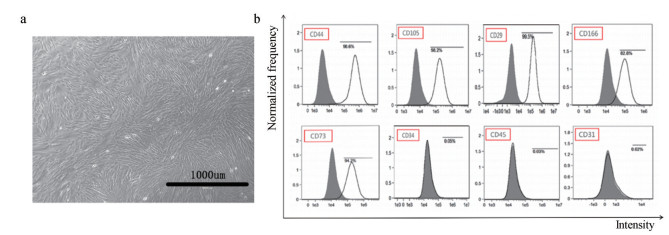
结果 1 分离的HucMSCs流式鉴定通过酶消化分离获得HucMSCs, 从图 2a中可见其形态呈梭状, 长到一定密度时, 整体呈涡旋式。培养到第三代再通过标记其表面蛋白进行鉴定, 从图 2b中可见, CD44、CD105、CD29、CD166和CD73呈阳性表达, CD34、CD45和CD31呈阴性表达, 说明成功分离得到HucMSCs, 可用于以下相关实验研究。
|
图 2 Human umbilical cord mesenchymal stem cells (HucMSCs) obtained by enzymatic digestion. a: Morphology of P3 HucMSCs; b: Identify the surface marker of HuCMSCs by flow cytometry |
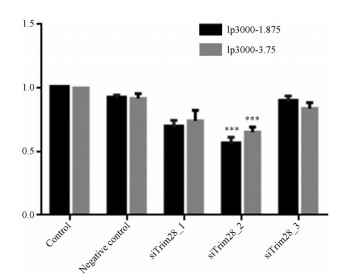
使用常规转染剂Lipofectamine 3000来筛选最有效的基因序列。在HucMSCs中加入不同siRNA序列与转染试剂混合液, 转染48 h后再荧光定量PCR分析, 进行3次重复实验, 每次3个复孔。由图 3显示, siTrim28_2使Trim28 mRNA有较好的敲低效果, siTrim28_2的序列为---CCATGTGTCAGGTGTGAAA---。
|
图 3 RT-PCR results for different tripartite motif containing 28 (siTrim28). n = 3, x± s. ***P < 0.01 vs control group. lp3000-1.875: Lipofectamine 3000 (1.875 μL); lp3000-3.75: Lipofectamine 3000 (3.75 μL) |
人工外泌体的粒径和分散系数结果(图 4)显示, 磷脂材料与膜蛋白的比例为400:1, 其平均粒径为111.187 nm, 分散系数为0.124, 说明此比例的稳定性很好。

|
图 4 Particle size, polydispersity index (PDI) of different phospholipid materials and membrane proteins |
由于人工外泌体的大小尺寸在基因治疗应用方面尤为重要, 为了更好的发挥其作用, 首先要考虑药物能否传递至目标细胞。关于基因治疗的转染载体研究表明, 其尺寸应该介于20~200 nm之间才能通过肿瘤组织的高通透性和滞留效应(EPR)。
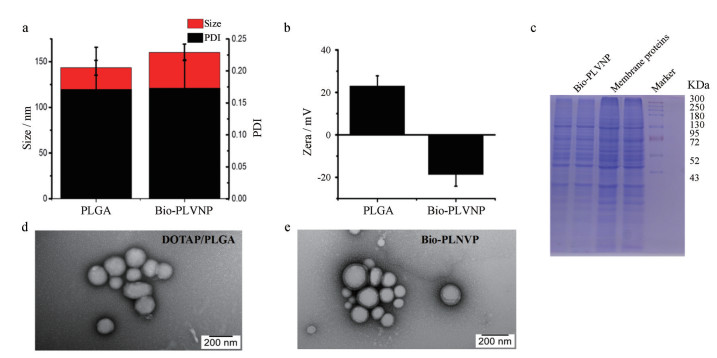
4.1 动态光散射检测结果通过使用动态光散射(dynamic light scattering, DLS)检测仿生膜涂覆的DOTAP/PLGA纳米粒的粒度和表面电荷来验证在表面上仿生膜是否成功涂覆。在粒径分布图(图 5a)中, PLGA纳米球平均粒径为125.41 nm, PDI为0.145, 包裹仿生膜后其粒径为156.13 nm, 增加了30 nm左右, PDI为0.184, 说明合成的人工外泌体分散性良好。从zeta电位结果(图 5b)可见, PLGA的电位值为23.43 ± 1.25 mV, 而包裹仿生膜后, 其电位值为-18.23 ± 0.57 mV, 进一步证明了PLGA成功被包裹。颗粒大小和zeta电位数据一致表明PLGA成功地用仿生膜涂覆。为了检测人工外泌体是否包裹上细胞膜蛋白, 将获得的人工外泌体离心, 取沉淀颗粒进行SDS-PAGE凝胶电泳, 用考马斯亮蓝染色(图 5c), 结果显示人工外泌体保留了细胞膜中的大部分蛋白质。
|
图 5 Characterization of PLGA and mimetic exosomes. a: Particle size and PDI of PLGA and mimetic exosomes; b: Zeta potential of PLGA and mimetic exosomes; c: Electrophoresis of DOTAP/PLGA; d, e: Electron micrograph of mimetic exosomes. Bio-PLNVP: Biomimetic proteolipid vesicles-cloaked PLGA nanoparticles |
通过透射电子显微镜观察人工外泌体的形态(图 5d、e)可见, 在聚合物核心上形成独特的DOTAP/PLGA纳米粒和单层膜涂层, 即由DOTAP/PLGA纳米粒作为内核, 仿生膜结构作为壳, 与其粒径与DLS测量结果非常接近, 进一步证明人工外泌体成功包被了膜蛋白。
5 人工外泌体转染时间依赖性和溶酶体逃逸实验有效核酸和蛋白介导的基因治疗的两个先决条件是药物的高细胞摄取和药物成功释放到细胞质中。为了研究人工外泌体的细胞摄取, 检测了两种不同药物负载体系在HucMSCs的内化情况。在有义链(Cy3-siRNA)的5'-末端用Cy3染料(激发/发射波长: 550/615 nm)标记Trim28 siRNA, 在蛋白交联上FITC染料(488/525 nm)标记OCT4蛋白。选用HucMSCs作为目的细胞, 将荧光标记的人工外泌体与HucMSCs在血清存在下分别孵育1、3、6和12 h来确定共孵育(给药)时间, 由细胞摄入共聚焦实验结果(图 6a)可见, 随着共培养时间增加至6 h, 各组荧光强度明显增加。这取决于人工外泌体系随着时间推移逐渐在细胞内积累, 更多的siRNA和蛋白释放到细胞内。采用细胞摄入流式细胞术方法, 进一步定量分析细胞的摄入量, 结果显示, 当人工外泌体与HucMSCs共培养6 h后, 双阳性达到了90% (图 6b)。
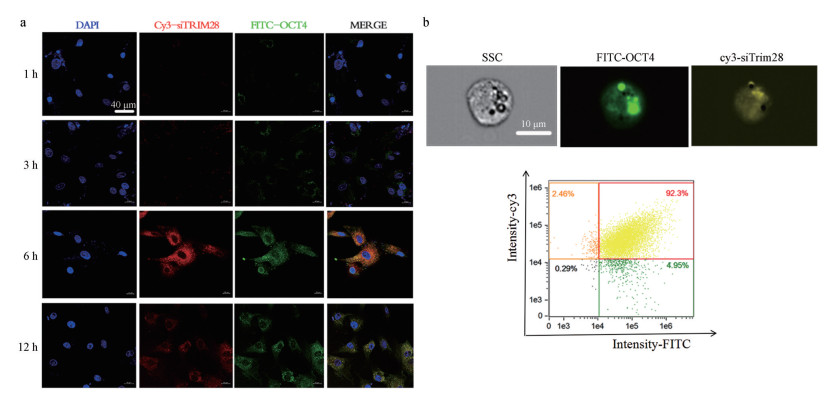
|
图 6 Cellular uptake of mimetic exosomes. a: CLSM analysis of mimetic exosomes over different incubation times; b: Flow cytometry results of HucMSCs co-cultured with Bio-PLNVP for 6 h. Excitation/emission: 488 nm/525 nm (FITC-OCT4); 550 nm/615 nm (Cy3-siRNA); 358 nm/461 nm (DAPI), CLSM: Confocal laser scanning microscope; SSC: Side scatter |
为了研究人工外泌体的溶酶体逃逸, 用LysoTracker染色HucMSCs并使用共聚焦荧光图像监测细胞, 红色(Cy3-siRNA)、绿色(FITC-OCT4)和蓝色(LysoTracker)荧光共定位于HucMSCs中(图 7), 在分别孵育1 h和3 h后通过共定位发现人工外泌体进入到溶酶体中; 在孵育6 h后, 红色(Cy5-siRNA)、绿色(FITC-OCT4)和蓝色(LysoTracker)荧光分离, 表明人工外泌体(Bio-PLVNP/OCT4/siTrim28)可以从溶酶体逃逸到细胞质中, 这可能是DOTAP的“质子海绵效应”, 从而能从溶酶体逃逸。
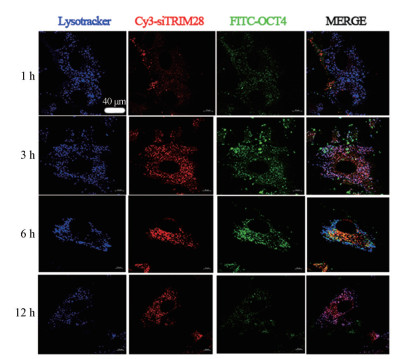
|
图 7 Bio-PLVNP/OCT4/siTrim28 lysosomal escape in HucMSCs. HucMSCs were incubated with Bio-PLVNP/OCT4/siTrim28 for 1, 3, 6 and 12 h, respectively, and were analyzed by CLSM. Excitation/emission: 488 nm/525 nm (FITC-OCT4); 550 nm/615 nm (Cy3-siRNA); 358 nm/461 nm (lysotracke) |
考察人工外泌体载入siRNA对目的基因的沉默效果情况, 结果如图 8a、b所示, Bio-PLVNP/siTrim28、Bio-PLVNP/OCT4/siTrim28组与其他组相比, 能有效地沉默Trim28蛋白质的表达, 沉默率达50%。说明合成的人工外泌体可以有效地降低HucMSCs中Trim28 mRNA和蛋白质表达水平, 达到抑制基因表达的效果。
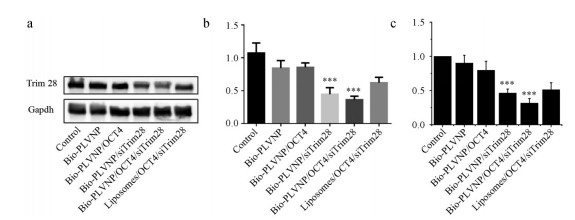
|
图 8 Expression levels of Trim28 were repeated three times by Western blot. a: Strip chart of related groups; b: A gray scale statistic analyzed by Image J; c: RT-qPCR analyzed results of Trim28. n = 3, x± s. ***P < 0.01 vs Control group |
通过RT-PCR考察Trim28 mRNA的表达情况, 结果见图 8c, 与阴性对照组(PBS)相比, Bio-PLVNP/OCT4/siTrim28组与HucMSCs共培养48 h后, Trim28 mRNA的表达水平降低约70%左右, 说明人工外泌体的siRNA成功转入细胞并发挥功效。
讨论随着仿生学的进展, 材料的生物启发设计, 已经促使开发新颖的策略, 以赋予纳米和微粒具有必要的多种生物功能。仿生学是有效纳米粒设计方法, 利用自然发生的策略, 如用细胞原始蛋白质修饰纳米粒以解决复杂的问题, 赋予材料更多生物功能[21]。目前, 张良方团队[22]已成功将来自癌细胞、干细胞、红细胞和血小板的细胞膜被用于改造纳米粒并赋予它们类似细胞的功能。这种仿生功能化策略利用细胞与其环境相互作用的固有能力, 赋予传统纳米载体增强的生物黏附能力。纳米粒表面复制了细胞膜的表面抗原多样性, 使得纳米粒具有同源靶向性。
本研究采用自上而下的合成方法, 使用带正电荷的DOTAP形成反胶束修饰PLGA球, 因为DOTAP可以与带负电荷的siRNA相互作用, 从而确保siRNA在水核内的有效包封, 最外层的仿生膜(DPPC、DOPC、DSPC、胆固醇和膜蛋白)的存在和PLGA的高刚性可以导致增强的细胞摄取, 并初步探索了人工外泌体能有效将核酸和蛋白递送到细胞中并发挥作用。这种将仿生膜修饰在纳米粒表面, 制备具有仿生性能的人工外泌体结构复制了特定细胞表面抗原多样性, 赋予其同源靶向能力, 使其在特定细胞中释放药物。同时, 这种结构改善了纳米粒的表面性能, 增强其稳定性。本研究为人工外泌体的进一步开发应用提供依据。
| [1] |
Mitragotri S, Burke PA, Langer R. Overcoming the challenges in administering biopharmaceuticals:formulation and delivery strategies[J]. Nat Rev Drug Discov, 2014, 13: 655-672. DOI:10.1038/nrd4363 |
| [2] |
Kamly N, Fredman G, Subramanian M, et al. Development and in vivo efficacy of targeted polymeric inflammation-resolving nanoparticles[J]. Proc Natl Acad Sci, 2013, 110: 6506-6511. DOI:10.1073/pnas.1303377110 |
| [3] |
Luk BT, Zhang L. Cell membrane-camouflaged nanoparticles for drug delivery[J]. J Control Release, 2015, 220: 600-607. DOI:10.1016/j.jconrel.2015.07.019 |
| [4] |
Ibrahim AG, Cheng K, Marbán E. Exosomes as critical agents of cardiac regeneration triggered by cell therapy[J]. Stem Cell Rep, 2014, 2: 606-619. DOI:10.1016/j.stemcr.2014.04.006 |
| [5] |
Hu CJ, Fang RH, Wang K, et al. Nanoparticle biointerfacing by platelet membrane cloaking[J]. Nature, 2015, 526: 118-121. DOI:10.1038/nature15373 |
| [6] |
Chen XL, Zhou Y, Liang X, et al. In vitro study of black phosphorus quantum dot-loaded liposomes for photothermal therapy of cervical cancer[J]. Acta Pharm Sin (药学学报), 2019, 54: 729-736. |
| [7] |
Ju SW, Mu JY, Dokland T, et al. Grape exosome-like nanoparticles induce intestinal stem cells and protect mice from DSS-induced colitis[J]. Mol Ther, 2013, 21: 1345-1357. DOI:10.1038/mt.2013.64 |
| [8] |
Lunavat TR, Jang SC, Nilsson L, et al. RNAi delivery by exosome-mimetic nanovesicles-implications for targeting c-Myc in cancer[J]. Biomaterials, 2016, 102: 231-238. DOI:10.1016/j.biomaterials.2016.06.024 |
| [9] |
Lee SH, Mok H, Lee YH, et al. Self-assembled siRNA-PLGA conjugate micelles for gene silencing[J]. J Control Release, 2011, 152: 152-158. DOI:10.1016/j.jconrel.2010.12.007 |
| [10] |
Vlassov AV, Magdaleno S, Setterquist R, et al. Exosomes:current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials[J]. Biochim Biophys Acta, 2012, 1820: 940-948. DOI:10.1016/j.bbagen.2012.03.017 |
| [11] |
Clotilde T, Laurencel Z, Sebastian A. Exosomes:composition, biogenesis and function[J]. Nat Rev Immunol, 2002, 2: 569-579. DOI:10.1038/nri855 |
| [12] |
Clotilde T. Exosomes:secreted vesicles and intercellular communications[J]. Biol Rep, 2011, 3: 1-8. |
| [13] |
Mathivanan S, Ji H, Simpson RJ. Exosomes:extracellular organelles important in intercellular communication[J]. J Proteomics, 2010, 3: 1907-1920. |
| [14] |
Raposo G, Stoorvogel W. Extracellular vesicles:exosomes, microvesicles, and friends[J]. J Cell Biol, 2013, 200: 373-383. DOI:10.1083/jcb.201211138 |
| [15] |
Schneider A, Simons M. Exosomes:vesicular carriers for intercellular communication in neurodegenerative disorders[J]. Cell Tissue Res, 2013, 352: 33-47. DOI:10.1007/s00441-012-1428-2 |
| [16] |
Lai RC, Chen TS, Lim SK. Mesenchymal stem cell exosome:a novel stem cell-based therapy for cardiovascular disease[J]. Regen Med, 2011, 6: 481-492. DOI:10.2217/rme.11.35 |
| [17] |
Lu LL, Liu YJ, Yang SG, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica, 2006, 91: 1017-1026. |
| [18] |
Han Y, Tao R, Sun T, et al. Optimization of human umbilical cord mesenchymal stem cell isolation and culture methods[J]. Cytotechnology, 2013, 65: 819-827. DOI:10.1007/s10616-012-9528-0 |
| [19] |
Jensen DK, Jensen LB, Koocheki S, et al. Design of an inhalable dry powder formulation of DOTAP-modified PLGA nanoparticles loaded with siRNA[J]. J Control Release, 2012, 157: 141-148. DOI:10.1016/j.jconrel.2011.08.011 |
| [20] |
Molinaro R, Corbo C, Martinez JO, et al. Biomimetic proteolipid vesicles for targeting inflamed tissues[J]. Nat Mater, 2016, 15: 1037-1046. DOI:10.1038/nmat4644 |
| [21] |
Luo L, Tang J, Nishi K, et al. Fabrication of synthetic mesenchymal stem cells for the treatment of acute myocardial infarction in mice[J]. Circul Res, 2017, 120: 1768-1775. DOI:10.1161/CIRCRESAHA.116.310374 |
| [22] |
Luk BT, Zhang L. Cell membrane-camouflaged nanoparticles for drug delivery[J]. J Control Release, 2015, 220: 600-607. DOI:10.1016/j.jconrel.2015.07.019 |
 2020, Vol. 55
2020, Vol. 55


