2. 广东药科大学广东省生物活性药物研究重点实验室, 广东 广州 510006;
3. 广东药科大学药学院, 广东 广州 510006;
4. 广东药科大学中药学院, 广东 广州 510006;
5. 广东药科大学医学信息工程学院, 广东 广州 510006
2. Key Laboratory of Bioactive Drugs Research in Guangdong Province, Guangdong Pharmaceutical University, Guangzhou 510006, China;
3. School of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China;
4. School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China;
5. College of Medical Information Engineering, Guangdong Pharmaceutical University, Guangzhou 510006, China
2型糖尿病(T2DM)是常见的代谢性综合征, 它是由于胰岛β细胞不能产生足够的胰岛素或机体不能有效利用胰岛素而引起的[1]。现如今T2DM的发病率逐年上升, 据统计很多国家2.5%~15%的医疗开支是由T2DM引起的[1]。目前口服降糖西药有很多, 但会产生低血糖、肠胃不适等诸多不良反应。因此, 从疗效稳定、不良反应小的中药或天然产物中寻找治疗疾病的方法将越来越受关注。
中药黄芪[Astragalus membranaceus (Fisch.) Bge.]与山药(Dioscorea opposita Thunb.)是中医药学中“甘温补气”和“健脾养阴”的要药, 是中医临床上治疗T2DM疗效突出且使用频次较高的补益药。著名中医药学家施今墨将黄芪山药组成药对治疗糖尿病[2], 他认为黄芪甘温, 补气升阳, 善补脾阳, 山药甘平, 补脾养肺, 养阴生津, 善补脾阴, 两药伍用, 一阳一阴, 阴阳相合, 相互促进, 相互转化, 共收健脾胃, 消除尿糖之功[3]。大量文献研究也发现黄芪山药作为药对配伍使用, 高频率的出现在临床治疗T2DM的中药复方或中成药中, 其临床疗效已被广大中医学者认可。耿淼等[4]对黄芪山药配伍治疗MLD-STZ诱导T2DM进行了实验研究, 证实黄芪山药配伍能有效防治糖尿病。同时本课题组前期实验也发现黄芪-山药药对能有效降低T2DM大鼠的血糖及血脂, 与文献研究结果相同[5]。目前, 有关中药的作用机制研究主要还是以化学药物的方法为基础, 忽视了中药的整体疗效, 故建立一种适合中药的研究方法很有必要。
代谢组学通过检测生物样品中的小分子代谢物来反映机体在疾病或药物干预下代谢网络的变化[6], 可从整体角度对生物体进行综合分析, 这种分析方法符合中医的“整体观念”。本研究使用1H NMR代谢组学方法, 研究了高脂饲料联合STZ诱导的T2DM大鼠经黄芪-山药药对治疗后尿液代谢物的变化, 为揭示黄芪-山药药对对T2DM的治疗机制奠定基础。
材料与方法实验动物、试剂及仪器 SPF级雄性SD大鼠37只(320 g ± 20 g), 购自广东省医学实验动物中心, 许可证号: SCXK (粤) 2018-0002, 饲养于广东药科大学动物实验中心(温度25 ℃ ± 2 ℃, 湿度50% ± 5%), 12 h交替照明, 自由饮食饮水。实验方案经广东药科大学伦理委员会批准, 批号为SPF2017087。
黄芪(批号: 20171203)、山药(批号: 18Z0401)购自采芝林药业有限公司, 由广东药科大学中药学院马鸿雁副教授分别鉴定为豆科植物蒙古黄芪[Astragalus membranaceus (Fisch.) Bge. var. monglholicus (Bge.) Hsiao]的干燥根、薯蓣科植物薯蓣[Dioscorea opposita Thunb.]的干燥根茎。二甲双胍片(批号: ABB3937)购自Merck公司。链脲佐菌素(STZ) (批号: 181015)购自Sigma公司; 罗氏血糖仪(罗氏公司); 高脂饲料(猪油18%, 蔗糖20%, 蛋黄3%, 基础饲料59%, 委托广东省医学实验动物中心加工, 许可证号SCXK (粤) 2018-0002);重水(D2O)和5 mm核磁管(青岛腾龙微波科技有限公司); 500 MHz Bruker AVANCE Ⅲ NMR仪(Bruker公司)。
黄芪山药水煎液的制备 取黄芪和山药各45 g, 置于1 L圆底烧瓶中, 用600 mL蒸馏水浸泡0.5 h后加热回流2 h, 过滤, 滤残用如上方法煎煮、过滤, 随后将滤液混合并置于旋转蒸发仪中浓缩至3.0 g·mL-1。
糖尿病大鼠模型制备、分组及给药 将所有大鼠随机分为两组:对照组(C组=7只), T2DM组=30只。C组正常饲料喂养, T2DM组高脂饲料喂养4周。4周后, 所有大鼠禁食不禁水12 h, T2DM组腹腔注射新鲜配制的STZ柠檬酸钠混悬液(35 mg·kg-1), 同时C组大鼠注射相同体积的柠檬酸盐缓冲液。在STZ注射后的第3、6天, 测量T2DM大鼠空腹8 h血糖(FBG), FBG≥16.7则被视为T2DM大鼠[7]。T2DM组中共有25只大鼠FBG达标, 成功率为83.33%。将FBG达标的25只大鼠随机分为3组:模型组(M组=8只), 黄芪山药组(HS组=8只)和二甲双胍组(Y组=9只)。
HS组大鼠灌胃黄芪-山药药对提取液(6.3 g·kg-1); Y组大鼠灌胃二甲双胍(200 mg·kg-1); C组和M组给予相同体积的蒸馏水, 实验持续8周。
生化指标检测 给药8周后, 于末次给药2 h后腹主动脉取血, 收集大鼠全血及血清(4 ℃、3 000 r·min-1离心15 min, 取上清液), 按照相关试剂盒步骤, 使用全自动生化分析仪测定TC、TG、H-DLC、L-DLC及BUN水平, 使用高效液相色谱检测HbA1c含量。
大鼠肾脏系数 大鼠处死后, 快速取出其肾脏置于PBS溶液中, 除去周围组织并称重, 计算肾脏系数= (大鼠双侧肾脏总重量/大鼠体重)×100%。
尿液样本的采集和1H NMR检测 给药8周后, 将大鼠置于代谢笼中禁食不禁水, 收集大鼠24 h尿液, 4 ℃、12 000 r·min-1, 离心10 min, 将上清液置于2 mL的EP管中并在-80 ℃保存直至进一步分析。
在1H NMR分析之前, 室温解冻尿液样本, 离心去除沉淀后, 取尿液300 μL、150 μL磷酸盐缓冲液(PBS, 0.2 mol·L-1, pH 7.0)及D2O 80 μL于核磁管中。用500-MHz AVANCE Ⅲ核磁共振波谱仪记录尿液样品的1H NMR谱。采集过程中使用预饱和的NOESYPR1D脉冲序列压制水峰, 参数设置:温度为298 K, 光谱宽度为10 kHz, 采样点为64 000, 叠加128次[8]。
数据处理与分析 FID信号经过傅里叶变换为NMR图谱, 然后导入MestReNova9.0.1软件[8]。随后对所有谱图进行手动相位矫正、基线矫正和谱峰对齐, 以TSP (δ=0.00)为对照峰对所有谱图进行定标, 此时谱图中大部分物质对齐效果较好, 但还是有小部分物质无法对齐, 此时, 对这些没有对齐的物质重新定标, 然后再把新的数据更新调整, 以保证谱峰对齐效果。在δ 0.5~9.5 ppm区域按δ 0.002 ppm等间隔分段积分, 为消除水峰的影响, 将4.67~5.22 ppm区间的积分值设置为0[9]。所有数据归一化处理后导入SIMCA-P 13.0软件中进行主成分分析(PCA)及偏最小二乘判别分析(PLS-DA), 使用200次置换检验对PLS-DA模型进行外部验证, 判断其有效性(R2和Q2值低于原始值)。PLS-DA分析中, VIP > 1的值被认为是潜在差异代谢物。本研究中对VIP > 1的代谢物采用组间独立样品t检验, P < 0.05的代谢物被选为两组间的差异代谢物[10]。
代谢通路分析 筛选出的差异代谢物输入到MetaboAnalyst数据库中进行通路分析和富集分析。Impact值是根据路径拓扑分析计算出的路径影响值[11], P < 0.01且impact值> 0.1被认为是与T2DM发生最相关的通路。
相关性分析 为了进一步探讨差异代谢物与生化指标之间的潜在关系, 使用SPSS 22.0对实验所得的16种差异代谢物和7个生化指标进行了Pearson相关性分析。*P < 0.05表明数据差异具有统计学意义, **P < 0.01代表数据具有极显著差异。
结果 1 生化指标及肾脏系数分析由表 1可见, 血红蛋白与葡萄糖结合产生HbA1c, 与C组比较, M组大鼠HbA1c值明显增加, 说明其血中葡萄糖含量较高, M组中FBG的含量(P < 0.01)也证明这一点。而HS组中HbA1c、FBG水平明显降低(P < 0.01), 说明黄芪-山药药对具有较好的降糖作用。与C组比较, M组大鼠TC、TG、L-DLC含量明显升高(P < 0.01), H-DLC含量明显下降(P < 0.01)。在经黄芪-山药药对治疗后, 上述指标均显著回调(P < 0.05, P < 0.01)。这些脂质相关指标含量异常说明模型大鼠脂代谢紊乱, 黄芪-山药药对治疗后可以显著降低T2DM大鼠的血脂水平。BUN是反映肾功能的重要标志, M组大鼠BUN含量显著增加, 提示模型大鼠肾功能出现损伤, 其显著增加的肾脏系数值(P < 0.05)也说明了这一点, 黄芪山药治疗可以一定程度地改善模型大鼠肾脏功能, 保护T2DM大鼠肾脏的代偿性增生。
| 表 1 The biochemical parameters and kidney index of C (Control), M (Model), HS (Huangqi Shanyao) and Y (Metformin). x±s. *P < 0.05, **P < 0.01 vs C; #P < 0.05, ##P < 0.01 vs M |
图 1为4组大鼠尿液的1H NMR谱。通过查阅大量文献以及HMDB数据库比对, 共鉴定出37种内源性代谢物。由于个体差异, 难以用肉眼直接观察到各组大鼠尿液代谢物的变化, 故本文使用模式识别法选出与T2DM及黄芪山药治疗有关的标志性代谢物。
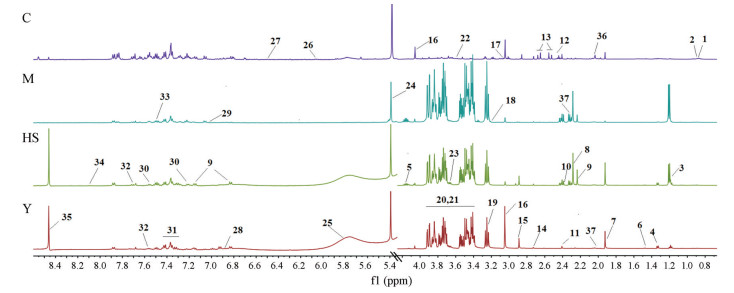
|
Figure 1 1H NMR spectra of urine obtained from rats of the C, M, HS and Y group. 1: Isoleucine; 2: Leucine; 3: 3-Hydroxybutyrate; 4: Lactate; 5: Threonine; 6: Alanine; 7: Acetate; 8: Acetoacetate; 9: P-cresol; 10: Pyruvate; 11: Succinate; 12: Glutamine; 13: Citrate; 14: Dimethylamine; 15: Trimethylamine; 16: Creatinine; 17: Malonate; 18: Choline; 19: Taurine; 20: α-Glucose; 21: β-Glucose; 22: Glycine; 23: Inositol; 24: Allantoin; 25: Urea; 26: Inosine; 27: Fumarate; 28: Tyrosine; 29: Histidine; 30: Xanthurenate; 31: Phenylalanine; 32: Hippuratre; 33: Benozate; 34: Hypoxanthine; 35: Formate; 36: N-Acetyl-β-D-glucosaminidase; 37: Glutamate |
图 2B2~D2是PLS-DA的200次置换检验结果(R2、Q2均低于原始值且Q2回归线在Y轴上的截距 < 0), 说明本研究建立的模型没有过拟合, 模型有效。图 2A1为4组大鼠尿液的PCA得分图, 发现M组及C组(蓝色和黄色)大鼠主要分布于t1轴平面的左右两侧, HS组及Y组则位于二组之间, 但分离趋势不明显。PLS-DA能按照预先定义的分类最大化组间的差异, 获得比PCA更好的分离效果, 图 2A2是4组大鼠尿液的PLS-DA得分图, 图中可以更清晰的看出4组的分离趋势, 说明T2DM大鼠在经过二甲双胍及黄芪-山药药对治疗后, 体内代谢物紊乱得以改善。
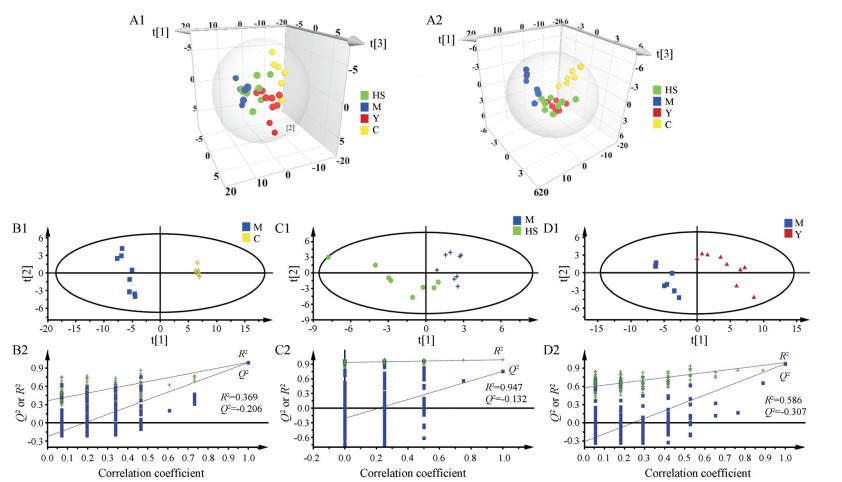
|
Figure 2 Multivariate analyses of urine 1H NMR spectra. A1: PCA scores plot (R2X=90.3%); A2: PLS-DA scores plot (R2X=75.1%, R2Y=64.4%, Q2=51.6%); B1: PLS-DA score plot for C/M group (R2X=76.6%, R2Y=99.5%, Q2=99%); C1: PLS-DA score plot for M/HS group (R2X=87.6%, R2Y=99.4%, Q2=75.6%); D1: PLS-DA score plot for M/Y group (R2X=78.4%, R2Y=99.1%, Q2=96.9%). B2-D2: Permutation test plots (200 permutations) for urine extracts |
为了进一步说明黄芪-山药药对对T2DM大鼠的影响, 本研究使用PLS-DA分析各组大鼠的尿液样本。VIP > 1的值被认为是潜在差异代谢物。本研究中对VIP > 1的代谢物采用组间独立样品t检验, P < 0.05的代谢物被选为两组间的差异代谢物。模型组中共筛选出20个差异代谢物(表 2), 黄芪-山药药对治疗后可在一定程度上逆转M组中16个代谢物的变化(含量变化见图 3), 结果均具统计学意义, 提示黄芪-山药药对T2DM有一定的治疗作用。
| 表 2 Statistical analysis results of the main metabolites in urine |
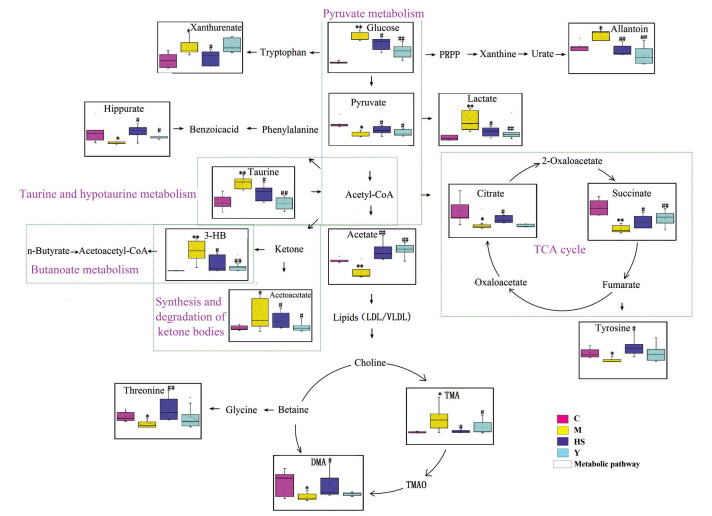
|
Figure 3 Schematic diagram of the metabolic pathways. *P < 0.05, **P < 0.01 vs C. #P < 0.05, ##P < 0.01 vs M |
使用MetaboAnalyst数据库对上述16个差异代谢物进行路径分析。图 4中, 气泡的大小及颜色与每条通路的影响值及P值大小有关[11]。P < 0.05且impact值> 0.1的代谢通路被认为与黄芪-山药药对治疗T2DM最相关的通路, 结果共发现5条重要相关通路。提示这些通路可能成为黄芪-山药药对治疗T2DM的靶向通路。
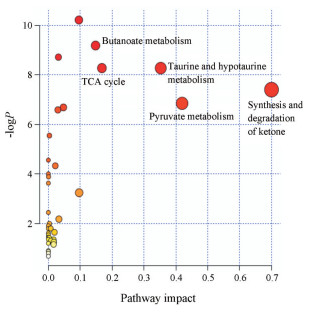
|
Figure 4 Pathway topology analysis |
通过查阅KEGG数据库及大量文献, 本研究建立了生物标志物和代谢通路之间的代谢网络图。从图 3中可以清楚地看出T2DM大鼠体内代谢物已经发生了紊乱。然而黄芪-山药药对治疗后, 相应的代谢物水平已经恢复到正常, 表明黄芪-山药药对在一定程度上可以改善T2DM大鼠体内的代谢紊乱。
5 模型大鼠尿液差异代谢物与生化指标的相关性将上述16个黄芪山药发挥治疗T2DM作用的差异代谢物与生化指标进行Pearson相关性分析, 结果见图 5。由图可知FBG与3-羟基丁酸呈负相关(r= -0.82, P < 0.05); TC与乙酸呈正相关(r= 0.9, P < 0.01); TG与乳酸呈正相关(r= 0.84, P < 0.05)、与葡萄糖(r= -0.86, P < 0.05), 酪氨酸(r= -0.94, P < 0.01), 苏氨酸(r= -0.87, P < 0.05)呈负相关; L-DLC与黄尿酸呈负相关(r= -0.86, P < 0.05); BUN与马尿酸呈正相关(r= 0.95, P < 0.05)。
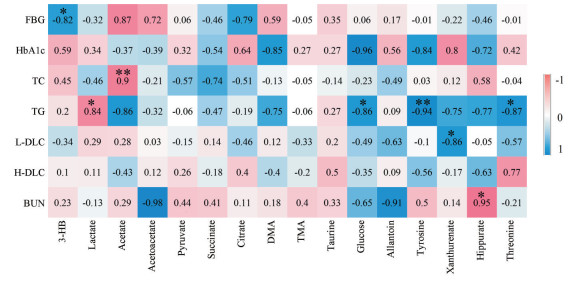
|
Figure 5 Pearson correlation analysis of 16 biomarkers and 7 biochemical markers (*P < 0.05, **P < 0.01) |
在过去的10年中, 代谢组学已经取得了显著的进展, 为许多代谢性疾病(如T2DM、肥胖症和癌症)的发病机制研究提供了帮助。在上百年的实践中, 中医药治疗T2DM的疗效已得到肯定。本课题前期研究证实[12]黄芪-山药药对能有效降低T2DM大鼠的血糖, 增强T2DM大鼠的抗氧化作用, 但其降糖机制需要进一步探究。因此, 本研究采用代谢组学的方法, 寻找黄芪-山药药对治疗T2DM的生物标志物, 为探索其治疗T2DM的作用机制奠定基础。
T2DM的发生与生物体内糖代谢紊乱密切相关, 近年来, 有研究发现线粒体功能障碍是T2DM发生的新机制[13, 14]。线粒体功能受损, 氧化磷酸化不彻底, 导致TCA循环相关的代谢产物丙酮酸、柠檬酸和琥珀酸含量减少。此时糖酵解的无氧氧化会增强, 使得尿液、血液和脑脊液中乳酸异常积累。此外, 乳酸含量异常还与糖异生有关, 糖异生主要发生在肝肾中, 根据本实验肾脏系数及BUN检测结果提示模型大鼠肾脏可能出现一定程度的损伤, 肾脏中的乳酸代谢转化出现障碍, 乳酸含量增加。本研究结果显示模型组大鼠体内丙酮酸、柠檬酸及琥珀酸含量明显下降, 乳酸含量明显上升。黄芪山药治疗后可逆转上述代谢物的改变, 同时也可以显著性降低BUN值及肾脏系数。提示黄芪-山药药对可调节大鼠糖代谢紊乱且对线粒体功能及肾脏功能具有一定的调节作用。乙酸是糖酵解中间产物之一。本研究结果发现模型组大鼠尿中乙酸含量明显减少, 此结果与Duggan等[15]报道结果一致, 但与Serkova等[16]研究结果相反。希望可以通过进一步完善研究, 检测乙酸在T2DM大鼠体内含量的准确变化, 解决目前对于乙酸这些相互矛盾的实验结果。
酮体(3-羟基丁酸和乙酰乙酸)是肝脏中脂肪酸代谢的中间产物[17], T2DM会致使生物体内血糖过高, 脂肪动员增加, 大量脂肪酸转化为酮体, 导致体内酮体含量增加。本实验结果显示M组大鼠尿液中3-羟基丁酸及乙酰乙酸含量显著增加, 而这两个代谢物在黄芪山药组中有明显的下降趋势, 提示黄芪-山药药对可能通过调节酮体的合成与降解途径治疗T2DM。本研究还发现丁酸代谢途径中包含了4个标志代谢物(琥珀酸、丙酮酸、3-羟基丁酸、乙酰乙酸)。由于丁酸代谢途径位于脂质、碳水化合物和氨基酸代谢途径之间, 故该途径中这几个差异代谢物的含量变化可能受到其他几条代谢通路失调的影响。
T2DM会导致机体对葡萄糖的利用不足, 使蛋白质分解能力增强, 生糖氨基酸通过糖异生途径生成葡萄糖为机体提供能量[18]。这与本实验研究结果一致, 模型大鼠尿液中生糖氨基酸(酪氨酸、苏氨酸)含量显著下降, 黄芪山药干预后其含量显著回调, 提示黄芪-山药药对可通过调节糖尿病大鼠氨基酸代谢而起到治疗糖尿病的作用。在牛磺酸和亚牛磺酸代谢途径中, 磺基乙酰在一系列酶的作用下转化成乙酰辅酶A和乙酸乙酯[19]。现代研究还发现牛磺酸可通过糖异生起到降糖作用。本研究中模型大鼠尿液中牛磺酸含量明显升高, 可能是因为牛磺酸排泄增加导致其含量在体内相对不足。黄芪山药治疗后牛磺酸排泄量明显减少, 提示黄芪-山药药对可能通过牛磺酸和亚牛磺酸代谢途径对T2DM的发生发展起一定的控制作用。据报道, 马尿酸是大鼠肾毒性的早期生物标记物[20]。在本研究中, 模型组大鼠尿液中马尿酸含量降低, 这与HgCl2所致大鼠肾毒性的结果一致[20], 说明模型大鼠的肾功能出现了一定程度的损伤。此外, 经黄芪山药治疗后, 马尿酸含量的回调表明黄芪-山药药对对糖尿病大鼠肾功能有一定的保护作用。
在嘌呤代谢中, 黄嘌呤氧化酶(XO)可将黄嘌呤转化为尿酸[21], 同时产生活性氧簇(ROS), 尿酸被ROS进一步氧化成尿囊素, 因此尿囊素也被认为是人类氧化应激的候选生物标志物。在本实验中, 模型大鼠尿囊素含量升高, 而黄芪山药组尿囊素含量显著回调, 说明黄芪-山药药对可以通过抑制黄嘌呤氧化酶通路以减轻T2DM大鼠体内氧化应激反应。二甲胺(DMA)含量的变化可以反映肾脏损伤情况。本研究中模型组大鼠尿液中DMA的含量显著性降低, 说明大鼠肾脏可能出现一定程度的损伤, 黄芪山药治疗后, DMA含量回调, 提示其对肾脏具有一定的保护作用。三甲胺(TMA)是通过肠道微生物对胆碱的作用而产生的, 其含量升高可说明机体肠道功能发生紊乱。本实验结果显示模型组大鼠TMA含量升高, 黄芪山药可降低TMA的含量, 说明黄芪-山药药对可调节大鼠肠道微生物功能紊乱, 降低血糖。色氨酸经过犬尿酸代谢通路生成黄尿酸, 据报道糖尿病患者尿液中黄尿酸的排泄量增加[22], 黄尿酸可与胰岛素结合从而降低胰岛素的生物学效应, 导致患者出现高血糖状态。本实验研究结果证实了上述观点, 黄芪山药干预后黄尿酸含量显著降低, 提示黄芪-山药药对可通过抑制犬尿酸代谢通路以减少黄尿酸生成, 从而对糖尿病大鼠起到治疗作用。
葡萄糖、乙酸、乳酸是糖酵解或糖异生通路中的代谢物, 3-羟基丁酸是酮体代谢过程的代谢物, 酪氨酸、苏氨酸、马尿酸是氨基酸代谢相关的代谢物, 这些代谢物的相对含量与血糖血脂等生化指标存在一定的相关性, 说明通过代谢组学所筛选出的差异代谢物具有一定的生物学意义。FBG是糖尿病最常用的检测指标, 糖尿病会导致糖代谢发生障碍, 使得脂肪酸氧化作用增强, 酮体(3-羟基丁酸)产生增多, 这与作者的代谢组学结果一致; 相关性分析中, FBG与3-羟基丁酸具有强烈相关性也证实了这一点。酪氨酸和苏氨酸可以通过糖异生途径生成葡萄糖, 随后参与体内的糖脂代谢, 其与TG的显著相关性也说明了本实验代谢组学的结果可靠。临床上常将BUN作为判断肾小球滤过功能的标志, 本研究发现其与马尿酸有显著的相关性; 马尿酸是肾毒性的生物标记物, 二者之间的相关性说明了大鼠肾脏可能出现一定程度的损伤。TC、TG及LDL是临床上常用的脂代谢指标, 其含量异常说明T2DM大鼠脂代谢存在一定程度的紊乱, 而脂代谢与糖代谢关联紧密, 常并行发生, 代谢组学检测结果显示糖代谢中间产物(葡萄糖、乙酸、乳酸)的含量异常, 也说明T2DM大鼠体内糖代谢紊乱, 这些脂质相关生化指标与糖代谢中间产物的相关性说明利用代谢组学寻找代谢标志物从而探讨药物疗效方法的可行及可靠性。
本研究通过1H NMR代谢组学的方法, 对T2DM大鼠的尿液进行检测分析, 结果显示模型大鼠体内20种代谢物含量出现异常, 黄芪山药干预后可回调16种代谢物的紊乱, 说明黄芪-山药药对对T2DM具有较好的治疗作用, 这可能与其可以调节能量代谢(三羧酸循环通路和丙酮酸代谢)、酮体的合成与降解、牛磺酸和亚牛磺酸代谢以及丁酸代谢的紊乱有关。同时, 本研究从药效学和代谢组学相结合的层面阐明黄芪-山药药对经体内直接作用指标的变化规律, 为深入探讨药对干预T2DM模型的作用机制奠定基础。
| [1] |
Guariguata L, Whiting DR, Hambleton I, et al. Global estimates of diabetes prevalence for 2013 and projections for 2035[J]. Diabetes Res Clin Pract, 2014, 103: 137-149. DOI:10.1016/j.diabres.2013.11.002 |
| [2] |
Pang B. Research on the Inheritance of Jinmo Shi School's Academic Thoughts and Experience in the Diagnosis and Treatment of Diabetes (施今墨学派名老中医诊治糖尿病学术思想与经验传承研究) [D]. Beijing: Beijing University of Chinese Medicine, 2012.
|
| [3] |
Chen C. Study on the Core TCM for Treating Type 2 Diabetes Mellitus Based on Complex Network Structure and the Rules of Medication. (基于复杂网络的2型糖尿病中医核心用药挖掘及其机制研究) [D]. Beijing: Beijing University of Chinese Medicine, 2018.
|
| [4] |
Geng M, Chen HY, Tong ZQ, et al. Research of combination therapy with Huangqi and Shanyao on MLP-STZ induced diabetic mice[J]. J Reg Anat Oper Surg (局解手术学杂志), 2012, 21: 465-469. |
| [5] |
Zhang R, Li K, Li AP, et al. 1H NMR-based metabolomics analysis of the anti-fatigue effects of Astragali Radix based on muscle tissue Pubescentis[J]. Acta Pharm Sin (药学学报), 2018, 53: 782-790. |
| [6] |
Chen RQ, Liao CB, Guo Q, et al. Combined systems pharmacology and fecal metabonomics to study the biomarkers and therapeutic mechanism of type 2 diabetic nephropathy treated with Astragalus and leech[J]. RSC Adv, 2018, 8: 27448-27463. DOI:10.1039/C8RA04358B |
| [7] |
Liao CB, Wu LR, Chen RQ, et al. Urine metabonomics study of different times of type 2 diabetic nephropathy based on 1H NMR[J]. J Guangdong Pharm Univ (广东药科大学学报), 2017, 33: 541-546. |
| [8] |
Chen RQ, Wang J, Liao CB, et al. 1H NMR studies on serum metabonomic changes over time in a kidney-Yang deficiency syndrome model[J]. RSC Adv, 2017, 10: 1039-1044. |
| [9] |
Wei D, Wang JS, Wang PR, et al. Toxic effects of chronic low-dose exposure of thioacetamide on rats based on NMR metabolic profiling[J]. J Pharm Biomed Anal, 2014, 98: 334-338. DOI:10.1016/j.jpba.2014.05.035 |
| [10] |
Tian JS, Zhao L, Shen XL, et al. 1H NMR-based metabolomics approach to investigating the renal protective effects of Genipin in diabetic rats[J]. Chin J Nat Med, 2018, 16: 261-270. |
| [11] |
Zhang R, Li K, Li AP, et al. 1H NMR-based metabolomics analysis of the anti-fatigue effects of Astragali Radix based on muscle tissue Pubescentis[J]. Acta Pharm Sin (药学学报), 2018, 53: 782-790. |
| [12] |
Wu LR, Liu WB, Ye YJ, et al. Experimental research of the drug pair of Astragalus and Chinese Yam on hypoglycemic and antioxidant[J]. Res Pract Chin Med (现代中药研究与实践), 2018, 32: 23-26. |
| [13] |
Guan MM, Xie LY, Diao CF, et al. Systemic perturbations of key metabolites in diabetic rats during the evolution of diabetes studied by urine metabonomics[J]. PLoS One, 2013, 8: e60409. DOI:10.1371/journal.pone.0060409 |
| [14] |
Jia Y, Zhao SJ, Qin XM, et al. Hypoglycemic effect of tartarian buckwheat water extracts in diabetic rats by metabolomics approach[J]. Acta Nutr Sin (营养学报), 2017, 39: 177-182. |
| [15] |
Duggan GE, Hittel DS, Sensen CW, et al. Metabolomic response to exercise training in lean and diet-induced obese mice[J]. J Appl Physiol, 2011, 110: 1311-1318. DOI:10.1152/japplphysiol.00701.2010 |
| [16] |
Serkova NJ, Jackman M, Brown JL, et al. Metabolic profiling of livers and blood from obese Zucker rats[J]. J Hepatol, 2006, 44: 956-962. DOI:10.1016/j.jhep.2005.07.009 |
| [17] |
Filla LA, Yuan W, Feldman EL, et al. Global metabolomic and isobaric tagging capillary liquid chromatography-tandem mass spectrometry approaches for uncovering pathway dysfunction in diabetic mouse aorta[J]. J Proteome Res, 2014, 13: 6121-6134. DOI:10.1021/pr501030e |
| [18] |
Adeva MM, Calvino J, South G, et al. Insulin resistance and the metabolism of branched chain amino acids in humans[J]. Amino Acids, 2012, 43: 171-181. DOI:10.1007/s00726-011-1088-7 |
| [19] |
Adermark L, Jonsson S, Söderpalm B, et al. Regionspecific depression of striatal activity in wistar rat by modest ethanol consumption over a ten-month period[J]. Alcohol, 2013, 47: 289-298. DOI:10.1016/j.alcohol.2013.03.003 |
| [20] |
Tian JS, Zhao L, Shen XL, et al. 1H NMR-based metabolomics approach to investigating the renal protective effects of Genipin in diabetic rats[J]. Chin J Nat Med, 2018, 16: 261-270. |
| [21] |
Zhang ZJ, Ma H, Dong JY. Application of 1H NMR metabolomics in the monitoring of characteristic metabolites in type 2 diabetes mellitus[J]. Chin J Geriatr (中国老年学杂志), 2018, 38: 810-812. |
| [22] |
PI ZF, Men LH, Zang J, et al. Serumal metabonomic study on mechanism of Schisandra chinensis in rat diabetic nephropathy[J]. Anal Chem (分析化学), 2015, 43: 169-175. |
 2020, Vol. 55
2020, Vol. 55


