2. 山西大学化学化工学院, 山西 太原 030006;
3. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Science and Peking Union Medical College, Beijing 100050, China
中国是世界上老年人口数量最多的国家, 且老龄化程度日益加深, 给社会造成了沉重的负担。如何延长寿命, 并提高老年人的生活质量, 是当前研究的热点。
细胞衰老由Hayflick & Moorhead于1961年首次提出, 最初用来描述衰老的成纤维细胞在适宜的生长条件下丧失复制能力, 进入永久的生长周期停滞状态[1], 分为增殖衰老和早熟衰老两种类型。除此之外, 细胞的另一个典型特征是分泌SASP。SASP由Coppe等[2]于2008年首次提出, 是衰老细胞分泌的细胞因子的总称, 可通过自分泌和旁分泌途径诱发机体炎症, 并向邻近细胞传递衰老信号, 通过组织微环境和ROS介导的途径, 加剧端粒功能障碍, 加速细胞衰老[3]。
1.2 SASP的组成根据细胞种类, 以及引起细胞衰老的刺激方式不同, 细胞可分泌不同类型的SASP。基于启动SASP活性的作用方式不同[4], 可将SASP分为3种类型: ①受体需要型:促炎因子:白介素-1α (interleukin-1α, IL-1α)、白介素-1β (interleukin-1β, IL-1β)、白介素-6 (interleukin-6, IL-6)、白介素-8 (interleukin-8, IL-8)等, 趋化因子-1 (chemokine-1, CXCL-1)、趋化因子-3 (chemokine-3, CXCL-3)、趋化因子-10 (chemokine-10, CXCL-10)等, 生长因子:肝细胞生长因子(hepatocyte growth factor, HGF)、转化生长因子-β (transforming growth factor-β, TGF-β)、粒细胞巨噬细胞集落刺激因子(granulocytemacrophage colony stimulating factor, GM-CSF)等; ②直接反应型:金属蛋白酶(matrix metalloproteinases, MMPs)、丝氨酸蛋白酶、活性氧(reactive oxygen species, ROS)、代谢物、转运离子等; ③调节型:金属蛋白酶的组织抑制剂(tissue inhibitors of metalloproteinases, TIMPs)、纤溶酶原激活物抑制剂(plasminogen activator inhibitor, PAIs)和胰岛素样生长因子结合蛋白(insulin-like growth factor-binding proteins, IGFBPs)等。此外, 小的胞外囊泡(small extracellular vesicles, sEVs)及其miRNA可作为SASP的新成员[5], 被称为“EV-SASP”, 在细胞状态改变或受到外界刺激时产生并分泌, 以类似于激素或细胞因子的方式, 参与细胞间通讯, 并维持衰老细胞的抗凋亡活性[6]。
1.3 SASP的生理作用SASP是一柄双刃剑[7], 在正常细胞中能正向调节免疫反应、细胞生长抑制或细胞分化; 而在人类恶性肿瘤中, 能促进肿瘤迁移、增殖、侵袭和血管生成, 最终导致肿瘤转移。事实上, SASP的促炎作用是机体正常修复反应的一部分, 能保护人体免受细菌和病毒感染及有害环境因素的影响[8], 具有激活免疫系统、促进伤口愈合[9]、促进胚胎发育等重要作用, 因而在进化中被保留下来; 但是, 随着年龄增长, 在机体免疫功能下降、自噬失调、端粒缺失等多种因素影响下[10], 衰老细胞在体内大量积累, 导致炎症因子水平增加, 促进疾病发生[11]。因此, 衰老细胞分泌的SASP是机体衰老的重要指标, 也是多种年龄相关疾病的诱发因素[12]。
2 衰老过程中SASP的变化随着年龄增长, 多种刺激导致DNA损伤不断积累[13], 造成DNA过度损伤, 不仅会破坏端粒, 还会导致持续的DNA损伤反应(DNA damage response, DDR), 进而引起衰老[14]。在细胞衰老进程中, SASP的分泌是一个动态过程, 可分为以下三个阶段:第一阶段在DNA损伤后立即开始, 并持续36 h, 但不足以导致衰老; 第二阶段是“早期”SASP的形成, 在诱发细胞衰老后数天, 开始出现最重要的SASP因子, 例如IL-1α; 第三阶段是“成熟”SASP的形成, 在接下来的4~10天内, 通过正反馈回路对转录进行调控, 使大多数因子的分泌增加, 最终形成“成熟”的SASP[15]。
在多种衰老模型中, 如: SAMP8快速老化小鼠[16]、D-半乳糖诱导的衰老大鼠[17]、衰老果蝇、衰老线虫[18]、百草枯诱导的衰老星形胶质细胞[19]、自然衰老的胎盘细胞[20]、MDM2抑制剂诱导人成纤维细胞衰老模型[21], 均表现出SASP因子大量分泌, 主要是IL-1α、IL-1β、IL-6和肿瘤坏死因子-α (tumornecrosisfactor-α, TNF-α)等, 其中IL-1α是其他SASP的上游调节因子。
在正常细胞中, SASP基因通常被高度抑制, 以防止炎症信号的不恰当表达, 然而在衰老细胞中, SASP基因却高度表达。事实上, SASP的表达进程很慢, 在DNA损伤诱导的衰老成纤维细胞中需要一周时间才能达到峰值。SASP基因的延迟表达, 有助于免疫系统及时清除衰老细胞[22], 并进行DNA损伤修复[23]。与此同时, 衰老细胞通过分泌SASP因子向邻近细胞传递衰老信号, 分泌到周围环境中的SASP, 通过阻断细胞的分化, 阻止受损细胞的更新, 干扰组织的年轻化, 进一步加速衰老[24]。
3 SASP调节途径DDR是SASP的重要驱动因素, 它的启动依赖于两种主要激酶系统(ataxia-telangiectasia mutated, ATM和ataxia-telangiectasia and Rad3 related, ATR)的激活[25]。双链DNA断裂是DDR的强效活化剂, 能促进ATM激酶在DNA损伤位点聚集, 使组蛋白H2AX磷酸化, 最终激活ATM。ATM能磷酸化多种亚基, 包括两种必需的激酶:检查点激酶1 (checkpoint kinase 1, CHK1)和检查点激酶2 (checkpoint kinase 2, CHK2), 并能磷酸化P53, 激活P53通路, 引起细胞生长周期停滞和SASP分泌[26]。NF-κB对SASP的转录至关重要, 在细胞衰老或DNA损伤刺激时, NF-κB易位至细胞核, 与几个启动子共同作用结合SASP基因, 对其进行转录调节, 是SASP的“主要调节器”[27], 如图 1所示。SASP存在高度异质性, 主要受到以下三种途径的调节:表观基因修饰、转录水平和转录后水平[28]。
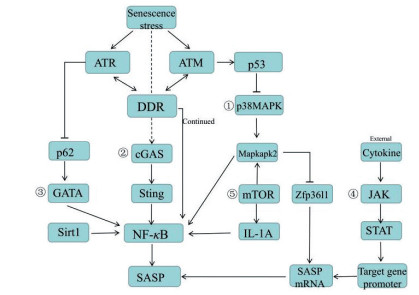
|
Figure 1 Several ways to regulate SASP. NF-κB is the "main regulator" of SASP. ①-⑤ respectively represent the p38MAPK/NF-κB pathway, the cGAs-STING pathway, the GATA pathway, the JAK/STAT pathway, and the mTOR pathway. The size of the font indicates the importance |
表观遗传变化是新发现的分子标志物, 可预测健康状况。表观基因组的改变能影响表观遗传, 从而影响衰老进程。表观遗传修饰包括多种类型, 这里主要从非编码RNA调控、DNA甲基化、蛋白质共价修饰三个方面进行论述[29]。
3.1.1 非编码RNA非编码RNA (non-coding RNA, ncRNA)包括微RNA (microRNA, miRNA)、长链非编码RNA (long non- coding RNA, lncRNA)[30]和环状RNA (circular RNA, circRNA)。ncRNA通过与蛋白质和DNA相互作用, 在转录、转录后和翻译后水平调节SASP基因的表达, 以达到对SASP的高度精确控制[31]。长链ncRNA在整个染色体水平发挥顺式调节作用, 而短链RNA主要在基因组水平对基因表达进行调控。
miRNA是SASP的主要内容, 它们表达为发夹结构, 通过多个步骤转化为单链RNA, 并被整合到RNA诱导的沉默复合物中, 识别并结合靶mRNA上的互补基因。在衰老进程中, miRNA显著上调, 可显著改变细胞的表型特征。作为衰老相关的潜在指标, 对于极长寿的个体, miRNA表达变化较少, 证明操纵miRNA可以控制SASP, 用于治疗老年病。例如miR-146a/b通过作用于IRAK1 mRNA (IL-1α信号通路的关键因子), 抑制SASP因子IL-6和IL-8的分泌, 从而负反馈抑制SASP的过度分泌; miR-17能调控年轻间充质干细胞(mesenchymal stem cells, MSC)分泌生长分化因子6 (Growth differentiation factor 6, Gdf6)[32], 从而减少IL-6、IL-1β和CCL-5等SASP因子水平, 表明上调Gdf6能抑制慢性炎症, 进而延缓衰老[33]。
3.1.2 DNA甲基化多聚腺苷二磷酸核糖聚合酶1 (poly (ADP-ribose) polymerase-1, PARP-1)通过调节DNA甲基转移酶(DNA methyltransferase, DNMT)和组蛋白修饰酶的活性和定位, 从而影响染色质结构。PARP-1能抑制DNMT启动子活性, 从而保证抑癌基因(P53和PTEN)的正常表达。例如褪黑色素通过调节PARP-1, 抑制衰老细胞中SASP基因IL-6、IL-8、MMP-3和趋化因子配体20 (chemokine ligand 20, CCL20)的表达[34]。
3.1.3 组蛋白共价修饰新合成的组蛋白需经过翻译后修饰才具备一定的活性, 即组蛋白的共价修饰, 主要包括组蛋白乙酰化和甲基化反应。组蛋白修饰可通过影响转录因子与启动子的亲和性进行基因调控。其中, 乙酰化反应与基因的活化相关, 可调控基因转录和细胞分裂周期, 而甲基化反应可激活或抑制转录。
3.1.3.1 组蛋白乙酰化组蛋白去乙酰化酶(Sirt1)是一种NAD+依赖性脱乙酰酶, 可在细胞核和细胞质之间不断穿梭[35]。Sirt1能调节多种应激调节因子, 包括NF-κB、p53、缺氧诱导因子-1α (hypoxia-inducible factor-1α, HIF-1α)和叉头盒转录因子(forkhead box O, FOXO); 同时也能维持基因组和染色质的稳定性, 参与DNA损伤的信号传递和修复[36]。衰老进程中, Sirt1显著下调, 使得启动子区域的组蛋白H3 (K9)和H4 (K16)乙酰化增加, 导致IL-6和IL-8大量分泌[37]。
3.1.3.2 组蛋白甲基化组蛋白去甲基化酶(Jumonji domain-containing protein 3, JMJD3)是一种抑制性的表观遗传标记, 通过对组蛋白H3 (demethylates lysine 27 on histone H3, H3K27me3)去甲基化, 调控免疫激活和损伤修复反应(包括再生和细胞衰老)。JMJD3过表达能刺激SASP因子IL-6、IL-8、单核细胞趋化蛋白1 (monocyte chemoattractant protein 1, MCP-1)和蛋白酶MMP-10、MMP-13、TIMP-1、TIMP-2和TIMP-4的分泌[38]。
细胞衰老后, 抑制性标志H3K9me2在IL-6和IL-8的启动子处减少, 可能是由于ATM依赖性DDR信号通路的激活, 使组蛋白甲基转移酶G9a降解, 导致SASP因子分泌增加所致[39]。
3.2 转录水平 3.2.1 p38MAPK/NF-κB通路—DNA损伤独立调节器细胞受到非常严重的刺激后, 能引起衰老反应, 激活DDR, 而DDR的持续激活是SASP因子(如IL-6和IL-8)表达的必要条件。然而, DDR是在损伤后立即发生的, 而SASP的产生通常需要数日的时间, 这一过程需要P38丝裂原激活的蛋白激酶(P38 mitogen-activated protein kinase, p38MAPK)通路的参与。在DNA损伤后, p38MAPK通路被慢性激活, 通过增加NF-κB的转录活性诱导SASP的分泌, 上调IL-2、IL-4、IL-6、IL-8和TNF-α等细胞因子的表达[40], 这一过程是独立于DDR的。此外, P53可通过抑制p38MAPK通路抑制SASP, 避免SASP对组织微环境的损伤[41]。
3.2.2 cGAs-STING通路cGAs (cGMP-AMP synthase)是DNA传感器, 位于非分裂细胞的细胞质中, 能激活先天免疫反应, 并导致细胞衰老。cGAs的缺失加速小鼠胚胎成纤维细胞自发永生化, 并消除自然衰老和DNA损伤剂诱导产生的SASP[42]。DNA损伤导致少量的DNA进入细胞质, 而衰老细胞中DNA酶(DNase2和TREX1)表达下调[43], 使细胞质染色质片段积累并异常激活cGAs。活化的cGAs产生第二信使环二核苷酸(cGAMP), 与干扰素基因刺激蛋白(stimulator of interferon genes, STING)结合, 促进STING与TANK结合激酶1(TANK-binding kinase 1, TBK1)和IκB激酶的聚集, 从而分别激活干扰素调节因子3 (interferon regulatory factor 23, IRF3)和NF-κB, 导致I型干扰素和IL-6、IL-8、IL-1β、MMP12等SASP因子的产生[44]。
3.2.3 GATA通路GATA4是新的衰老调节途径, 通过NF-κB调节SASP, 进而调节衰老[45]。在这个途径中, DDR是衰老进程的发起者, 激活两个关键激酶ATM和ATR, 抑制自噬衔接子P62 (选择性自噬GATA4), 导致GATA4积累, 随后通过肿瘤坏死因子受体相关因子相互作用蛋白2 (tumor necrosis factor receptor-associated factor interacting protein 2, TRAF3IP2)和IL-1A激活NF-κB, 促进IL-6、IL-8、CXCL-1、GM-CSF等多种SASP因子的分泌, 诱导细胞衰老[46]。
3.2.4 JAK/STAT通路JAK/STAT (Janus kinase/signal transducer and activator of transcription)途径在衰老细胞中高度激活, 是调节细胞因子产生的主要途径之一[47]。JAK/STAT途径通过配体(例如生长因子、干扰素或白细胞介素)与特异性跨膜受体的结合来激活JAK, 从而将信号转移至级联的细胞质部位。在细胞质中, 活化的JAK募集失活的STAT蛋白, 随后磷酸化STAT蛋白结构中的酪氨酸残基, 通过其SH2结构域与其他STATs形成稳定的二聚体STAT蛋白。STATs既是信号转导因子也是转录因子, 二聚化的STAT易位到核中, 能够在几分钟内激活非活性基因的转录[48]。例如: JAK2/STAT3途径, 能上调SASP因子, 主要是免疫抑制因子的表达, 如CXCL-1/CXCL-2、GM-CSF、IL-10和IL-13;在TNF-α诱导的衰老中, 能激活依赖STAT1/3的自分泌环, 通过正反馈机制上调细胞因子IL-8、IL-6、IL-1α、IL-1β、IL-32和趋化因子CXCL-1、CXCL-2、CXCL-5、CXCL-6、CXCL-10、CXCL-11、CCL2、CCL5、CCL20的表达[49]; 在老龄小鼠中, 给予JAK1/2抑制剂能显著抑制IL-6、IL-8、CXCL-1、MCP-1、MMP3等多种SASP的mRNA水平, 减轻脂肪组织和全身的炎症[50]。
3.3 转录后水平 3.3.1 mTOR通路mTOR通过促进SASP上游调节器IL-1A的转录, 以旁分泌和自分泌的方式触发炎症转录因子NF-κB和C/EBP-β的转录, 分泌IL-6和IL-8等SASP因子。此外, mTOR能激活p38MAPK的下游MAPK激活的蛋白激酶2 (MAPK-activated protein kinase 2, MAPKAPK2)的转录, 抑制RNA结合蛋白ZFP36L, 阻止其降解编码SASP因子的mRNA, 从而稳定许多SASP因子的mRNA水平[51]。
3.3.2 miR‐335/COX‐2/PTEN通路在衰老的癌症细胞和正常的成纤维细胞中, miR‐335显著上调。PTEN是miR‐335的靶标, 也是PI3-K/Akt信号通路的负调节因子。miR-335通过对PTEN的转录后调节, 下调其表达, 从而增加IL-6、MCP-1和MMP-2等促炎SASP的分泌。同时, 也观察到环氧化酶-2 (cyclooxygenase 2, COX-2)和前列腺素E2 (prostaglandin E2, PGE2)分泌增加, 且COX-2抑制剂塞来昔布能减少miR-335的表达, 恢复PTEN的表达。因此, miR‐335/ COX‐2/PTEN是调节SASP的一种新途径[52]。
4 调节SASP药物 4.1 雷帕霉素雷帕霉素是哺乳动物雷帕霉素靶蛋白(mammalian target rapamycin, mTOR)抑制剂, 通过抑制mTOR通路, 减少SASP的分泌, 从而调节体内炎症反应, 延缓细胞衰老[53], 治疗老年性相关疾病。雷帕霉素延缓衰老的机制一方面与通过增加衰老细胞中Nrf2基因, 激活细胞自噬途径, 调节细胞周期停滞有关[54]; 另一方面, 可通过抑制STAT3途径, 并选择性抑制IL-1A的翻译, 减少IL-1、IL-6、IL-8、MMP-3、MMP-13、TNF-α等SASP基因的表达。
4.2 白藜芦醇白藜芦醇是天然的植物抗毒素, 具有良好的保健价值和抗衰老功能。白藜芦醇通过Sirt1/NF-κB通路调节MRC5成纤维细胞衰老相关特征, 并减少大量SASP相关细胞因子的分泌[55]。NF-κB家族的转录因子, 包括Rel (RelA/p65)和NF-κB (p50), 它们在细胞质中彼此二聚化, 与IκB蛋白结合后以失活的状态保留在细胞质中[56], 其中RelA/p65的乙酰化是NF-κB激活的标志。白藜芦醇通过上调Sirt1降低RelA/p65和p-IκBα的mRNA水平, 从而抑制NF-κB的活性并减少多种SASP的表达, 如IL-1α、IL-1β、IL-6、IL-8和TGF-β; 基质金属蛋白酶MMP3和MMP2;胰岛素生长因子IGF-1R、TGFβ-R2和趋化因子受体4 (chemokine receptor 4, CXCR4)[57]。
4.3 人参皂苷F1人参皂苷F1能抑制星形胶质细胞的SASP, 治疗衰老相关脑部疾病。星形胶质细胞是中枢神经系统稳态、防御和再生的基础, 而阿尔茨海默症患者脑组织中存在衰老的星形胶质细胞, 且SASP因子的高度表达, 导致大脑功能下降。人参皂苷F1通过减少星形胶质细胞中p38MAPK的激活, 降低NF-κB活性, 从而减少IL-6、IL-8、MCP-1等SASP因子的分泌[58]。
4.4 阿达木单抗阿达木单抗(adalimumab)是一种针对TNF-α的单克隆抗体, 能改善免疫系统的炎症反应, 调节细胞衰老, 并使SASP的促肿瘤发生和促转移行为减少; 此外, 还能抑制神经炎症, 改善阿尔兹海默症患者的认知功能障碍[59]。阿达木单抗通过诱导衰老细胞的表观遗传修饰miR-146a-5p和miR-126-3p, 降低IL-6、IL-1β等SASP因子的表达; 同时能降低NF-κB活性, 减少TNF-α和IL-6等细胞因子的产生[60]。
4.5 达沙替尼加槲皮素衰老细胞常出现线粒体功能障碍, 使衰老细胞的促存活途径(senescent cell anti-apoptotic pathways, SCAP)上调, 其自身分泌的促凋亡SASP对自己无效, 从而长期保持在衰老状态。Senolytic是杀死衰老细胞药物的总称, 通过干扰衰老细胞的SCAP途径激活细胞凋亡[61], 从而选择性地消除衰老细胞, 延缓衰老。达沙替尼是一种senolytic药物, 其与槲皮素的鸡尾酒混合物, 经小鼠口服后能选择性清除自然衰老小鼠中的衰老细胞, 而不损害健康细胞[62], 从根源上抑制了SASP的分泌, 从而改善了自然衰老小鼠的生理功能, 有效延缓衰老。
5 总结随着年龄的增长, 机体衰老细胞的自凋亡行为逐渐减少, 造成衰老细胞大量积累, 同时衰老细胞能持续分泌SASP, 破坏组织稳态, 显著促进衰老。细胞衰老是老年人组织老化的基础, SASP在衰老细胞的生理活动中具有重要作用[63], 一方面其促炎作用能保护机体免受细菌病毒的侵害, 并能促进伤口愈合、促进免疫系统及时清除衰老细胞等有益作用; 另一方面也能通过自分泌和旁分泌途径向周围细胞传递衰老信号, 加速机体衰老, 导致衰老相关疾病的发生。因此, 对SASP进行适当的调节, 对于延长寿命、治疗衰老相关疾病、提高老年人的晚年生活质量具有重要意义。
虽然目前已有很多SASP相关的研究, 且对SASP调节途径的研究不断丰富, 但每条通路、每个分子的微小变化都息息相关, 休戚与共。因此, 了解SASP通路、分子之间的内在联系, 以及SASP影响衰老及衰老相关疾病的具体机制, 仍需要研究者进行大量的探索。
| [1] |
Young AR, Narita M. SASP reflects senescence[J]. EMBO Rep, 2009, 10: 228-230. DOI:10.1038/embor.2009.22 |
| [2] |
Coppe JP, Patil CK, Rodier F, et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor[J]. PLoS Biol, 2008, 6: 2853-2868. |
| [3] |
Jurk D, Wilson C, Passos JF, et al. Chronic inflammation induces telomere dysfunction and accelerates ageing in mice[J]. Nat Commun, 2014, 2: 4172-4186. |
| [4] |
Byun HO, Lee YK, Kim JM, et al. From cell senescence to age-related diseases: differential mechanisms of action of senescence-associated secretory phenotypes[J]. BMB Rep, 2015, 48: 549-558. DOI:10.5483/BMBRep.2015.48.10.122 |
| [5] |
Kadota T, Fujita Y, Yoshioka Y, et al. Emerging role of extracellular vesicles as a senescence-associated secretory phenotype: insights into the pathophysiology of lung diseases[J]. Mol Aspects Med, 2017, 60: 92-103. |
| [6] |
Terlecki-Zaniewicz L, Lämmermann I, Latreille J, et al. Small extracellular vesicles and their miRNA cargo are anti-apoptotic members of the senescence-associated secretory phenotype[J]. Aging, 2018, 10: 1103-1132. DOI:10.18632/aging.101452 |
| [7] |
Soto-Gamez A, Demaria M. Therapeutic interventions for aging: the case of cellular senescence[J]. Drug Discov Today, 2017, 22: 786-795. DOI:10.1016/j.drudis.2017.01.004 |
| [8] |
Rea IM, Gibson DS, McGilligan V, et al. Age and age-related diseases: role of inflammation triggers and cytokines[J]. Front Immunol, 2018, 9: 586-614. DOI:10.3389/fimmu.2018.00586 |
| [9] |
Hou J, Kim S. Possible role of ginsenoside Rb1 in skin wound healing via regulating senescent skin dermal fibroblast[J]. Biochem Biophys Res Commun, 2018, 499: 381-388. DOI:10.1016/j.bbrc.2018.03.170 |
| [10] |
Loaiza N, Demaria M. Cellular senescence and tumor promotion: is aging the key?[J]. Biochim Biophys Acta, 2016, 1865: 155-167. |
| [11] |
He S, Sharpless NE. Senescence in health and disease[J]. Cell, 2017, 169: 1000-1011. DOI:10.1016/j.cell.2017.05.015 |
| [12] |
Campisi J. Cellular senescence: putting the paradoxes in perspective[J]. Curr Opin Genet Dev, 2011, 21: 107-112. DOI:10.1016/j.gde.2010.10.005 |
| [13] |
Ritschka B, Storer M, Mas A. The senescence-associated secretory phenotype induces cellular plasticity and tissue regeneration[J]. Genes Dev, 2017, 31: 172-183. DOI:10.1101/gad.290635.116 |
| [14] |
Watanabe S, Kawamoto S, Ohtani N, et al. Impact of senescence-associated secretory phenotype and its potential as a therapeutic target for senescence-associated diseases[J]. Cancer Sci, 2017, 108: 563-569. DOI:10.1111/cas.13184 |
| [15] |
Borodkina AV, Deryabin PI, Giukova АА, et al. "Social life" of senescent cells: what is SASP and why study it?[J]. Acta Nat, 2018, 10: 4-14. |
| [16] |
Yamamoto K, Kushida M, Tsuduki T. The effect of dietary lipid on gut microbiota in a senescence-accelerated prone mouse model (SAMP8)[J]. Biogerontology, 2018, 19: 367-383. DOI:10.1007/s10522-018-9764-6 |
| [17] |
Dehghani A, Hafizibarjin Z, Najjari R, et al. Resveratrol and 1, 25-dihydroxyvitamin D co-administration protects the heart against D-galactose-induced aging in rats: evaluation of serum and cardiac levels of klotho[J]. Aging Clin Exp Res, 2019, 31: 1195-1205. DOI:10.1007/s40520-018-1075-x |
| [18] |
Gao AW, Uit de Bos J, Sterken MG, et al. Forward and reverse genetics approaches to uncover metabolic aging pathways in Caenorhabditis elegans[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1864: 2697-2706. |
| [19] |
Chinta SJ, Woods G, Demaria M, et al. Cellular senescence is induced by the environmental neurotoxin paraquat and contributes to neuropathology linked to Parkinson's disease cell reports[J]. Cell Rep, 2018, 22: 930-940. DOI:10.1016/j.celrep.2017.12.092 |
| [20] |
Menon R, Behnia F, Polettini J, et al. Placental membrane aging and HMGB1 signaling associated with human parturition[J]. Aging, 2016, 8: 216-230. DOI:10.18632/aging.100891 |
| [21] |
Wiley CD, Schaum N, Alimirah F, et al. Small-molecule MDM2 antagonists attenuate the senescence-associated secretory phenotype[J]. Sci Rep, 2018, 8: 2410-2419. DOI:10.1038/s41598-018-20000-4 |
| [22] |
Chinta SJ, Woods G, Rane A, et al. Cellular senescence and the aging brain[J]. Exp Gerontol, 2015, 68: 3-7. DOI:10.1016/j.exger.2014.09.018 |
| [23] |
Ito Y, Hoare M, Narita M. Spatial and temporal control of senescence[J]. Trends Cell Biol, 2017, 27: 820-832. DOI:10.1016/j.tcb.2017.07.004 |
| [24] |
de Keizer PL. The fountain of youth by targeting senescent cells?[J]. Trends Mol Med, 2017, 23: 6-17. DOI:10.1016/j.molmed.2016.11.006 |
| [25] |
Shi Q, Shen LY, Dong B, et al. The identification of the ATR inhibitor VE-822 as a therapeutic strategy for enhancing cisplatin chemosensitivity in esophageal squamous cell carcinoma[J]. Cancer Lett, 2018, 432: 56-68. DOI:10.1016/j.canlet.2018.06.010 |
| [26] |
Weber AM, Ryan AJ. ATM and ATR as therapeutic targets in cancer[J]. Pharmacol Ther, 2015, 149: 124-138. DOI:10.1016/j.pharmthera.2014.12.001 |
| [27] |
Ghosh K, Capell BC. The senescence-associated secretory phenotype: critical effector in skin cancer and aging[J]. J Invest Dermatol, 2016, 136: 2133-2139. DOI:10.1016/j.jid.2016.06.621 |
| [28] |
Hernandez-Segura A, Nehme J, Demaria M. Hallmarks of cellular senescence[J]. Trends Cell Biol, 2018, 28: 436-453. DOI:10.1016/j.tcb.2018.02.001 |
| [29] |
Aslani S, Jafari N, Javan MR, et al. Epigenetic modifications and therapy in multiple sclerosis[J]. Neuromol Med, 2017, 19: 11-23. DOI:10.1007/s12017-016-8422-x |
| [30] |
Degirmenci U, Lei S. Role of lncRNAs in cellular aging[J]. Front Endocrinol, 2016, 7: 151-161. |
| [31] |
Panda AC, Abdelmohsen K, Gorospe M. SASP regulation by noncoding RNA[J]. Mech Aging Dev, 2017, 168: 37-43. DOI:10.1016/j.mad.2017.05.004 |
| [32] |
Hisamatsu D, Naka-Kaneda H. Reversing multiple age-related pathologies by controlling the senescence-associated secretory phenotype of stem cells[J]. Neural Regen Res, 2016, 11: 1746-1747. DOI:10.4103/1673-5374.194715 |
| [33] |
Hisamatsu D, Ohno-Oishi M, Nakamura S, et al. Growth differentiation factor 6 derived from mesenchymal stem/stromal cells reduces age-related functional deterioration in multiple tissues[J]. Aging, 2016, 8: 1259-1275. DOI:10.18632/aging.100982 |
| [34] |
Yu S, Wang X, Geng P, et al. Melatonin regulates PARP1 to control the senescence-associated secretory phenotype (SASP) in human fetal lung fibroblast cells[J]. J Pineal Res, 2017, 63: e12405. DOI:10.1111/jpi.12405 |
| [35] |
Ryu DR, Yu MR, Kong KH, et al. Sirt1-hypoxia-inducible factor-1α interaction is a key mediator of tubulointerstitial damage in the aged kidney[J]. Aging Cell, 2019, 18: e12904. DOI:10.1111/acel.12904 |
| [36] |
Hekmatimoghaddam S, Dehghani-Firoozabadi A, Zare-Khormizi MR, et al. Sirt1 and Parp1 as epigenome safeguards and microRNAs as SASP-associated signals, in cellular senescence and aging[J]. Ageing Res Rev, 2017, 40: 120-141. DOI:10.1016/j.arr.2017.10.001 |
| [37] |
Hayakawa T, Iwai M, Aoki S, et al. SIRT1 suppresses the senescence-associated secretory phenotype through epigenetic gene regulation[J]. PLoS One, 2015, 10: e0116480. DOI:10.1371/journal.pone.0116480 |
| [38] |
Perrigue PM, Silva ME, Warden CD, et al. The histone demethylase jumonji coordinates cellular senescence including secretion of neural stem cell-attracting cytokines[J]. Mol Cancer Res, 2015, 13: 636-650. DOI:10.1158/1541-7786.MCR-13-0268 |
| [39] |
Kang KA, Hyun JW. Oxidative stress, Nrf2, and epigenetic modification contribute to anticancer drug resistance[J]. Toxicol Res, 2017, 33: 1-5. DOI:10.5487/TR.2017.33.1.001 |
| [40] |
Feng YL, Yin YX, Ding J, et al. Alpha-1-antitrypsin suppresses oxidative stress in preeclampsia by inhibiting the p38MAPK signaling pathway: an in vivo and in vitro study[J]. PLoS One, 2017, 12: e0173711. DOI:10.1371/journal.pone.0173711 |
| [41] |
Freund A, Patil CK, Campisi J. p38MAPK is a novel DNA damage response-independent regulator of the senescence-associated secretory phenotype[J]. EMBO J, 2011, 30: 1536-1548. DOI:10.1038/emboj.2011.69 |
| [42] |
Takahashi A, Loo TM, Okada R, et al. Downregulation of cytoplasmic DNases is implicated in cytoplasmic DNA accumulation and SASP in senescent cells[J]. Nat Commun, 2018, 9: 1249-1261. DOI:10.1038/s41467-018-03555-8 |
| [43] |
Chen K, Liu J, Cao XT. cGAS-STING pathway in senescence-related inflammation[J]. Natl Sci Rev, 2018, 5: 308-310. DOI:10.1093/nsr/nwx146 |
| [44] |
Yang H, Wang H, Ren J. cGAS is essential for cellular senescence[J]. Proc Natl Acad Sci U S A, 2017, 114: E4612-E4620. DOI:10.1073/pnas.1705499114 |
| [45] |
Cao X, Li M. A new pathway for senescence regulation[J]. Genom Proteom Bioinf, 2015, 13: 333-335. DOI:10.1016/j.gpb.2015.11.002 |
| [46] |
Kang C, Xu Q, Martin TD, et al. The DNA damage response induces inflammation and senescence by inhibiting autophagy of GATA4[J]. Science, 2015, 349: aaa5612. DOI:10.1126/science.aaa5612 |
| [47] |
Xu M, Tchkonia T, Kirkland JL. Perspective: targeting the JAK/STAT pathway to fight age-related dysfunction[J]. Pharmacol Res, 2016, 111: 152-154. DOI:10.1016/j.phrs.2016.05.015 |
| [48] |
Bousoik E, Montazeri Aliabadi H. "Do we know Jack" about JAK? A closer look at JAK/STAT signaling pathway[J]. Front Oncol, 2018, 8: 287-307. DOI:10.3389/fonc.2018.00287 |
| [49] |
Kandhaya-Pillai R, Miro-Mur F, Alijotas-Reig J, et al. TNFα-senescence initiates a STAT-dependent positive feedback loop, leading to a sustained interferon signature, DNA damage, and cytokine secretion[J]. Aging, 2017, 9: 2411-2435. DOI:10.18632/aging.101328 |
| [50] |
Xu M, Tchkonia T, Ding H, et al. JAK inhibition alleviates the cellular senescence-associated secretory phenotype and frailty in old age[J]. Proc Natl Acad Sci U S A, 2015, 112: E6301-E6310. DOI:10.1073/pnas.1515386112 |
| [51] |
Laberge RM, Sun Y, Orjalo AV, et al. MTOR regulates the pro-tumorigenic senescence-associated secretory phenotype by promoting IL1A translation[J]. Nat Cell Biol, 2015, 17: 1049-1061. DOI:10.1038/ncb3195 |
| [52] |
Kabir TD, Leigh RJ, Tasena H, et al. A miR-335/COX-2/PTEN axis regulates the secretory phenotype of senescent cancer-associated fibroblasts[J]. Aging, 2016, 8: 1608-1635. DOI:10.18632/aging.100987 |
| [53] |
Gao C, Ning B, Sang C, et al. Rapamycin prevents the intervertebral disc degeneration via inhibiting differentiation and senescence of annulus fibrosus cells[J]. Aging, 2018, 10: 131-143. DOI:10.18632/aging.101364 |
| [54] |
Wang R, Yu Z, Sunchu B, et al. Rapamycin inhibits the secretory phenotype of senescent cells by a Nrf2-independent mechanism[J]. Aging Cell, 2017, 16: 564-874. DOI:10.1111/acel.12587 |
| [55] |
Menicacci B, Laurenzana A, Chillà A, et al. Chronic resveratrol treatment inhibits MRC5 fibroblast SASP-related protumoral effects on melanoma cells[J]. J Gerontol A Biol Sci Med Sci, 2017, 72: 1187-1195. DOI:10.1093/gerona/glw336 |
| [56] |
Cheng X, Yao X, Xu S, et al. Punicalagin induces senescent growth arrest in human papillary thyroid carcinoma BCPAP cells, via NF-κB signaling pathway[J]. Biomed Pharmacother, 2018, 103: 490-498. DOI:10.1016/j.biopha.2018.04.074 |
| [57] |
Liu S, Zheng Z, Ji S, et al. Resveratrol reduces senescence-associated secretory phenotype by SIRT1/NF-κB pathway in gut of the annual fish Nothobranchius guentheri[J]. Fish Shellfish Immunol, 2018, 80: 473-479. DOI:10.1016/j.fsi.2018.06.027 |
| [58] |
Hou J, Cui C, Kim S, et al. Ginsenoside F1 suppresses astrocytic senescence-associated secretory phenotype[J]. Chem Biol Interact, 2018, 283: 75-83. DOI:10.1016/j.cbi.2018.02.002 |
| [59] |
Park J, Lee SY, Shon J, et al. Adalimumab improves cognitive impairment, exerts neuroprotective effects and attenuates neuroinflammation in an Aβ1-40-injected mouse model of Alzheimer's disease[J]. Cytotherapy, 2019, 21: 671-682. DOI:10.1016/j.jcyt.2019.04.054 |
| [60] |
Prattichizzo F, Giuliani A, Recchioni R, et al. Anti-TNF-α treatment modulates SASP and SASP-related microRNAs in endothelial cells and in circulating angiogenic cells[J]. Oncotarget, 2016, 7: 11945-11958. |
| [61] |
Kirkland JL, Tchkonia T. Cellular senescence: a translational perspective[J]. EBioMedicine, 2017, 21: 21-28. DOI:10.1016/j.ebiom.2017.04.013 |
| [62] |
Xu M, Pirtskhalava T, Farr JN, et al. Senolytics improve physical function and increase lifespan in old age[J]. Nat Med, 2018, 24: 1246-1256. DOI:10.1038/s41591-018-0092-9 |
| [63] |
Sikora E, Bielak-Zmijewska A, Mosieniak G. Cellular senescence in ageing, age-related disease and longevity[J]. Curr Vasc Pharmacol, 2014, 12: 698-706. |
 2020, Vol. 55
2020, Vol. 55


