2. 浙江康佰裕生物科技有限公司, 浙江 杭州 310051;
3. 绍兴文理学院附属医院, 浙江 绍兴 312000
2. Carbiogene Therapeutics Co., Ltd., Hangzhou 310051, China;
3. Affiliated Hospital of Shaoxing University, Shaoxing 312000, China
乳腺癌是女性中最常见的癌症, 最新癌症统计报告显示乳腺癌发病率占女性癌症的30%[1], 其发病率已经上升到我国女性恶性肿瘤的第一位[2]。目前肿瘤治疗方法有化疗、放疗和手术治疗等, 其中化疗仍然是治疗肿瘤特别是晚期肿瘤并防止肿瘤术后复发的主要手段[3]。然而, 目前大部分化疗药物均有选择性较差、毒副作用大等缺点[4]。如多柔比星(doxorubicin, DOX)是治疗乳腺癌的一线抗肿瘤药物之一, 其作用机制是通过抑制肿瘤细胞核酸的合成来发挥作用[5]。但DOX具有严重不良反应特别是剂量依赖性的心脏毒性, 长期应用还可引起耐药, 极大地限制了其在临床上的应用[6, 7]。因此, DOX常与环磷酰胺、紫杉醇等联合应用, 可同时作用于肿瘤细胞内不同的信号通路, 克服单靶点治疗缺陷, 有效提高DOX的抗肿瘤功效、减轻或逆转耐药等[8, 9]。
二甲双胍(metformin, Met)是常用的治疗糖尿病药物, 流行性病学资料显示, 应用Met的糖尿病患者, 其在一些恶性肿瘤中的发病率明显低于使用其他药物患者[10, 11]。最近研究表明, Met对肝癌、胰腺癌、结肠癌和乳腺癌等多种恶性肿瘤的生长具有明显的抑制和诱导凋亡作用[12]。因此, Met与DOX联合治疗乳腺癌具有很大潜力。但Met在体内半衰期短, 易被清除, 且Met亲水性高, 难以跨过细胞膜[13]。研究显示, Met发挥作用必须借助有机阳离子转运体或外排转运蛋白进入细胞, 提高其跨膜效率, 增加生物利用度, 但可能会增加其不良反应, 如横纹肌溶解等[14]。而游离的DOX进入体内后与血浆结合率低, 可迅速分布于各组织器官中, 从而降低抗肿瘤效果并伴随严重的毒副作用[15, 16]。使用纳米载体提高Met的入胞效率和延长半衰期, 降低DOX毒性以达到更好的抗肿瘤效果是一种可行的方法。目前对Met的载体研究已有的报道不多, 尽管有多柔比星脂质体[17]已投入临床使用, 但DOX与Met共载的脂质体或纳米粒等研究较少。因为两药或多药纳米给药系统研究面临种种困难, 如很难同时兼顾两种药物的包封率、载药量, 载体构建的复杂性增加; 且两药之间由于理化性质差异难以按比例共载等[18]。
本课题组前期将聚乙烯亚胺与双胍基在加热的条件下合成了二甲双胍聚合物(polymetformin, PolyMet)[19, 20]。前期研究表明, PolyMet具有Met类似的作用机制和抗肿瘤效果, 即通过激活AMPK, 抑制mTOR及其下游效应激酶(p70S6K)的活性引发癌细胞自噬[21], 甚至表现出比Met更好的抗肿瘤作用。并且PolyMet是一条富含胍基的带正电荷的高分子链, 富含胍基的分子可增加细胞的穿透性, 促进细胞的摄取和跨膜转运[22], 可在抗肿瘤的同时作为载体, 如递送siRNA[20], 以及将一些难溶性的药物如顺铂制备成负电荷的高分子链从而实现共载等[19]。
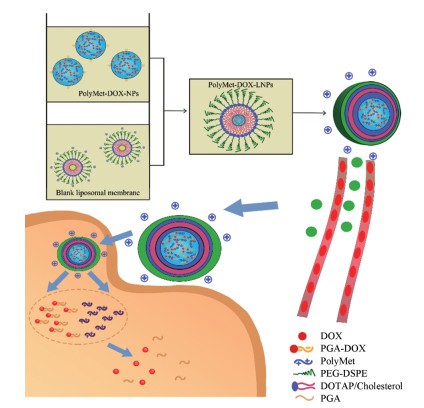
因此, 本文拟将PolyMet与DOX联合使用研究其治疗乳腺癌的效果; 将DOX和γ-聚谷氨酸(γ-polyglutamic acid, PGA)制备成阴离子高分子链(PGA-DOX), 与阳离子高分子链PolyMet通过静电吸附形成负电荷的稳定纳米粒(PolyMet-DOX-nanoparticles, PolyMet-DOX-NPs), 随后利用阳离子脂质体膜包裹纳米粒制备得到核膜型脂质纳米粒(PolyMet-DOX-lipid-nanoparticles, PolyMet-DOX-LNPs) (图 1), 研究其对乳腺癌小鼠移植瘤生长抑制作用, 考察其降低DOX毒性的能力。本研究首次将PolyMet与水溶性抗肿瘤药物DOX共载于一个脂质纳米粒中, 为进一步扩大PolyMet在抗肿瘤领域的应用奠定基础。
|
Figure 1 Lipid membrane-wrapped nanoparticles loaded with metformin polymer (PolyMet) and doxorubicin (DOX) (PolyMet-DOX-LNPs). PGA: Polyglutamic acid; PEG-DSPE: Polyethylene glycol-distearoyl phosphoethanolamine; DOTAP: (2, 3-Dioleoyloxy-propyl)-trimethylammonium |
材料与试剂 盐酸多柔比星(doxorubicin, DOX, 纯度99.9%, 中国海正辉瑞公司); PolyMet (本实验室合成); 高糖DMEM培养基、青/链霉素(P/S)、0.25%胰蛋白酶(美国Gibico公司); 胎牛血清(FBS, 美国Corning公司); 二甲亚砜(DMSO)、3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴(MTT试剂)、苏木精、伊红(美国Sigma-Aldrich公司); 磷脂(DOTAP, mPEG2000-DSPE, malPEG3400-DSPE, 上海艾韦特医药科技有限公司); 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)、1-羟基苯并三唑(HOBt) (上海阿拉丁生化股份有限公司); γ-聚谷氨酸(PGA)、胆固醇(上海源叶生物科技有限公司); D-荧光素钾(美国Thermo公司); 磷酸缓冲盐溶液(PBS, 杭州Northrend公司); 携带萤火虫荧光素酶(Fluc)的慢病毒转染试剂盒、嘌呤霉素(上海吉凯基因化学技术有限公司); 中性树胶封片剂(北京博奥森生物技术有限公司); 羊血清(美国Invitrogen公司); 其他试剂均为分析纯。
主要仪器 Mill-Q超纯水器、分子截留MW 3 500 Da超滤离心管(美国Millipore公司); 倒置荧光显微镜(日本Nikon公司); IVIS小动物活体成像系统(美国Xenogen公司); cope A1光学显微镜(德国EISS公司)。
细胞培养 鼠乳腺癌细胞株4T-1, 由浙江中医药大学高建莉教授赠送。4T-1细胞用含1% P/S和10% FBS的高糖DMEM培养基在37 ℃、5% CO2培养箱中培养, 每1~2天换液, 当细胞生长至80%~90%丰度时, 采用酶消化法按1:2进行传代。
实验动物 Balb/c小鼠, 雌性, 4~6周龄, 18~20 g, 由上海斯莱克实验动物有限责任公司提供, 生产许可证: SCXK (沪) 2017-0005。动物实验符合伦理学标准, 并获得浙江中医药大学实验动物伦理委员会批准。小鼠分笼饲养, 每笼5~6只, 饲养于浙江中医药大学动物实验中心, 饲养条件:环境温度(25 ± 2) ℃, 相对湿度50%~60%。动物均自由饮水、进食。
稳定转染4T-1细胞株构建 取对数生长期的4T-1细胞用0.25%胰蛋白酶消化, 制成每毫升8.0×104个细胞悬液, 按100 μL/孔均匀滴加于96孔板中, 培养过夜。待细胞汇合至30%左右且细胞状态良好时弃去上清液, 将携带萤火虫荧光素酶报告基因的慢病毒液用无P/S的培养液稀释成所需的不同感染复数(multiplicity of infection, MOI), 按100 μL/孔加入96孔板, 分别为MOI=10、30、45、60和90 [MOI=(病毒滴度×病毒体积)/细胞数目]。加入polybrene, 使每孔的终质量浓度为5 μg·mL-1, 转染8 h后于显微镜下观察细胞生长状态和数量, 并更换为常规培养液。培养2~3天后, 收集部分细胞加入荧光素酶底物(D-荧光素钾), 于小动物活体成像仪(IVIS)检测发光信号, 将每个发光信号值以各处理组蛋白浓度平均化, 即得各处理组的相对生物发光信号值(relative bioluminescence imaging, BLIrel)。筛选发光信号强度高的细胞用含嘌呤霉素(1 μg·mL-1)的完全培养基培养1周使其稳定表达Fluc, 用于后续实验。
PolyMet联合DOX体外细胞毒性实验 取对数生长期的4T-1细胞, 用0.25%胰蛋白酶消化, 加入适量DMEM培养液稀释制成细胞数为8×104个/mL的细胞悬液接种于96孔板中, 每孔100 μL, 置于37 ℃、5% CO2饱和湿度的培养箱中培养。待细胞汇合80%时, 弃去上清, 按浓度梯度分别加入含DOX、PolyMet和DOX+PolyMet培养液, 每组6个复孔。阴性对照组为不加药的等体积新鲜培养液, 阳性对照组为含Met、DOX+Met的培养液, 转入培养箱中继续培养48 h。弃去含药培养液, PBS清洗2~3次, 每孔加入100 μL含MTT (0.5 mg·mL-1)的培养液继续孵育4 h, 弃去上清, 每孔加入DMSO 100 μL, 置于摇床上低速震荡10 min, 使结晶物充分溶解, 采用多功能酶标仪在490 nm处测定各孔的吸光度(A)值, 以空白组调零, 计算4T-1细胞的增殖抑制率及IC50值。采用Chou-Talaly法对药效综合指数(CI)进行计算, 并以CI值判断DOX与PolyMet之间的作用关系, 其中CI < 1 (协同效应)、CI=1 (相加效应)和CI > 1 (拮抗效应)。
阳离子高分子链PolyMet合成 根据前期研究方法合成PolyMet[19, 20]。将聚乙烯亚胺(MW ~8 000) 0.2 g与双氰胺(MW 84) 2.0 g溶解于10 mL去离子水中, 加入浓盐酸2 mL混匀, 在氮气保护下油浴(100 ℃)反应4 h。所得产物用透析管纯化(截留MW 3 500 Da)后置于冷冻干燥机中冻干, 所得的冻干产物存放于-20 ℃冰箱。
阴离子高分子链PGA-DOX合成 精密称取PGA粉末10 mg置于茄形瓶中, 加入pH 6去离子水20 mL搅拌15 min使其溶解; 精密称取DOX粉末6.2 mg, 加入去离子水1 mL溶解, 并缓慢滴入PGA溶液中, 室温下搅拌30 min后转入4 ℃下继续搅拌15 min。分别称取EDC•HCl 3.2 mg和HOBt 1.4 mg溶解于1 mL DMSO中, 加入到上述溶液中, 于4 ℃下搅拌4 h后转入室温下继续搅拌20 h。所得溶液经0.22 μm滤膜过滤纯化即得PGA-DOX溶液, 最后用超滤离心管(截留MW 3 500 Da)低速离心除去未与PGA结合的游离DOX, 冷冻干燥后得到PGA-DOX粉末。
PGA-DOX结构表征和合成率测定 采用1H NMR验证PGA-DOX是否成功合成。测定方法:取适量DOX、PGA和PGA-DOX分别置于核磁管中, 以氘水1 mL完全溶解, 用核磁共振氢谱仪测得各化合物的1H NMR图。采用高效液相色谱法(high performance liquid chromatography, HPLC)测定PGA-DOX的合成效率。色谱条件:色谱柱为Aglient ZORBAX Eclipse Plus C18柱(250 mm×4.6 mm, 5 μm); 流动相为十二烷基硫酸钠溶液-乙腈-甲醇(500:500:60, w/w); 流速: 1.00 mL·min-1; 检测波长: 254 nm; 柱温23 ℃; 进样量5 μL。测定方法:精密量取过滤纯化后的PGA-DOX溶液1 mL, 于5 mL量瓶中加流动相定容至刻度, 采用HPLC测定PGA-DOX含量, 记录CPGA-DOX。同法测定同等投药量的DOX溶液并测定含量, 记录CDOX, 计算合成率(synthesis efficiency, SE%), SE%=(CPGA-DOX/CDOX)×100%。
PolyMet-DOX-LNPs制备及粒径、zeta电位、形态观察 将PGA-DOX与PolyMet均匀混合(摩尔比为3:2), 于室温下孵育10 min即得PolyMet-DOX-NPs, 采用经典的薄膜分散法制备空白脂质体膜包裹纳米粒。精密称取处方量DOTAP、胆固醇、mPEG2000-DSPE、malPEG3400-DSPE (摩尔比为1:1:0.12:0.11)置于圆底烧瓶中, 用氯仿2 mL溶解, 在40 ℃下减压除去氯仿, 待圆底烧瓶瓶壁上形成一层均匀的薄膜后, 用1 mL蒸馏水将脂质膜水合过夜, 并依次通过聚碳酸酯膜(100 nm×5次, 50 nm×5次)挤出即得空白阳离子脂质体溶液。按照PolyMet-DOX-NPs与DOTAP的摩尔比为1:16计算, 将脂质体溶液加入到含PolyMet-DOX-NPs的水溶液, 水浴超声混合, 即得PolyMet-DOX-LNPs (图 1)。根据相同的方法制备载DOX的脂质纳米粒(DOX-LNPs)和载PolyMet的脂质纳米粒(PolyMet-LNPs)。采用马尔文粒径仪测定粒径和zeta电位, 透射电镜下观察其形态。
包封率及载药量测定 采用超滤离心法测定包封率(encapsulation efficiency, EE)和载药量(drug loading, DL), HPLC法分析所得的样品含量。色谱条件:色谱柱为Aglient ZORBAX Eclipse Plus C18柱(250 mm×4.6 mm, 5 μm); 流动相为十二烷基硫酸钠溶液-乙腈-甲醇(500:500:60, w/w); 流速: 1.00 mL·min-1; 检测波长: 254 nm; 柱温23 ℃; 进样量5 μL。测定方法:取PolyMet-DOX-LNPs用超滤离心管离心(12 000 r·min-1, 10 min), 将离心后滤液加入Triton-100破坏脂质膜, 过0.22 μm微孔滤膜, 采用HPLC测定脂质纳米粒中DOX的量(WDOX)和PolyMet的量(WPolyMet), 根据公式(1)~(3)计算EE和DL。
| $ {\rm{EE}}\% = ({W_{{\rm{DOX}}}}/{W_{{\rm{总DOX}}}}) \times 100\% $ | (1) |
| $ {\rm{D}}{{\rm{L}}_{{\rm{DOX}}}}\% = ({\mathit{W}_{{\rm{DOX}}}}/{W_{{\rm{LNPs总量}}}}) \times 100\% $ | (2) |
| $ {\rm{D}}{{\rm{L}}_{{\rm{PolyMet}}}}\% = ({W_{{\rm{PolyMet}}}}/{W_{{\rm{LNPs总量}}}}) \times 100\% $ | (3) |
其中, W总DOX为总DOX投药量; WLNPs总量为脂质纳米粒总量。
体外释放特性 采用透析法考察PGA-DOX和PolyMet-DOX-LNPs中DOX的释放情况。测定方法:以PBS作为释放介质, 将2 mL DOX、PGA-DOX和PolyMet-DOX-LNPs溶液分别装入预先处理过的透析袋内, 置于装有30 mL释放介质的广口瓶中, 于(37 ± 0.5) ℃恒温箱中以75 r·min-1振荡, 分别于0.1、0.25、0.75、1、1.5、2、4、6、8、10、12、24、36和48 h时间点吸取透析介质1 mL, 同时补加等量等温度的释放介质, 所有样品经0.22 μm微孔滤膜滤过后用HPLC测定释放介质中DOX的浓度, 按照公式(4)计算相应时间下DOX累积释放率(Q%), 并绘制释药曲线。
| $ \begin{array}{l} {M_n} = {C_n}{V_0} + \Sigma {C_i}{V_i}\\ {Q_n}\% = {M_n}/{V_0} \times 100\% \end{array} $ | (4) |
式中, Mn为每个时间点的药物累积释放, Qn为每个时间点药物累积释放百分比, Cn为tn时的药物浓度, V0为释放介质的体积, Vi为每次取样体积, Ci为ti时的药物浓度, C0为总药物浓度。
PolyMet-DOX-LNPs体内抗乳腺癌药效研究 取对数生长期的4T-1Fluc细胞制成每毫升4×106个细胞悬液, 无菌条件下抽取0.1 mL, 通过皮下接种于Balb/c小鼠左侧第二对乳房处, 建立荷4T-1Fluc移植瘤模型。待肿瘤长至约100 mm3时, 随机分为5组(n=6):对照组(生理盐水)、游离DOX组、PolyMet-LNPs组、DOX-LNPs组和PolyMet-DOX-LNPs组。采取尾静脉给药, 剂量以DOX计算(5 mg·kg-1), 给药体积均为0.1 mL, 隔天给药, 连续给药10次。给药后观察肿瘤生长情况, 用游标卡尺测量肿瘤的体积, 绘制皮下肿瘤生长曲线。肿瘤体积计算公式: V=1/2×L×W2。式中, V为肿瘤体积, L为肿瘤长距, W为肿瘤宽距。以活体生物发光成像技术(BLI)监测给药后肿瘤组织中存活的4T-1细胞发光信号强度。称取适量D-荧光素钾, 用PBS溶解制备过饱和D-荧光素钾溶液(75 mg·kg-1), 荷瘤小鼠用异氟烷气体吸入麻醉后, 腹腔注射D-荧光素钾溶液, 立刻置于IVIS成像系统中, Em=533 nm, 记录测得的发光信号值(获取总光子数)作为定量单位, 绘制肿瘤细胞发光变化曲线, 结合肿瘤体积生长曲线评价肿瘤抑制情况。
PolyMet-DOX-LNPs体内毒性评价 给药后记录荷瘤小鼠体重、一般状态等毒性指标, 并绘制小鼠体重动态变化曲线。于治疗后第20天, 每组颈椎脱臼处死荷瘤小鼠, 肿瘤组织和各器官(心、肝、脾、肺、肾)固定于4%多聚甲醛中, 用于制备石蜡切片, 通过H & E染色评估PolyMet是否可以降低DOX的毒性。
统计学方法 实验结果数据以x ± s表示, 采用SPSS 13.0软件进行统计学处理, 比较多组间均数采用单因素方差分析, 比较两组间均数采用t检验。以P < 0.05表示有显著性差异。
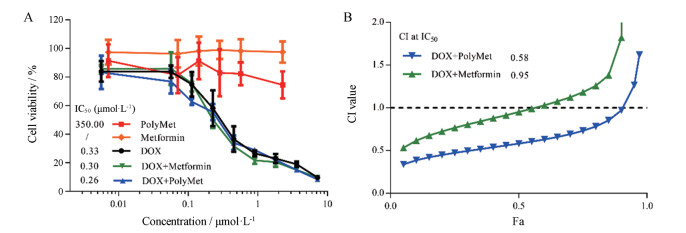
结果 1 PolyMet联合DOX对乳腺癌4T-1细胞增殖抑制作用的影响MTT实验结果如图 2A, 用DOX、PolyMet、Met、PolyMet+DOX、DOX+Met分别处理4T-1细胞48 h后, 联合用药组DOX的IC50小于单用DOX组, 且PolyMet联合DOX降低IC50更多, 提示PolyMet能增强DOX抑制4T-1乳腺癌细胞的增殖作用, 协同指数分析(图 2B)显示, PolyMet联合组的CI值为0.58, 远小于Met联合组(CI值为0.95), 说明PolyMet协同DOX抗乳腺癌的效果更好。
|
Figure 2 Cell proliferation of 4T-1 for 48 h after treatment with different drugs (A). The combination index (CI) curve of different combination groups (B). Fa: Inhibition rate. n = 6, x ± s |
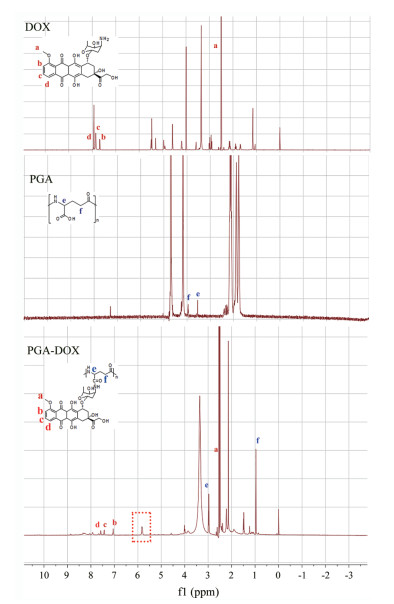
PGA分子链上有丰富的羧基, DOX结构上含有氨基。因此, 该反应以活性较强的酰胺反应为基础, 在EDC•HCl和HOBt的催化下活化PGA上的羧基, 与DOX上的氨基发生酰胺反应, 将DOX接枝PGA上形成PGA-DOX偶联物。该反应条件温和、简单, 合成率较高, 操作简便易于重复。通过对1H NMR的图谱进行分析(图 3), 其中DOX的化学式中标注位置(a, b, c, d)分别在图谱中对应, PGA化学式中标注的两个位置(e, f)同样在图谱中对应, 并且上述标注的出峰位置在PGA-DOX的图谱均能对应, 说明合成产物中含有DOX和PGA。另外, PGA-DOX图谱中在δ 6.0附近出现特征峰, 为PGA和DOX发生酰胺反应后形成的酰胺键上的氢质子特征峰, 提示PGA-DOX成功合成。马尔文粒径仪测得其zeta电位为(-57.0 ± 1.23) mV (表 1)。通过HPLC法测定PGA-DOX中DOX的含量并计算合成率, 结果表明合成率可达(72.03 ± 1.29)%。
|
Figure 3 Nuclear magnetic resonance hydrogen spectroscopy of DOX (A), PGA (B), PGA-DOX (C) |
| Table 1 Average size, polydispersity index (PDI) and zeta potentials of PGA-DOX, blank liposomal membrane, PolyMet-DOX-NPs and PolyMet-DOX-LNPs. n = 3, x ± s |
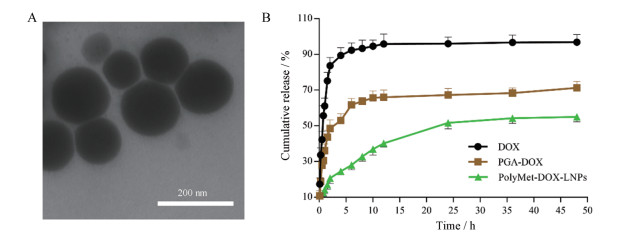
PolyMet前期研究证明其zeta电位为(+22.0 ± 1.10) mV。因此, 当PGA-DOX的量多于PolyMet可通过静电吸附形成负电荷的PolyMet-DOX-NPs, 在PGA-DOX与PolyMet的摩尔比为3:2时, 该纳米粒粒径为(119.9 ± 2.00) nm, zeta电位为(-27.2 ± 1.10) mV; 空白脂质体溶液粒径为(164.7 ± 0.55) nm, zeta电位为(+43.0 ± 0.50) mV (表 1)。当PolyMet-DOX-NPs加入到该阳离子脂质体溶液后, 其粒径为(159.3 ± 7.40) nm, PDI为0.20 ± 0.01, zeta电位由负电荷转变为(+36.3 ± 1.90) nm, 透射电子显微镜结果如图 4A所示, 该脂质纳米粒呈中心黑色、边缘白色的光滑圆球形, 根据前期研究显示[20]未包裹脂膜的纳米粒为不光滑的黑色团状。因此, 本实验结果证明PolyMet-DOX-NPs被脂膜包被后形成了核-膜结构脂质纳米粒PolyMet-DOX-LNPs。
|
Figure 4 Transmission electron microscope (TEM) images of PolyMet-DOX-LNPs (A). Release of DOX from PGA-DOX or PolyMet-DOX-LNPs in vitro (B). n = 3, x ± s |
通过HPLC法测得LNPs中DOX总浓度及游离药物浓度并计算LNPs的EE和DL, 得到PolyMet-DOX-LNPs的EE为(72.76 ± 1.92) %, DLDOX为(1.16 ± 0.12) %, DLPolyMet为(10.45 ± 0.63) %。
通过透析法考察PGA-DOX和PolyMet-DOX-LNPs中DOX的释放情况, 结果如图 4B。游离DOX体外释放很快, 在4 h内释放约90%; PGA-DOX在12 h内累积释放(66.04 ± 1.02) %, 在48 h后累积释放可达到(71.3 ± 0.93) %, 其释放行为较游离DOX缓慢。此外, PolyMet-DOX-LNPs在48 h内呈现出适当的释放速率, 释放速率明显慢于PGA-DOX和DOX (P < 0.05), 前12 h的累积释放量为(55.05 ± 0.69)%, 说明该脂质纳米粒具有较好的缓释效果。
4 稳定转染4T-1Fluc细胞株构建本课题组前期通过将携带萤火虫荧光素酶报告基因或携带绿色荧光蛋白(green fluorescent protein, GFP)的慢病毒感染MCF-7细胞株, 证实采用慢病毒感染的方式可以成功转染细胞株, 使细胞株稳定表达萤火虫荧光素酶报告基因[23]。本研究采用相同的方法, 通过慢病毒转染技术将萤火虫荧光素酶基因导入4T-1细胞株, 发光信号强度随着MOI的增大而增加, 当MOI = 90时, BLI的响应值明显增加(P < 0.001), 因此, 本文选择MOI = 90为最佳感染值, 并以该MOI的4T-1Fluc细胞株用于后续实验。
5 PolyMet-DOX-LNPs对乳腺癌小鼠移植瘤(4T-1Fluc)生长抑制作用的影响 5.1 PolyMet-DOX-LNPs对乳腺癌小鼠移植瘤生长的影响以实验天数为横坐标, 肿瘤体积为纵坐标绘制肿瘤生长曲线, 结果见图 5。由图 5A可知, 游离DOX组、PolyMet-DOX-LNPs组、DOX-LNPs组和PolyMet-LNPs组的肿瘤体积增长速率显著低于对照组(P < 0.001), 其中PolyMet-DOX-LNPs组与游离DOX组、DOX-LNPs组比较均具有显著性差异(P < 0.05), 提示共载DOX/PolyMet的纳米脂质体较DOX单给药组具有更好的肿瘤抑制作用。
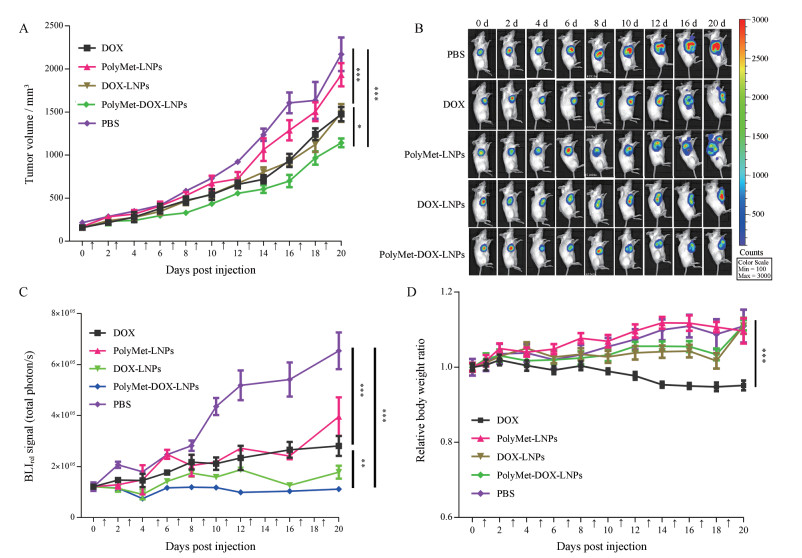
|
Figure 5 Tumor inhibition effects of PolyMet-DOX-LNPs on 4T-1 tumor-bearing mice. A: Tumor volume curve after treatment with different drugs for different times in vivo; B: The changes of tumor luminescent intensity of tumor-bearing mice; C: BLIrel signal photon-time curve after treatment with different drugs for different times in vivo; D: Effect of different drugs on body weight of tumor bearing mice. n = 6, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001. BLIrel: Relative bioluminescence imaging |
监测肿瘤体积时, 实际测定得到的是肿瘤细胞和其他细胞如肿瘤相关成纤维细胞等多种细胞和细胞基质的混合体积, 本研究中采用BLI技术实时监测体内存活的肿瘤细胞进一步评价体内药效。由于4T-1Fluc细胞成功表达萤火虫荧光素酶报告基因, 当小鼠腹腔注射荧光素酶底物(D-荧光素钾)后, 置于IVIS系统中可在几分钟内产生发光现象(图 5B)。以实验天数为横坐标, BLIrel为纵坐标绘制肿瘤细胞发光变化曲线, 结果见图 5C。由图可知, 游离DOX组、PolyMet-DOX-LNPs组、DOX-LNPs组和PolyMet-LNPs组的肿瘤细胞发光强度显著低于对照组(P < 0.001);相比游离DOX, DOX-LNPs处理后发光强度有所降低, 而PolyMet-DOX-LNPs处理后显著降低, 说明PolyMet-DOX-LNPs处理后4T-1Fluc细胞增殖速率降低更快, 存活的4T-1Fluc细胞更少(P < 0.01)。值得一提的是, PolyMet-LNPs处理后肿瘤生长受到抑制, 说明PolyMet自身具有较好的抗肿瘤作用, 进一步证明了PolyMet作为载体递送DOX的优势。
6 PolyMet-DOX-LNPs对乳腺癌小鼠(4T-1Fluc)体内毒性评价 6.1 PolyMet-DOX-LNPs对乳腺癌小鼠体重的影响各组荷瘤小鼠在给药期间均无死亡。实验过程中, 各组小鼠体重变化情况如图 5D, 游离DOX组小鼠在第2次给药后即开始出现体重下降, 与对照组相比有显著性差异(P < 0.001), 提示游离的DOX可对小鼠产生明显毒性使其体重下降。而其余组小鼠体重在给药后没有明显下降。
6.2 PolyMet-DOX-LNPs对乳腺癌小鼠中肿瘤组织和各脏器毒性的影响H & E染色后组织病理切片结果如图 6显示, 对照组的肿瘤细胞成团块状, 索状排列, 肿瘤核大深染, 可见红染核仁, 肿瘤细胞大小形态不等; 而PolyMet-DOX-LNPs组、DOX-LNPs组、PolyMet-LNPs组和游离DOX组的肿瘤细胞有局灶性坏死, 细胞核染色加深, 密度减少, 可见空洞, 提示肿瘤细胞发生了凋亡和坏死。另外, 对照组各脏器的细胞大小均匀、紧密排列, 细胞形态完整, 基本没有发生凋亡和坏死, 而游离DOX组心肌细胞间隙变大且较多, 排列松散, 形态改变, 表明游离DOX可导致较严重的心脏损伤; 其余各组心肌细胞间隙较少, 排列相对有序, 其中, 与DOX-LNPs组比较, PolyMet-DOX-LNPs组心肌细胞间隙更少, 排列更有序, 说明PolyMet可减轻DOX引起的心脏毒性。各药物处理组其他器官(肝、脾、肺、肾)细胞形态较完整, 胞核无明显增大, 未见显著性损伤。
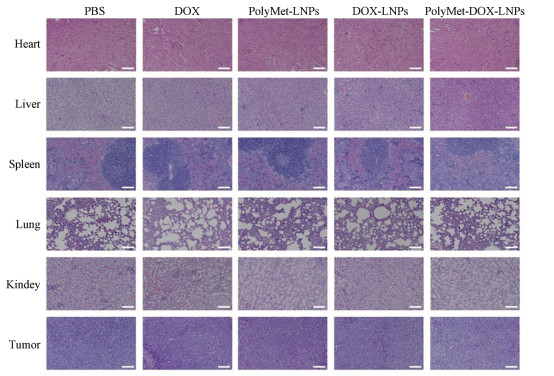
|
Figure 6 H & E staining of major tissue and tumor from tumor-bearing mice after therapy by different drugs and bar repreaents 100 μm |
纳米给药技术已经被广泛应用于各种化疗药物的递送以延长体内循环时间和提高药物的生物利用度, 其优势在于利用了肿瘤部位增强的渗透性和保留效应, 使药物被动地蓄积于肿瘤部位, 起到靶向递送抗肿瘤药物的目的[24]; 或通过对递药系统表面修饰特定的靶分子, 如抗体、多肽、蛋白等使其能被特定的细胞所识别和摄取[25]。有研究表明DOX和Met联合应用能够起到抗肿瘤的作用, 如Met能增强MCF-7细胞对DOX的敏感性及减少氧化应激来增强抗乳腺癌疗效[26]; Met通过靶向缺氧的肿瘤微环境, 增强DOX的抗肿瘤作用[8]。但Met理化性质限制其难以跨膜[27]; 而DOX具有非特异性细胞毒性, 通常会产生严重的不可逆的心脏毒性, 因此在抗肿瘤应用方面具有一定的局限性。纳米技术递送药物的优势或许能使之成为共载DOX/Met的理想载体。但由于Met亲水性强, 制备成普通的脂质体容易从内水相渗漏至外水相, 导致包封率低, 稳定性不高, 若与同为水溶性的DOX•HCl共载制备脂质体更加困难, 虽有不少研究者通过将水溶性药物疏水化或制备成前体药物改变药物性质等[28, 29], 但均具有一定的局限。因此, 目前关于Met载体的报道不多, 也只有少数的Met纳米粒被报道。已报道的载体, 如聚醚酰亚胺、聚酰胺-胺型树枝状高分子等, 其本身不能表现出抗肿瘤活性。在前期研究中[20], PolyMet已被证实兼具药物载体和抗肿瘤治疗等优势, 可在一定程度上比Met产生更好的抗肿瘤效果。Xiong等[19]制备了PolyMet/CDDP共载的纳米粒通过肿瘤特异性受体(σ受体)主动靶向递送大量药物进入肿瘤部位来治疗非小细胞肺癌, PolyMet通过激活AMPK通路导致mTOR蛋白失活引起细胞自噬来达到一定的抗肿瘤作用。
本文还运用BLI技术进一步评价体内药效。该技术不需要激发光源, 是生物体内的自发荧光, 通过成像系统可直接监测生物体内分子及细胞等的发展进程例如细胞迁移、信号转导、增殖和凋亡等[30]。其原理主要是荧光素酶在ATP及氧气存在的条件下和荧光素发生催化反应而发光, 且本文中荧光素酶仅构建于肿瘤细胞内激发相等摩尔量的光子, 因此只有在活细胞内才会产生发光现象, 而光的强度(光子数值)与标记细胞的数目线性相关[31]。通过对同一组荷瘤小鼠进行监测, 便可跟踪给药后荷瘤小鼠中存活的4T-1Fluc细胞发光强度变化。因此, 利用该方法可以准确地实时定量治疗后体内存活的肿瘤细胞, 更好地评价肿瘤的抑制情况。与传统的方法相比, BLI技术直接用于活细胞检测, 在肿瘤动物皮下和深部组织器官均可检测到发光信号, 具有较高的灵敏度和操作方法简便、省时。
总之, PolyMet是一种具有一定抗肿瘤作用的载体, 目前已成功用于装载水溶性药物(DOX)或难溶性药物(顺铂), 因此可考虑进一步扩大其在抗肿瘤领域的应用。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68: 7-30. DOI:10.3322/caac.21442 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115-132. DOI:10.3322/caac.21338 |
| [3] |
Johnson ML, Patel JD. Chemotherapy and targeted therapeutics as maintenance of response in advanced non-small cell lung cancer[J]. Semin Oncol, 2014, 41: 93-100. DOI:10.1053/j.seminoncol.2013.12.007 |
| [4] |
Guillemard V, Uri Saragovi H. Prodrug chemotherapeutics bypass p-glycoprotein resistance and kill tumors in vivo with high efficacy and target-dependent selectivity[J]. Oncogene, 2004, 23: 3613-3621. DOI:10.1038/sj.onc.1207463 |
| [5] |
Cagel M, Grotz E, Bernabeu E, et al. Doxorubicin: nanotechnological overviews from bench to bedside[J]. Drug Discov Today, 2017, 22: 270-281. DOI:10.1016/j.drudis.2016.11.005 |
| [6] |
Wang DD, Liu R, Wang Y, et al. In vitro targeting efficiency evaluation of reduction-responsive co-loaded doxorubicin/siRNA nanoparticles[J]. Acta Pharm Sin (药学学报), 2018, 53: 2104-2112. |
| [7] |
Prieto-Vila M, Takahashi RU, Usuba W, et al. Drug resistance driven by cancer stem cells and their niche[J]. Int J Mol Sci, 2017, 18: 2-22. |
| [8] |
Li Y, Luo J, Lin MT, et al. Co-delivery of metformin enhances the antimultidrug resistant tumor effect of doxorubicin by improving hypoxic tumor microenvironment[J]. Mol Pharm, 2019, 16: 2679-2699. |
| [9] |
Sudha T, Bharali DJ, Yalcin M, et al. Targeted delivery of paclitaxel and doxorubicin to cancer xenografts via the nanoparticle of nano-diamino-tetrac[J]. Int J Nanomedicine, 2017, 12: 1305-1315. DOI:10.2147/IJN.S123742 |
| [10] |
Kendall DL, Amin R, Clayton PE. Metformin in the treatment of obese children and adolescents at risk of type 2 diabetes[J]. Paediatr Drugs, 2014, 16: 13-20. DOI:10.1007/s40272-013-0045-1 |
| [11] |
Noto H, Goto A, Tsujimoto T, et al. Cancer risk in diabetic patients treated with metformin: a systematic review and meta-analysis[J]. PLoS One, 2012, 7: 1-9. |
| [12] |
Dewaal D, Nogueira V, Terry AR, et al. Hexokinase-2 depletion inhibits glycolysis and induces oxidative phosphorylation in hepatocellular carcinoma and sensitizes to metformin[J]. Nat Commun, 2018, 9: 446-460. DOI:10.1038/s41467-017-02733-4 |
| [13] |
Cetin M, Sahin S. Microparticulate and nanoparticulate drug delivery systems for metformin hydrochloride[J]. Drug Deliv, 2016, 23: 2796-2805. DOI:10.3109/10717544.2015.1089957 |
| [14] |
Xu XN, Shi R, Ma YM. Research progress of pharmacokinetics of metformin based on transporters[J]. Acta Pharm Sin (药学学报), 2017, 52: 865-870. |
| [15] |
Yousefpour P, Ahn L, Tewksbury J, et al. Conjugate of doxorubicin to albumin-binding peptide outperforms aldoxorubicin[J]. Small, 2019, 15: 1-13. |
| [16] |
Yang C, Yuan C, Liu W, et al. DPD studies on mixed micelles self-assembled from MPEG-PDEAEMA and MPEG-PCL for controlled doxorubicin release[J]. Colloids Surf B Biointerfaces, 2019, 178: 56-65. DOI:10.1016/j.colsurfb.2019.02.043 |
| [17] |
Alibloandi M, Abnous K, Mohammadi M, et al. Extensive preclinical investigation of polymersomal formulation of doxorubicin versus Doxil-mimic formulation[J]. J Control Release, 2017, 264: 228-236. DOI:10.1016/j.jconrel.2017.08.030 |
| [18] |
Li J, Wang Y, Zhu Y, et al. Recent advances in delivery of drug-nucleic acid combinations for cancer treatment[J]. J Control Release, 2013, 172: 589-600. DOI:10.1016/j.jconrel.2013.04.010 |
| [19] |
Xiong Y, Zhao Y, Miao L, et al. Co-delivery of polymeric metformin and cisplatin by self-assembled core-membrane nanoparticles to treat non-small cell lung cancer[J]. J Control Release, 2016, 244: 63-73. DOI:10.1016/j.jconrel.2016.11.005 |
| [20] |
Zhao Y, Wang Y, Guo S, et al. PolyMetformin combines carrier and anticancer activities for in vivo siRNA delivery[J]. Nat Commun, 2016, 7: 1-9. |
| [21] |
Liang JW, Fang ZH, Li QS. Effect of metformin combined with paclitaxel on apoptosis and AMPK signaling in human breast cancer cells[J]. Chin J Pathophys (中国病理生理杂志), 2018, 34: 2186-2196. |
| [22] |
Nimesh S, Chandra R. Guanidinium-grafted polyethylenimine: an efficient transfecting agent for mammalian cells[J]. Eur J Pharm Biopharm, 2008, 68: 647-655. DOI:10.1016/j.ejpb.2007.09.008 |
| [23] |
Zhu LY, Tang CY, Yu JD, et al. Impact of Coix seed oil on fluorescence excretion pharmacokinetics and protein expression in doxorubicin-resistant cells MCF-7/DOX[J]. Acta Pharm Sin (药学学报), 2018, 53: 84-89. |
| [24] |
Khan M, Ong ZY, Wiradharma N, et al. Advanced materials for co-delivery of drugs and genes in cancer therapy[J]. Adv Healthc Mater, 2012, 1: 373-372. DOI:10.1002/adhm.201200109 |
| [25] |
Gao H, Yang Z, Zhang S, et al. Glioma-homing peptide with a cell-penetrating effect for targeting delivery with enhanced glioma localization, penetration and suppression of glioma growth[J]. J Control Release, 2013, 172: 921-928. DOI:10.1016/j.jconrel.2013.10.002 |
| [26] |
Marinello PC, Panis C, Silva TNX, et al. Metformin prevention of doxorubicin resistance in MCF-7 and MDA-MB-231 involves oxidative stress generation and modulation of cell adaptation genes[J]. Sci Rep, 2019, 9: 1-11. DOI:10.1038/s41598-018-37186-2 |
| [27] |
Daugan M, Dufay Wojcicki A, Dhayer B, et al. Metformin: an anti-diabetic drug to fight cancer[J]. Pharmacol Res, 2016, 113: 675-685. DOI:10.1016/j.phrs.2016.10.006 |
| [28] |
Elhissi AM, Karnam KK, Danesh-Azari MR, et al. Formulations generated from ethanol-based proliposomes for delivery via medical nebulizers[J]. J Pharm Pharmacol, 2006, 58: 887-894. DOI:10.1211/jpp.58.7.0002 |
| [29] |
Immordino ML, Brusa P, Rocco F, et al. Preparation, characterization, cytotoxicity and pharmacokinetics of liposomes containing lipophilic gemcitabine prodrugs[J]. J Control Release, 2004, 100: 331-346. DOI:10.1016/j.jconrel.2004.09.001 |
| [30] |
Sekiguchi Y, Owada J, Oishi H, et al. Noninvasive monitoring of β-cell mass and fetal β-cell genesis in mice using bioluminescence imaging[J]. Exp Anim, 2012, 61: 445-451. DOI:10.1538/expanim.61.445 |
| [31] |
Li J, Chen L, Du L, et al. Cage the firefly luciferin! – a strategy for developing bioluminescent probes[J]. Chem Soc Rev, 2013, 42: 662-676. DOI:10.1039/C2CS35249D |
 2019, Vol. 54
2019, Vol. 54


