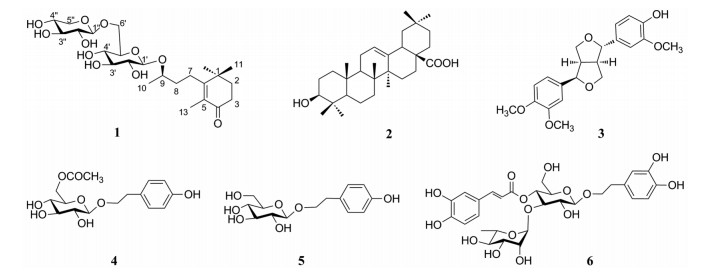
木犀科(Oleaceae)木犀属(Osmanthus)植物全世界共有30种, 主要分布于亚洲东部和北美洲东南部。桂花(Osmanthus fragrans)属于木犀属植物, 主要分布在我国大陆长江以南地区, 故我国是桂花的分布中心。桂花是深受我国人民喜爱的一种观赏性植物, 被评为中国十大名花。经过上千年的引种和人工培育, 桂花已经形成了多达上百个品种。根据桂花的开花季节以及花色, 桂花被分为金桂、银桂、丹桂和四季桂等4个品种群[1]。除观赏外, 桂花还被用于制作风味食品以及被用于化妆品。近年来, 对桂花的化学成分及药理活性有一些研究, 结果发现桂花中含有木脂素、苯丙素和环烯醚萜等类型的成分[2, 3], 其中一些成分显示有抗氧化、抑制β-分泌酶或NO释放等活性[4-6]。丹桂(Osmanthus fragrans var. aurantiacus)为桂花的一个变种, 其花色呈丹红色, 是桂花各品种中花色最深的品种, 是丹桂品种群的代表品种。本课题组长期对不同品种桂花、不同部位等开展化学成分及药理活性研究[7-10]。由于丹桂的资源非常丰富, 为了进一步开发丹桂资源, 同时, 为了发现丹桂中的活性成分, 课题组对丹桂干花进行了较为系统的化学成分研究。结果从丹桂干花的95%乙醇提取物中分离并鉴定了6个成分(1~6), 其中1为新化合物, 所有化合物均为首次从丹桂中得到(图 1)。
|
Figure 1 The structures of compounds 1-6 |
化合物1:无固形粉末, Molish反应呈阳性; [α] -27.3 (c 0.116, MeOH); mp 115.5~120.0 ℃; 紫外光谱λmaxMeOH nm (logε): 250 (2.81);红外光谱νmaxnear cm-1: 3 363 (-OH)、2 923 (-CH2-)、1 645 (C=O)、1 421 (C=C), 提示1中含有羟基、羰基和双键。HR-ESI-MS显示1的准分子离子峰m/z 527.246 8 [M+Na]+, (计算值527.246 8), 确定1的分子式为C24H40O11, 不饱和度Ω = 5。
1的1H NMR谱中显示了4个甲基信号δΗ 1.17 (6H, s), 1.73 (3H, s), 1.27 (3H, d, J = 6.4 Hz); 4个亚甲基信号δΗ 1.64 (2H, m), 1.78 (2H, t, J = 6.8 Hz), 2.41 (2H, t, J = 6.8 Hz), 2.26、2.51 (2H, m); 2个糖的端基氢信号δΗ 4.32 (1H, d, J = 7.6 Hz)和4.34 (1H, d, J = 8.0 Hz)。1的13C NMR谱、DEPT谱、结合HSQC显示13个苷元碳信号, 包括4个甲基碳信号δC 12.0、22.2、27.4和27.4; 4个亚甲基碳信号δC 27.8、35.2、36.7和38.6; 10个含氧取代叔碳信号δC 78.3、77.9、77.8、77.1、75.4、75.0、71.6、71.3、69.9、67.1; 1个季碳信号δC 37.8, 1个酮羰基碳信号δC 201.7, 以及2个烯碳信号δC 131.8、168.7; 2个糖的端基碳信号δC 104.4和105.7。上述1H、13C NMR数据提示1可能为含有两个单糖基的苷类化合物。
将1的1H、13C NMR数据与文献对照, 发现1与(9R)- 9-hydroxymengastigman-5-en-4-one-9-O-primeveroside (A)[11]的NMR数据相似。进一步比较两者的NMR数据, 发现1的C-8 (δC 36.7)的信号较A的C-8 (δC 37.3)向高场移动了0.6个化学位移值单位, C-9 (δC 77.9)、C-10 (δC 22.2)和Glc-1' (δC 104.4)的信号较A的C-9 (δC 76.0)、C-10 (δC 20.0)和Glc-1' (δC 102.5)分别向低场移动了1.9、2.2和1.9个化学位移值单位。提示1的C-9构型可能与A不一致。将1进行酸水解, 得到1的苷元(B), B的比旋光度[α] +5.6 (c 0. 35, CHCl3), 与文献[12] [α] +8.1 (c 0.4, CHCl3)接近, 证明B为9S-构型。最终确定1的苷元为单环降倍半萜(9S)-9-hydroxymengastigman-5-en-4-one。
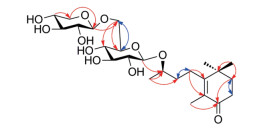
1经酸水解、中和后的水液部分, 经薄层色谱分析, 确定含有D-葡萄糖和D-木糖。进一步将获得的中和后的水液部分蒸馏除水, 然后乙酰化。乙酰化产物与乙酰化D-葡萄糖和乙酰化D-木糖标准品进行气相色谱分析比较, 进一步证实1中所含有的单糖为D-葡萄糖和D-木糖。1的1H NMR显示, 两个单糖的端基氢偶合常数分别为7.6 Hz和8.0 Hz, 提示两个单糖的端基碳构型均为β-构型。在1的非去偶HSQC谱中, 观察到D-葡萄糖和D-木糖的端基碳氢偶合常数JC-H均为162 Hz, 进一步证实D-葡萄糖和D-木糖的端基碳构型均为β-构型。通过1的HMBC谱(图 2), 可观察到δH 4.32 (1H, d, J = 7.6 Hz, 1-H of D-Xyl)与δC 69.9 (C-6' of D-Glc)存在远程相关, 证实D-木糖的C-1''应与D-葡萄糖的C-6'相连, 即为β-D-木糖基-(1→6)-β-D-葡萄糖双糖(樱草糖, primeverose)。
|
Figure 2 The key correlations of 1H-1H COSY (H↔H) and HMBC (H→C) of 1 |
1的HMBC谱中, δH 4.34 (1H, d, J = 8.0 Hz, 1-H of D-Glc)与δC 77.9 (C-9)存在远程相关, 表明D-葡萄糖的C-1'应连接在苷元的C-9。
综上分析, 确定1为降倍半萜双糖苷(9S)-9-hydroxymengastigman-5-en-4-one-9-O-primeveroside, 该化合物为一新化合物。
根据1的1H、13C NMR, 1H-1H COSY, HSQC以及HMBC谱, 对1的1H和13C信号全部进行了归属(表 1)。
| Table 1 1H (400 MHz) and 13C NMR (100 MHz) data of 1 in methanol-d4 |
Bruker AV-400和AV-600核磁共振仪(美国Varian, 以CD3OD、CDCl3、DMSO-d6为溶剂, TMS为内标); Nicolet 6700红外分光光度计(Thermo Electron Corporation, Waltham, USA); AmaZon SL质谱仪(Bruker Corporation, USA); GL-3000半制备高效液相色谱仪(Gelai Precision Instruments Co., Ltd., Chengdu China); 薄层色谱硅胶GF254和柱色谱用硅胶G (青岛海洋化工有限公司, 100~200目、200~300目); MCI CHP-20P (75~150 μm, 日本Mitsubishi公司); GC-2010 (HP-1:17 m×0.2 mm×0.11 μm, Agilent, Santa Clara, CA); 丹桂干花, 2017年10月采自四川成都都江堰市, 经四川大学华西药学院天然药物化学黄静教授鉴定为丹桂Osmanthus fragrans var. aurantiacus, 凭证标本(GH20171008)保存于四川大学华西药学院天然药物学系(药学科教大楼806室)。
1 提取与分离取丹桂干花4.7 kg, 用95%乙醇浸润10 min后, 用95%乙醇连续回流提取1.5 h, 过滤, 滤液减压浓缩回收溶剂后, 得到乙醇浸膏410 g; 乙醇浸膏在室温下用甲醇复溶, 过滤、浓缩得到甲醇浸膏360 g。甲醇浸膏经硅胶(200~300目)柱色谱, 用二氯甲烷-甲醇(30:1、20:1、10:1、5:1、1:1、0:1)梯度洗脱, 薄层色谱检查后合并相同部分, 得到Frs.1~8。Fr.3 (15.6 g)经反复硅胶柱色谱得到化合物2 (6 mg)。Fr.4 (121.7 g)经反复硅胶柱色谱得到化合物3 (160 mg)。Fr.5 (60 g)经反复硅胶柱色谱得到化合物4 (10 mg)。Fr.7 (50.8 g)经反复硅胶柱色谱、MCI、半制备反相高效液相色谱分离, 得到化合物1 (40 mg)、5 (30 mg)和6 (40 mg)。
2 化合物的酸水解、衍生化及GC分析称取20 mg化合物1, 加入10% H2SO4, 95 ℃条件下加热3 h, 用10% NaOH调pH = 7后, 用CHCl3萃取3次, 每次3 mL。水层减压浓缩, 再用MeOH溶解过滤得到单糖。分别取单糖、D-葡萄糖对照品1 mg和D-木糖对照品1 mg, 分别加入1 mL无水吡啶、1 mL乙酸酐和0.5 mg DMAP, 室温下搅拌3 h, 加水终止反应。反应液用CH2Cl2萃取3次, 每次1 mL, 得到单糖样品及对照品的乙酰化衍生物。然后进行气相色谱分析, 色谱条件如下。色谱柱: HP-1色谱柱, 进样器和检测器温度均为250 ℃。程序升温:从150到250 ℃, 升温速率: 3 ℃·min-1。单糖样品中D-木糖的保留时间为14.609 min, 与D-木糖对照品的保留时间(tR 14.603 min)基本一致; D-葡萄糖的保留时间为22.071 min, 与D-葡萄糖对照品的保留时间(tR 22.126 min)基本一致。
3 结构鉴定化合物1:无固形粉末, Molish反应呈阳性; [α] -27.3 (c 0.116, MeOH); mp 115.5~120.0 ℃; 紫外光谱λmaxMeOH nm (logε): 250 (2.81);红外光谱νmaxnear cm-1: 3 363 (-OH)、2 923 (-CH2-)、1 645 (C=O)、1 421 (C=C); HR-ESI-MS显示1的准分子离子峰m/z 527.246 8 [M+Na]+ (计算值527.246 8)。1H NMR (400 MHz, CD3OD)和13C NMR (100 MHz, CD3OD)数据见表 1。
化合物2 (齐墩果酸):白色粉末, Liebermann-Burchard反应呈阳性, 1H NMR (400 MHz, DMSO-d6) δH 5.16 (1H, brs, 12-H), 1.09, 0.89, 0.87, 0.88, 0.85, 0.71, 0.67 (3H each, s, 23, 27, 29, 30, 25, 24, 26-H)。13C NMR (100 MHz, DMSO-d6) δC 179.0 (C-28), 144.3 (C-13), 122.0 (C-12), 77.3 (C-3), 55.2 (C-5), 44.5 (C-9), 46.1 (C-17), 46.0 (C-19), 41.8 (C-14), 41.2 (C-18), 39.3 (C-8), 38.8 (C-4), 38.5 (C-1), 37.0 (C-10), 33.8 (C-21), 33.3 (C-29), 32.9 (C-7), 32.5 (C-22), 30.8 (C-20), 28.7 (C-23), 27.6 (C-15), 27.4 (C-2), 26.1 (C-27), 23.8 (C-30), 23.4 (C-16), 23.0 (C-11), 18.5 (C-6), 17.3 (C-26), 16.5 (C-24), 15.6 (C-25)。
化合物3 (连翘脂素):白色粉末, FeCl3-K3[Fe(CN)6]反应呈阳性, 提示化合物3中含有酚羟基。1H NMR (400 MHz, CDCl3) δH 6.85~6.95 (1H, m, Ar-H), 4.87 (1H, d, J = 5.6 Hz, 7'-H), 4.43 (1H, d, J = 7.2 Hz, 7-H), 4.12, 3.83 (2H, m, 9-H), 3.86, 3.37 (2H, m, 9'-H), 3.33 (1H, m, 8'-H), 2.90 (1H, m, 8-H), 三个甲氧基信号: 3.89 (3H, s, -OCH3), 3.90 (3H, s, -OCH3), 3.91 (3H, s, -OCH3); 13C NMR (100 MHz, CDCl3) δC 148.8 (C-3'), 148.0 (C-3), 146.7 (C-4'), 145.3 (C-4), 133.0 (C-1), 130.9 (C-1'), 119.1 (C-6), 117.1 (C-6'), 114.2 (C-5), 111.0 (C-5'), 108.9 (C-2), 108.5 (C-2'), 87.7 (C-7), 82.0 (C-7'), 71.0 (C-9'), 69.7 (C-9), 56.0, 55.9, 55.9 (OMe-3, 3', 4'), 54.5 (C-8), 50.1 (C-8')。
化合物4 (红景天苷酯):白色粉末, FeCl3-K3[Fe(CN)6]反应呈阳性, 提示化合物4中含有酚羟基。1H NMR (400 MHz, DMSO-d6) δH 7.03 (2H, d, J = 8.4 Hz, 2, 6-H), 6.66 (2H, d, J = 8.4 Hz, 3, 5-H), 5.15 (1H, d, J = 5.2 Hz, 1'-H), 5.04 (2H, m, 8-H), 4.24 (2H, m, 7-H), 3.61~4.24 (4H, m, 2'~5'-H), 2.97~3.16 (3H, m, 2'~4'-OH), 2.73 (2H, m, 6'-H), 2.01 (3H, s, COCH3); 13C NMR (400 MHz, DMSO-d6) δC 170.8 (CO), 156.1 (C-4), 130.2 (C-2), 130.2 (C-6), 129.0 (C-1), 115.5 (C-3), 115.5 (C-5), 103.1 (C-1'), 76.9 (C-3'), 74.0 (C-2'), 73.8 (C-5'), 70.8 (C-8), 70.4 (C-4'), 64.1 (C-6'), 35.3 (C-7), 21.1 (CH3)。
化合物5 (红景天苷):白色块晶, FeCl3-K3[Fe(CN)6]反应呈阳性, 提示化合物5中含有酚羟基。1H NMR (400 MHz, DMSO-d6) δH 7.04 (2H, d, J = 8.4 Hz, 2, 6-H), 6.67 (2H, d, J = 8.4 Hz, 3, 5-H), 4.88~4.97 (3H, m, 2'~4'-OH), 4.48 (1H, t, J = 5.7 Hz, 6'-OH), 4.18 (1H, d, J = 8.0 Hz, 1'-H), 2.95~3.89 (8H, m, 2'~6'-H), 2.75 (2H, m, 7-H); 13C NMR (100 MHz, DMSO-d6) δC 156.0 (C-4), 130.2 (C-2), 130.2 (C-6), 129.1 (C-1), 115.5 (C-3), 115.5 (C-5), 103.3 (C-1'), 77.3 (C-5'), 77.3 (C-3'), 73.9 (C-2'), 70.6 (C-8), 70.4 (C-4'), 61.6 (C-6'), 36.3 (C-7)。
化合物6 (类叶升麻苷):黄色粉末, FeCl3-K3[Fe(CN)6]反应呈阳性, 提示化合物6中含有酚羟基。1H NMR (400 MHz, MeOH-d4):咖啡酰单元: δH 7.40 (1H, d, J = 16.0 Hz, 7-H), 6.92 (1H, d, J = 2.0 Hz, 2-H), 6.82 (1H, dd, J = 8.4, 2.0 Hz, 6-H), 6.65 (1H, d, J = 8.4 Hz, 5-H), 6.13 (1H, d, J = 16.0 Hz, 8-H); 苯乙醇单元: δH 6.55 (1H, d, J = 2.0 Hz, 2-H), 6.53 (1H, d, J = 8.0 Hz, 5-H), 6.42 (1H, dd, J = 8.0, 2.0 Hz, 6-H), 2.64 (2H, m, 7-H), 3.56 (1H, m, 8a-H), 3.87 (1H, m, 8b-H); 葡萄糖单元: δH 4.23 (1H, d, J = 8.0 Hz, 1-H); 鼠李糖单元: δH 0.93 (3H, d, J = 6.0 Hz, 6-H), 5.03 (1H, br s, 1-H); 13C NMR (100 MHz, MeOH-d4):咖啡酰单元: δC 167.5 (CO), 149.3 (C-4), 147.2 (C-3), 146.4 (C-7), 127.1 (C-1), 122.7 (C-6), 116.2 (C-5), 114.8 (C-2), 114.4 (C-8);苯乙醇单元: δC 145.7 (C-3), 144.7 (C-4), 130.9 (C-1), 120.8 (C-6), 116.8 (C-2), 116.0 (C-5), 71.7 (C-8), 36.1 (C-7);葡萄糖单元: δC 103.7 (C-1), 80.9 (C-3), 75.7 (C-2), 75.6 (C-6), 70.1 (C-4), 61.8 (C-6);鼠李糖单元: δC 102.4 (C-1), 73.2 (C-4), 71.8 (C-2), 71.5 (C-3), 69.9 (C-5), 18.2 (C-6)。
化合物2~6:分别与对照品进行共薄层色谱分析, 或与文献比较, 最终确定为齐墩果酸(2)[13]、连翘脂素(3)[14]、红景天苷酯(4)[15]、红景天苷(5)[16]和类叶升麻苷(6)[17]。
| [1] |
Liu LC, Xiang QB. Research progress on Osmanthus Genus[J]. J Nanjing Forest Univ (Nat Sci Ed) (南京林业大学学报·自然科学版), 2007, 27: 84-88. |
| [2] |
Machida K, Yamauchi M, Kikuchi M. Studies on the constitutes of Osmanthus species. XXⅡ. Two new secoiridoid glycosides from the leave of Osmanthus fragrans Lour. var. aurantiacus Makino[J]. J Tohoku Pharm Univ, 2009, 56: 33-36. |
| [3] |
Machida K, Sakamoto S. Two new neolignan glycosides from leaves of Osmanthus heterophyllus[J]. J Nat Med, 2009, 63: 227-231. DOI:10.1007/s11418-009-0315-y |
| [4] |
Lee DG, Choi JS, Yeon SW, et al. Secoiridoid glycoside from the flowers of Osmanthus fragrans var. aurantiacus Makino inhibited the activity of |
| [5] |
Lee DG, Lee SM, Bang MH, et al. Lignans from the flowers of Osmanthus fragrans var. aurantiacus and their inhibition effect on NO production[J]. Arch Pharm Res, 2011, 34: 2029-2035. DOI:10.1007/s12272-011-1204-y |
| [6] |
Zhang XP. Study on the Antioxidant Activity of Polygonum cuspidatum Rhizoma and Osmanthus fragrans (Thunb.) Lour Pulp (虎杖根茎和桂花果肉的抗氧化活性初探)[D]. Guilin: Guangxi Normal University, 2008.
|
| [7] |
Tang M, Tan XY, Zhong XM, et al. Chemical constituents from the flowers of Osmanthus fragrans'Rixianggui'[J]. West China J Pharm (华西药学杂志), 2009, 24: 010-013. |
| [8] |
Zhang X, Qin YQ, Zhang CY, et al. Studies on the chemical components of the roots of Osmanthus fragrans 'Rixianggui' (Ⅲ)[J]. Chin J Synth Chem (合成化学), 2016, 24: 728-731. |
| [9] |
Qiao CL, Qin YQ, Zhang CY, et al. Studies on the chemical components of the seeds of Osmanthus fragrans 'Bayuegui'[J]. Chin J Synth Chem (合成化学), 2015, 23: 854-857. |
| [10] |
Huan M, Liu M, Xu HR, et al. Studies on the chemical components of the roots of Osmanthus fragrans'Rixianggui'(Ⅱ)[J]. Chin J Synth Chem (合成化学), 2013, 21: 689-691. |
| [11] |
Otsuka H, Tamaki A. Platanionosides D-J: megastigmane glycosides from the leaves of Alangium platanifolium (SIEB.et ZUCC.) HARMS var. platanifolium[J]. Chem Pharm Bull, 2002, 50: 390-394. DOI:10.1248/cpb.50.390 |
| [12] |
Lin TC, Cheng YS, Fang JM. Terpenes and lignans from leaves of Chamaecyparis formosensis[J]. Phytochemistry, 1999, 51: 793-801. DOI:10.1016/S0031-9422(99)00074-6 |
| [13] |
Mahato SB, Kundu AP. 13C-NMR spectra of pentacyclie triterpenoids-a compilation and some salient features[J]. Phytochemistry, 1994, 37: 1517-1575. DOI:10.1016/S0031-9422(00)89569-2 |
| [14] |
Luo B, Zhang JZ. Study on chemical constituents of extract of Forsythia suspense[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 143-146. |
| [15] |
Qiao CL, Qin YQ, Zhang CY, et al. Studies on the chemical components of the seeds of Osmanthus fragrans'Bayuegui'[J]. Chin J Synth Chem (合成化学), 2015, 23: 854-857. |
| [16] |
Ni FY, Chen Z, Xu QM, et al. Chemical constituents from Rhodiola sachalinensis[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 798-802. |
| [17] |
Gao YP, Zhong GY, Shen YH. Chemical constituents from Incarvillea sinensis var. przewalskii[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 712-716. |
 2019, Vol. 54
2019, Vol. 54


