2. 中国医学科学院药物研究所, 神经科学中心, 北京 100050
2. Institute of Materia Medica, Neuroscience Center, Chinese Academy of Medical Sciences, Beijing 100050, China
抑郁症是一种目前备受关注的精神疾病, 其核心症状是明显可见的情绪低落、快感缺失、饮食和睡眠作息异常, 通常被认为由生理遗传因素、环境因素和心理因素等多方面导致。根据世界卫生组织的数据, 由于抑郁症患者的身体或精神残疾数量的上升, 抑郁症已成为全世界范围内负担最重的疾病之一[1], 由此而带来的种种压力, 不单单给患者及其家属带来痛苦, 宏观来说也对社会发展产生不利影响。目前针对抑郁症的临床治疗手段通常有药物治疗和心理疗法。从药物治疗角度来讲, 常用的单胺氧化酶抑制剂、三环类抗抑郁药等抗抑郁药物普遍具有患者依从性差、靶点单一、不良反应多等缺点[2]。
有大量古代医学文献记载, 传统中医药在抑郁症的治疗用药方面有着丰富的经验。由于中药中化学成分的复杂性及药理靶点的多样性, 结合中医所特有的理论指导及辨证思维, 天然药物和中药方剂的抗抑郁作用愈加受到人们的关注。人参在中国自古被誉为“百草之王”, 是具备“滋阴补生、扶正固本”之用的极品中草药。《神农本草经》中提到人参有“主补五脏, 安精神, 定魂魄, 止惊悸, 明目, 开心益智之功效”。生物活性包括增强活力、提高抗应激力、抗衰老能力以及免疫调节活性。此外, 人参还具有广泛的神经营养和神经保护作用, 包括预防缺血/再灌注损伤、阿尔茨海默病和抗抑郁作用等。其首要活性成分是人参皂苷(ginsenosides)。许多学者通过动物模型和行为学实验发现, 人参总皂苷、人参皂苷Rg1、Rb1、Re、Rg3等及其代谢物原人参二醇[20(S)-原人参二醇]都具有一定的抗抑郁作用。其作用机制涉及下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴和单胺类神经递质(monoamine neurotransmitter, MA)调节等。
1 人参皂苷的抗抑郁作用机制当前抑郁症的发病原因还不清楚, 由此产生的学说众多, 大多围绕神经内分泌系统、神经免疫系统、神经递质系统以及神经营养物质来展开研究, 因此, 这些假说与HPA轴功能失调、单胺递质及其受体的调节受阻、神经元可塑性调节及神经元再生障碍、炎症因子释放增加等有关。已有文献报道, 人参皂苷的抗抑郁机制主要涉及改善HPA轴调节紊乱, 提高脑源性营养神经因子与单胺类神经递质水平, 降低异常表达的细胞因子等(图 1)。
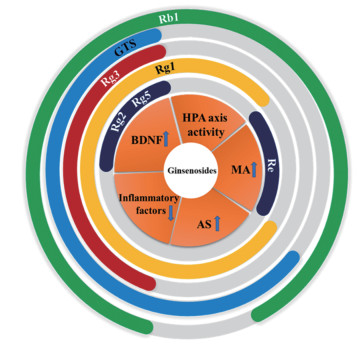
|
Figure 1 The anti-depression mechanisms of ginsenosides. HPA: Hypothalamic-pituitary-adrenal; BDNF: Brain derived neurotrophic factor; AS: Astrocyte; MA: Monoamine neurotransmitter; GTS: Ginseng total saponins; Rb1: Ginsenoside Rb1; Re: Ginsenoside Re; Rg: Ginsenoside Rg |
近年来, 大量的研究表明HPA轴参与了多种情绪和认知障碍的病理生理学。神经内分泌研究发现, 重度抑郁症患者的HPA轴过度活跃, 抑郁症的发病率和HPA轴失调之间存在着一定的关系[3]。应激引发HPA轴的过度活跃, 使得由肾上腺皮质释放的糖皮质激素增加。目前已有学者从调节HPA轴的角度, 叙述总结了对人参总皂苷和皂苷单体两类成分的药理作用。而抑郁症主要是由于HPA轴负反馈调节机制被损害, 神经细胞被过度释放的糖皮质激素损坏而导致[4]。此外研究显示, 抑郁症患者血浆脑源性神经营养因子(brain derived neurotrophic factor, BDNF)水平下降, 有自杀想法的抑郁症患者外周单核细胞BDNF mRNA的含量显著低于正常人, 并且发现随着抑郁症的程度加深, BDNF mRNA含量的下降幅度则越大, 证实BNDF在抑郁症的发病机制中起着重要作用[5]。
Liu等[6]通过测定大鼠血清中皮质酮(corticosterone, CORT)、糖皮质激素受体(glucocorticoid receptor, GR)、盐皮质激素受体(mineralocorticoid receptor, MR)和脑组织中BDNF的mRNA水平, 探讨人参皂苷的抗抑郁作用机制。结果发现, 慢性不可预知应激6周后的大鼠表现为糖水偏好指数显著下降, 强迫游泳测试(forced swimming test, FST)不动时间显著增加等抑郁样行为。随后的生化检测发现, 具有抑郁样行为的大鼠血清中CORT水平增加, 海马GR、海马及大脑皮层BDNF mRNA水平也都明显降低。而在制备抑郁模型的同时给予人参皂苷低、中、高(12.5、25、50 mg·kg-1) 3个剂量6周后发现, 人参皂苷能明显改善由慢性应激所致的大鼠抑郁样行为及生化指标变化, 且随剂量升高效果愈明显。提示人参皂苷的抗抑郁作用机制可能与调节HPA轴功能、提高海马和大脑皮层BDNF mRNA水平有关。
1.2 通过调节细胞因子与改变星形胶质细胞数抗抑郁抑郁症发病的同时, 免疫系统被激活也受到了研究人员的广泛关注, 主要特征为患者血浆肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)、白介素1β (interleukin-1β, IL-1β)水平升高。这些体内异常表达的细胞因子可激活核转录因子κB (nuclear factor-κB, NF-κB)这一下游信号分子通路, 将信号透过血脑屏障传输至中枢神经, 影响中枢神经元活动的平衡, 从而加速抑郁症状的产生, 抑郁症状有明显改善的患者其IL-6水平显著下降[7], 因而说明可以通过减少细胞因子的分泌治疗抑郁症。星形胶质细胞(astrocyte, AS)是中枢神经系统(central nerve system, CNS)的主要成分之一, 与CNS疾病有紧密的联系, 它含有的神经营养因子, 具有长期营养支持神经元的作用。在针对抗抑郁药物研究中, 通常会发现其抗抑郁作用可能与神经保护及促神经元再生和保护星形胶质细胞等机制有关。以葡萄糖形式供应能量的星型胶质细胞, 参与谷氨酸转运和代谢, 调节N-甲基-D-天冬氨酸受体的活性, 调整炎症反应失衡。星形胶质细胞功能障碍是抑郁症发病的要素之一。An等[8]用脂多糖(lipopolysaccharide, LPS)诱导的神经炎症型抑郁模型, 对人参总皂苷(ginseng total saponins, GTS)的抗抑郁作用进行评估, 结果表明, GTS对LPS诱导抑郁行为的恢复平行于抑郁模型小鼠海马中IL-1β、IL-6和TNF-α的水平降低, 且发现GTS可显著抑制LPS刺激小鼠体内各类促炎因子的产生。Chen等[9]通过实验发现, GTS的给予可明显对抗皮质酮给药引起的抑郁样行为, 高剂量的GTS可逆转皮质酮诱导的海马胶质纤维酸性蛋白阳性(glial fibrillary acidic protein-positive, GFAP+)星形胶质细胞细胞数和海马体积的下降, 而且可以检测出GTS给药组海马GFAP+细胞突起长度和胞浆体积的缩减现象被显著改善, 从海马星型胶质细胞结构可塑性角度证明了人参抗抑郁作用。
1.3 增加脑内单胺类神经递质含量抑郁发病机制单胺类神经递质学说中多巴胺能及肾上腺能神经系统功能异常, 体现在5-羟色胺(5-hydroxytryptamine, 5-HT)等MA释放减少, 并伴随与其相关的转运体、受体及酶的异常变化。He等[10]采用高效液相色谱法, 测定血清单胺类神经递质及其代谢产物在抑郁症及抑郁共病焦虑障碍中水平的变化。结果表明, 抑郁症患者血清中去甲肾上腺素和肾上腺素浓度比对照组显著降低, 该实验可证实单胺类神经递质减少所致抑郁的假说。Jiang等[11]给予慢性温和不可预知性应激(chronic unpredictable mild stress, CUMS)模型小鼠人参活性成分——达玛烷皂苷(dammarane sapogenin, DS), 发现与抑郁模型小鼠相比, 口服DS可显著改善抑郁行为。脑组织及血清生化分析显示, DS治疗恢复了由CUMS引起的海马神经递质——血清素、多巴胺(dopamine, DA)、去甲肾上腺素(norepinephrine, NE)、氨基丁酸等单胺类神经递质浓度下降, 从而证实人参可通过增加脑内单胺类神经递质含量发挥抗抑郁的作用。
2 人参抗抑郁有效部位人参为五加科植物人参Panax ginseng C.A. Mey的根。皂苷类组分被认为是人参的主要活性成分。人参皂苷可以按照结构分为原人参二醇类、原人参三醇类和齐墩果酸类。原人参二醇类主要有: Rb1、Rc、Rd、Rg3;原人参三醇类主要有: Re、Rf、Rg1、Rg2、Rh1;齐墩果酸类为Ro。至目前为止, 已经有广泛的对人参总皂苷以及人参皂苷单体或苷元抗抑郁药效以及作用机制的研究报道。
2.1 人参总皂苷在人参皂苷抗抑郁作用研究中, 人参总皂苷多由动物实验证实其有抗抑郁的功能。Chen等[12]在连续22天给予皮下注射皮质酮诱导的小鼠抑郁模型中发现, 给予GTS可缓解小鼠的抑郁样行为, 且不改变升高的血清皮质酮水平。在机制研究方面, Dang等[13]采用FST和慢性轻度应激(chronic mild stress, CMS)两种经典动物模型, 对GTS的抗抑郁作用进行了探索, 观察到GTS显著缩短了小鼠FST静止时间, 还逆转了CMS大鼠在饥饿环境下的糖水偏好指数以及运动活动的降低和进食潜伏期的延长情况。此外, GTS几乎完全逆转了CMS诱导的海马单胺类神经递质浓度和BDNF表达的下降, 表明其抗抑郁机制可能是通过提高海马单胺神经递质浓度和BDNF表达介导的。
2.2 人参皂苷Rg1人参皂苷Rg1是人参的代表成分, 具有人参的许多生物活性。Huang等[14]给予小鼠不同剂量的Rg1, 发现在急性应激实验中, 3个剂量组均能够显著减少FST中小鼠的不动时间。慢性应激后, Rg1的3个剂量均能显著减少大鼠在FST中的不动时间, 增加糖水偏好实验中糖水消耗的百分比, 并延长动物睡眠时间。Zhu等[15]在蔗糖偏好和强迫游泳实验中发现, 长期给予人参皂苷Rg1的抑郁模型大鼠其抑郁样行为显著改善。并发现人参皂苷Rg1通过介导反应元件结合蛋白(CAMP-response element binding protein, CREB)的磷酸化水平, 以提高前额皮质内神经营养因子的表达来产生抗抑郁效应。Mou等[16]利用小鼠CUMS模型和性腺切除模型, 进一步验证分析Rg1的抗抑郁作用, 结果发现Rg1能显著降低强迫游泳及悬尾实验中小鼠的不动时间, 降低小鼠血清皮质酮水平, 上调血清睾酮水平以及前额皮质和海马中的GR蛋白水平, 证实人参皂苷Rg1可通过调节HPA和下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis, HPG)表现出抗抑郁活性。Rg1能明显减轻大鼠抑郁样行为的机制也被解释为长期Rg1处理可改善前额叶皮层中星形胶质细胞缝隙连接的超微结构, 对脑内缝隙连接通道的功能活性有良好的影响, 表明Rg1可能是通过保护前额皮质内的星形胶质细胞缝隙连接功能发挥抗抑郁作用的[17, 18]。有学者采用透射电镜, 观察基底外侧杏仁核(basolateral amygdala, BLA)内的神经元突触, 检测突触可塑性相关蛋白CREB和BDNF, 结果提示人参皂苷Rg1通过激活BLA内CREB-BDNF系统, 可能具有神经保护和抗抑郁作用, 其改善抑郁样行为可能涉及基底外侧杏仁核内突触相关因子miR-134的调节[19]。另外, Fan等[20]发现, 人参皂苷Rg1的慢性预处理可以通过减轻促炎因子的过度表达和小胶质细胞、星形胶质细胞的激活, 显著抑制炎症通路活性, 以减轻CUMS模型大鼠的抑郁行为。
2.3 人参皂苷Rb1Wang等[21]发现在CUMS抑郁模型的基础上, 人参皂苷Rb1连续21天给药后, 大鼠NE、5-HT、DA等单胺类神经递质及其代谢产物5-羟基吲哚乙酸的水平明显上调, 从而起到抗抑郁作用。Liu等[22]研究发现, 接受慢性应激处理的大鼠在旷场实验中表现出自发运动减少, 糖水偏好百分比以及生化检测中海马-杏仁核组织微管相关蛋白-2 (microtubule-associated protein 2, MAP-2)的水平也都低于对照组, 然而在由人参皂苷Rb1干预的大鼠中, 以上的检测指标均低于对照组, 但比模型组较高, 说明人参皂苷Rb1可能通过影响海马、杏仁核MAP-2的表达产生抗抑郁作用。近期有研究显示, 在CUMS联合LPS制备的抑郁C57BL/6J小鼠模型中发现, 接受Rb1治疗的小鼠在强迫游泳和悬尾实验中的不动时间明显缩短, 并出现血清中促肾上腺皮质激素和CORT含量显著降低的现象, 除此之外, 高剂量的Rb1还成功逆转了抑郁模型小鼠TNF-α炎症因子的升高与海马中BDNF表达水平的下降[23]。因此考虑人参皂苷Rb1可能参与调节HPA轴、炎症通路及BNDF而发挥抗抑郁效应。
2.4 其他药理研究显示, 大鼠口服20(S)-原人参二醇[20(S)-PPD]后, 进行TST、FST和嗅球切除实验, 其产生的抗抑郁作用与氟西汀效应相当。且经20(S)-PPD处理的嗅球切除动物脑内MA与切除嗅球不给予药物的动物相比含量较高, 不会像氟西汀那样显著降低嗅球切除抑郁模型动物的脑组织氧化应激能力, 并且可以抑制接受嗅球切除手术动物血清中皮质酮浓度的升高, 对动物中枢神经系统的正常功能产生干扰, 提示20(S)-PPD可作为开发抗抑郁药物的备选成分[24]。人参皂苷Rg3是红参的主要成分, 对中枢神经系统具有脑缺血神经保护、抵抗神经毒性、抗抑郁等作用。有学者发现, 在FST和TST中, 给予人参皂苷Rg3的小鼠其不动时间明显低于空白对照组, 并发现Rg3完全逆转了慢性社会挫败应激诱导的海马BDNF信号通路的下调, 并且Rg3的抗抑郁作用可被BDNF信号通路抑制剂阻断。由此可知, 人参皂苷Rg3的抗抑郁效应与上调海马BDNF信号通路有关[25]。从免疫调节角度, Rg3对LPS导致的小鼠抑郁样行为有明显的改善作用, 改善了海马中色氨酸和血清素的代谢紊乱, 同时降低了促炎细胞因子和肿瘤坏死因子的含量, 提示Rg3可以有效改善免疫激活引起的抑郁样行为[26]。除此以外, 人参皂苷Re可通过调节大鼠中枢去甲肾上腺素能系统, 明显克服了应激诱导的行为缺陷[27]。人参皂苷Rg2和Rg5在小鼠体内可产生一种类似抗抑郁药物的作用, 这种作用在一定程度上是通过促进海马BDNF信号通路介导产生[28, 29]。
3 结语抑郁症属情感障碍性疾病, 即使其发病率在近几年呈上升趋势, 但其发病机制至今却尚无统一定论, 以生化指标作为抗抑郁药效的评价机制并不完善。至目前为止, 合成药物治疗仍作为对抗抑郁症的经典武器, 但抗抑郁药物治疗普遍存在发挥药效时间较长、容易引起复发、不良反应多的问题。从传统中药或天然产物角度切入研究, 为越来越多的学者探求、研制更理想的抗抑郁药物提供了新思路。人参是具有大补元气、补脾益肺、生津、安神益智功效的传统中药。大量研究已证明, 人参皂苷在治疗抑郁症方面具有显著的疗效。人参皂苷Rg1是目前研究最多的一种成分, 其介导抗抑郁效果的机制已有多种解释, 而许多其他活性成分, 如Re、Rg2和Rg5发挥作用的机制及途径还有进一步探索的空间, 且不同人参皂苷的药效缺少比较性研究。人参中的非皂苷类成分, 也可进行抗抑郁药效的探究性实验。除此之外, 通过文献调研发现, 在过去近10年, 对单一人参皂苷抗抑郁活性成分基础研究已有丰富的积累。在这一基础上, 研究人员开始将目光转至与人参相关的中药方剂或药对的临床前研究, 例如在近期, 以人参、当归、远志、刺梨子为原料的一种改良中药配方PAPZ, 被证明可通过增加BDNF蛋白表达, 提高大脑抗氧化能力, 对小鼠皮质酮诱导抑郁模型产生治疗作用[30]。朱十伟等[31]提出抗抑郁药对的理念, 以期突破中药方剂复杂的配伍规律现代研究的瓶颈。同时提到, 与人参相关的药对, 如人参-当归等研究很少。鉴于目前临床抗抑郁药物多为针对某一特定靶点, 人参皂苷抗抑郁机制的多样性则凸显出极大的优势。因此, 随着人参皂苷抗抑郁作用研究的进一步深入, 可以人参皂苷单体药效研究为基础, 尝试开发中药新药抗抑郁相关药物, 以期人参在治疗抑郁等相关情感类疾病中发挥更大的作用。
| [1] |
Smith K. Mental health: a world of depression[J]. Nature, 2014, 515: 181. |
| [2] |
Zhang F, Qin XM, Du GH, et al. Progress in study of antidepressants metabolism in vivo[J]. Acta Pharm Sin (药学学报), 2017, 52: 1791-1800. |
| [3] |
Keller J, Gomez R, Williams G, et al. HPA axis in major depression: cortisol, clinical symptomatology and genetic variation predict cognition[J]. Mol Psychiatry, 2017, 22: 527-536. DOI:10.1038/mp.2016.120 |
| [4] |
Li H, Liu SY, Wang B. Progress of the regulation effect of ginsenosides on HPA axis[J]. Acta Pharm Sin (药学学报), 2014, 49: 569-575. |
| [5] |
Lee BH, Kim YK. BDNF mRNA expression of peripheral blood mononuclear cells was decreased in depressive patients who had or had not recently attempted suicide[J]. J Affect Disord, 2010, 125: 369-373. DOI:10.1016/j.jad.2010.01.074 |
| [6] |
Liu LQ, Luo Y, Zhang RR, et al. Effects of ginsenosides on hypothalamic-pituitary-adrenal function and brain-derived neurotrophic factor in rats exposed to chronic unpredictable mild stress[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 1342-1347. |
| [7] |
Lou JS, Yang XC, Fang J, et al. The mediation of immune activation on serotonin and glutamate systems in pathological process of depression[J]. Chin Pharmacol Bull (中国药理学通报), 2009, 25: 1555-1558. |
| [8] |
An K, Hao H, Xiao Z, et al. Peripheral anti-inflammatory effects explain the ginsenosides paradox between poor brain distribution and anti-depression efficacy[J]. J Neuroinflammation, 2011, 8: 100. DOI:10.1186/1742-2094-8-100 |
| [9] |
Chen L, Wang X, Lin ZX, et al. Preventive effects of ginseng total saponins on chronic corticosterone-induced impairment in astrocyte structural plasticity and hippocampal atrophy[J]. Phytother Res, 2017, 31: 1341-1348. DOI:10.1002/ptr.5859 |
| [10] |
He YC, Zhang B, Zhai W, et al. Value of serum monoamine neurotransmitters and their metabolites in diagnosis of comorbid anxiety and depression and major depressive disorder[J]. J Third Mil Medi Univ (第三军医大学学报), 2014, 36: 806-810. |
| [11] |
Jiang N, Zhang BY, Dong LM, et al. Antidepressant effects of dammarane sapogenins in chronic unpredictable mild stress-induced depressive mice[J]. Phytother Res, 2018, 32: 1023-1029. DOI:10.1002/ptr.6040 |
| [12] |
Chen L, Dai J, Wang Z, et al. The antidepressant effects of ginseng total saponins in male C57BL/6N mice by enhancing hippocampal inhibitory phosphorylation of GSK-3β[J]. Phytother Res, 2014, 28: 1102-1106. DOI:10.1002/ptr.5103 |
| [13] |
Dang H, Chen Y, Liu X, et al. Antidepressant effects of ginseng total saponins in the forced swimming test and chronic mild stress models of depression[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2009, 33: 1417-1424. DOI:10.1016/j.pnpbp.2009.07.020 |
| [14] |
Huang Q, Chu SF, Lian XY, et al. Antidepressive-like effect of ginsenoside Rg1 and its mechanism[J]. Acta Neuropharm (神经药理学报), 2013, 3: 1-11. |
| [15] |
Zhu X, Gao R, Liu Z, et al. Ginsenoside Rg1 reverses stress-induced depression-like behaviours and brain-derived neurotrophic factor expression within the prefrontal cortex[J]. Eur J Neurosci, 2016, 44: 1878-1885. DOI:10.1111/ejn.13255 |
| [16] |
Mou Z, Huang Q, Chu SF, et al. Antidepressive effects of ginsenoside Rg1 via regulation of HPA and HPG axis[J]. Biomed Pharmacother, 2017, 92: 962-971. DOI:10.1016/j.biopha.2017.05.119 |
| [17] |
Jin C, Wang ZZ, Zhou H, et al. Ginsenoside Rg1-induced antidepressant effects involve the protection of astrocyte gap junctions within the prefrontal cortex[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2017, 75: 183-191. DOI:10.1016/j.pnpbp.2016.09.006 |
| [18] |
Ren Q, Xia CY, Wang ZZ, et al. Protective effects of ginsenoside Rg1 against corticosterone-induced primary astrocytes injury[J]. Acta Pharm Sin (药学学报), 2017, 52: 1410-1415. |
| [19] |
Yu H, Fan C, Yang L, et al. Ginsenoside Rg1 prevents chronic stress-induced depression-like behaviors and neuronal structural plasticity in rats[J]. Cell Physiol Biochem, 2018, 48: 2470-2482. DOI:10.1159/000492684 |
| [20] |
Fan C, Song Q, Wang P, et al. Neuroprotective effects of ginsenoside-Rg1 against depression-like behaviors via suppressing glial activation, synaptic deficits, and neuronal apoptosis in rats[J]. Front Immunol, 2018, 9: 2889. DOI:10.3389/fimmu.2018.02889 |
| [21] |
Wang GL, He ZM, Zhu HY, et al. Involvement of serotonergic, noradrenergic and dopaminergic systems in the antidepressant-like effect of ginsenoside Rb1, a major active ingredient of Panax ginseng C.A. Meyer[J]. J Ethnopharmacol, 2017, 204: 118-124. DOI:10.1016/j.jep.2017.04.009 |
| [22] |
Liu J, Zang W, Yuan Y, et al. Influence of ginsenoside Rb1 on expression of phosphorylated MAP-2 in hippocampus and amygdala of CUMS rat[J]. J Liaoning Univ Tradit Chin Med (辽宁中医药大学学报), 2016, 18: 47-49. |
| [23] |
Lu YY, Zhu MJ, Ni LN, et al. Establishment of CUMS + LPS induced depression model in mice and antidepressant mechanism research of ginsenoside Rb1[J]. J Yantai Univ (Nat Sci Engine Edit) (烟台大学学报(自然科学与工程版)), 2019, 32: 146-150. |
| [24] |
Xu C, Teng J, Chen W, et al. 20(S)-Protopanaxadiol, an active ginseng metabolite, exhibits strong antidepressant-like effects in animal tests[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2010, 34: 1402-1411. DOI:10.1016/j.pnpbp.2010.07.010 |
| [25] |
You Z, Yao Q, Shen J, et al. Antidepressant-like effects of ginsenoside Rg3 in mice via activation of the hippocampal BDNF signaling cascade[J]. J Nat Med, 2017, 71: 367-379. DOI:10.1007/s11418-016-1066-1 |
| [26] |
Kang A, Xie T, Zhu D, et al. Suppressive effect of ginsenoside Rg3 against lipopolysaccharide-induced depression-like behavior and neuroinflammation in mice[J]. J Agric Food Chem, 2017, 65: 6861-6869. DOI:10.1021/acs.jafc.7b02386 |
| [27] |
Lee B, Shim I, Lee H, et al. Effect of ginsenoside Re on depression- and anxiety-like behaviors and cognition memory deficit induced by repeated immobilization in rats[J]. J Microbiol Biotechnol, 2012, 22: 708-720. DOI:10.4014/jmb.1112.12046 |
| [28] |
Ren Y, Wang JL, Zhang X, et al. Antidepressant-like effects of ginsenoside Rg2 in a chronic mild stress model of depression[J]. Brain Res Bull, 2017, 134: 211-219. DOI:10.1016/j.brainresbull.2017.08.009 |
| [29] |
Xu D, Wang C, Zhao W, et al. Antidepressant-like effects of ginsenoside Rg5 in mice: involving of hippocampus BDNF signaling pathway[J]. Neurosci Lett, 2017, 645: 97-105. DOI:10.1016/j.neulet.2017.02.071 |
| [30] |
Chen H, Huang Q, Zhang S, et al. The Chinese herbal formula PAPZ ameliorates behavioral abnormalities in depressive mice[J]. Nutrients, 2019, 11: 859. DOI:10.3390/nu11040859 |
| [31] |
Zhu SW, Gao XX, Tian JS, et al. Research progress of traditional Chinese antidepressant herb-pair[J]. Acta Pharm Sin (药学学报), 2019, 54: 235-244. |
 2019, Vol. 54
2019, Vol. 54


