2. 四川省中医药科学院, 国家中医药管理局中药质量生物评价重点研究室, 四川 成都 610041;
3. 大理大学药学与化学学院, 云南 大理 671000;
4. 成都永康制药有限公司, 四川 成都 611137;
5. 中国人民解放军总医院第五医学中心, 全军中医药研究所, 北京 100039;
6. 江西中医药大学, 江西 南昌 330004
2. State Key Laboratory of Quality Evaluation of Traditional Chinese Medicine, Sichuan Academy of Traditional Chinese Medicine, Chengdu 610041, China;
3. Department of Pharmacy and Chemistry, Dali University, Dali 671000, China;
4. Chengdu Yongkang Pharmaceutical Co., Ltd., Chengdu 611137, China;
5. China Military Institute of Chinese Medicine, the Fifth Medical Centre of Chinese People's Liberation Army General Hospital, Beijing 100039, China;
6. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
中药质量评价是中医药研究领域重要的科学问题, 是确保中药临床疗效的必要基础, 深入开展物质基础及作用机制研究的重要前提, 对提升中药全产业链质量、提高产品质量一致性和可控性、保护和传承中药品牌与文化具有重要的学术价值与现实意义[1]。现行中药质量一致性评价方法较多, 包括化学评价、生物评价以及近红外光谱[2]等。目前, 化学评价方法是中药学领域普遍应用的质量评价方法, 其中, 活性成分含量与化学指纹图谱是终产品质量一致性评价的重要方法, 是国际公认的控制评价中药和天然药物质量的有效手段[3-5]。生物评价是以生物统计为工具、运用特定的实验设计、测定药物生物活性的一种方法[6]。生物评价具有药效相关、整体可控等技术优势, 符合中医药特点的质量标准控制模式及方法, 已成为中药质量标准化的重要发展方向之一[7]。
小金丸是当代中医临床治疗乳腺增生的首选中成药[8], 具有散结消肿, 化瘀止痛的功效, 临床主要用于治疗痰气凝滞所致的瘰疬、瘿瘤、乳岩、乳癖等证, 被列入国家基本药物、国家医保乙类处方药, 具有名优中成药培育的潜力与价值。近年来, 随着药理研究的深入, 小金丸适用症范围扩大, 对于甲状腺肿[9]、良性前列腺增生[10]、带状疱疹后遗神经痛、聚合型痤疮、慢性盆腔炎包块、结节性筋膜炎[11]、乙型肝炎纤维化均有良好的治疗作用[12]。
小金丸组方复杂, 由麝香、木鳖子、制草乌、枫香脂、醋乳香、醋没药、五灵脂、酒当归、地龙、京墨共10味药材组成。全方包含贵细药、树脂树胶类药物、植物药、种子类药物、动物药、粪便类药物、矿物药, 各药味均原粉入药[13]。其中, 乳香、没药主要依靠进口, 药材来源难追踪, 质量难控制; 枫香脂是枫香树的干燥树脂, 药农采收后需先熬制、晾干, 过程无统一标准, 导致不同批次枫香脂质量差异大, 甚至外观性状各异; 木鳖子去油工艺未规范, 去油程度无规定, 入药状态差异明显。五灵脂来源无法固定, 未被2015年版《中国药典》收录; 地龙野生品与饲养品交织, 来源地域跨度大, 且缺少有效的质控方法; 京墨尚无药用标准, 三味药材缺乏有效的质量控制法规, 生产企业无标准可依。综上分析, 特殊的组方药物、入药形式与原药材来源的变异性导致小金丸质量变异度大、难以控制。课题组前期建立了液相色谱质谱联用(LC-MS/MS)同时测定小金丸中10种成分含量的分析方法, 并测定了8个厂家23个批次的小金丸, 各成分含量变异系数高达56.38%~164.07%[14]。为更好地保障小金丸的质量一致性, 亟需探索适合小金丸整体质量评控的技术方法。
本研究分别从生物和化学角度对2个厂家16个批次市售小金丸进行质量一致性分析研究。鉴于小金丸组方的复杂性, 课题组建立了脂溶性和水溶性双部位指纹图谱, 并且对16个批次市售小金丸进行了抗血小板聚集生物效价、环氧化酶2 (cyclooxygenase-2, COX-2)抑制率以及指纹图谱的测定, 结合多元统计分析发现枫香脂和当归是影响指纹图谱相似度的主要因素, 并测定其抗血小板聚集和抑制COX-2活性作用, 对比思考化学检测与生物效应在小金丸成药整体质量评价中的适宜性与科学性, 文章设计思路如图 1。本研究对于探索复杂中成药整体质量评控方法具有一定的参考价值。
材料与方法仪器与试剂 Thermo Scientific UltiMate 3000高效液相色谱仪(美国赛默飞世尔科技有限公司); Welch UltiMate AQ-C18色谱柱(4.6 mm×250 mm) (月旭科技股份有限公司); BSA224S型电子分析天平(德国赛多利斯公司); KQ-300DA型数控超声波清洗器(昆山市超声仪器有限公司); AggRMA血小板聚集分析仪(美国海伦娜公司); XL5A多管架自动平衡离心机(湖南湘立科学仪器有限公司); 超声仪(上海科导超声仪器有限公司, 53 kHz); 旋转蒸发器(上海亚荣生化仪器厂); Sdenz-100F冷冻干燥机(宁波新芝生物科技股份有限公司); SpectraMax iD5多功能微孔读板机(美谷分子仪器(上海)有限公司)。乙腈为色谱纯(美国赛默飞世尔科技有限公司); 其他试剂均为分析纯。
雄性SD大鼠, SPF级, 体重240~260 g, 动物许可证号: SCXK-(湘) 2014-0011, 由长沙市天勤生物技术有限公司提供。COX-2酶联反应试剂盒购自上海碧云天生物技术有限公司。阿司匹林(批号SLBV2290)购自美国贝克曼公司; 二磷酸腺苷(ADP, 批号716E021)购自北京索莱宝科技有限公司; 原儿茶酸对照品(170822)、阿魏酸对照品(CHB180206)和花生四烯酸对照品(170217)均购自成都克洛玛生物科技有限公司, 质量分数均≥98%。
试药 收集A、B两个厂家共16个批次市售小金丸, 其样品编号及批号见表 1。
| Table 1 Sample information of collected Xiaojin pills |
富血小板血浆(PRP)和贫血小板血浆(PPP)的制备 雄性SD大鼠, 体重240~260 g, 先用苯巴比妥钠(60 mg·kg-1)麻醉, 再用2.7 mL真空采血管从腹主动脉取血, 立即置于离心机内在转速800 r·min-1、温度为18~25 ℃模式下离心15 min, 小心吸取上清液置于洁净的5 mL EP管内; 剩余血液重复操作一次, 小心吸取上清液置于前述EP管内, 得到富血小板血浆(PRP); 剩余血液在转速3 000 r·min-1模式下离心30 min, 小心吸取上清液置于另一支5 mL EP管内, 得到贫血小板血浆(PPP), 备用。PRP和PPP需要保持在18~25 ℃内, 并尽量减少扰动。本研究动物实验方案已获成都中医药大学附属医院实验动物伦理委员会批准(批准号2018BL-002)。
抗血小板聚集对照品溶液的制备 准确称取阿司匹林10.0 mg, 加0.5%二甲基亚砜(DMSO)溶液500 mL, 超声溶解, 制成0.02 mg·mL-1溶液, 并按剂间距1:0.8稀释成各个浓度的对照品溶液。
抗血小板聚集供试品溶液的制备 取小金丸适量, 研末, 准确称取粉末3 g, 置具塞锥形瓶中, 加入80%甲醇50 mL后, 超声提取30 min过滤, 滤渣提取第2次, 合并滤液, 减压回收溶剂, 浓缩液冷冻干燥得到小金丸粉末, 备用。准确称取不同批次小金丸的冷冻干燥粉末适量, 加5% DMSO溶液, 超声溶解, 4 000 r·min-1离心5 min, 取上清液制成浓度为100 mg·mL-1的小金丸供试品溶液。并按间距1:0.8稀释成各个浓度的供试品溶液。
|
Figure 1 The study flowchart |
诱导剂的制备 每瓶含有200 μmol·L-1腺苷二磷酸, 用去离子水1 mL复溶, 轻轻摇晃直到完全溶解, 作为诱导剂储备液。吸取适量储备液用生理盐水按照1:3的比例稀释储备液, 作为诱导剂工作液。复溶后的储备液保存在2~6 ℃可稳定一周或在-80 ℃下可保存3个月。工作液应在制备后3 h内使用。
活血效价计算 血小板聚集率测定过程中, 由于拮抗血小板聚集的药物使血小板最大聚集率降低, 由此可以计算药物对血小板聚集过程的最大抑制程度, 即抑制率(I, %)= (空白血浆的最大聚集率-供试品的最大聚集率) /空白血浆的最大聚集率。
根据《药品生物检定》中简化概率单位法的原理计算活血效价。实验中暂以国际公认的抗血小板聚集药物阿司匹林作为参照物质, 参考生物制品的效价设定, 阿司匹林对照品的活血效价赋值为10 000 U·mol-1, 将每个样品的4个测试浓度和相应的抑制率输入生物效价质反应计算软件, 计算不同样品的生物效价和效价的可信限率(FL)。
COX-2抑制率测定 根据课题组前期建立的小金丸COX-2酶联反应试剂盒方法制备供试品, 测定COX-2抑制率[15]。
指纹图谱标准溶液的制备 精密称取阿魏酸、原儿茶酸、花生四烯酸对照品适量, 甲醇定容, 分别配制成浓度为10.4、11.6和47.1 μg·mL-1的对照品溶液。
指纹图谱供试品溶液的制备 脂溶性部分供试品制备:小金丸粉碎, 精密称取0.6 g, 加入乙醚5 mL, 超声30 min, 过滤, 滤渣加3 mL乙醚, 超声15 min, 过滤, 2 mL乙醚洗涤滤渣, 合并滤液, 40 ℃挥干溶剂, 残渣加甲醇溶解, 甲醇定容至5 mL, 过0.22 μm滤膜, 即得脂溶性部分供试品溶液。水溶性部分供试品制备:取脂溶性样品滤渣, 挥干残留乙醚, 加入超纯水5 mL, 超声30 min, 离心, 取上清液, 过0.22 μm滤膜, 即得水溶性部分供试品溶液。
仪器工作参数 脂溶性部分测定工作参数: Welch UltiMate AQ-C18色谱柱(4.6 mm×250 mm), 流动相为0.1%磷酸水溶液-乙腈, 梯度洗脱: 0~5 min, 40%乙腈; 5~10 min, 40%~50%乙腈; 10~20 min, 50%~60%乙腈; 20~30 min, 60%~65%乙腈; 30~40 min, 65%~70%乙腈; 40~50 min, 70%~80%乙腈; 50~60 min, 80%~90%乙腈; 60~65 min, 90%~95%乙腈; 65~75 min, 95%~100%乙腈; 75~80 min, 100%~100%乙腈。体积流量为1 mL·min-1; 柱温30 ℃; 进样量10 μL; 检测波长202 nm。进样前按初始流动相条件平衡10 min。水溶性部分测定工作参数: Welch UltiMate AQ-C18色谱柱(4.6 mm×250 mm), 流动相为0.1%磷酸水溶液-乙腈, 梯度洗脱: 0~20 min, 2%~5%乙腈; 20~30 min, 5%~10%乙腈; 30~37 min, 10%~20%乙腈; 37~45 min, 20%~30%乙腈; 45~50 min, 30%~40%乙腈; 50~58 min, 40%乙腈。体积流量为1 mL·min-1; 柱温30 ℃; 进样量20 μL; 检测波长250 nm。进样前按初始流动相条件平衡10 min。
指纹图谱相似度分析 取A、B两个厂家不同批次的小金丸进行指纹图谱检测, 将结果导入“中药色谱指纹图谱相似度评价系统(2012.0版)”, 进行指纹图谱相似度分析。
多元统计分析 色谱峰三维矩阵结果引入SIMCA-P 13.0软件分析, 对主成分分析(principal component analysis, PCA)和正交偏最小二乘判别法(orthogonal partial least squares discrimination analysis, OPLS-DA)进行模式识别分析。对A、B两个厂家16个批次小金丸脂溶性和水溶性部位共115个峰的峰面积进行PCA分析; 采用OPLS-DA对A、B两个厂家共16个批次小金丸脂溶性和水溶性部位所有指纹图谱峰面积进行分析; 将全部色谱峰面积分信息及去除筛选的几个面积较大色谱峰后的峰积分信息导入SPSS 13.0软件程序, 以色谱峰最多的小金丸样品A6为参照值进行系统聚类分析。
药材归属峰指认 按照小金丸处方比例, 精密称取麝香、木鳖子、制草乌、枫香脂、乳香(醋)、没药(醋)、五灵脂、当归(酒)、地龙等九味小金丸组方药材, 分别按照供试品溶液的制备方法制备药材供试品溶液, 按照仪器工作参数进行指纹图谱测定。
枫香脂生物活性检定 精密称取枫香脂3 g, 置具塞锥形瓶中, 加入80%甲醇50 mL后, 超声提取30 min过滤, 滤渣提取第2次, 合并滤液, 减压回收溶剂, 浓缩液冷冻干燥得到枫香脂冻干粉末, 取冻干粉加5% DMSO溶液稀释成浓度为1、5、10、25、50和100 mg·mL-1的枫香脂供试品溶液, 按照抗血小板聚集方法进行血小板聚集抑制率的测定; 准确称取枫香脂0.2 g, 加DMSO稀释成浓度为0.1、0.5、1、5、10和20 mg·mL-1的供试品溶液, 按照COX-2抑制率测定方法进行测定。
当归生物活性检定 精密称取当归3 g, 置具塞锥形瓶中, 加入80%甲醇50 mL后, 超声提取30 min过滤, 滤渣提取第2次, 合并滤液, 减压回收溶剂, 浓缩液冷冻干燥得到当归冻干粉末, 取冻干粉加5% DMSO溶液稀释成浓度为1、5、10、25、50和100 mg·mL-1的供试品溶液, 按照抗血小板聚集方法进行血小板聚集抑制率的测定; 准确称取当归0.2 g, 加DMSO稀释成浓度为0.1、1、2.5、5、10和20 mg·mL-1的供试品溶液, 按照COX-2抑制率测定方法进行测定。
结果 1 抗血小板聚集效价和COX-2抑制率16个批次小金丸抗血小板聚集及COX-2抑制率测定结果如图 2, 各批次小金丸的生物效价为0.712~1.278 (U·mg-1), RSD为15.4%, COX-2抑制率为52.07%~68.95%, RSD为8.91%。据生物检定结果可知, 各批次小金丸在活血和抗炎效价无明显分类情况, 且各样品之间生物效应差异较小, 说明各批次小金丸生物效应一致性较好。
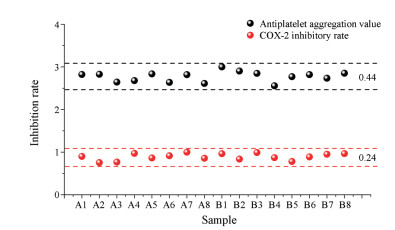
|
Figure 2 Antiplatelet aggregation value and cyclooxygenase-2 (COX-2) inhibitory rate of 16 batches of Xiaojin pills |
小金丸脂溶性部位指纹图谱可检出41个峰(图 3A), 水溶性部位可检出33个峰(图 3B), 通过对照品指认, 脂溶性部位23号峰为花生四烯酸, 水溶性部位13号峰为原儿茶酸, 22号峰为阿魏酸。
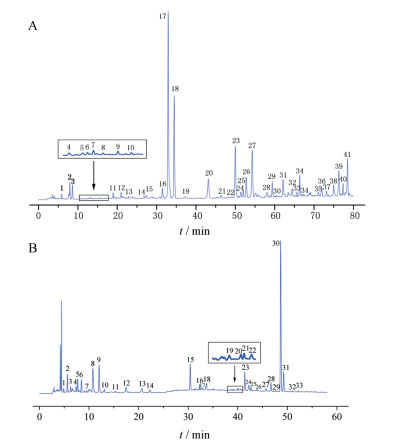
|
Figure 3 Fingerprint of liposoluble fraction (A) and water-soluble fraction (B) of Xiaojin pills. The number in the figure is the number of chromatographic peak in the fingerprint of liposoluble fraction and water-soluble fraction |
记录16批小金丸供试品的脂溶性、水溶性HPLC指纹图谱(图 4A和4B), 相似度结果见图 4C, 脂溶性部位共11个共有峰, 水溶性部位7个共有峰, 各样品共有峰面积差异较大, 变异系数最大达165.37%。由相似度结果可知, 小金丸水溶性部位相似度高于脂溶性部位, 且A厂家生产的8个批次小金丸相似度较好, 均大于0.9, B厂家生产的小金丸相似度差异较大, 其中B6相似度最低, 脂溶性部位为0.473, 水溶性部位为0.745。综上, 从指纹图谱结果可知, 16个批次小金丸一致性差, 且各厂家生产的小金丸一致性情况有所差异。
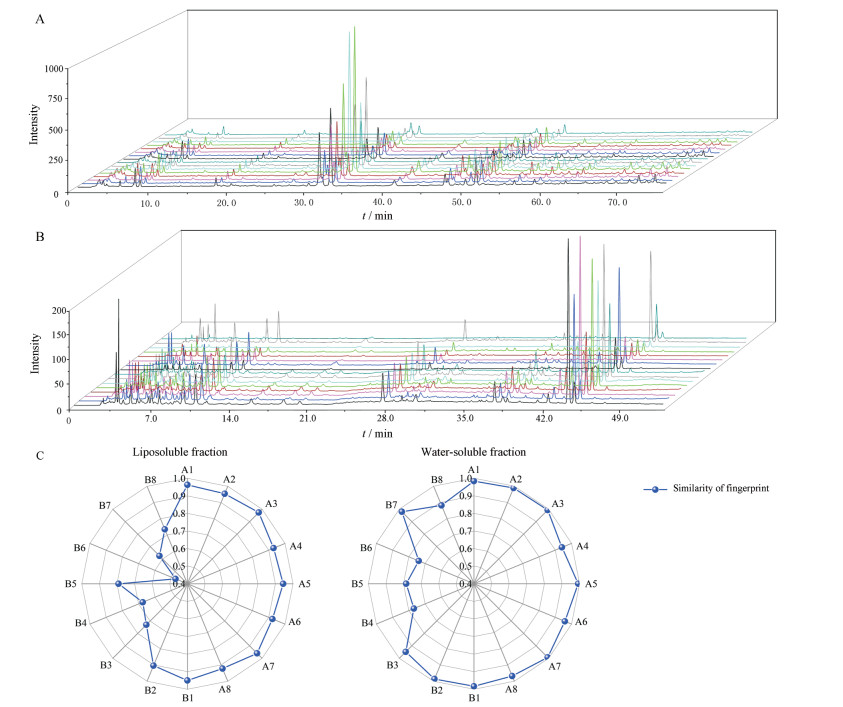
|
Figure 4 Fingerprint of liposoluble fraction (A), water-soluble fraction (B) and similarity evaluation (C) of 16 batches of Xiaojin pills |
PCA分析结果如图 5, 两个主成分累计贡献率为94.5%, 说明所建模型良好。根据PCA得分图(图 5A)可知A、B厂家小金丸具有明显的分类, 且A厂家小金丸较B厂家小金丸变异大。根据载荷图(图 5B)可知, 脂溶性部位17、18号峰是影响主成分的主要变量, 同时20、23、27号峰和水溶性部位30号峰也对分类有一定的影响作用。
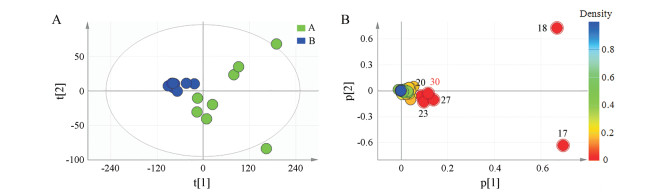
|
Figure 5 PCA score scatter plot (A) and loading scatter plot (B) of peak area of 16 batches Xiaojin pills |
模型R2X (cum)、R2Y (cum)和Q2 (cum)分别为0.825、0.622、0.597, 相应的参数结果表明该模型良好, 预测精度较高。OPLS-DA分析结果(图 6A)显示A、B厂家小金丸能够较好地分为两类, 且结果与PCA分析结果吻合(图 6B)。为验证模型的有效性, 进行了100次迭代置换试验(图 6C), 这些检验将原模型的拟合优度与随机排列模型的拟合优度进行了比较, 如图 6C所示, 验证结果表明原始模型是有效的。在相应的S图中, 远离原点的变量被认为贡献更大, 在所有检测到的信号中, 根据VIP≥1.5和P (corr)≥0.58的阈值识别出对聚类和鉴别有显著贡献的变量。S-Plot分析结果显示(图 6D), 脂溶性部位17、18、20、23和27号峰, 水溶性部位30号峰为有显著贡献的变量, 判别分析结果与PCA分析结果一致。
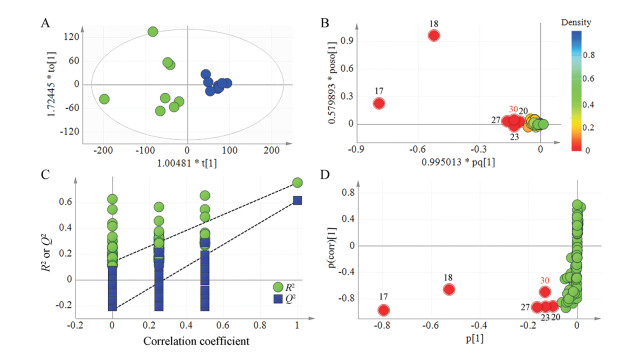
|
Figure 6 OPLS-DA score scatter plot (A), loading scatter plot (B), 100 iterations replacement test results (C), S-Plot (D) of peak area of 16 batches Xiaojin pills |
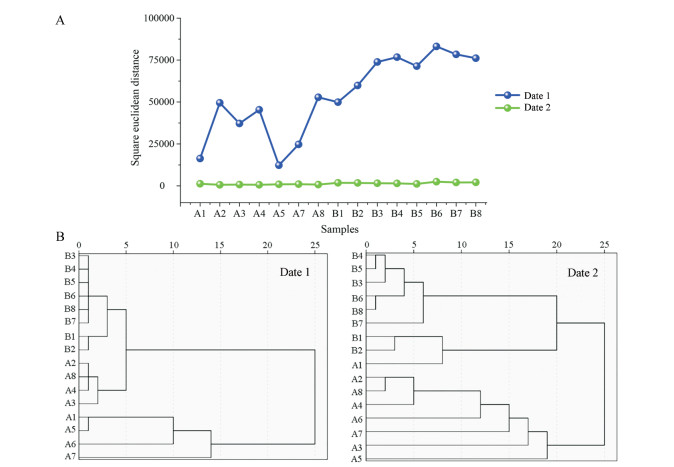
系统聚类分析结果显示, 相似性矩阵中平方Euclidean距离越小, 说明样品之间差异越小。从系统聚类结果可以看出, 与全峰聚类结果(date 1)相比, 去除脂溶性部位17、18、20、23和27号峰, 水溶性部位30号色谱峰后(date 2)平方Euclidean距离大幅减小, 各小金丸样品平方Euclidean距离差异性也明显变小, 且树状图分类的相对距离均变小, 说明小金丸各样品变异程度更小。系统聚类结果说明各样品的变异程度主要受面积较大的色谱峰的影响。
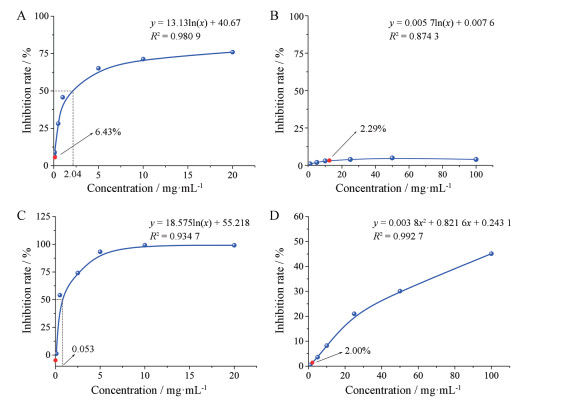
5 枫香脂和当归生物活性测定通过小金丸原药材的峰归属指认, 发现脂溶性部位17、18、20、23和27号峰均属于枫香脂, 因此枫香脂被认为是造成A、B两个厂家小金丸脂溶性部位化学差异性的主要原因。对枫香脂进行抗血小板聚集效价和COX-2抑制率的测定, 枫香脂半抑制率(IC50)曲线如图 8A, 其IC50为2.04 (mg·mL-1), 但在小金丸组方剂量下, 枫香脂COX-2抑制率仅6.43%, 说明在小金丸组方比例下, 枫香脂的抗炎活性极弱; 抗血小板聚集效价结果如图 8B, 在小金丸100 mg·mL-1组方比例下, 枫香脂血小板聚抑制率仅为2.29%, 集枫香脂在1~100 mg·mL-1浓度内几乎没有抗血小板聚集作用。通过高分辨质谱分析, 发现水部位30号峰为当归中的壬二酸, 因此当归被认为是造成A、B两个厂家小金丸水溶性部位化学差异性的主要原因。对当归进行COX-2抑制率和抗血小板聚集抑制率的测定, 当归IC50曲线如图 8C, 其IC50为0.005 3 (mg·mL-1), 说明当归有明显抑制COX-2表达的作用, 但在小金丸组方剂量下, 当归对COX-2抑制率为负, 说明在小金丸组方比例下, 当归不表现出抗炎活性; 抗血小板聚集效价结果如图 8D, 当归有较强的活血作用, 但在小金丸100 mg·mL-1组方比例下, 当归对血小板聚集抑制率仅为2.00%, 因此, 在小金丸处方比例下, 当归抑制血小板聚集活性较弱。
|
Figure 7 Systematic clustering square Euclidean distance (A) and clustering result (B) of chromatographic peaks |
|
Figure 8 50% inhibitory concentration (IC50) curve (A) and antiplatelet aggregation inhibition rate (B) of Liquidambaris resina, IC50 curve(C) and antiplatelet aggregation inhibition rate (D) of Angelicae Sinensis Radix |
小金丸临床疗效显著, 且各厂家、各批次在治疗效果上几乎无差别。本研究测定的16个批次小金丸抑制血小板聚集活性和抑制COX-2活性结果显示厂家、批次间无明显分类差异, 而根据指纹图谱数据分析结果发现A、B厂家小金丸有明显的分类现象, 来自A厂家的小金丸相似度明显地优于B厂家, 而色谱峰的多元统计分析结果显示B厂家小金丸差异更小。结果说明化学检测与生物检测结果存在一定的偏差。
小金丸十味组方药材中, 麝香、当归、乳香、没药、枫香脂、五灵脂六味药材具有活血功效, 麝香、草乌、当归、乳香、枫香脂、五灵脂六味药材具有止痛功效。中医认为乳腺增生是气滞血瘀导致的局部结节, 小金丸具有较强的活血作用, 能够改善局部结节情况, 达到治疗乳腺增生的目的。现代临床研究表明, 小金丸对前列腺炎[16]、甲状腺节结、乳腺癌[17-19]等具有一定的治疗作用, 在前列腺炎治疗过程中, 主要通过抑制COX-2的表达达到治疗的目的[20]。因此, 本研究选择以活血、止痛生物效应为导向, 以抗血小板聚集实验和抑制COX-2表达测试初探小金丸体外生物活性效价。血小板聚集是由血小板膜糖蛋白Ⅱb/Ⅲa (GPⅡb/Ⅲa)受体所调节, 纤维蛋白原与活化的GPⅡb/Ⅲa受体结合, 在相邻的血小板之间形成横桥, 形成血栓和骨架, 参与生理性止血和病理性血栓形成。抗血小板聚集活性能在一定程度上反映小金丸的活血化瘀功效[21]。抗血小板聚集实验直接取实验动物血液进行活性测定, 是更接近试药体内生物活性的一种方法。5个批次小金丸体内的耳肿胀抗炎活性结果与本研究所使用的COX-2酶联反应试剂盒方法结果趋势基本一致, 说明本研究所使用的COX-2酶联反应试剂盒方法用于小金丸的抗炎活性评价可靠、有效。
化学指纹图谱相似度作为评价方法, 是中药质量一致性评价的重要手段。经过小金丸整体色谱峰面积的多元统计分析发现, 峰面积较大的组分是造成小金丸指纹图谱差异性的主要因素, 去除这些影响较大的组分后, 小金丸样品之间差异性明显降低。脂溶性部位面积较大的峰大多来自小金丸组方药材枫香脂, 枫香脂祛风活血, 解毒止痛, 止血生肌, 作佐药[22], 而在小金丸剂量下的枫香脂几乎没有抗血小板聚集和抑制COX-2的作用。水溶性部位面积较大的峰来自组方药材当归, 当归具有活血、补血、调节机体免疫功能等作用[23], 但在小金丸组方剂量下, 活血作用极弱, 且不表现抗炎活性, 因此, 小金丸指纹图谱评价结果难以反映其活血、止痛活性。在指纹图谱相似度评价过程中, 一些高丰度、强响应、低活性的色谱峰可能主导相似度的评价结果。同时, 相似度评价是共有峰参与的过程, 忽略了其他色谱峰的贡献效果, 造成了在多元统计分析结果中, A厂家小金丸差异性明显大于B厂家, 与指纹图谱相似度评价结果不一致的现象。综上, 指纹图谱用于小金丸整体质量评价具有局限性, 仅以化学评价方法难以全面地、科学地评价小金丸等复杂中成药的质量一致性。化学评价主要以色谱峰的变异程度作为药物质量评价的依据, 但一些峰面积较大的色谱峰往往决定着评价的结果, 而这些具有决定作用的色谱和生物效应联系不大, 可能会导致化学评价结果一致而生物效应相差较甚的结果。因此, 在进行药物质量评价时, 以生物效应为导向, 在化学指纹图谱相似度计算时, 去除对整体活性贡献度不大的色谱峰, 以高活性为原则, 将化学指纹图谱与生物效应紧密地联系在一起, 使化学评价结果能够更好地反映于临床。
本研究仅对小金丸活血、抗炎功效进行了生物活性评价, 还应该进一步拓展其生物评价方法, 建立小金丸生物活性谱, 全面地对小金丸的疗效进行评估。美国FDA发布的《植物药发展的工业指南(2015版)》指出, 不能以化学方法证明中草药和植物药质量一致性的, 可以选择采用生物评价的方法予以证明[24]。因此, 在现有化学评价方法基础上引入生物评价方法, 有利于从不同维度收集复杂体系的质量信息, 更加科学、全面地评价复杂中成药的整体质量, 更好地保障临床用药的安全、有效, 促进工业化制造水平的提高。
| [1] |
Xiao XH, Zhang DK, Wang JB, et al. Comprehensive quantitative evaluation and control system for traditional Chinese medicine quality-power pyramid of standard evaluation[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 7-12. |
| [2] |
Tanaka R, Takahashi N, Nakamura Y, et al. In-line and real-time monitoring of resonant acoustic mixing by near-infrared spectroscopy combined with chemometric technology for process analytical technology applications in pharmaceutical powder blending systems[J]. Anal Sci, 2017, 33: 41-46. DOI:10.2116/analsci.33.41 |
| [3] |
Chen S, Sun G, Ma D, et al. Quantitative fingerprinting based on the limited-ratio quantified fingerprint method for an overall quality consistency assessment and antioxidant activity determination of Lianqiao Baidu pills using HPLC with a diode array detector combined with chemometric methods[J]. J Sep Sci, 2018, 41: 548-559. DOI:10.1002/jssc.201700566 |
| [4] |
Yi LZ, Wu H, Liang YZ. Chromatographic fingerprint and quality control of traditional Chinese medicines[J]. Chin J Chromatogr (色谱), 2008, 26: 166-171. |
| [5] |
Zhao CP. Overview of traditional Chinese medicine fingerprints[J]. Chin J Trauma Disabil Med (中国伤残医学), 2014, 5: 290-291. |
| [6] |
Sun TT, Ma XH, Li XX, et al. Discussion on the status quo and development ideas of traditional Chinese medicine bio-potency[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 1906-1911. |
| [7] |
Li XJ, Huang YY, Yang Z, et al. Research strategy of biomarkers for quality of traditional Chinese medicine based on effect benchmark[J]. Acta Pharm Sin (药学学报), 2019, 54: 34-40. |
| [8] |
Sun LK, Liu F, Chen WQ, et al. Meta-analysis-based evaluation of Xiaojin pills in the treatment of breast hyperplasia[J]. Chin J Drug Eval (中国药物评价), 2016, 33: 448-451. |
| [9] |
Zhang D, Ma R, Lin CX. Clinical observation of Xiaojin pills in the treatment of multiple small nodular goiter[J]. Mod J Integr Tradit Chin West Med (现代中西医结合杂志), 2016, 25: 309-311. |
| [10] |
Qu JN. 80 cases of benign prostatic hyperplasia treated with Xiaojin pills[J]. World Chin Med (世界中医药), 2008, 3: 277. |
| [11] |
Luo ZP, Zhou YX. Progress in clinical application of Xiaojin pills[J]. Chin Pract Med (中国实用医药), 2009, 4: 227. |
| [12] |
Wei ZY, Pan LY, Tan Y. Observation on therapeutic effect of Xiaojin pills on chronic hepatitis B hepatic fibrosis[J]. Chin Pharm (中国药业), 2011, 20: 73. |
| [13] |
Xiong X, Feng B, Cao B, et al. Study on the modern research of Xiaojin pills and analysis of key programs[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 4801-4807. |
| [14] |
Xiong X, Pan Y, Zhang DK, et al. Quantitative determination of HPLC-MS/MS in combination with stoichiometry to study the quality consistency of commercially sold Xiaojin pills[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 2189-2196. |
| [15] |
Xiong X, He YN, Bi F, et al. Screening for the anti-inflammation quality markers of Xiaojin pills based on HPLC-MS/MSmethod, COX-2 inhibition test and protein interaction network[J]. Sci Rep, 2018, 8: 7454. DOI:10.1038/s41598-018-25582-7 |
| [16] |
Qu XW, Zhang SW, Zhang PH, et al. Xiaojin pills inhibits the expression of COX-2 in prostate tissues of prostatitis pain rats[J]. Nat J Androl, 2008, 14: 759-762. |
| [17] |
Li HB. Clinical observation of Xiaojin pills combined with Youjiale in the treatment of nodular goiter[J]. Chin Manip Rehabil Ther (按摩与康复医学), 2016, 7: 41-42. |
| [18] |
An MJ, Cheon JH, Kim SW, et al. Guggulsterone induces apoptosis in colon cancer cells and inhibits tumor growth in murine colorectal cancer xenografs[J]. Cancer Lett, 2009, 279: 93-100. DOI:10.1016/j.canlet.2009.01.026 |
| [19] |
Zhou AG, Ding YX, Guo HY, et al. Experimental investigation on the anti-cancer effect of modifed Xiaojin pills[J]. J Shanghai Second Med Univ (上海第二医科大学学报), 1990, 3: 185-188. |
| [20] |
Qu XW, Zhang SW, Zhang PH, et al. Effect of Xiaojin pills on COX-2 expression in prostate tissue of rats with prostatitis pain[J]. Nat J Androl (中华男科学杂志), 2008, 8: 759-762. |
| [21] |
Xu DD, Bao YR, Liu Y, et al. Overview of research on antiplatelet aggregation mechanism of traditional Chinese medicine[J]. Chin J Ethnomed Ethnopharm (中国民族民间医药), 2018, 27: 88-91. |
| [22] |
Hua DF. A review of existing Chinese patent medicines for adjuvant anti-tuberculosis therapy[J]. J Clin Pulm Med (临床肺科杂志), 2010, 15: 1286-1288. |
| [23] |
Zhang h, Wang YT, Yan C, et al. Research progress and comparison of pharmacological effects of Angelica and Ligusticum wallichii[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2008, 19: 293-295. |
| [24] |
Food and Drug Administration. Botanical Drug Development Guidance for Industry. 2016-12-27[2019-08-20]. https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm458484.pdf.
|
 2019, Vol. 54
2019, Vol. 54


