2. 海南绿槟榔科技发展有限公司, 海南 定安 571200
2. Hainan Green Areca Technology Development Co. LTD., Ding'an 571200, China
帕金森病(Parkinson's disease, PD)是一种以黑质多巴胺能神经元变性缺失为主要特征的神经退行性疾病[1]。氧化应激在帕金森病的发病机制中起着至关重要的作用[2, 3]。活性氧的产生(reactive oxygen species, ROS)超过细胞抗氧化能力时, 会发生氧化应激损伤, 过度的氧化应激会引发一系列病理生理反应。ROS参与帕金森病等神经退行性疾病的发生和发展, 抗氧化药物有望用于帕金森疾病的治疗[4]。
沉默信息调节因子2相关酶1 (silent mating type information regulation 2 homolog 1, Sirt1)是依赖于烟酰胺腺嘌呤二核苷酸的组蛋白脱乙酰化酶, 在氧化应激中起重要作用[5-7]。Sirt1可使多种蛋白脱乙酰化, 调节细胞内氧化应激、凋亡和衰老等过程[8]。过氧化物酶体增殖物激活受体γ辅助激活因子1α (peroxisome proliferator-activated receptor γ coactivator-1α, PGC-1α)是Sirt1去乙酰化底物, 参与线粒体生物合成及能量代谢等通路的调节[9-11]。线粒体是细胞产生ROS的主要来源, 去乙酰化的PGC-1α可刺激线粒体生物合成, 因此, Sirt1/PGC-1α信号通路在细胞防御氧化应激和线粒体功能障碍中发挥重要作用。
异鼠李素(isorhamnetin, ISO)是一种黄酮类化合物, 广泛存在于多种植物的花、果实和叶子中。研究表明, ISO具有多种药理学活性, 能够抑制NF-κB信号通路发挥抗炎作用[12], 能够清除自由基, 减轻氧化应激造成的心肌细胞损伤[13]。然而, ISO能否通过Sirt1/PGC-1α信号通路抑制1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridiniumion, MPP+)诱导的SH-SY5Y细胞氧化损伤, 未见报道。因此, 本实验建立MPP+损伤SH-SY5Y细胞模型, 探讨ISO对MPP+损伤SH-SY5Y细胞的保护作用及机制, 为帕金森病等神经退行性疾病的治疗提供新的思路。
材料与方法试剂 异鼠李素购自上海源叶生物科技有限公司。人神经母细胞瘤细胞SH-SY5Y购自中国医学科学院基础医学研究所。Dulbecco's modified eagle medium: nutrient mixture F-12 (DMEM/F12)培养基、胎牛血清(fetal bovine serum, FBS)、2', 7'-二氯荧光黄双乙酸盐(2', 7'-dichlorofluorescin diacetate, DCFH-DA)和红色线粒体超氧化物荧光探针(MitoSOX red mitochondrial superoxide indicator, MitoSOX)均购自Thermo Scientific公司。MPP+、Hoechst 33258、Sirtinol、氮乙酰半胱氨酸(N-acetylcysteine, NAC)和MTT均购自Sigma公司; 乳酸脱氢酶检测试剂盒(LDH cytotoxicity assay kit, LDH)和线粒体膜电位检测试剂盒(JC-1 mitochondrial membrane potential assay kit, JC-1)均购自碧云天生物技术公司。超氧化物歧化酶(superoxide dismutase, SOD)试剂盒和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒均购自南京建成生物工程研究所。Sirt1、PGC-1α、β-actin、Bax、Bcl-2抗体和anti-rabbit IgG (H+L), F(ab')2 fragment、anti-mouse IgG (H+L), F(ab')2 fragment荧光二抗均购自Cell Signaling Technology公司。Goat anti-rabbit IgG和Goat anti-mouse IgG均购自江苏康为世纪生物科技有限公司。
细胞培养 用含10%胎牛血清, 100 u·mL-1青霉素和100 μg·mL-1链霉素的DMEM/F12培养液, 在37 ℃、5% CO2饱和湿度条件下培养SH-SY5Y细胞。
MTT检测细胞存活率 正常对照组细胞始终使用完全培养基孵育。加药组给予不同浓度ISO预孵育2 h, 之后损伤组加入500 μmol·L-1 MPP+, 孵育24 h后吸除培养液, 每孔加入100 μL MTT工作液, 37 ℃培养4 h后吸除MTT, 每孔加入100 μL DMSO溶解结晶后, 490 nm处测定吸光度。
LDH释放率检测 实验终点, 取细胞上清, 应用碧云天生物技术公司提供的检测试剂盒测定LDH释放, 具体操作按照说明书进行。
细胞活性氧的检测 实验终点, 倾去培养液, PBS洗涤1次, 加入DCFH-DA和Hoechst 33258, 避光孵育30 min后PBS洗涤3次, 应用高内涵细胞分析系统进行检测。
线粒体膜电位检测 实验终点, 倾去培养液, PBS洗涤1次, 加入含10 μg·mL-1 Hoechst 33258的JC-1染色工作液, 避光孵育20 min后用染色缓冲液洗涤2次。最终加入100 μL培养基, 应用高内涵细胞分析系统进行检测。
SOD和GSH-Px活性测定 实验终点, 收集细胞上清液, 根据南京建成科技有限公司提供的试剂盒, 测定SOD和GSH-Px活性。
Western blot检测蛋白表达 实验终点, 磷酸缓冲盐溶液(phosphate buffer saline, PBS)洗涤1次, 加入蛋白裂解液后冰上裂解30 min, 提取细胞总蛋白。加入loading buffer后沸水浴10 min。采用等量上样, 进行聚丙烯酰胺凝胶电泳, 之后转印至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)。将转印后的PVDF膜置于5%牛血清白蛋白(bovine serum albumin, BSA)封闭2 h后分别用稀释后的Sirt1、PGC-1α、Bax、Bcl-2和β-actin抗体4 ℃孵育过夜。接下来用Tris缓冲盐溶液(Tris buffered saline Tween, TBST)洗涤3次, 再置于稀释后对应种属二抗中室温孵育2 h, 最终TBST洗涤3次后显色成像。
免疫荧光检测Sirt1、PGC-1α蛋白表达 实验终点, 吸除原培养液, PBS洗涤1次, 加入多聚甲醛固定; PBS洗涤1次, 加入0.3% Triton-100透化; PBS洗涤1次, 加入5% BSA封闭; 之后加入稀释后的Sirt1和PGC-1α抗体孵育过夜; 回收抗体后用PBS洗涤3次, 然后加入对应的荧光二抗稀释液, 避光孵育1.5 h; PBS洗涤3次后加入Hoechst 33258避光孵育30 min; 最后PBS洗涤1次, 置于高内涵分析仪进行检测。
统计学处理 结果以x± s表示, 对于统计学差异分析, 使用GraphPad Prism version 7.0 (GraphPad Software, CA, USA)软件中one-way ANOVA (Tukey's post hoc test)方法进行统计处理。P < 0.05表示具有显著的统计学差异。
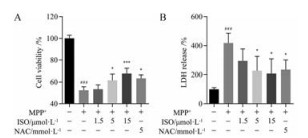
结果 1 ISO减轻MPP+诱导的SH-SY5Y细胞损伤如图 1A所示, 与正常对照组相比, 500 μmol·L-1 MPP+作用后SH-SY5Y细胞存活率降低为正常对照组的52.46%, 5和15 μmol·L-1 ISO及5 mmol·L-1抗氧化阳性药NAC能够显著提高细胞存活率, 细胞存活率分别为正常对照组的61.61%、67.55%和63.39% (P < 0.05、P < 0.001和P < 0.05)。LDH检测同样证实了ISO对SH-SY5Y细胞的保护作用, 如图 1B所示, MPP+损伤后SH-SY5Y细胞中LDH释放量显著增加(P < 0.001), 5和15 μmol·L-1 ISO及5 mmol·L-1 NAC均能够显著抑制MPP+诱导的LDH释放(P < 0.05)。
|
Figure 1 The effects of isorhamnetin (ISO) on SH-SY5Y cell viability. A: Cell viability was determined using MTT assay; B: LDH release was detected by the LDH cytotoxicity assay kit. n = 4, x± s. ###P < 0.001 vs control group; *P < 0.05, ***P < 0.001 vs MPP+ group. NAC: N-Acetylcysteine; LDH: Lactate dehydrogenase; MPP+: 1-Methyl-4-phenylpyridiniumion |
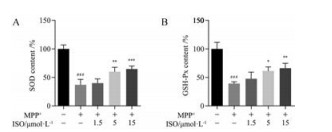
如图 2所示, 与对照组相比, MPP+损伤SH-SY5Y细胞模型组SOD和GSH-Px活性显著降低(P < 0.001)。5和15 μmol·L-1 ISO预处理能够显著提高SH-SY5Y细胞中SOD的活性(P < 0.01, P < 0.001), 以及GSH-Px的活性(P < 0.05, P < 0.01)。
|
Figure 2 Effects of ISO on the activities of superoxide dismutase (SOD, A) and glutathione peroxidase (GSH-Px, B). n = 4, x± s. ###P < 0.001 vs control group; *P < 0.05, **P < 0.01, ***P < 0.001 vs MPP+ group |
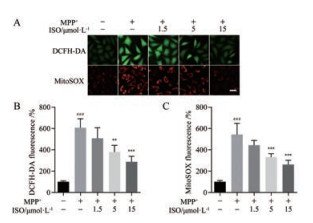
采用ROS特异性荧光探针DCFH-DA对MPP+损伤SH-SY5Y细胞后, 细胞内ROS的生成量进行检测。如图 3A和B所示, 500 μmol·L-1 MPP+损伤后模型组SH-SY5Y细胞中ROS释放量显著增加(P < 0.001), 而5和15 μmol·L-1 ISO预处理均能显著降低MPP+损伤引起的ROS释放(P < 0.01, P < 0.001)。采用线粒体超氧化物荧光探针MitoSOX, 对MPP+损伤SH-SY5Y细胞后线粒体内超氧化物水平进行检测。如图 3A和C所示, MPP+损伤模型组细胞线粒体中MitoSOX荧光强度显著高于正常对照组(P < 0.001), 5和15 μmol·L-1 ISO能够显著降低线粒体中超氧化物水平(P < 0.001)。
|
Figure 3 The effects of ISO on the MPP+ induced cellular reactive oxygen species (ROS) and mitochondrial superoxide production. A: Representative images of DCFH-loaded and MitoSOX-loaded SH-SY5Y cells; B: Quantitative analysis of the production of DCFH-DA; C: Quantitative analysis of the production of MitoSOX. n = 4, x± s. ###P < 0.001 vs control group; **P < 0.01, ***P < 0.001 vs MPP+ group. Scale bar = 20 μm. DCFH-DA: 2', 7'-Dichlorofluorescin diacetate; MitoSOX: MitoSOXTM red mitochondrial superoxide indicator |
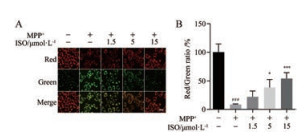
如图 4所示, 与正常对照组相比, MPP+损伤SH-SY5Y细胞后线粒体膜电位显著降低(P < 0.001), 红色荧光转变为绿色。ISO (5和15 μmol·L-1)可显著抑制MPP+诱导的SH-SY5Y细胞损伤, 减缓线粒体膜电位下降(P < 0.05, P < 0.001)。
|
Figure 4 ISO increased mitochondrial membrane potential in SH-SY5Y cells after MPP+ injury. A: Representative double immunofluorescent staining for JC-1; B: ISO increased the ratio of red and green fluorescence intensity. n = 4, x± s. ###P < 0.001 vs control group; *P < 0.05, ***P < 0.001 vs MPP+ group. Scale bar = 20 μm |
采用Western blot和免疫荧光检测ISO对SH-SY5Y细胞中Sirt1/PGC-1α信号通路的影响。如图 5所示, 与正常对照组相比, MPP+损伤SH-SY5Y细胞模型组中Sirt1和PGC-1α蛋白水平显著降低(P < 0.001)。与模型组相比, ISO预孵育能够显著提高Sirt1和PGC-1α的表达水平。Sirt1特异性抑制剂Sirtinol能够部分阻断ISO引起的Sirt1和PGC-1α蛋白水平升高。
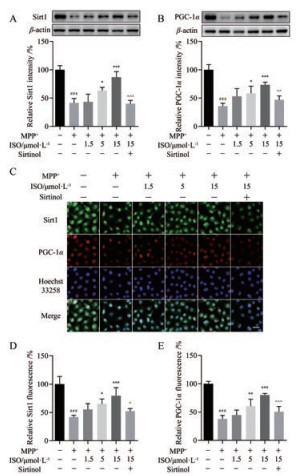
|
Figure 5 The effects of ISO on silent mating type information regulation 2 homolog 1 (Sirt1) and peroxisome proliferator-activated receptor γ coactivator-1α (PGC-1α) levels in MPP+-injured SH-SY5Y cells. A: Sirt1 levels detected by Western blot; B: PGC-1α levels detected by Western blot; C: Sirt1 and PGC-1α levels detected by immunofluorescence; D: The quantitative analysis of Sirt1 fluorescence; E: The quantitative analysis of PGC-1α fluorescence. n = 4, x± s. ###P < 0.001 vs control group; *P < 0.05, **P < 0.01, ***P < 0.001 vs MPP+ group; ^P < 0.05, ^^P < 0.01, ^^^P < 0.001 vs 15 μmol·L-1 ISO group. Scale bar = 20 μm |
采用Western blot法对凋亡相关蛋白Bcl-2和Bax的表达情况进行检测。如图 6所示, 与正常对照组比较, MPP+损伤导致SH-SY5Y细胞抗凋亡蛋白Bcl-2显著降低, 促凋亡蛋白Bax表达明显增加。ISO能够显著降低MPP+导致的Bax表达升高, 抑制Bcl-2的降低, 抑制细胞凋亡, 而ISO所介导的细胞凋亡抑制能够被Sirt1特异性抑制剂Sirtinol所逆转。
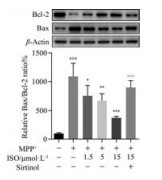
|
Figure 6 The effects of ISO on the expression of Bax and Bcl-2. β-Actin served as the loading control. n = 4, x± s. ###P < 0.001 vs control group; *P < 0.05, **P < 0.01, ***P < 0.001 vs MPP+ group; ^^^P < 0.001 vs 15 μmol·L-1 ISO group |
1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine, MPTP)是一种神经毒素, 可经B型单胺氧化酶转换为MPP+, MPP+通过多巴胺转运体被转运到细胞内, 并被多巴胺能神经元内的线粒体吸收, 通过抑制线粒体电子传递复合物破坏细胞内氧化磷酸化过程, 最终影响细胞内能量消耗和自由基产生, 引起氧化应激损伤。SH-SY5Y细胞是具有多巴胺能特性的神经瘤细胞。研究表明, ISO具有较好的抗肿瘤、降血脂、抗氧化等药理学活性[14-17]。本实验采用MPP+处理SH-SY5Y诱导细胞损伤, 研究ISO对MPP+损伤SH-SY5Y细胞的保护作用。通过检测细胞活力, 发现ISO能够提高MPP+损伤后SH-SY5Y细胞存活率。LDH检测进一步证实了ISO的保护作用, 与MPP+损伤模型组相比, ISO预处理后LDH释放量显著降低。并且, ISO能够增加SOD和GSH-Px的活性, 抑制MPP+损伤导致的细胞内活性氧和线粒体超氧化物增加, 减缓SH-SY5Y细胞线粒体膜电位下降。以上结果表明, ISO对MPP+损伤的SH-SY5Y细胞具有明显的保护作用。
激活Sirt1在阿尔茨海默病和帕金森病等神经退行性疾病的治疗中表现出良好作用[18-20]。Sirt1的激活, 可以促进PGC-1α活化, 进而抑制氧化应激损伤, 改善线粒体功能。为了明确ISO对MPP+损伤SH-SY5Y细胞的保护机制, 本实验通过加入Sirt1特异性抑制剂Sirtinol后采用Western blot和免疫荧光的方法, 考察Sirt1/PGC-1α信号通路是否参与ISO对SH-SY5Y的保护作用。实验结果表明, ISO通过Sirt1/PGC-1α信号途径减弱MPP+诱导的SH-SY5Y细胞中氧化损伤。Sirtinol能够部分阻断ISO引起的Sirt1和PGC-1α蛋白表达升高。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax是线粒体凋亡途径的关键参与者。在本实验中, 通过ISO预处理可以逆转MPP+损伤模型组中Bcl-2蛋白水平降低和Bax表达增加, 调节Bcl-2和Bax表达平衡, 抑制细胞凋亡, 而ISO所介导的细胞凋亡抑制, 能够被Sirt1特异性抑制剂Sirtinol所逆转。
综上所述, ISO通过提高细胞存活率, 降低LDH释放, 清除细胞氧自由基和线粒体超氧化物, 减缓线粒体膜电位下降, 发挥SH-SY5Y细胞的保护作用。ISO对MPP+损伤后SH-SY5Y细胞的保护作用, 可能是通过激活Sirt1/PGC-1α信号通路实现的。
| [1] | Cookson MR, Bandmann O. Parkinson's disease: insights from pathways[J]. Hum Mol Genet, 2010, 19: R21–R27. DOI:10.1093/hmg/ddq167 |
| [2] | Wu DM, Han XR, Wen X, et al. Salidroside protection against oxidative stress injury through the Wnt/beta-catenin signaling pathway in rats with Parkinson's disease[J]. Cell Physiol Biochem, 2018, 46: 1793–1806. DOI:10.1159/000489365 |
| [3] | Li C, Tang B, Feng Y, et al. Pinostrobin exerts neuroprotective actions in neurotoxin-induced Parkinson's disease models through Nrf2 induction[J]. J Agric Food Chem, 2018, 66: 8307–8318. DOI:10.1021/acs.jafc.8b02607 |
| [4] | Ouyang L, Zhang L, Liu B. Autophagy pathways and key drug targets in Parkinson's disease[J]. Acta Pharm Sin (药学学报), 2016, 51: 9–17. |
| [5] | Shekhar S, Yadav Y, Singh AP, et al. Neuroprotection by ethanolic extract of Syzygium aromaticum in Alzheimer's disease like pathology via maintaining oxidative balance through SIRT1 pathway[J]. Exp Gerontol, 2018, 110: 277–283. DOI:10.1016/j.exger.2018.06.026 |
| [6] | Liu N, Chen J, Gao D, et al. Astaxanthin attenuates contrast agent-induced acute kidney injury in vitro and in vivo via the regulation of SIRT1/FOXO3a expression[J]. Int Urol Nephrol, 2018, 50: 1171–1180. DOI:10.1007/s11255-018-1788-y |
| [7] | Wang G, Yao J, Li Z, et al. miR-34a-5p inhibition alleviates intestinal ischemia/reperfusion-induced reactive oxygen species accumulation and apoptosis via activation of SIRT1 signaling[J]. Antioxid Redox Signal, 2016, 24: 961–973. DOI:10.1089/ars.2015.6492 |
| [8] | Chen HY, Geng M, Hu YZ, et al. Effects of baicalin against oxidative stress injury of SH-SY5Y cells by up-regulating SIRT1[J]. Acta Pharm Sin (药学学报), 2011, 46: 1039–1044. |
| [9] | Wang Q, Li L, Li CY, et al. SIRT3 protects cells from hypoxia via PGC-1α- and MnSOD-dependent pathways[J]. Neuroscience, 2015, 286: 109–121. DOI:10.1016/j.neuroscience.2014.11.045 |
| [10] | Wu L, Wang Q, Guo F, et al. Activation of FoxO1/PGC-1alpha prevents mitochondrial dysfunction and ameliorates mesangial cell injury in diabetic rats[J]. Mol Cell Endocrinol, 2015, 413: 1–12. DOI:10.1016/j.mce.2015.06.007 |
| [11] | Fu B, Zhao J, Peng W, et al. Resveratrol rescues cadmium-induced mitochondrial injury by enhancing transcriptional regulation of PGC-1alpha and SOD2 via the Sirt3/FoxO3a pathway in TCMK-1 cells[J]. Biochem Biophys Res Commun, 2017, 486: 198–204. DOI:10.1016/j.bbrc.2017.03.027 |
| [12] | Kim SY, Jin CY, Kim CH, et al. Isorhamnetin alleviates lipopolysaccharide-induced inflammatory responses in BV2 microglia by inactivating NF-κB, blocking the TLR4 pathway and reducing ROS generation[J]. Int J Mol Med, 2019, 43: 682–692. |
| [13] | Zhao TT, Yang TL, Gong L, et al. Isorhamnetin protects against hypoxia/reoxygenation-induced injure by attenuating apoptosis and oxidative stress in H9c2 cardiomyocytes[J]. Gene, 2018, 666: 92–99. DOI:10.1016/j.gene.2018.05.009 |
| [14] | Wei J, Su H, Bi Y, et al. Anti-proliferative effect of isorhamnetin on HeLa cells through inducing G2/M cell cycle arrest[J]. Exp Ther Med, 2018, 15: 3917–3923. |
| [15] | Shi H, He J, Li X, et al. Isorhamnetin, the active constituent of a Chinese herb Hippophae rhamnoides L, is a potent suppressor of dendritic-cell maturation and trafficking[J]. Int Immunopharmacol, 2018, 55: 216–222. DOI:10.1016/j.intimp.2017.12.014 |
| [16] | Qi F, Sun JH, Yan JQ, et al. Anti-inflammatory effects of isorhamnetin on LPS-stimulated human gingival fibroblasts by activating Nrf2 signaling pathway[J]. Microb Pathog, 2018, 120: 37–41. DOI:10.1016/j.micpath.2018.04.049 |
| [17] | Lee MS, Kim Y. Effects of isorhamnetin on adipocyte mitochondrial biogenesis and AMPK activation[J]. Molecules, 2018, 23: 1853. DOI:10.3390/molecules23081853 |
| [18] | Maiese K. SIRT1 and stem cells: in the forefront with cardiovascular disease, neurodegeneration and cancer[J]. World J Stem Cells, 2015, 7: 235–242. DOI:10.4252/wjsc.v7.i2.235 |
| [19] | Martin A, Tegla CA, Cudrici CD, et al. Role of SIRT1 in autoimmune demyelination and neurodegeneration[J]. Immunol Res, 2015, 61: 187–197. DOI:10.1007/s12026-014-8557-5 |
| [20] | Donmez G, Outeiro TF. SIRT1 and SIRT2: emerging targets in neurodegeneration[J]. EMBO Mol Med, 2013, 5: 344–352. DOI:10.1002/emmm.201302451 |
 2019, Vol. 54
2019, Vol. 54


