肿瘤免疫疗法已成为近年来肿瘤治疗的研究热点。该治疗手段主要是提高自身免疫系统肿瘤微环境(tumours microenviroment, TME)中肿瘤特异性T细胞(tumour-specific T cell)的免疫应答来杀伤或抑制肿瘤。其中CD3+CD8+ T在TME中起着非常重要的作用, 它属于细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTLs), 可特异性识别肿瘤细胞表面抗原, 进而靶向杀伤肿瘤细胞[1, 2]。而CD3+CD4+ T归属于辅助性T细胞(T helper cells, Th), 它能通过胞溶机制直接清除肿瘤细胞或间接调节TME发挥抗肿瘤作用。此外, Th辅助细胞可增加CTLs的克隆数量, 提高其分泌IFNγ的能力, 增强CTLs抑瘤活性[1, 3, 4]。因此, 评价CD3+CD4+和CD3+CD8+ T细胞功能在肿瘤免疫治疗分子机制及其药物研发具有重要意义。本实验采用不同的刺激剂CD3/CD28抗体、金黄色葡萄球菌B型肠毒素(Staphylococcus auresus enterooxin B, SEB)、白介素27 (interleukin 27, IL27)、植物血凝素(phytohaemagglutinin, PHA)和佛波酯+离子霉素(PMA+ionomycin)作用于人外周血单个核细胞(peripheral blood mononuclear cells, PBMC) 24 h, 观察CD3+CD4+ T和CD3+CD8+ T细胞的活化标志物CD69的变化以及淋巴细胞增殖和IFNγ分泌能力。一方面综合评价这些生物学指标能否反映T功能变化; 另一方面对比这些刺激剂活化T细胞的强度, 从而为后续肿瘤免疫研究和药物筛选提供实验依据。
材料与方法血液样本 新鲜健康人全血, 由中国食品药品检定研究院提供, 已取得志愿者的知情同意, 并得到中国食品药品检定研究院伦理委员会批准。
试剂 人外周血淋巴细胞分离液购于达科为生物技术有限公司。CellTiter-Glo检测试剂盒购于Promega公司, IL27、PHA、SEB、PMA、ionomycin购于Sigma公司。IFNγ的ELISA试剂盒、CD3/CD28抗体和Pecy7 anti-human CD69抗体购自Biolegend公司。
仪器 美国BD公司的FACSVerse流式细胞仪, 日本三洋公司的CO2培养箱, 美国Sigma公司冷冻离心机, 美国Bio-tec酶标仪。
人PBMC的制备 取新鲜抗凝人全血至无菌的50 mL离心管, 再用等体积的磷酸盐缓冲液(phosphate buffer saline, PBS)稀释全血。在另一离心管中加入一定体积的分离液, 将稀释后的全血小心缓慢地平铺到分离液面上方, 使两界面保持清晰。淋巴细胞分离液、未稀释全血、PBS体积比为1:1:1。于室温并置于水平转子离心机, 800 ×g离心25 min。离心结束后, 小心吸取离心管中部致密白色细胞层(PBMC层)移至新的无菌离心管中。用PBS稀释到一定体积, 颠倒混匀。于室温水平转子250 ×g离心10 min, 弃上清。重复洗涤2次, 进行细胞计数后调整细胞数至1×106个/孔。
流式细胞术检测不同刺激剂对淋巴细胞的活化作用 将制备好的PBMC接种于96孔U型板中, 置于37 ℃、5% CO2的细胞培养箱中平衡2 h。加入不同刺激剂, 如抗人CD3/CD28抗体(终质量浓度: 20和200 ng·mL-1)、SEB (终质量浓度10 ng·mL-1)、PHA (终质量浓度1 μg·mL-1)、IL27 (终质量浓度10 ng·mL-1)、PMA + ionomycin联合刺激(终质量浓度为PMA: 10 ng·mL-1、ionomycin: 1 μg·mL-1)。每个剂量组设3个平行孔, 置于37 ℃、5% CO2的细胞培养箱中继续培养24 h。离心, 收集细胞上清, 冻于-80 ℃冰箱保存。将细胞用预冷PBS洗涤2次, 加入Pecy7 anti-human CD69抗体孵育30 min, 预冷的PBS洗涤2次后, 采用流式细胞检测仪(BD FACS Verse)检测淋巴细胞CD69的表达情况, 并采用Flowjo 7.6软件分析淋巴细胞CD69的平均荧光强度和CD69阳性淋巴细胞百分比。
CellTiter-Glo发光法检测淋巴细胞增殖 将上述处理的细胞重悬, 移取100 μL细胞悬液至新的96孔板中, 加入100 μL CellTiter-Glo底物, 室温避光5 min, 于Bio-tec酶标仪检测发光值。
ELISA试剂盒检测IFNγ 将试剂盒中Capture antibody加入96孔板中, 4 ℃过夜孵育。次日用清洗缓冲液清洗5次, 向每孔中加入待测样品及不同浓度的标准品于室温孵育2 h, 用清洗缓冲液洗5次。加入检测抗体于室温孵育1 h, 清洗缓冲液洗5次。加入辣根过氧化物酶(HRP)标记的二抗室温孵育30 min。再加入底物TMB于室温避光孵育15 min, 加入硫酸终止, 在酶标仪450 nm处检测。
统计学方法 采用GraphPad Prism统计软件处理, 数据用x ± s表示。P≤0.05为具有统计学意义。
结果 1 不同刺激剂对CD3+CD4+ T细胞表面的CD69蛋白表达情况采用流式细胞术, 对CD3+CD4+ T细胞亚群中的CD69表达进行检测。如图 1所示, 静息状态下CD3+CD4+ T细胞表面上的CD69表达量较低。CD3/CD28 (20和200 ng·mL-1)、PMA (10 ng·mL-1)+ionomycin (1 μg·mL-1)、SEB (10 ng·mL-1)和IL27 (10 ng·mL-1)均可以显著性促进CD69的表达, 表现为PE-Cy7通道的平均荧光强度右移。其中PMA+ionomycin诱导CD3+CD4+ T细胞上CD69的表达能力最强, CD3/CD28、SEB和IL27刺激因子诱导CD3+CD4+ T细胞上CD69的表达能力基本一致。上述这些因子诱导CD69高表达的CD3+CD4+ T细胞百分比分别为74.7%、91.5%、85.2%、64.1%、68.3%。而PHA (1 μg·mL-1)对CD3+CD4+ T细胞上CD69的表达无诱导作用, CD3+CD4+CD69+ T细胞百分比基本无影响。
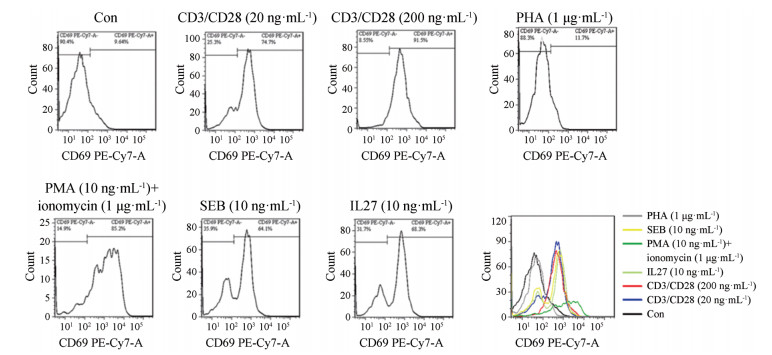
|
Figure 1 The effect of different stimulators on the CD69 expression of CD3+CD4+ T lymphocytes at 24 h by flow cytometry analysis. PHA: Phytohaemagglutinin; SEB: Staphylococcus auresus enterooxin B; IL27: Interleukin 27; PMA: Phorbol myristrate acetate |
本研究也检测了不同刺激因子对CD3+CD8+ T细胞亚群中的CD69表达的影响。如图 2所示, 与CD3+CD4+ T细胞一致, 在未刺激状态下CD3+CD8+ T细胞表面上的CD69表达量较低。CD3/CD28 (20和200 ng·mL-1)、PMA (10 ng·mL-1)+ionomycin (1 μg·mL-1)、SEB (10 ng·mL-1)、IL27 (10 ng·mL-1)和PHA (1 μg·mL-1)均可以促进CD3+CD8+ T细胞CD69的表达。其中CD3/CD28、PMA+ionomycin、SEB和IL27促进CD3+CD8+ T细胞CD69的表达能力基本一致, 都显著强于PHA。上述这些因子诱导CD69高表达的CD3+CD8+ T细胞百分比分别为88.3%、92.4%、88.5%、70.6%、82.9%、15.1%。
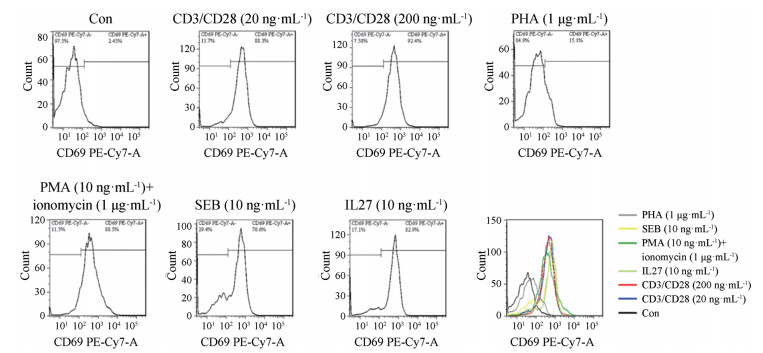
|
Figure 2 The effect of different stimulators on the CD69 expression of CD3+CD8+ T lymphocytes at 24 h by flow cytometry analysis |
T细胞增殖对机体的免疫应答起到了重要作用。本研究采用CellTiter-Glo®发光法检测了不同刺激剂对淋巴细胞增殖能力的检测。如图 3所示, CD3/CD28、PMA+ionomycin、SEB、IL27和PHA作用24 h均无明显促进人淋巴细胞增殖的作用。
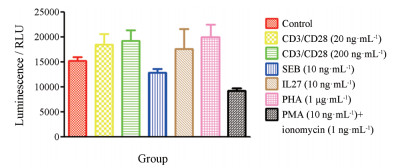
|
Figure 3 The proliferation of lymphocytes after exposed of different stimulators for 24 h |
IFNγ是T淋巴细胞活化的重要标志。采用ELISA法检测了不同刺激剂对淋巴细胞分泌IFNγ含量的影响。如图 4所示, CD3/CD28 (200 ng·mL-1)、PMA (10 ng·mL-1)+ionomycin (1 μg·mL-1)、SEB (10 ng·mL-1)、IL27 (10 ng·mL-1)作用24 h显著诱导由淋巴细胞分泌的IFNγ。其中, PMA+ionomycin诱导IFNγ分泌的作用最强。
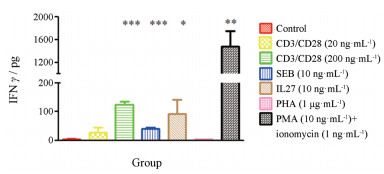
|
Figure 4 The IFNγ levels were detected after exposed of different stimulators for 24 h |
T细胞的功能, 主要从T细胞增殖、活化和分泌水平方面进行评价。增殖能力检测常用形态学观察、放射性核素掺入法和MTT法。镜下形态观察效率低且主观影响大; 同位素虽然精确, 但会对环境造成污染; MTT法灵敏度不够, 同时会受到化合物自身的颜色干扰。本研究采用CellTiter-Glo发光法检测淋巴细胞的增殖。该方法通过检测ATP含量, 可快速灵敏地反映活细胞数量, 成为目前免疫细胞增殖检测的一种常用方法[5, 6]。活化能力评价的方法有CFSE标记检测细胞分裂[7], ELISA法检测细胞因子分泌如IFNγ, 流式细胞术检测细胞表面标志物CD69、CD25和HLA-DR等[8-10]。本研究则检测不同功能刺激剂对T细胞亚群细胞表面标志物CD69表达和IFNγ分泌。其中, CD3/CD28抗体为体外模拟特异性T淋巴细胞活化信号而诱导T细胞的增殖[11]; PMA激活PKC信号从而使T细胞活化增殖[12], ionomycin为Ca2+载体并介导Ca2+的内流[13], 与PMA联用进一步增强其激活淋巴细胞的能力; SEB为超级抗原, 通过T细胞受体β (TCR-β)大量激活T细胞[14]; PHA是一种有丝分裂原从而激活淋巴细胞[7]; IL27与其受体相互作用诱导早期Th1型反应[15]。在本实验所用浓度下的CD3/CD28抗体、PMA+ionomycin、SEB和IL27作用刺激24 h, CD3+CD4+和CD3+CD8+ T细胞CD69的表达显著增高。以上结果提示, CD69是一个很好的T细胞早期活化的标志物, 可同时反映CD3+CD4+和CD3+CD8+ T的活化。与此同时, 淋巴细胞分泌的IFNγ含量也显著增高。IFNγ是T淋巴细胞活化的重要指征之一[16]。IFNγ最初由机体固有免疫中自然杀伤细胞(NK)和自然杀伤T (NKT)细胞分泌, 然后被特异性抗原免疫中Th1和CTLs细胞进一步分泌[17]。因此, 应该综合活化标志物CD69与IFNγ含量来评价T细胞的活化状态。而刺激剂作用24 h对淋巴细胞增殖几乎无影响, 提示淋巴细胞在接受刺激后短时间内以活化为主, 随着时间的延长才可能表现出增殖能力增强。
由于小分子化合物体外单独作用不能直接刺激淋巴细胞活化, 因此在体外评价小分子化合物对T细胞功能的影响时, 需要模拟肿瘤微环境的抗原呈递细胞(APCs)与T细胞的相互作用, 或者采用刺激因子先将T细胞活化[18]。本研究除了发现反映T细胞活化的标志物外, 更好地建立了体外活化T细胞的方法, 为进一步抗肿瘤免疫小分子药物发现奠定实验基础。
| [1] | Borst J, Ahrends T, Bąbała N, et al. CD4+ T cell help in cancer immunology and immunotherapy[J]. Nat Rev Immunol, 2018, 18: 635–647. DOI:10.1038/s41577-018-0044-0 |
| [2] | Galluzzi L, Vacchelli E, Bravo-San Pedro JM, et al. Classification of current anticancer immunotherapies[J]. Oncotarget, 2014, 5: 12472–12508. |
| [3] | Melssen M, Slingluff CL Jr. Vaccines targeting helper T cells for cancer immunotherapy[J]. Curr Opin Immunol, 2017, 47: 85–92. DOI:10.1016/j.coi.2017.07.004 |
| [4] | Bevan MJ. Helping the CD8+ T-cell response[J]. Nat Rev Immunol, 2004, 4: 595–602. DOI:10.1038/nri1413 |
| [5] | Mollgard L, Tidefelt U, Sundman-Engberg B, et al. In vitro chemosensitivity testing in acute non lymphocytic leukemia using the bioluminescence ATP assay[J]. Leuk Res, 2000, 24: 445–452. DOI:10.1016/S0145-2126(00)00003-5 |
| [6] | Ishizaka A, Tono-oka T, Matsumoto S. Evaluation of the proliferative response of lymphocytes by measurement of intracellular ATP[J]. J Immunol Methods, 1984, 72: 127–132. DOI:10.1016/0022-1759(84)90440-X |
| [7] | Xue NN, Dong K, Lai FF, et al. CFSE-labeled proliferative assays for assessment of T cell function induced by different stimulants[J]. J Harbin Univ Commerce (Nat Sci Ed) (哈尔滨商业大学学报(自然科学版)), 2017, 33: 129–134. |
| [8] | Rea IM, McNerlan SE, Alexander HD. CD69, CD25, and HLA-DR activation antigen expression on CD3+ lymphocytes and relationship to serum TNF-α, IFN-γ, and sIL-2R levels in aging[J]. Exp Gerontol, 1999, 34: 79–93. DOI:10.1016/S0531-5565(98)00058-8 |
| [9] | Theze J, Alzari PM, Bertoglio J. Interleukin 2 and its receptors:recent advances and new immunological functions[J]. Immunol Today, 1996, 17: 481–486. DOI:10.1016/0167-5699(96)10057-C |
| [10] | Ziegler SF, Ramsdell F, Alderson MR. The activation antigen CD69[J]. Stem Cells, 1994, 12: 456–465. DOI:10.1002/stem.5530120502 |
| [11] | Trickett A, Kwan YL. T cell stimulation and expansion using anti-CD3/CD28 beads[J]. J Immunol Methods, 2003, 275: 251–255. DOI:10.1016/S0022-1759(03)00010-3 |
| [12] | Seo HH, Lee CY, Lee J, et al. The role of nuclear factor of activated T cells during phorbol myristate acetate-induced cardiac differentiation of mesenchymal stem cells[J]. Stem Cell Res Ther, 2016, 7: 90. DOI:10.1186/s13287-016-0348-6 |
| [13] | Nakamura S, Nakanishi A, Takazawa M, et al. Ionomycin-induced calcium influx induces neurite degeneration in mouse neuroblastoma cells:analysis of a time-lapse live cell imaging system[J]. Free Radic Res, 2016, 50: 1214–1225. DOI:10.1080/10715762.2016.1227074 |
| [14] | Xu SX, Kasper KJ, Zeppa JJ, et al. Superantigens modulate bacterial density during Staphylococcus aureus nasal colonization[J]. Toxins (Basel), 2015, 7: 1821–1836. DOI:10.3390/toxins7051821 |
| [15] | Carl JW, Bai XF. IL27:its roles in the induction and inhibition of inflammation[J]. Int J Clin Exp Pathol, 2008, 1: 117–123. |
| [16] | McNamara MJ, Hilgart-Martiszus I, Barragan Echenique DM, et al. Interferon-γ production by peripheral lymphocytes predicts survival of tumor-bearing mice receiving dual PD-1/CTLA-4 blockade[J]. Cancer Immunol Res, 2016, 4: 650–657. DOI:10.1158/2326-6066.CIR-16-0022 |
| [17] | Schoenborn JR, Wilson CB. Regulation of interferon-γ during innate and adaptive immune responses[J]. Adv Immunol, 2007, 96: 41–101. DOI:10.1016/S0065-2776(07)96002-2 |
| [18] | Li L, Lai FF, Du TT, et al. Effect of different stimulators on PD-1 and TIM3 expression in lymphocytes[J]. Chin Med Biotechnol (中国医药生物技术), 2019, 14: 127–135. |
 2019, Vol. 54
2019, Vol. 54


