2. 南京中医药大学药学院, 江苏 南京 210023;
3. 上海交通大学生命科学技术学院, 微生物代谢国家重点实验室, 上海 200240
2. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. State Key Laboratory of Microbial Metabolism, School of Life Science and Biotechnology, Shanghai Jiao Tong University, Shanghai 200240, China
肿瘤诱导的免疫抑制微环境是促进肿瘤生长、侵袭及远处转移, 限制机体抗肿瘤免疫应答的关键因素, 也是当前多种治疗手段包括分子靶向治疗疗效不佳的重要原因[1]。一方面, 免疫细胞与其分泌的细胞因子相互作用共同构成免疫微环境, 通过启动抗凋亡通路、介导免疫耐受、诱导上皮间质转化及形成肿瘤干细胞等途径促进肿瘤产生治疗耐受, 降低肿瘤治疗疗效; 另一方面, 绝大多数小分子靶向药物会损伤T细胞和B细胞的功能, 造成免疫抑制。因为多种分子靶向药物针对的信号转导通路是免疫细胞和肿瘤细胞共用的, 如丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、丝裂原活化蛋白激酶激酶(MAPKK, MEK)、周期蛋白依赖的激酶(cyclin-dependent kinases, CDK)通路等[1]。肿瘤免疫抑制微环境组成包括肿瘤相关巨噬细胞(TAMs)、髓系来源的抑制性细胞(myeloid-derived suppressor cells, MDSCs)、调节性T细胞(Tregs)、调节性B细胞(Bregs)、调节性树突状细胞(Treg dendritic cell, Treg DCs), 由这些细胞分泌的抑制性细胞因子, 如转化生长因子beta (transfer growth factor β, TGFβ)、白细胞介素10 (interleukin-10, IL-10)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等[2]。其中MDSCs和Treg是肿瘤免疫抑制微环境主要细胞成分。小鼠体内产生两种MDSC细胞, 分别是单核细胞来源的MDSC (monocytic MDSC, M-MDSC)标记为CD11b+Gr-1high和粒细胞来源的MDSC (granulocytic MDSC, G-MDSC), 标记为CD11b+Gr-1int[3]。肿瘤免疫抑制机制包括:抑制性受体-配体的作用, 如程序性死亡受体-配体(programmed cell death protein 1, PD-1/PD-L1), 细胞毒性T淋巴细胞相关蛋白4及其配体(CTLA-4/B7-H1), 以及免疫细胞分泌的免疫抑制细胞因子IL-10和TGFβ等介导肿瘤免疫逃逸。因此, 靶向肿瘤免疫微环境, 逆转肿瘤免疫抑制, 激活肿瘤免疫应答的治疗策略已经成为当前肿瘤免疫治疗的新热点[4-6]。如阻断CTLA4/B7-H1相互作用, 能够显著增强T细胞抗肿瘤效应, 在黑色素瘤治疗中, 能够延长患者的总生存期; 靶向PD1-PD-L1轴的抗体已取得了突破性的临床疗效, 能够抑制多种恶性肿瘤, 如黑色素瘤、肾癌、鼻咽癌和前列腺癌等[7]。
S100A9属于钙结合蛋白S100蛋白家族, 常与S100A8以钙离子依赖性方式形成异源二聚体, 可抑制酪蛋白激酶的活性, 主要表达于粒细胞、单核细胞等髓系来源的细胞和特定病理状态下的角质化细胞[8]。S100A9具有多个配体及翻译后修饰, 与炎症发生和肿瘤侵袭密切相关[9]。最近的研究也表明, S100A9在肿瘤细胞、侵润性免疫细胞中异常高表达并直接参与了恶性肿瘤发生发展、侵袭、转移的各个阶段[9-11]。如有研究表明, 胰腺癌组织中S100A9可通过上调TGFβ诱导上皮间质转变(EMT)并促进肿瘤细胞迁移[11]。S100A9对于MDSCs的分化和聚集具有重要作用。肿瘤细胞诱导的MDSC表面S100A9高表达能够抑制树突状细胞的成熟和分化, 并增加MDSC向肿瘤周围微环境的募集, 从而导致多种细胞因子和趋化因子的合成和分泌, 促进免疫抑制微环境形成[8, 9]。S100A8/A9异源二聚体在多种炎症疾病及恶性肿瘤中大量释放, 可作为临床诊断及治疗的潜在靶标进行深入研究[12]。
霍乱毒素(cholera toxin, CT)由A亚基(CT-A)及一个五聚化的B亚基(CTB)组成, CTB能够与大多数哺乳动物细胞表面的神经节苷脂GM1特异性结合, 可促进与其连接抗原蛋白通过黏膜屏障, 同时增强抗原被DC等抗原提呈细胞的提呈作用[13]。因此, CTB是一个良好的载体蛋白。本课题组在前期研究中以霍乱毒素B亚基(CTB)五聚体为载体构建了一种靶向小鼠MDSC表面标识蛋白S100A8的重组多肽疫苗CTB-S100A8, 免疫小鼠后能打破自身免疫耐受产生高滴度的S100A8抗体并有效抑制小鼠乳腺癌肿瘤的生长, 并减少外周血中肿瘤诱导的单核细胞来源的MDSC[14]。本研究以CTB为载体蛋白构建了一种CTB-S100A9五聚体多肽疫苗, 并对其抗肿瘤活性及其抗肿瘤机制进行了初步探索。
材料与方法质粒、菌株及试剂 大肠杆菌分泌表达载体pCTB2及大肠杆菌菌株E.coli TG1、E.coli Top 10感受态细胞、E.coli BL21 (DE3)感受态细胞及DNA分子量标准购自天根生化科技有限公司; 蛋白分子量标准(Thermo公司); ClonExpress Ⅱ One Step Cloning Kit (Vazyme公司); BspE I及BamH I内切酶(NEB公司); 酪蛋白水解物(casin hydrolyate, Fluka公司); 凝胶回收及质粒小提试剂盒(Axygen公司); 流式抗体anti-CD4 anti-CD25 (BD公司); cyclophosphamide (江苏恒瑞医药股份有限公司); ELISA包被用重组小鼠S100A9蛋白购自Prospec公司(catalogue no. PRO-878);氢氧化铝佐剂(alumiunm hydroxide, Alum)购自英潍捷基(Invitrogen)公司; 寡聚核苷酸CpG (序列: TCCATGA CGTTCCTGACGTT)由南京金斯瑞生物科技有限公司。其他试剂均为国产或进口分析纯试剂。
实验动物及细胞株 SPF级6周龄雌性BALB/C小鼠购自上海实验动物中心, 体重(20 ± 2) g, 许可证号: SCXK (沪) 2012-0002。小鼠均采用标准的啮齿类动物饲料进行喂养, 所有相关动物实验的操作严格按照《实验动物管理条例》并按照南京中医药大学附属中西医结合医院动物伦理委员会批准的实验方案进行。小鼠乳腺癌4T1细胞株购自中科院上海细胞库, 接种于含10%胎牛血清的RPMI 1640培养基中, 37 ℃、5% CO2培养箱中培养。
引物设计与基因合成 S100A9 (基因序列号P27005)序列由上海捷瑞生物工程有限公司合成并装载至pET28a载体中, 引物由南京金斯瑞生物科技有限公司合成。引物序列如表 1。
| Table 1 Primers used for the construction of cholera toxin B (CTB)-S100A9. The underlined nucleotides are BspE I and BamH I restriction sites |
重组表达载体构建及蛋白纯化 重组CTB-S100A9表达质粒的构建与CTB-S100A8质粒构建方法相同, 详细流程参考文献[14]。以pET28a-S100A9为模板, S100A9-F/R为引物扩增S100A9 (267 bp)片段, 通过同源重组法将其整合至线性化质粒pCTB2的BamH I及BspE I酶切位点之间。PCR鉴定为阳性(PCR条件、电泳检测方法如前[14])的单克隆送南京金斯瑞生物科技有限公司测序。重组蛋白S100A9/CTB-S100A9的表达纯化工艺与前作[14]相同。
免疫BALB/c小鼠及肿瘤接种
肿瘤预防模型 20只BALB/c小鼠随机分成5组, 分别为模型组(注射PBS)、Alum+CpG 30 μg佐剂组、CTB组、S100A9组、CTB-S100A9组。第0、12天进行皮下免疫, 注射剂量为: 50 μg (400 μL)抗原/只/次, 5组均辅以Alum 325 μg·(20 bgw)-1+CPG 30 μg·(20 bgw)-1。第17天进行眼眶静脉采血, 将血样室温静置2 h至血浆沉淀、血清完全析出, 4 ℃、4 000 r·min-1离心20 min, 取血清储存于-70 ℃。第20天接种4T1肿瘤细胞, 接种剂量为1×105个(100 μL, 10 mmol·L-1, pH 7.0的PBS稀释)。第25天进行第3次皮下免疫, 剂量方法如前。第35天, 解剖小鼠, 收集血液样本, 并解剖收集肺脏, 按Ma等[15]的方法统计肺脏转移灶, 计算每只小鼠肺脏的转移灶数目。
肿瘤治疗模型 64只小鼠按上述方案接种4T1肿瘤细胞; 接种后监测出瘤情况及瘤体大小, 当平均瘤体大小在50~100 mm3时(一般为接瘤后第7~10天)将荷瘤小鼠随机分为5组, 分别为PBS组(model)、Alum+CpG佐剂组、S100A9组、CTB组、CTB-S100A9组。肿瘤接种后第7、14、21、28和35天进行皮下免疫。上述模型中肿瘤为每周测试2次, 两种模型均于治疗终点采集小鼠肿瘤及血液样本, 称量小鼠瘤重和体重。
Elisa法检测血清抗体 用50 mmol·L-1碳酸盐缓冲液(pH 9.6)稀释S100A9单结构域蛋白至10 μg·mL-1, 包被96孔培养皿, 每孔100 μL, 4 ℃孵育过夜。0.1% PBST洗涤6次, 3% BSA 37 ℃封闭2 h, 0.1% PBST洗涤6次, 封闭液1:100稀释血清, 每孔包被100 μL, 4 ℃孵育过夜。0.1% PBST洗涤6次, HRP-rabbit-anti-mouse IgG用封闭液1:5 000稀释, 每孔包被100 μL, 37 ℃孵育1 h, 0.1% PBST洗涤12次后TMB/H2O2室温显色20 min, 100 μL 2 mol·L-1硫酸终止反应。采用双波长法于酶标仪上读取数据OD450和OD630, 实验组血清(OD450-OD630)大于正常组2.1倍确认为抗体阳性。对于血清抗体滴度的检测:各组取(OD450-OD630)读数介于中间值的样本检测抗体滴度。S100A9包被, 洗涤, 封闭如上操作。血清用封闭液倍比稀释如下倍数: 100×20, 100×21, 100×22, ……, 100×210, 每孔包被100 μL, 4 ℃孵育过夜。二抗孵育, 洗涤及显色反应如上操作, 采用双波长法于酶标仪上读取数据OD450和OD630, 根据OD450-OD630读数计算各组抗体滴度。
流式细胞术测定外周血及脾脏MDSC、Treg等细胞数量 第17天及第49天, 在超净台中分离小鼠脾脏, 将脾脏放入盛有2 mL 10 mmol·L-1 PBS (pH 7.4)的小皿中, 无菌镊子夹碎, 细胞悬液采用细胞筛进行过滤, 过滤后的脾脏细胞悬浊液1 500 r·min-1离心5 min并加入上述PBS重悬洗涤2次, 外周血则直接离心。在脾脏细胞悬液和外周血细胞加入3~5倍细胞体积的红细胞裂解液, 轻轻吹打混匀, 室温裂解1~2 min。4 ℃、2 000 r·min-1离心5 min, 弃上清。离心后的细胞沉淀加入适量上述PBS重悬并洗涤2次。
将上述制备好的细胞用流式缓冲液重悬, 稀释细胞为每毫升5×106个细胞, 分成4组进行流式染色, 每支流式检测管中加入100 μL细胞悬液, 分组如下: ① CD4-FITC, CD3-APC, CD8-PE; ② CD4-FITC, FOXP3-APC; ③ CD11b-FITC, Gr-1-APC, F4/80-PE; ④ CD11c-PE, CD86-FITC。每管均加入1 μL Fcγ R Ⅲ/Ⅱ抗体, 轻柔混匀并在冰上孵育10 min, 然后每管加入2 mL上述PBS洗涤2次。流式缓冲液重悬细胞, 在每个流式检测管中加入对应的荧光标记抗体, 然后各管避光孵育30 min, 如上重复洗涤2次, 最后加入500 μL流式缓冲液, 充分重悬细胞。上机检测。
统计学方法 本研究中所有统计均采用one-way ANOVA (and nonparametric) Tukey test分别做两组间统计, *表示P<0.05, **表示P<0.01, ***表示P<0.001。所有统计数据均采用GraphPad Prism 5.0软件进行统计分析制图。
结果 1 CTB-S100A9表达载体的构建及重组蛋白制备经鉴定为基因正确装入的表达载体pCTB2-S100A9转化至BL21菌株进行表达, Ni柱亲和纯化, 得到大小约为12 kDa的S100A9单结构域蛋白, SDS-PAGE电泳检测蛋白纯度大于90% (图 1A)。CTB及CTB-S100A9在TG1宿主菌进行培养表达, 采用Ni2+柱进行亲和纯化, 获得纯度>90%的重组蛋白(图 1B)。使用变性还原及变性非还原两种上样缓冲液进行SDS-PAGE检测重组蛋白是否具有多聚体形态。结果显示:将CTB融合S100A9表达时, 重组蛋白能形成包括五聚体在内的多聚体形态(图 1B)。
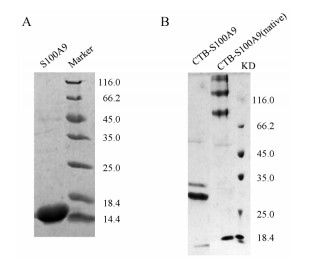
|
Figure 1 Purification and identification of cholera toxin B (CTB), S100A9 and CTB-S100A9. A: SDS-PAGE analysis of the expression of S100A9 under reducing condition; B: SDS-PAGE analysis of the production of recombinant CTB and CTB-S100A9 pentamer. To detect the pentameric CTB and CTB-S100A9, the purified proteins were mixed with 4 × non-reducing sample buffer and directly loaded onto the gel without heating |
分别以S100A8及S100A9单结构域蛋白包被, 将不同蛋白第二次免疫后的血清作为一抗, 进行ELISA测定。ELISA结果显示S100A9及CTB-S100A9组都能产生均一的针对S100A9的阳性抗体, 且CTB-S100A9组抗体强度显著高于S100A9组(图 2A)。在荷瘤小鼠体内, 检测发现CTB-S100A9的抗体强度进一步提高, 并未受到肿瘤导致的免疫抑制环境的影响(图 2B)。说明五聚化的CTB能够增加抗原尺寸, 增强免疫反应, 是良好的多肽疫苗载体蛋白。有意思的是由于S100A8与S100A9之间存在蛋白序列同源性, S100A8免疫后也能产生针对S100A9的抗体。但是无论是S100A9还是CTB-S100A9免疫后却并未产生针对S100A8的抗体(图 2C)。这个结果表明S100A9免疫产生的抗体特异性更强。
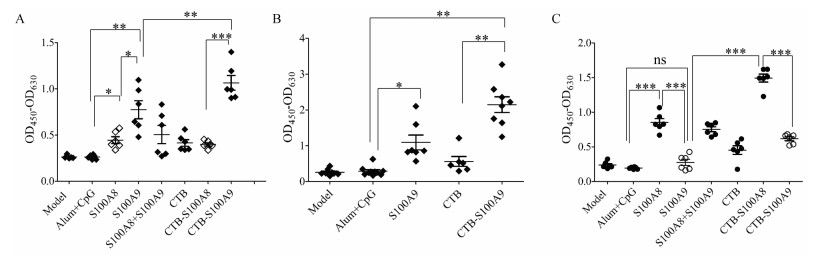
|
Figure 2 Antibody specificity analysis by ELISA. Results shown anti-S100A9 responses from pooled mouse sera obtained 5 days after the second immunization (A) and from pooled mouse sera obtained 15 days after tumor inoculation (B). C: Results shown anti-S100A8 responses from pooled mouse sera obtained pooled mouse sera obtained 5 days after the second immunization. The mouse with average OD450-OD630 readings in each group were detected. n = 5, x ± s. Repeat 3 times (r = 3). *P < 0.05, **P < 0.01, ***P < 0.001. ns: No sense |
按图 3A所示对小鼠进行免疫、样本采集及肿瘤接种。肿瘤体积测试表明, 自肿瘤接种第14天起, S100A9和CTB-S100A9均具有显著的肿瘤抑制效果, 在肿瘤接种21天后, Alum+CpG佐剂组肿瘤平均体积达到了1 450 mm3, 而S100A9组和CTB-S100A9组分别只有350 mm3和480 mm3 (图 3B)。CTB-S100A9免疫后小鼠肿瘤平均重量为1.72 g, 显著低于CTB组(3.87 g, P<0.01)及Alum+CpG佐剂组(3.51 g, P<0.05) (图 3C)。以上结果表明, S100A9及CTB-S100A9均有显著的肿瘤预防作用, 且CTB-S100A9的肿瘤生长抑制活性更强。更有意思的是, 4T1作为一种小鼠高转移性乳腺癌细胞, 其具有很强的肺转移能力。转移后的肺脏表面不平整, 形态不规则, 充血。观察显示CTB-S100A9免疫组小鼠的肺脏转移灶相对其他各组更少, 肺脏形态更完整, 表面更光滑(图 3D)。而S100A9抑制肿瘤肺转移活性不显著。对各免疫组的小鼠肺脏转移灶进行计数发现, Alum+CpG佐剂组的肺脏转移灶在12~15个之间(n = 3), 而S100A9及CTB-S100A9组显著减少。CTB-S100A9组的肺脏转移灶平均为4~7个, 大约是佐剂对照组的50% (图 3E)。这表明在肿瘤预防模型中, CTB-S100A9疫苗免疫后能显著减少小鼠乳腺癌的肺转移。
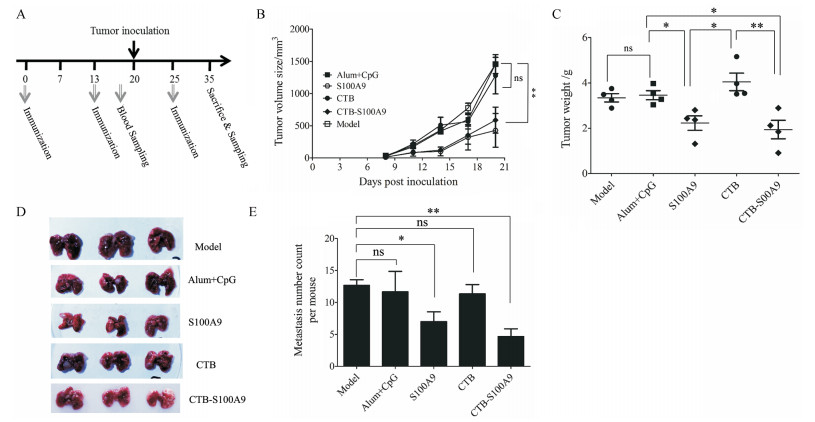
|
Figure 3 Tumor protective efficacy of CTB-S100A9 on 4T1 tumor-bearing mice. A: The vaccination schedule shows that mice got 3 immunizations on day 0, day 13 and day 25. Mice after 2 immunizations were given inoculations with 4T1 cells on day 20; Mice were sacrificed at day 35; B: Inhibition of 4T1 tumor growth in BALB/c mice following tumor inoculation every 3 day. Tumor size was expressed as tumor volume; C: Weight of separated tumors was measured after sacrifice; D: Photos of lung separated from different groups; E: Pulmonary metastases statistics of each group in 4T1 tumor bearing BALB/c mice. For statistics in panel B and C, all the above values are expressed as n = 4, x ± s. For statistics in panel E, data was analysis by comparison the model group with the other groups with two tailed t test. *P < 0.05, **P < 0.01 |
流式细胞分析第二次免疫后第5天小鼠外周血及脾脏白细胞, 结果发现:各免疫组对小鼠脾脏CD4+和CD8+ T细胞以及外周血中的Mφ均无显著影响(图 4A~C), 但是显著减少外周血中的DC细胞含量(图 4D)。这可能与S100A9蛋白本身的抑制性活性相关。CTB-S100A9相较于Alum+CpG佐剂组能够轻微增加MDSC的含量(图 4E、F, 统计无显著差异)。这同样可能与S100A9的生物学活性相关, 因为有研究表明在小鼠体内过表达S100A9将会抑制DC及Mφ的成熟和活化, 促进MDSC的成熟与募集。
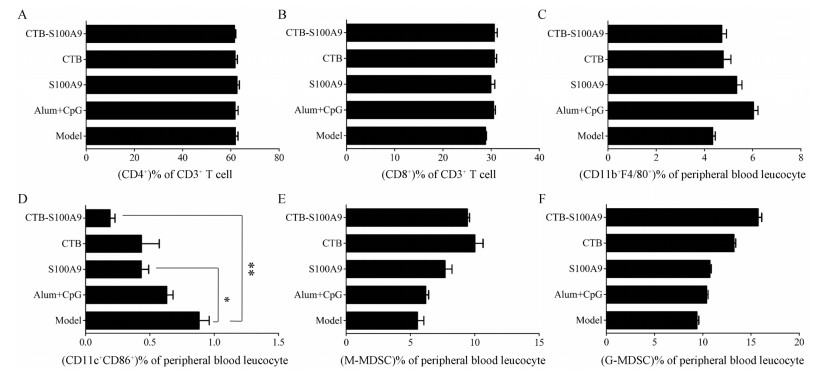
|
Figure 4 Effect of CTB-S100A9 on T cells, macrophage, dendritic cell (DC), and myeloid-derived suppressor cells (MDSCs) in splenocyte and periphera blood leucocyte after the second vaccination. A, B: Percentage of CD4+ T (A) and CD8+ T (B) cells among splenocytes; C, D: Percentage of Mφ (C) and DCs (D) cells among periphera blood leucocytes; E: Percentage of monocytic MDSC (M-MDSC, CD11b+Gr-1high) among periphera blood leucocytes; F: Percentage of granulocytic MDSC (G-MDSC, CD11b+Gr-1int) among periphera blood leucocytes. All the statics were represented the comparison between model group and the other groups (n = 3, r = 3). Data was analyzed by using two tailed t test. *P < 0.05, **P < 0.01 |
按照图 5A所示的流程, 肿瘤接种后第7天开始免疫, 每周免疫1次, 在模型组肿瘤体积达到2 000 mm3时终止实验(约35天)。结果提示, 在肿瘤接种后免疫2次(第22天) CTB-S100A9免疫组肿瘤平均体积开始与对照组显示显著差异。在实验终点, S100A9组、CTB组及佐剂对照组与模型组的肿瘤体积均值均达到了近2 000 mm3, 而CTB-S100A9组只有700 mm3 (图 5B)。这表明CTB-S100A9具有显著的肿瘤治疗活性。值得一提的是, S100A9单结构域免疫尽管具有一定的肿瘤预防作用, 但是在治疗模型中并未观察到显著疗效。在第35天实验终点解剖小鼠分离肿瘤进行称重, 发现佐剂对照组与模型组以及S100A9组、CTB组的肿瘤平均重量均在2~2.5 g左右, 而CTB-S100A9组的肿瘤平均重量只有0.4 g (图 5C、D)。
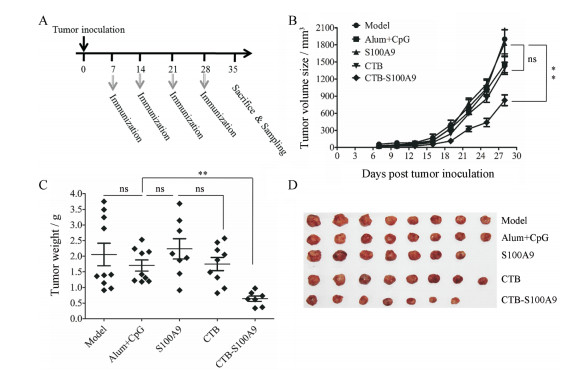
|
Figure 5 Tumor therapeutic efficacy of CTB-S100A9 vaccine on 4T1 mammary cancer-bearing mice. A: Tumor therapy schedule. Mice got 3 immunizations from day 7 after tumor inoculation and about 1 vaccination per week; Tumor size (B) and tumor weight (C) statistics are shown as the x ± s per group (n = 8, r = 3); D: After sacrifice, tumors were removed from mice in different groups and photographed; Statistical differences were analyzed by one-way ANOVA with Bonferroni's multiple comparison test. **P < 0.01 |
流式细胞分析4T1荷瘤小鼠的脾脏及外周血细胞中免疫抑制细胞MDSC及Treg的数量, 结果如图 6所示, S100A9及CTB-S100A9免疫后的小鼠外周血中, 经肿瘤诱导的G-MDSC减少, 其中CTB-S100A9组与模型组及Alum+CpG佐剂组相比有显著性差异(P<0.01), CTB-S100A9组的G-MDSC只有模型组和佐剂组的50%左右(图 6A)。但是M-MDSC的数量在各组间无显著差异(图 6B, P>0.05), 这与CTB-S100A8的结果不同, CTB-S100A8主要抑制肿瘤诱导的M-MDSC[14]。有意思的是, S100A9及CTB-S100A9均能减少外周血中CD4+FOXP3+ Treg的含量(图 6C), 特别是CTB-S100A9免疫组外周血中CD4+FOXP3+ Treg的含量比模型组和佐剂组减少80%, 仅有0.4%左右(图 6C), 并且CTB-S100A9能同时减少脾脏中CD4+FOXP3+ Treg (图 6D, P<0.01)。
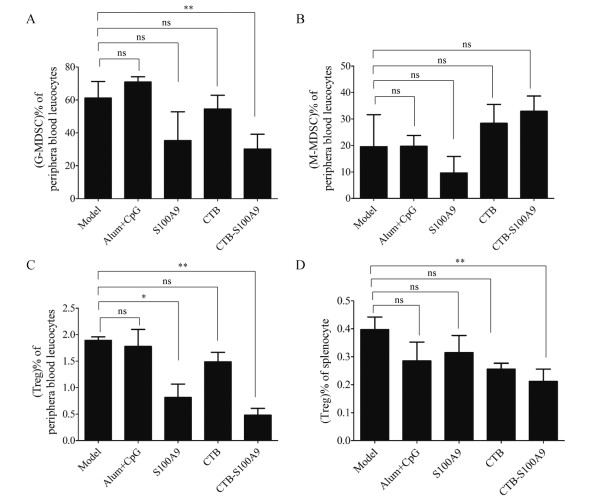
|
Figure 6 Effect of CTB-S100A9 on MDSCs in splenocyte and periphera blood leucocytes of tumor-bearing mice. A, B: Statistics on the percentage of G-MDSC (A) and M-MDSC (B) in periphera blood leucocytes respectively; C, D: Percentage of CD4+FOXP3+ Treg cells in periphera blood leucocytes (C) and splenocyte (D), respectively. x ± s, n = 3, r = 3. Data was analyzed by using two tailed t test. *P < 0.05, **P < 0.01 |
MDSC和Treg是最重要的免疫抑制细胞[16]。其中MDSC可通过多种机制影响机体固有免疫应答和适应性免疫应答, 包括抑制自然杀伤细胞的细胞毒活性, 抑制树突状细胞和巨噬细胞的分化, 诱导Treg细胞的产生和扩增等。此外, MDSC表面表达的S100A8/S100A9可作为其特异性标志物用于靶向药物设计。在前期研究中, 本课题组利用融合表达技术率先设计了一种靶向S100A8的多肽疫苗CTB-S100A8, 该重组多肽疫苗在BALB/c小鼠中能有效打破自身免疫耐受, 抑制外周血中M-MDSC的表达, 在4T1乳腺癌荷瘤小鼠模型中具有显著的肿瘤预防作用。而MDSC的另一种特异性标志物S100A9, 与肿瘤发生发展关系更为密切, 但其作为靶向MDSC的多肽疫苗设计靶点是否具有改善肿瘤免疫微环境和抗肿瘤疗效尚不明确。
对于CTB-S100A8的研究发现, 其能有效抑制肿瘤生长, 并减少外周血中肿瘤诱导的单核细胞来源的MDSC, 但是对粒细胞来源的MDSC及另一种抑制性细胞Treg影响不显著。此外, 重组疫苗产生的S100A8抗体会与S100A9产生交叉反应。本研究依照前作, 以CTB为载体蛋白构建了一种靶向S100A9的多聚体重组多肽CTB-S100A9。与CTB-S100A8相似, S100A9与CTB融合后产生了高滴度的S100A9抗体。并且相对于S100A8, CTB-S100A9产生的抗体特异性更高, 与S100A8几乎不发生交叉免疫反应。
CTB-S100A9重组多肽疫苗在4T1乳腺癌荷瘤小鼠模型中显示出显著的肿瘤预防作用。有意思的是在肿瘤预防模型中发现, CTB-S100A9免疫组小鼠肺脏转移显著少于其他各组。这表明CTB-S100A9重组疫苗能够抑制乳腺癌细胞的肺转移。更重要的是, 该多肽疫苗同时具有显著的肿瘤治疗作用。尽管重组S100A9也能产生一定浓度的抗体应答, 但是研究并没有观察到S100A9疫苗的肿瘤治疗作用。这说明融合CTB不仅显著增强了S100A9的抗体应答, 而且显著促进了其抗肿瘤活性。
CTB-S100A9免疫后对脾脏中CD4+或CD8+ T细胞亚群无显著影响。该结果表明, CTB-S100A9重组多肽疫苗对机体的基础免疫并无显著影响。尽管如此, CTB-S100A9免疫后外周血髓系来源的Mφ和DC细胞含量有一定下降, 特别是DC细胞下降显著。而CTB-S100A9免疫后对MDSC则有一定的促进增殖作用(统计结果与对照相比不显著)。这可能与重组的S100A9/CTB-S100A9具有一定的生物学活性有关。因为有研究表明, 过表达S100A9能够抑制DC、Mφ的分化同时促进MDSC聚集[17]。但是在荷瘤小鼠体内, CTB-S100A9免疫组中G-MDSC显著减少, 而M-MDSC则变化不大。这表明CTB-S100A9与CTB-S100A8对外周血MDSC影响不同[14], S100A9主要表达于G-MDSC, 而S100A8主要表达于M-MDSC。
Treg作为另一种主要的免疫抑制细胞, 与MDSC存在一定的交互作用。Treg能够通过B7-H1信号转导通路产生IL-35抑制Th1和Th17免疫途径, 进一步促进CD4+ T细胞分泌IL-10。IL-10能够抑制DC细胞的分化和成熟, 抑制CD8+ T细胞的活化, 促进MDSC细胞的募集[18]。本研究发现, 荷瘤小鼠S100A9/CTB-S100A9免疫组的外周血和脾脏CD4+ FOXP3+ Treg细胞含量同样显著降低, 这在前作CTB-S100A8疫苗中并未观察到类似效果。这表明抑制荷瘤小鼠体内的G-MDSC有可能通过MDSC与Treg的互作进而下调肿瘤诱导的Treg, 而S100A9很有可能参与这种互作反馈调节机制, 其详细机制需要进一步研究。
本研究再次证明, 通过设计靶向MDSC分子标志物的重组多肽疫苗能够显著抑制MDSC和Treg, 改善抑制性肿瘤免疫微环境, 促进抗肿瘤免疫应答。本研究可为靶向肿瘤免疫环境的疫苗设计提供新的思路。
| [1] | Allegrezza MJ, Conejo-Garcia JR. Targeted therapy and immunosuppression in the tumor microenvironment[J]. Trends Cancer, 2017, 3: 19–27. DOI:10.1016/j.trecan.2016.11.009 |
| [2] | Zhou P, Shaffer DR, Alvarez Arias DA, et al. In vivo discovery of immunotherapy targets in the tumour microenvironment[J]. Nature, 2014, 506: 52–57. DOI:10.1038/nature12988 |
| [3] | Qin H, Lerman B, Sakamaki I, et al. Generation of a new therapeutic peptide that depletes myeloid-derived suppressor cells in tumor-bearing mice[J]. Nat Med, 2014, 20: 676–681. DOI:10.1038/nm.3560 |
| [4] | Motz GT, Coukos G. Deciphering and reversing tumor immune suppression[J]. Immunity, 2013, 39: 61–73. DOI:10.1016/j.immuni.2013.07.005 |
| [5] | Jiang X, Wang J, Deng X, et al. Role of the tumor microenvironment in PD-L1/PD-1-mediated tumor immune escape[J]. Mol Cancer, 2019, 18: 10. DOI:10.1186/s12943-018-0928-4 |
| [6] | Binnewies M, Roberts EW, Kersten K, et al. Understanding the tumor immune microenvironment (TIME) for effective therapy[J]. Nat Med, 2018, 24: 541–550. DOI:10.1038/s41591-018-0014-x |
| [7] | Philips GK, Atkins M. Therapeutic uses of anti-PD-1 and anti-PD-L1 antibodies[J]. Int Immunol, 2015, 27: 39–46. DOI:10.1093/intimm/dxu095 |
| [8] | Markowitz J, Carson WE. Review of S100A9 biology and its role in cancer[J]. Biochim Biophys Acta, 2013, 1835: 100–109. |
| [9] | Leanderson T, Ivars F. S100A9 and tumor growth[J]. Oncoimmunology, 2012, 1: 1404–1405. DOI:10.4161/onci.21027 |
| [10] | Hwang SH, Ahn JH, Lee M. Upregulation of S100A9 contributes to the acquired resistance to BRAF inhibitors[J]. Genes Genomics, 2019. DOI:10.1007/s13258-019-00856-0 |
| [11] | Zha H, Li X, Sun H, et al. S100A9 promotes the proliferation and migration of cervical cancer cells by inducing epithelialmesenchymal transition and activating the Wnt/β-catenin pathway[J]. Int J Oncol, 2019, 55: 35–44. |
| [12] | Leanderson T, Liberg D, Ivars F. S100A9 as a pharmacological target molecule in inflammation and cancer[J]. Endocr Metab Immune Disord Drug Targets, 2015, 15: 97–104. DOI:10.2174/1871530315666150316123854 |
| [13] | Baldauf KJ, Royal JM, Hamorsky KT, et al. Cholera toxin B:one subunit with many pharmaceutical applications[J]. Toxins, 2015, 7: 974–996. DOI:10.3390/toxins7030974 |
| [14] | Qiu LC, Lu WG, Li RX. Construction and anti-tumor efficacy of a pentameric peptide vaccine that targets S100A8[J]. Acta Pharm Sin (药学学报), 2016, 51: 294–301. |
| [15] | Ma G, He JJ, Yu Y, et al. Tamoxifen inhibits ER-negative breast cancer cell invasion and metastasis by accelerating twist1 degradation[J]. Int J Biol Sci, 2015, 11: 618–628. DOI:10.7150/ijbs.11380 |
| [16] | Lindau D, Gielen P, Kroesen M. The immunosuppressive tumour network:myeloid-derived suppressor cells, regulatory T cells and natural killer T cells[J]. Immunology, 2013, 138: 105–115. DOI:10.1111/imm.12036 |
| [17] | Cheng P, Corzo CA, Luetteke N. Inhibition of dendritic cell differentiation and accumulation of myeloid-derived suppressor cells in cancer is regulated by S100A9 protein[J]. J Exp Med, 2008, 205: 2235–2249. DOI:10.1084/jem.20080132 |
| [18] | Fujimura T, Kambayashi Y, Aiba S. Crosstalk between regulatory T cells (Tregs) and myeloid derived suppressor cells (MDSCs) during melanoma growth[J]. Oncoimmunology, 2012, 1: 1433–1434. DOI:10.4161/onci.21176 |
 2019, Vol. 54
2019, Vol. 54


