抗体治疗疾病的历史可追溯到几千年前, 早在公元前我国已经开始利用抗感染性疾病的疫苗。然而, 真正的治疗抗体药物大约出现在一百多年前, 当时医学家发现用毒素(如白喉毒素或病毒等)免疫的动物血清是一种有效的治疗药剂, 并首次提出了基于抗体的疾病治疗, 单克隆抗体药物[1]治疗疾病也上升到理论研究的高度。
抗体是一类用于抵抗外源性物质侵袭的蛋白质, 由B淋巴细胞或记忆细胞增殖分化成的浆细胞所产生的、可与特定抗原发生特异性结合, 分子量约为15万~90万道尔顿(Da)。抗体主要分布在机体的血清中, 也分布于组织液及外分泌液中, 是重要的疾病防御活性物质。
1975年英国剑桥大学科学家乔治斯•科勒(Georges J. F. Kohler)和赛瑟•米尔斯坦(Cesar Milstein)[2]共同发表了一篇关于抗体研究性论文, 描述了一种能够大量生产单克隆抗体的杂交瘤技术, 治疗性抗体药物的生产由此从理论逐渐变为了现实, 杂交瘤细胞就像一个高智能抗体生产工厂, 可以不断生产性质相同的单克隆抗体。1984年Kohler和Milstein因此研究和在免疫学方面卓越的贡献获得了诺贝尔生理学和医学奖。
1986年美国食品药品监督管理局(Food and Drug Administration, FDA)首次批准鼠源单克隆抗体muromonab-CD3 (OKT3)上市, 但鼠源淋巴细胞杂交瘤生产的抗体容易被人免疫系统识别, 该类治疗性单抗药物半衰期较短, 疗效效果不佳, 同时会引起人抗鼠抗体反应(human anti-mouse antibody, HAMA)等严重药物不良反应。后来随着重组DNA技术和各种人源化抗体技术迅速发展, 单克隆抗体药物经历鼠源和人鼠嵌合单抗后, 逐渐发展为人源化和全人源化单抗[3]。
2002年, 全球第一个全人源抗体药物-阿达木单抗获批上市, 目前全球已上市的治疗性单克隆抗体类药物, 治疗领域主要集中在肿瘤、自身免疫性疾病、器官移植排斥及病毒感染等重大疾病领域。由于单克隆抗体具有与抗原靶点高亲和力和特异性识别等优点, 而且通过改造的抗体其免疫原性大大降低, 这些改进使得单抗药物在临床治疗中较化学药物具有特异性强、疗效好、不良反应低等优点, 因而单克隆抗体药物已经成为全球靶向药物重要发展方向和研究热点。
抗体偶联药物的研究基于一百多年前保罗•埃尔利希(Paul Ehrlich)[4]提出的“魔术子弹(magic bullet)”理论和抗体药物的发展, 纵观治疗性抗体偶联药物(含抗体类药物)的发展历程[5], 可以概况地分为以下几个发展阶段(图 1): ① Kohler和Milstein发明单克隆抗体杂交瘤技术; ②第一个抗体药物莫罗莫那获准上市; ③嵌合抗体和人源化抗体上市; ④全球第一款抗体偶联药物Mylotarg上市, 2010年撤市; ⑤抗体偶联药物Adcetris上市; ⑥抗体偶联药物Kadcyla上市; ⑦抗体偶联药物Besponsa上市, Mylotarg重新上市; ⑧抗体偶联药物Lumoxiti上市; ⑨抗体偶联药物Polivy上市。
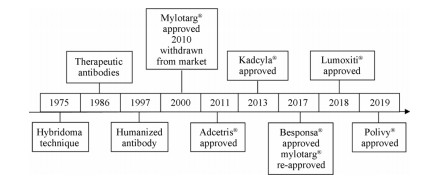
|
Figure 1 Antibody-drug conjugates (ADCs) timeline |
众所周知抗体药物虽然具有一定的疗效且高活性特异性靶向作用, 但单抗药物作为单一药物对癌症特别是恶性肿瘤的疗效也不尽如人意, 而有些高活性细胞毒类小分子化学药物由于靶向性差、治疗窗口窄且毒副作用大在临床失败而无法成药, 为了解决这些问题, 科学家将高活性细胞毒类小分子药物与抗体药物通过化学偶联技术开发出新一代靶向药物即抗体偶联药物。根据药物分子设计理论, 抗体偶联药物协同发挥了抗体的“特异性”靶向作用和高活性细胞毒类药物“高效”癌细胞杀伤作用, 各取所长。该类药物就像一枚精准制导的“生物导弹”[6], 具备“定点定位”杀伤癌细胞的能力。理论上, 抗体偶联药物一方面可以增加抗体的杀伤癌细胞作用, 另一方面也提升了高活性细胞毒类药物特异选择性杀伤癌细胞的靶向作用, 提高药物的治疗窗口, 极大降低高活性细胞毒类药物的非靶向毒副作用, 提高药物的疗效和治疗窗口。抗体偶联药物主要作用机制[7]如下:
① 抗体偶联药物通过其具有“制导”作用的抗体部分特异性结合癌细胞抗原表位, 经过抗原介导的内吞作用使其进入癌细胞内部, 在细胞内部通过特殊的环境(如溶酶体或低pH值环境)释放出“弹头”高活性细胞毒性药物, 最终实现特异性杀死癌细胞[8], 其作用机制详见图 2。抗体偶联药物也被认为是更高级的药物递送系统, 其抗癌作用机制和抗体药物完全不同, 在业内被誉为具有新作用机制的抗体升级版药物。
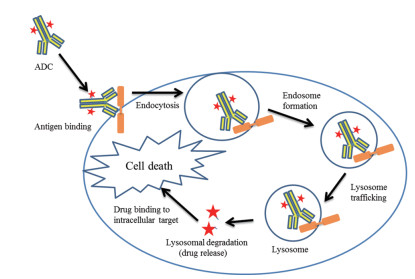
|
Figure 2 ADCs mechanism of action. ①ADC binds to receptors on the tumor cell surface; ②Internalized into the tumor cell via endocytosis; ③Once endocytosis is complete, antibody and receptor are degraded and a cytotoxic metabolite is released; ④Inside the tumor cell, cytotoxic binds to microtubules and inhibits their polymerization, and then induces the cancer cell death |
② 抗体偶联药物提高了抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity, ADCC), 该类药物的抗体Fab段结合病毒感染的细胞或肿瘤细胞的抗原表位, 其抗体的Fc段与杀伤细胞(NK细胞、巨噬细胞等)表面的FcR结合, 从而介导杀伤细胞(NK细胞、巨噬细胞等)直接杀伤癌细胞[9]。
③ 抗体偶联药物的抗体部分特异性结合癌细胞表位抗原靶点, 抑制抗原受体下游信号传导, 如罗氏的抗体偶联药物Kadcyla的抗体部分可与癌细胞HER2受体结合, 抑制HER2与HER1、HER3或HER4形成异源二聚体, 抑制细胞生长信号传导通路。同时HER2可以活化多种下游信号传导通路[10], 包括PI3K、MAPK等, Kadcyla的抗体阻碍了这些信号通路的正常传导, 将癌细胞阻滞于调定点, 诱导癌细胞凋亡。
④ “旁观者效应” (bystander):抗体偶联药物在癌细胞内释放的药物(或链接子-药物组合物)是可渗透或跨膜, 这些释放的药物能够杀死相邻癌细胞, 这种现象称为“旁观者效应”[11]。实体肿瘤细胞抗原的表达通常是异质性, 因此, 抗体偶联药物可能无法直接有效地杀伤邻近的抗原阴性癌细胞, 当抗体偶联药物在癌细胞外或靶细胞内释放细胞毒素后, 可释放出的小分子药物不仅可以杀死抗原阳性癌细胞, 还可以通过旁观者效应杀死附近的其他癌细胞。同时该类药物旁观者效应还破坏了肿瘤生长的环境, 如肿瘤基质细胞和肿瘤血管, 从而进一步增强杀伤癌细胞作用。
3 抗体偶联药物研究进展国际上Seattle Genetics、ImmunoGen和Immunomedic是抗体偶联药物研究领域的先驱和专业公司[12]。大型制药公司中, 罗氏(基因泰克)借助ImmunoGen构建了最大的抗体偶联药物研发管线和技术平台, 辉瑞、雅培从Seattle Genetics公司, 礼来、诺华从ImmunoGen公司, 默克从Ambrx公司分别引进抗体偶联药物技术平台或产品。
国内目前还没有抗体偶联药物产品上市, 罗氏的抗体偶联药物T-DM1 (ado-trastuzumab emtansine)在2019年初已经提交上市申请, 同时国内已有多家制药企业布局该类药物, 截止2019年7月, 我国至少已有18家企业申请了不少于16种抗体偶联药物产品的临床研究, 近些年来国内抗体偶联药物研发创新及商业化发展迅速, 相信不久的将来迎来该类药物产业的春天。
全球范围内已上市的抗体偶联药物多数是基于“第一代”和“第二代”抗体化学偶联技术, 随着抗体偶联药物研究不断深入和各学科技术不断发展, 下一代抗体偶联药物开发和生产主要发展方向如下。
3.1 抗体化学偶联技术发展已上市的抗体偶联药物基本都是采用了第一、二代化学偶联技术(即非定点偶联技术), 而目前处于临床研究阶段的抗体偶联药物多数都采用了第三代定点化学偶联技术[13]。抗体偶联药物未来研究的重点之一抗体定位偶联技术或酶催化定点偶联技术, 更精确的偶联技术可控制高活性药物分子在抗体上偶联的位置和数量, 抗体偶联药物的异质性会直接影响其在体内的分布和代谢, 因此抗体偶联药物具有更高的均质性将会提高药物纯度、质控等。另外如抗体部分尺寸更小及结合力更高, 药物分子能更好深入渗透至实体肿瘤, 如新一类DARPin (designed ankyrin repeat proteins)-毒素偶联药物, DARPins是新一代的靶标-结合蛋白, 其尺寸更小、结合力更高, 因此DARPins是理想的靶向药物, 可用于向肿瘤递送毒性小分子药物, 实现高效定点杀死癌细胞。
3.2 不同作用机制荷载药物(即高活性细胞毒素小分子药物)已上市或目前在研的抗体偶联药物使用的高活性细胞毒类药物主要有3类:微管蛋白抑制剂(如美登素类等)、烷化剂、DNA小沟抑制剂(烯二炔类抗生素)[14], 这些高活性细胞毒化学药物与传统的化疗药物相比, 对癌细胞具备更强的杀伤力, 通常平均4~6个分子的剂量就可实现对靶向癌细胞杀伤。针对癌细胞不同作用机制荷载药物的开发, 一方面有助于提高新一代抗体偶联药物有效性和安全性, 另一方面有助于规避专利, 同时也将提高药物的创新度和竞争力。
3.3 链接子技术发展抗体偶联药物的合成是通过链接子连接抗体和高活性细胞毒类小分子药物, 连接抗体和药物分子的链接子根据其解离特性主要分为“可切除类”和“不可切除类”[15]。这两类链接子在血浆中稳定性和半衰期也截然不同, “可切除类”链接子可在不同pH或胞内酶的作用下降解, 实现小分子化学药物与抗体分离, Adcetris使用的就是此类“可切除类”链接子。然而“不可切除类”链接子在整个药物血液运输过程中, 始终保证抗体与化学药物偶联完整性, 在血浆中稳定性较好, 半衰期较长, Kadcyla使用的便是此类“不可切除”链接子。目前已上市药物使用的链接子多数是非水溶性链接子, 因此具有水溶性且稳定性较好将是新一代链接子技术重要研发方向之一, 如链接有聚乙二醇(PEG)的链接子, 新一代链接子技术也将为抗体偶联药物研究开发提供新的选择和设计方案。
3.4 抗体偶联药物商业化生产抗体偶联药物需要使用高活性细胞毒类小分子药物作为荷载药物, 这类高活性细胞毒小分子药物的毒性非常大, 举例来说, 一个足球场内放一勺该类小分子药物粉末就足以使人致死。所以该类细胞毒小分子药物在生产、使用过程中防护级别非常高, 国际上Lonza和SafeBridge较为详细地研究过高活性细胞毒小分子药物职业接触限值(occupational exposure limits, OEL), 另外Lonza和SafeBridge同时都把抗体偶联药物也列为需要高级别防护的药品种类, 其在职业接触限值分类中, SafeBridge将抗体偶联药物归为第5类(OEL5)[16], 相当于最高防护级别。在抗体偶联药物生产过程中所有涉及高活性细胞毒类药物的称量、反应和质控等操作均需要采用隔离器等设备防护, 避免该类小分子药物产生气溶胶扩散出来, 同时也避免污染药品, 另外也要做好工作人员的个人防护和培训。个人防护包括呼吸系统、手套、鞋套和一次性防护服等, 如直接接触这类药物的工作人员需要穿着一次性无菌防护服(如杜邦的Tyvek®系列防护服)[17], 同时也要做好有毒废液的灭活处理工作。目前国内还没有抗体偶联药物商业化生产基地, 但是多家中大型制药企业已有布局或正在建设中, 估计不久的将来就会投入商业化生产。
一次性材料和耗材在抗体偶联药物生产中的使用将会极大压缩生产周期, 且可多产品灵活使用, 所以一次性材料和耗材在该类药物生产中的应用将越来越广泛。因为抗体偶联药物生产过程中通常需要用到一定比例的有机溶剂, 所以药物生产用材料(如一次性反应袋、超滤膜包、管路等)需要能够耐受有机溶剂且材料溶出物和析出物都需要符合法规要求, 但长期来看其生产成本较高, 需要综合考虑评估生产成本、效率和收益的平衡。
4 已上市的抗体偶联药物抗体偶联药物通过靶向特定抗原, 有效地渗透到肿瘤组织, 并被肿瘤细胞吞噬进入后, 通过溶酶体或特殊的胞内环境, 释放出活性细胞毒效应小分子药物, 特异性定点杀伤肿瘤细胞, 该类药物协同发挥了抗体药物选择性强以及化疗药物活性高的双重优点, 同时也改善了抗体疗效偏低和小分子化药的不良反应偏大等缺陷, 随着抗体化学偶联技术和链接子技术研究逐步成熟、加上不同作用机制的高活性细胞毒素不断开发出来, 抗体偶联药物将成为全球肿瘤药物研究的重点方向和热点研究之一[18]。
4.1 全球第一个抗体偶联药物Mylotarg 17年的跌宕起伏上市之路2000年, 已经15年没有上市新药的急性粒细胞白血病(acute myeloid leukemia, AML)治疗领域终于迎来了Mylotarg[19], 当时由于有大量急性粒细胞白血病患者的需求没有被满足, 美国FDA根据Mylotarg的3个Ⅱ期临床试验结果加速批准了全球首个商业化的抗体偶联药物Mylotarg上市用于治疗急性粒细胞白血病, 但不幸的是药物上市后和后期的大型Ⅲ期临床试验中, 该药物被证实可能增加患者的死亡率而存在较大的药物安全隐患[20], 辉瑞公司于2010年主动提起Mylotarg撤市申请。
2013年, 欧洲的研究人员分析了AML患者接受不同方案Mylotarg治疗的临床试验结果。研究发现, 对于部分患者, 尤其是那些中低风险的AML患者, Mylotarg是有益的, 其毒性是可耐受的[21]。
2016年, Meshinchi教授团队[22]在已完成的工作基础上, 对已有的临床研究进行了进一步深入分析, 发现Mylotarg只有在CD33蛋白高表达的AML患者中才有效, 2017年, 研究者们[23]在基因水平上进行了分析, 揭示了患者基因的差异导致了接受Mylotarg治疗效果的不同, 研究发现, 约51% AML患者基因型为CC, 能够产生完整的CD33靶点蛋白, 可以与Mylotarg高效结合。而49% AML患者基因型为CT或TT, 产生的CD33蛋白是不完整的, 缺少与Mylotarg结合的抗原靶点。所以, 这两类AML患者在接受化疗、化疗联合Mylotarg治疗时, 临床表现出极大的不同, 表达完整CD33蛋白的患者, 与接受化疗相比, 接受Mylotarg治疗联合化疗, 5年内的复发率明显降低(49% vs 26%, P < 0.001), 5年无病生存率明显升高(46% vs 65%, P=0.004);而表达不完整CD33蛋白的患者, 两种疗法的复发率及无病生存率没有差别, 基于最新临床研究结果, 辉瑞公司重新递交了药物上市申请。
2017年7月, 美国FDA肿瘤药物顾问委员会认为Mylotarg联合化疗用于治疗新诊断的CD33阳性急性髓性白血病具有有利的风险收益比, 根据最新临床研究数据, 2017年9月Mylotarg重新被FDA批准上市, 同时FDA也批准该药物用于治疗两岁及以上的CD33阳性AML患者, Mylotarg是首个包括儿童AML适应症的药物, 也是目前唯一一个靶向CD33的AML靶向治疗药物[24, 25]。
全球第一个抗体偶联药物Mylotarg经历Ⅲ期临床失败撤市后重新获批上市, 17年跌宕起伏的上市经历在制药业实属罕见, 科学的临床研究方案证明失败的不是药物本身, 而是以前Ⅲ期临床试验没有选对正确的临床研究患者, 这就是靶向药物的魅力和特点所在, 该药物上市经历也将为靶向药物的临床患者筛选提供了重要的参考和警示。
4.2 已上市的抗体偶联药物目前全球已上市6个抗体偶联药物, 中国尚无抗体偶联药物上市。到2019年8月底, 全球范围内已上市的抗体偶联药物中市场表现最好的为罗氏的靶向HER2抗体偶联药物Kadcyla, 它的成功上市更加推动了全球范围内抗体偶联药物的研发热情和资本投入。据不完全统计, 目前全球超过80个抗体偶联药物处于临床试验的不同阶段或临床前研究。截止到2019年8月, 全球范围内已上市的抗体偶联药物[5]如表 1。
| Table 1 The global ADCs approved for use |
Adcetris是由靶向CD30单克隆抗体和微管蛋白抑制剂MMAE (monomethyl auristatin E)通过一种蛋白酶敏感链接子偶联而成的抗体偶联药物[26], 该药物偶联技术采用西雅图遗传学公司的专利偶联技术。CD30抗原蛋白是霍奇金淋巴瘤(Hodgkin lymphoma, HL)癌细胞过度表达的靶点, Adcetris通过其抗体部分特异性靶向CD30靶点, 将微管蛋白抑制剂MMAE高效输送到癌细胞内部, 在癌细胞内微管蛋白抑制剂MMAE可通过抑制微管蛋白的聚合阻碍癌细胞分裂增生[27], 杀死癌细胞。
日本武田制药与西雅图遗传公司联合开发的Adcetris[28]于2011年获批上市。截至目前, Adcetris已获全球70多个国家批准多达6种适应症, 不同国家适应症有所不同。在欧洲已经获批的4个适应症分别为: ①接受造血干细胞移植或接受至少2种疗法失败且不适合造血干细胞移植或多药化疗的复发性或难治性CD30阳性HL成人患者; ②复发性或难治性系统性间变性大细胞淋巴瘤(anaplastic large cell lymphoma, sALCL)成人患者; ③接受自体造血干细胞移植后具有升高的复发或进展风险的CD30阳性HL成人患者; ④接受至少1种系统疗法的CD30阳性皮肤T细胞淋巴瘤(cutaneous T-cell lymphoma, CTCL)[29]。
4.2.2 Kadcyla (ado-trastuzumab emtansine)HER2阳性乳腺癌具有高侵袭性的特点, 大约15%~20%乳腺癌患者是HER2阳性过度表达[30]。Kadcyla是一种靶向HER2抗体偶联药物, 也是唯一获批作为单一药物用于治疗既往已接受赫赛汀和紫杉烷化疗(单独或联合治疗)的HER2阳性转移性乳腺癌患者的抗体偶联药物。该抗体偶联药物由曲妥珠单抗(trastuzumab, 赫赛汀活性药物成分)与高活性细胞毒素小分子药物美登素衍生物DM1通过一种稳定的异双功能链接子4-(N-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(SMCC: 4-(N-maleimidomethyl)cyclohexanecarboxylic acid N-hydroxysuccinimide ester)化学偶联而成, Kadcyla通过抗体特异性靶向可将高活性细胞毒类药物DM1定点递送至HER2阳性乳腺癌细胞内部, 极大地降低了高活性小分子药物的毒副作用, 也提高了小分子药物的治疗窗和靶向作用[31]。
2013年, 罗氏的Kadcyla获准用于治疗HER2阳性晚期乳腺癌[32]。2018年11月Kadcyla作为术后辅助疗法, 在治疗HER2阳性早期乳腺癌的Ⅲ期临床试验KATHERINE中, 达到了主要终点。HER2阳性的早期乳腺癌患者若在接受术前新辅助治疗后未实现病理性完全缓解, 可能会导致更差的预后。术前新辅助治疗, 旨在缩小肿瘤, 并帮助改善手术治疗结局。而作为提供给患者最佳治愈机会的早期乳腺癌完整治疗方案的一部分, 术后辅助治疗旨在消除体内残余的癌细胞, 以降低癌症复发风险和几率。
Ⅲ期临床试验KATHERINE旨在评估与赫赛汀相比, Kadcyla作为一种术后辅助疗法, 治疗HER2阳性早期乳腺癌的有效性和安全性。这些患者此前接受过包括赫赛汀和紫杉烷化疗等术前新辅助治疗, 但在乳腺/腋窝淋巴结中仍发现病理性残留病灶。试验的主要终点是无侵袭性疾病生存期(non-invasive disease-free survival, iDFS), 即从接受辅助治疗开始到浸润性乳腺癌复发或因任何原因死亡的时间。次要终点包括无病生存期(disease-free survival, DFS)和总生存期(overall survival, OS)。试验结果显示, 与赫赛汀相比, Kadcyla显著降低iDFS 50% (风险比hazard ratio=0.50, P < 0.000 1)。3年后, Kadcyla组88.3%患者没有出现复发, 而赫赛汀组, 这一比例为77.0%, 改善了11.3%。此外, 无论激素受体状态、淋巴结状况以及术前新辅助治疗中接受的HER2靶向治疗方案, 都不影响Kadcyla对iDFS的改善。该试验结果显示, Kadcyla能显著降低术前新辅助治疗后仍有残留病灶的HER2阳性早期乳腺癌的复发风险, 极大延长患者无进展生存期。
4.2.3 Besponsa (inotuzumab ozogamicin)Besponsa是一种靶向CD22的抗体-卡奇霉素(calicheamicin)偶联药物, 卡奇霉素可高效抑制癌细胞异常增殖[33]。2017年8月美国FDA正式批准白血病新药Besponsa用于成人复发性及难治性前体B细胞淋巴细胞白血病(acute lymphoblastic leukemia, ALL)。B细胞ALL表现为B淋巴细胞在骨髓中异常增殖, 影响造血功能, 疾病进展极快, 对于那些对初治方案无反应或者复发的B细胞ALL成人患者而言, 生存时间往往很短。此前, 临床上鲜有有效的治疗药物, 而Besponsa的获批, 将为ALL临床患者提供一种全新的治疗模式和药物[34]。
Besponsa的一项疗效及安全性临床试验共招募326名经治疗的复发性或难治性B细胞ALL患者。这些患者被随机分成两组, 分别接受Besponsa或者化疗, 考察治疗后的患者完全缓解率。结果显示, Besponsa治疗组完全缓解率达到35.8%, 中位生存期为8.0个月。化疗组完全缓解率为17.4%, 中位生存期为4.9个月。Besponsa的不良反应主要表现为血小板降低、白细胞减少、中性粒细胞减少、感染、贫血、疲乏、出血、发热、呕吐、头痛、发热性嗜中性粒细胞减少症、肝损伤(转氨酶或γ-谷氨酰转移酶升高)、腹痛及高胆红素血症等[35]。
4.2.4 Lumoxiti (moxetumomab pasudotox-tdfk)毛细管白血病(hairy cell leukemia, HCL)是一种罕见的、无法治愈且进展缓慢的淋巴增殖性慢性白血病, 以贫血、出血、脾脏肿大及外周血及骨髓出现大量边缘不整齐呈伪足状或纤毛样突出的白细胞为特征。该病可导致严重的、危及生命的后果, 包括严重感染、出血和贫血。
Lumoxiti是一种抗CD22重组免疫毒素偶联药物[36], 该药是一种治疗HCL的创新药物。免疫毒素是一类高活性抗癌药物, 利用抗体的特异性靶向将免疫毒素药物递送到癌细胞内部, 特异性杀伤癌细胞。CD22是一种在成熟B淋巴细胞中表达的Ⅰ型跨膜蛋白, 在B细胞信号传导中起重要作用。与正常B细胞相比, HCL细胞上存在过度表达的CD22蛋白, 这使其成为治疗HCL的一个非常理想的治疗靶点。该药物作用机制大致为: Lumoxiti与癌细胞CD22结合后, 被癌细胞内化、裂解并释放已修饰的蛋白毒素, 抑制癌细胞中蛋白质的翻译, 导致其凋亡。Lumoxiti的一项Ⅲ期临床研究在80例既往接受过至少两种方案的复发性或难治性HCL成人患者中开展, 评估了Lumoxiti单药治疗的疗效和安全性。该研究在全球14个国家34个治疗中心开展。临床研究证实, Lumoxiti单药治疗的总缓解率为75%, 完全缓解率为41%, 持久的完全缓解率为30%。
2018年9月, 美国FDA批准阿斯利康的Lumoxiti用于既往已接受过至少两种系统疗法(包括嘌呤核苷类似物)治疗失败的复发性或难治性HCL成人患者的治疗。Lumoxiti的批准, 使其成为过去20多年来获批治疗HCL的首款新药, 也标志着HCL临床治疗一个重大里程碑。
4.2.5 Polivy (polatuzumab vedotin-piiq)Polivy是一个靶向CD79b的抗体-MMAE偶联药物, 抗体部分可特异靶向B细胞表面的CD79b靶点, 偶联的小分子药物为蛋白微管抑制剂MMAE。其抗癌作用机制为: Polivy的抗体特异性结合B细胞后, 通过抗原介导内吞使其进入癌细胞后释放出细胞毒素MMAE, 对癌细胞高效特异性杀伤[37]。
Polivy的一项Ⅰb/Ⅱ期临床试验评估了80名患有复发性或难治性弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)的患者, 他们被随机分为两组, 一组接受标准的苯达莫司汀与rituximab治疗, 另一组则使用Polivy。研究结果表明, 标准治疗组患者的完全缓解率为18%, 而在Polivy治疗组, 完全缓解率达到40%, 此外在Polivy治疗组中取得部分或完全缓解的患者有64%的缓解持续时间超过了半年, 超过1年的比例也有近一半(48%), 这也是唯一比标准疗法彰显更高缓解率的随机关键临床试验[38]。
基于Polivy优异的临床研究结果, 2019年6月基因泰克的抗体偶联药物Polivy被加速批准上市, 与苯达莫司汀、rituximab联合使用, 治疗难治的弥漫性大B细胞淋巴瘤成人患者。针对DLBCL这种疾病, 这也是首款免疫化疗药物即抗体偶联药物。
5 挑战与展望抗体偶联药物研发难度大, 产业化制备工艺复杂, 研究开发涉及有机化学、生物医药、基因工程、药代等多种学科, 近些年来抗体偶联药物成功产业化上市已成为生物医药和有机化学跨学科成功融合的典范代表之一, 同时新一代抗体化学偶联技术发展离不开有机化学技术和抗体工程技术的发展。抗体偶联药物在理论及实际治疗效果上具有不可替代的作用, 同时也符合"精准医疗"的理念, 国内外抗体偶联药物的研发已经进入高潮期, 许多进入临床研究的该类药物都有望在近些年完成临床研究并申请上市。
抗体偶联药物作为一类新型药物, 通过已建立的药物技术平台可以采用针对不同抗原靶点的抗体、不同的链接子[39]和不同作用机制的小分子毒素药物进行组合, 开发出针对不同靶点和适应症的创新药物[40]。虽然已有多款抗体偶联药物上市或在Ⅲ期临床研究中, 但目前抗体偶联药物也存在一些问题或缺点需要不断克服和突破。①新靶点选择:抗体偶联药物的成功开发依赖于选择合适的抗原靶点, 使该类药物的抗体部分可以与之特异性高活性结合, 新靶点抗原应在肿瘤中的表达水平较高, 在正常组织中的表达很少或不表达, 或仅在特定组织类型中有表达, 以提高药物的安全性和有效性。②目前抗体偶联药物对实体瘤靶向输送作用相对较弱, 可能与肿瘤细胞表面抗原表达多样性、肿瘤血流供应不正常、肿瘤部位渗透压高有关。新型工程小型化抗体对肿瘤的穿透性较高, 利用小型化抗体构建的抗体偶联药物也许能够解决肿瘤靶向穿透不足的问题。另一方面用于抗体偶联药物开发的理想抗体应该是人源化或全人源单抗体, 使其能够高效结合肿瘤细胞而与正常细胞没有交叉反应, 以降低药物免疫原性。③目前已上市或处于临床研究阶段的抗体偶联药物大多数使用的毒素为微管蛋白抑制剂美登素类(maytansinoids)和甲基澳瑞他汀类(auristatins)。该类小分子毒素一方面为非水溶性药物, 另一方面药物毒性较大, 有可能造成神经麻痹等不良反应, 开发新型亲水性的小分子药物, 可以提高药物的吸收利用率, 同时也可以规避专利等问题。④链接子及偶联技术需要进一步优化改进, 非水性链接子有可能改变抗体电荷分布而导致其聚集产生聚体, 稳定亲水性链接子和定点偶联技术可以提高药物血浆稳定性和肿瘤部位细胞毒素的可控释放, 也可以提高药物的纯度和组分均一性, 最大程度减少药物非靶向和全身性毒性, 进一步提高药物的安全性和药物疗效。
去年, 国内监管机构已经发布抗体偶联药物申报及监管征求意见稿, 但国际上不同监管机构在其研发及政策上均有诸多不同之处, 随着该类药物不断获批上市, 药监单位也将会出台较为完善的法规和指导性文件。由于抗体偶联药物研发和生产都存在较大的挑战和技术门槛, 国内该类药物研发和产业化可谓挑战与机遇并存。随着近些年来抗体偶联药物新型技术的不断发展和突破, 也促使了该类药物不断从前期的药物发现进入临床研究或成功上市, 可以期待的是抗体偶联药物也正在改变癌症治疗领域, 将惠及更多患者。
| [1] | Janice MR, Viia EVR. Development trends for monoclonal antibody cancer therapeutics[J]. Nat Rev Drug Dis, 2007, 6: 349–356. DOI:10.1038/nrd2241 |
| [2] | Kohler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity[J]. Nature, 1975, 256: 495–497. DOI:10.1038/256495a0 |
| [3] | Dimitrov DS, Marks JD. Therapeutic antibodies: current state and future trends is a paradigm change coming soon[J]. Methods Mol Biol, 2009, 525: 1–27. |
| [4] | Strebhardt K, Ullrich A. Paul Ehrlich's magic bullet concept: 100 years of progress[J]. Nat Rev Cancer, 2008, 8: 473–480. DOI:10.1038/nrc2394 |
| [5] | Wolska-Washer A, Robak T. Safety and tolerability of antibody-drug conjugates in cancer[J]. Drug Saf, 2019, 42: 295–314. DOI:10.1007/s40264-018-0775-7 |
| [6] | Senter PD. Potent antibody drug conjugates for cancer therapy[J]. Curr Opin Chem Biol, 2009, 13: 235–244. DOI:10.1016/j.cbpa.2009.03.023 |
| [7] | Trail PA, Bianchi AB. Monoclonal antibody drug conjugates in the treatment of cancer[J]. Curr Opin Immunol, 1999, 11: 584–588. DOI:10.1016/S0952-7915(99)00012-6 |
| [8] | Xu S. Internalization, trafficking, intracellular processing and actions of antibody-drug conjugates[J]. Pharm Res, 2015, 32: 3577–3583. DOI:10.1007/s11095-015-1729-8 |
| [9] | Junttila TT, Li G, Parsons K, et al. Trastuzumab-dm1 (t-dm1) retains all the mechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer[J]. Breast Cancer Res Treat, 2011, 128: 347–356. DOI:10.1007/s10549-010-1090-x |
| [10] | Junttila TT, Akita RW, Parsons K, et al. Ligand-independent HER2/HER3/PI3K complex is disrupted by trastuzumab and is effectively inhibited by the PI3K inhibitor GDC-0941[J]. Cancer Cell, 2009, 15: 429–440. DOI:10.1016/j.ccr.2009.03.020 |
| [11] | Staudacher AH, Brown MP. Antibody drug conjugates and bystander killing: is antigen-dependent internalization required[J]. Br J Cancer, 2017, 117: 1736–1742. DOI:10.1038/bjc.2017.367 |
| [12] | Thayer AM. Building antibody-drug conjugates[J]. Chem Eng News, 2014, 92: 13–21. |
| [13] | Junutula JR, Raab H, Clark S, et al. Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index[J]. Nat Biotechnol, 2008, 26: 925–932. DOI:10.1038/nbt.1480 |
| [14] | Moldenhauer G, Salnikov AV, Luttgau S, et al. Therapeutic potential of amanitin-conjugated anti-epithelial cell adhesion molecule monoclonal antibody against pancreatic carcinoma[J]. J Natl Cancer Inst, 2012, 104: 622–634. DOI:10.1093/jnci/djs140 |
| [15] | Kovtun YV, Audette CA, Mayo MF, et al. Antibody-maytansinoid conjugates designed to bypass multidrug resistance[J]. Cancer Res, 2010, 70: 2528–2537. DOI:10.1158/0008-5472.CAN-09-3546 |
| [16] | Farris JP, Ader AW, Ku RH. History, implementation and evolution of the pharmaceutical hazard categorization and control system[J]. Chem Today, 2006, 24: 5–10. |
| [17] | Ader AW, Kimmel TA, Sussman RG. Applying health-based risk assessments to worker and product safety for potent pharmaceuticals in contract manufacturing operations[J]. Pharm Outsourcing, 2009, 10: 48–53. |
| [18] | Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of therapeutic antibodies[J]. Nat Rev Drug Discov, 2017, 16: 315–337. DOI:10.1038/nrd.2016.268 |
| [19] | Bross PF, Beitz J, Chen G, et al. Approval summary: gemtuzumab ozogamicin in relapsed acute myeloid leukemia[J]. Clin Cancer Res, 2001, 7: 1490–1496. |
| [20] | Petersdorf SH, Kopecky KJ, Slovak M, et al. A phase 3 study of gemtuzumab ozogamicin during induction and postconsolidation therapy in younger patients with acute myeloid leukemia[J]. Blood, 2013, 121: 4854–4860. DOI:10.1182/blood-2013-01-466706 |
| [21] | Rowe JM, Lowenberg B. Gemtuzumab ozogamicin in acute myeloid leukemia: a remarkable saga about an active drug[J]. Blood, 2013, 121: 4838–4841. DOI:10.1182/blood-2013-03-490482 |
| [22] | Pollard JA, Loken M, Gerbing RB, et al. CD33 expression and its association with gemtuzumab ozogamicin response: results from the randomized phase Ⅲ children's oncology group trial AAML0531[J]. J Clin Oncol, 2016, 34: 747–755. DOI:10.1200/JCO.2015.62.6846 |
| [23] | Breccia M, Lo-Coco F. Gemtuzumab ozogamicin for the treatment of acute promyelocytic leukemia: mechanisms of action and resistance, safety and efficacy[J]. Expert Opin Biol Ther, 2011, 11: 225–234. DOI:10.1517/14712598.2011.543895 |
| [24] | Sievers EL, Larson RA, Stadtmauer EA, et al. Efficacy and safety of Mylotarg (gemtuzumab ozogamicin) with CD33-postive acute myeloid leukemia in first relapse[J]. J Clin Oncol, 2001, 19: 3244–3254. DOI:10.1200/JCO.2001.19.13.3244 |
| [25] | Cowan AJ, Laszlo GS, Estey EH, et al. Antibody-based therapy of acute myeloid leukemia with gemtuzumab ozogamicin[J]. Front Biosci, 2013, 18: 1311–1334. DOI:10.2741/4181 |
| [26] | Younes A, Bartlett NL, Leonard JP, et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas[J]. N Engl J Med, 2010, 363: 1812–1821. DOI:10.1056/NEJMoa1002965 |
| [27] | Katz J, Janik JE, Younes A. Brentuximab vedotin (SGN-35)[J]. Clin Cancer Res, 2011, 17: 6428–6436. DOI:10.1158/1078-0432.CCR-11-0488 |
| [28] | Younes A, Gopal AK, Smith SE, et al. Results of a pivotal phase Ⅱ study of brentuximab vedotin for patients with relapsed or refractory Hodgkin's lymphoma[J]. J Clin Oncol, 2012, 30: 2183–2189. DOI:10.1200/JCO.2011.38.0410 |
| [29] | Pro B, Advani R, Brice P, et al. Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase Ⅱ study[J]. J Clin Oncol, 2012, 30: 2190–2196. DOI:10.1200/JCO.2011.38.0402 |
| [30] | Abraham J. Trastuzumab emtansine in advanced HER2-positive breast cancer[J]. Community Oncol, 2013, 10: 71–73. |
| [31] | Krop I, Beeram M, Modi S, et al. A phase Ⅰ study of trastuzumab-DM1, a HER2 antibody-drug conjugate, given every 3 weeks to patients with HER2+ metastatic breast cancer[J]. J Clin Oncol, 2010, 28: 2698–2704. DOI:10.1200/JCO.2009.26.2071 |
| [32] | Lewis-Phillips GD, Li G, Dugger DL. Targeting HER2-positive breast cancer with trastuzumab-DM1, an antibody-cytotoxic drug conjugate[J]. Cancer Res, 2008, 6: 9280–9290. |
| [33] | Lambert JM, Morris CQ. Antibody-drug conjugates (ADCs) for personalized treatment of solid tumors: a review[J]. Adv Ther, 2017, 34: 1015–1035. DOI:10.1007/s12325-017-0519-6 |
| [34] | Dijoseph JF, Dougher MM, Evans DY, et al. Preclinical anti-tumor activity of antibody-targeted chemotherapy with CMC-544 (inotuzumab ozogamicin), a CD22-specific immunoconjugate of calicheamicin, compared with non-targeted combination chemotherapy with CVP or CHOP[J]. Cancer Chemother Pharmacol, 2011, 4: 741–749. |
| [35] | Sievers EL, Senter PD. Antibody-drug conjugates in cancer therapy[J]. Annu Rev Med, 2013, 64: 15–29. DOI:10.1146/annurev-med-050311-201823 |
| [36] | Kreitman RJ, Dearden C, Zinzani PL, et al. Moxetumomab pasudotox in relapsed/refractory hairy cell leukemia[J]. Leukemia, 2018, 32: 1768–1777. DOI:10.1038/s41375-018-0210-1 |
| [37] | Dornan D, Bennett F, Chen Y, et al. Therapeutic potential of an anti-CD79b antibody drug conjugate, anti-CD79b-vc-MMAE, for the treatment of non-Hodgkin lymphoma[J]. Blood, 2009, 114: 2721–2729. |
| [38] | Doronina SO, Toki BE, Torgov MY, et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy[J]. Nat Biotechnol, 2003, 21: 778–784. DOI:10.1038/nbt832 |
| [39] | Bargh JD, Isidro-Llobet A, Parker JS. Cleavable linkers in antibody-drug conjugates[J]. Chem Soc Rev, 2019, 48: 4361–4374. DOI:10.1039/C8CS00676H |
| [40] | Teicher BA, Chari RVJ. Antibody conjugate therapeutics: challenges and potential[J]. Clin Cancer Res, 2011, 17: 6389–6397. DOI:10.1158/1078-0432.CCR-11-1417 |
 2019, Vol. 54
2019, Vol. 54


