PD-1是从凋亡小鼠杂交瘤中分离获得的一种负性共刺激分子, 因其能促进细胞程序性死亡而被命名为“程序性细胞死亡蛋白-1 (programmed cell death 1, PD-1)”。PD-1分子胞外区具有1个IgV样结构域和4个能被糖基化的位点, 在PD-1发挥免疫抑制作用中起着关键作用。目前研究发现, PD-1存在2种配体, 即PD-L1 (programmed cell death 1 ligand 1, 又称B7-H1)和PD-L2 (programmed cell death 1 ligand 2, 又称B7-DC)[1]。PD-L1与PD-L2为B7族同系物, 结构上均包括IgV和IgC样胞外区、跨膜区和短胞质尾区3个部分。PD-L1和PD-L2可被诱导表达于T细胞、B细胞、树突细胞、巨噬细胞、间充质干细胞、骨髓来源的肥大细胞和非造血细胞表面。
当PD-1与其配体PD-L1或PD-L2特异性结合后, PD-1胞内域的免疫受体酪氨酸抑制基序(immune receptor tyrosine-based inhibitory motif, ITIM)和免疫受体酪氨酸转换基序(immunoreceptor tyrosine-based switch motif, ITSF)发生磷酸化, 吸引酪氨酸磷酸酶SHP-1和SHP-2, 引起T细胞抗原受体(TCR)信号通路的蛋白激酶去磷酸化, 抑制下游T细胞活化所需基因和细胞因子的转录及翻译, 最终通过阻断细胞周期, 从而抑制T细胞的增殖分化及细胞因子的产生。相较于PD-1/PD-L2信号轴, PD-1/PD-L1信号轴在调节T细胞免疫应答的过程中发挥着更为重要的作用[1]。
从生理学角度上看, PD-1/PD-L1信号轴的存在能够防止T细胞被过度激活, 保持机体对自身抗原的免疫耐受。在正常生理条件下, T细胞正常表达PD-1, 当T细胞长期暴露于抗原刺激下时, T细胞PD-1表达上调, 其他细胞在活化T细胞释放的γ干扰素(IFN-γ)、白细胞介素(interleukin, IL)等细胞因子的诱导下过度表达PD-L1, 从而降低T细胞活化程度, 维持自身机体的免疫耐受。但是, 这一抑制T细胞活化的方式同时也使得肿瘤细胞实现免疫逃逸。对于肿瘤细胞而言, 其表达的PD-L1以及伴随的炎症反应或非炎症反应, 将借助PD-1-PD-L1通路实现免疫抑制。除此之外, 肿瘤细胞上高表达的PD-L1可直接导致Foxp3+调节性T (T-reg)细胞数量增加, 并可将未成熟的CD4+ T细胞诱导转化为T-reg细胞, 增强对T细胞的抑制, 从而逃脱人体免疫的监视, 实现免疫逃逸[2]。
1.2 基于阻断免疫检查点PD-1/PD-L1的抗体药物研究现状随着肿瘤免疫检测点蛋白PD-1/PD-L1研究的不断深入, 研究人员应用人源化抗体或半人源化抗体干预免疫检查点PD-1/PD-L1信号轴。与化疗、放疗、靶向治疗直接作用于肿瘤细胞不同, 靶向PD-1/PD-L1抗体药物通过阻断肿瘤微环境中PD-1/PD-L1的信号识别, 重新激发特异性T细胞功能, 恢复机体对肿瘤的免疫应答。目前国际上已有6个靶向PD-1/PD-L1抗体药物在全球被批准上市, 用于特定实体瘤治疗, 包括作用于PD-1受体的nivolumab、pembrolizumab和作用于PD-L1的durvalumab、atezolizumab、avelumab和cemiplimab。目前两个抗PD-1的抗癌药欧狄沃(Opdivo) nivolumab单抗注射液和可瑞达(Keytruda) pembrolizumab单抗注射液已在国内上市。此外, 国产抗PD-1单抗已有3款被CFDA批准上市, 尚有多个PD-1/PD-L1单抗正在进行临床试验或处于申报阶段。目前这些抗体药物在临床上多种恶性肿瘤治疗中都已经取得了明确的疗效(表 1), 并由此开启了肿瘤免疫治疗的新时代。
| 表 1 Anti-PD-1/PD-L1 antibody drugs approved by FDA and their approved indications. PD-1: Programmed cell death 1; PD-L1: Programmed cell death 1 ligand 1 |
虽然靶向PD-1/PD-L1抗体药物在治疗中对恶性肿瘤的治疗作用已经取得了明确效果, 但近几年的临床应用中逐步观察到靶向PD-1/PD-L1抗体药物在部分对该疗法无积极反应的患者中反而出现了疾病“超进展” (hyperprogressive disease, HPD)的情况。目前, HPD的定义尚未完全明确, 多数试验根据实体肿瘤的反应评估标准(response evaluation criteria in solid tumors, RECIST)将其定义为治疗失败时间(time to treatment failure, TTF)小于2个月, 肿瘤生长速率(tumor growth rate, TGR)增加不少于2倍, 肿瘤负荷相比于基线期增长超过50%。为了进一步分析这种用药后病情加速进展的情况, Champiat等[3]统计Gustave Roussy的Ⅰ期临床试验中接受抗PD-1/PD-L1治疗所有患者(n = 218)的医疗记录, 发现131名具有可评估性的不同肿瘤类型患者中, 有9%的患者在接受靶向PD-1/PD-L1抗体药物治疗后出现HPD, 这一研究初步呈现了HPD的发生率。而之后Fuentes-Antrás等[4]的统计显示, 4%~29%的癌症患者可能在免疫治疗后经历明显的进展, 可见HPD是抗PD-1/PD-L1治疗中较易发生的临床问题。除此之外, HPD对患者病情的严重负面影响更加令人担忧。Ferrara等[5]在一项接受抗PD-1/PD-L1治疗的406例晚期非小细胞肺癌(NSCLC)患者的研究中, 发现13.8% (n = 56)的人群中观察到HPD, 且与非HPD患者相比, 总生存期显著降低, 中位生存期从6.2个月降低至3.4个月。值得注意的是, HPD有时会呈现出相当迅猛和突发的特点。如一名患有肺腺癌的65岁男性患者, 在接受pembrolizumab药物治疗后两天突然出现HPD, 胸部原发肿瘤大小急速增加, 病情迅速进展, 并于给药第37天死亡[6]。这些回顾性研究和临床病例报道均表明, HPD在抗PD-1/PD-L1治疗过程中, 是一个不可忽视的问题, 其发生后的严重后果, 使得疾病“超进展”问题成为免疫治疗发展过程中不得不解决的问题。
2.2 产生疾病“超进展”的原因研究进展针对疾病“超进展”的成因, 已有部分研究试图揭示HPD与其他因素之间的相关性, 如年龄[3]、不同抗PD-1/PD-L1药物治疗[7]等, 但都不足以得出较为可靠的结论。此外, 近几年来还取得了一系列进展, 具体从3个角度分述如下(图 1)。
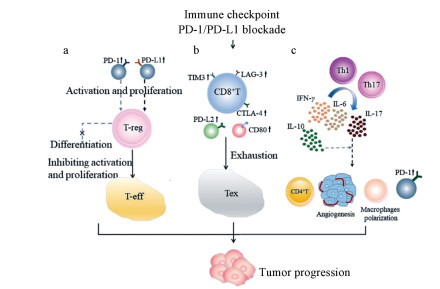
|
Figure 1 Scheme for the current knowledge of hyperprogressive disease (HPD) |
T-reg细胞是维持机体免疫耐受的重要因素之一。其能通过主动调节的方式积极地抑制效应T细胞的活化与增殖。这种T-reg细胞的调节机制被称为“反抑制现象(contrasuppression)”[8]。T-reg细胞的“反抑制现象”其实是机体稳态的一种体现。在肿瘤浸润的环境中, T-reg细胞能在不完全抑制对肿瘤的免疫检测之下, 将效应T细胞对自身造成的潜在损伤降到最低[9]。也就是说, T-reg细胞的存在, 能够让机体维持较高免疫力的同时, 防止因免疫过度而对自身组织产生伤害[10, 11]。因此, 这种T-reg细胞的反抑制调节机制最终能够让机体的肿瘤水平与免疫水平处于可控范围内。而事实上, 阻断PD-1/PD-L1信号的传导会导致T-reg细胞的增殖, 增殖之后的T-reg细胞抑制效应T细胞的活化与增殖从而导致HPD。那么, 阻断PD-1/PD-L1信号的传导之后, T-reg细胞增殖的原因是什么?研究发现, 一方面阻断PD-1/PD-L1信号的传导可能会导致PD-1水平的上调, 而PD-1是肿瘤浸润的T-reg细胞激活与增殖的重要因素[11-13]。PD-1浓度的提高会大幅度提高T-reg细胞的生成。此外, PD-1还有抑制T-reg细胞分化成其他细胞的作用[14]。因而, PD-1/PD-L1信号的传导被阻断后, PD-1浓度的提高会使T-reg细胞的浓度提高, 导致HPD; 另一方面, 阻断PD-1/PD-L1信号的传导还可能导致PD-L1水平的上调, 而PD-L1也表明具有调节诱导T-reg细胞生成的作用[2]。因此, PD-1/PD-L1信号传递的阻断会打破正常机体反抑制调节的平衡, 并导致T-reg细胞的显著增加和免疫抑制性肿瘤浸润, 最终导致肿瘤免疫逃逸和加速肿瘤生长。
2.2.2 替代性免疫检查点表达的增加T细胞上除了PD-1/PD-L1之外还有许多替代性免疫检查点, 如PD-1/PD-L2、T细胞免疫球蛋白黏蛋白3 (T cell immunoglobulin domain and mucin domain 3, TIM3)和淋巴细胞活化基因3 (lymphocyte activation gene 3, LAG3)等。当PD-1/PD-L1信号传递被阻断后, 替代性免疫检查点补偿性上调, 从而导致T细胞活化被抑制与衰竭增加, 出现HPD。这一原理可能与上述经由T-reg细胞“反抑制现象”导致HPD相似, 但由于并不直接涉及T-reg细胞, 所以两者并不完全相同。如在肺腺癌的小鼠模型和对两名NSCLC患者的检验中, 被阻断了PD-1/PD-L1信号传递的肿瘤浸润细胞毒性CD8+ T细胞过度表达了TIM3[15]。此外, TIM3的存在与PD-1被阻断的持续时间显著相关。这一发现更有力地证明了PD-1/PD-L1阻断会使替代性免疫检查点补偿性上调, 从而促进局部免疫抑制并导致肿瘤免疫逃避[15]。同样地, 在卵巢癌小鼠模型中, CD8+ T细胞上LAG3和细胞毒性T淋巴细胞相关蛋白4 (cytotoxic T-lymphocyte-associated protein 4, CTLA-4) (2种替代性免疫检查点)水平也会在阻断后上调[16]。但事实上, 不同的免疫检查点间, 具体的相互作用机制并不明确[17]。阻断PD-1还可上调CD80, 导致CD80/PD-L1介导的T细胞抑制。另外, 在表达PD-L1或PD-L2的细胞[如树突状细胞(dendritic cells, DC)]中也发现了涉及PD-L1和PD-L2相互作用的信号回路机制[18]。所以, 与之对应的, 阻断PD-L1可以上调PD-L2, 从而导致PD-1/PD-L2介导的T细胞抑制。总而言之, 可能解释过度进展性疾病现象的第二个假设是PD-1/PD-L1信号传递的阻断导致抗肿瘤细胞上替代性免疫检查点的补偿性上调, 从而抑制针对癌细胞的免疫反应, 导致肿瘤免疫逃避, 产生HPD。
2.2.3 异常炎症激活和促肿瘤生长免疫细胞亚群的调节肿瘤微环境可借助PD-1/PD-L1信号通路的抑制, 提高一些致癌性炎症传导介质水平, 如卵巢肿瘤中的活化T细胞的核因子(nuclear factor of activated T cells, NFATC1)和NF-κb p65等, 从而促进炎症反应的发生[19, 20]。具体来说, 这种对抗PD-1/PD-L1免疫治疗并产生炎症的机制, 依赖于PD-1/PD-L1阻断后辅助性T细胞1 (helper T cells 1, Th1)和辅助性T细胞17 (helper T cells 17, Th17)介导的外周炎症反应。这种炎症反应增加IFN-γ、IL-6和IL-17的分泌, 使PD-1表达上调[21]。另外, IL-10也因PD-1/PD-L1阻断补偿性释放, 而后IL-10水平增加也会导致PD-1表达增加[22]。与此同时, PD-1/PD-L1阻断后炎症反应过程中细胞因子的分泌, 将促进基质、组织重塑, 帮助无氧代谢和血管生成[23], 或者促进免疫细胞的极化和促肿瘤生长的免疫细胞亚群的产生, 最终促进肿瘤生长与扩散, 导致HPD。巨噬细胞的极化可以受肿瘤微环境中低水平IL-12和较高水平IL-10的影响, 为肿瘤生长和进展提供条件[24]。在乳腺癌中, CD4+ T细胞调节乳腺腺癌的肺转移。CD4+ T细胞通过IL-4调节活化的M2巨噬细胞和未成熟的骨髓细胞, 促进血管生成和组织重塑, 而后抑制免疫反应和辅助性T细胞适应性免疫[25, 26]。这些研究表明, PD-1/PD-L1通路的阻断通过炎症反应, 影响PD-1的表达, 或改变免疫细胞极化状态与促肿瘤生长免疫细胞亚群的生成, 使肿瘤细胞实现HPD。
3 基于生物标志物的抗PD-1/PD-L1药物合理应用因为疾病超进展具有突发性和免疫治疗可能产生严重反作用, 寻找可靠的生物标志物成为免疫治疗发展的重点方向。利用生物标志物, 既包括在治疗前筛选可获益患者, 并剔除具有较大几率患疾病超进展人群, 也需要其在治疗过程中, 对超进展是否发生或即将发生提供更可靠依据。但在免疫检查点阻断过程中, 一些先前被认为与疗效相关的生物标志物, 如TP53、KRAS、dMMR等无法有力解释、预测、评估超进展的发生, 寻找新的标志物成为当下及未来不可或缺的重要工作。根据目前对相关标志物寻找的研究, 同时基于超进展的可能成因, 针对HPD的生物标志物介绍分述如下(表 2)[2, 27, 28]。
| Table 2 Biomarkers for predicting HPD |
基于上述提到的, PD-1阻断可促进PD-1+ T-reg细胞增殖, 而PD-1+ T-reg细胞的扩增可能为HPD的一个原因。因此, 以肿瘤中PD-1+ T-reg细胞数量作为生物标志物, 可能实现对HPD的有效判断。治疗开始前, PD-1+ T-reg细胞的数量、分布在患者中并未显示出明显差异, 而在阻断PD-1/PD-L1信号的传导之后, PD-1+ T-reg细胞数量在HPD与非HPD患者中表现出明显差异。发生HPD的患者PD-1+ T-reg细胞数量增加, 非HPD患者则相反。由此, 通过检测肿瘤患者PD-1+ T-reg细胞水平, 可以为后续预测HPD提供合理思路[2]。
类似的, HPD的出现可能是由于抗肿瘤细胞上除PD-1/PD-L1信号通路以外免疫检查点的补偿性上调。代替性免疫检查点如PD-1/PD-L2、CTLA-4、LAG-3或TIM3等的表达增加, 可能也会导致HPD现象的产生。因此, 通过除PD-1以外其他免疫检查点水平的检测, 也能在一定程度上评估HPD, 从而有助于治疗和预防。
3.2 MDM2基因扩增一项由Kato等主导[27]的有关HPD与基因组改变的研究发现, 接受阻断PD-1/PD-L1信号传导治疗的155名患者中, 共有6名患者发生HPD现象。有意思的是, 其中6名MDM2家族扩增患者中(n = 5, MDM2; n = 1, MDM4)有4名(67%)表现出HPD现象, 且均为MDM2基因扩增。其作用机制可能是免疫检查点抑制剂导致了干扰素IFN-γ水平升高, 激活JAK-STAT信号传导后, 使得干扰素调节因子IRF-8表达增加, 并与MDM2启动子结合, 诱导MDM2表达。治疗前带有MDM2基因扩增的患者在使用免疫检查点抑制剂治疗时, MDM2进一步扩增, 导致能维持基因组完整性、防止肿瘤进展的p53蛋白功能降低, 进而加速肿瘤进展。因此, 在抗PD-1/PD-L1治疗前进行基因组检测中, MDM2基因的扩增或能作为生物标志物预测疾病超进展的发生。然而, 需要指出的是, 并非所有出现超进展的患者都具有MDM2扩增, 因此仍需要更多研究理清MDM2扩增与超进展之间的联系及作用机制。
3.3 EGFR突变EGFR是原癌基因C-erbB-1表达的一种表皮生长因子受体。Kato等[27]主导的有关超进展与基因组改变的研究中发现, 10名EGFR改变的患者中有8名患者TTF < 2个月, 2名出现疾病超进展现象, 肿瘤大小分别增加53.6%和125%。EGFR突变与TTF < 2个月具有显著的相关性(P=0.02), 根据目前超进展的定义, 这预示着EGFR突变可能为超进展的预测提供帮助, 然而其作用机制未知。
3.4 高度分化的CD28- CD27- CD4 T细胞(CD4 THD细胞)一项尚未正式发表的最新研究发现, PD-1/PD-L1信号通路的阻断可使得CD28- CD27- CD4 T细胞产生两种模式的变化。第一个治疗周期内, CD4 T细胞群数量受强烈影响, 体现出爆发增长或减少至较低水平, 两种模式的不同与临床治疗效果相关。CD4 THD细胞显着增加的患者均出现肿瘤进展, 而THD细胞显著减少的患者显示出肿瘤消退。根据Zuazo-Ibarra小组[28]的试验所得, 将基线定为CD4 THD < 40%以及CD28+ CD27+ CD4 T细胞 > 40%的组合后, 预测疗效可达到100%特异性和75%灵敏度, 可通过比较治疗前后患者CD4 THD水平, 显著提升的患者将预示着未来超进展的发生。
4 总结与展望疾病“超进展”被越来越多研究人员所关注, 但事实上目前对靶向PD-1/PD-L1抗体药物产生HPD的原因和机制仍知之甚少。为了进一步认识HPD, 进而解决HPD给免疫治疗带来的巨大风险, 对PD-1/PD-L1信号轴及HPD机制更深入的研究, 必然成为不可或缺的一环。如药物阻断后会对其他细胞具体产生何种影响, 对PD-1/PD-L2信号通路更确切的认知, 不同免疫检查点之间的相互作用等, 将有助于更全面认知PD-1/PD-L1信号通路和HPD现象, 实现治疗结果的改善。
细化HPD现象的评判标准和生物指标的选择工作对于之后应对HPD问题十分关键。如何在目前免疫相关反应标准的基础上, 对疾病HPD现象做出更加合理明确的统一化定义, 对之后的研究与治疗具有重要影响。
另外, 虽然已有一些生物标志物被提出用于预测和检测HPD现象, 但现有的标志物都不能取得令人满意的结果。在未来, 对于可靠生物标志物的寻找非常重要。一方面, 需要寻找具有前瞻性评估能力的标志物对患者肿瘤生长动力学进行前瞻性评估, 筛选对抗PD-1/PD-L1药物治疗存在较大风险、更高发展HPD倾向的患者。在治疗前期进行HPD预测, 以降低潜在危害; 另一方面, 考虑到HPD目前的界定标准尚不完善, 在免疫治疗的全部阶段, 尤其是早期阶段, 亟需可靠的生物标志物用于识别疾病“超进展”, 以便对已经发现HPD的患者抑制肿瘤的进一步进展, 并能够转向其他治疗方法, 使免疫治疗生存获益最大化。基于基因在PD-1/PD-L1治疗及超进展产生过程中的参与, 对基因组的监测技术或许是一种有效的手段。
从抗PD-1/PD-L1药物治疗来看, 与其他免疫检查点药物、抗炎药物或传统治疗方式的联合应用, 也许是解决疾病“超进展”的一个方向。与此同时, 如何细化不同患者的治疗方案, 实现个体化治疗, 最大限度地发挥治疗效果, 并尽量减少不良反应的发生也值得继续深入探究。
| [1] | Latchman Y, Wood CR, Chernova T, et al. PD-L2 is a second ligand for PD-1 and inhibits T cell activation[J]. Nat Immunol, 2001, 2: 261–268. DOI:10.1038/85330 |
| [2] | Francisco LM, Salinas VH, Brown KE, et al. PD-L1 regulates the development, maintenance and function of induced-regulatory T cells[J]. J Exp Med, 2009, 206: 3015–3029. DOI:10.1084/jem.20090847 |
| [3] | Champiat S, Dercle L, Ammari S, et al. Hyperprogressive disease (HPD) is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1[J]. Clin Cancer Res, 2016, 23: 1920–1928. |
| [4] | Fuentes-Antrás J, Provencio M, Díaz-Rubio E. Hyperprogression as a distinct outcome after immunotherapy[J]. Cancer Treat Rev, 2018, 70: 16–21. DOI:10.1016/j.ctrv.2018.07.006 |
| [5] | Ferrara R, Mezquita L, Texier M, et al. Hyperprogressive disease in patients with advanced non-small cell lung cancer treated with PD-1/PD-L1 inhibitors or with single-agent chemotherapy[J]. JAMA Oncol, 2018, 4: 1543–1552. DOI:10.1001/jamaoncol.2018.3676 |
| [6] | Tanaka Yuko. Hyperprogressive Disease after Treatment with Pembrolizumab in Lung Adenocarcinoma: An Autopsy Case Study[R]. Japan: Yuko Tanaka, 2019. |
| [7] | Aoki M, Shoji H, Nagashima K, et al. Hyperprogressive disease during nivolumab or irinotecan treatment in patients with advanced gastric cancer[J]. J Clin Oncol, 2019, 4: 124. |
| [8] | Gershon RK, Eardley DD, Durum S, et al. Contrasuppression. A novel immunoregulatory activity[J]. J Exp Med, 1981, 153: 1533–1546. DOI:10.1084/jem.153.6.1533 |
| [9] | Barnaba V, Schinzari V. Induction, control, and plasticity of Treg cells: the immune regulatory network revised?[J]. Eur J Immunol, 2013, 43: 318–322. DOI:10.1002/eji.201243265 |
| [10] | Krupnick AS, Gelman AE, Barchet W, et al. Cutting edge: murine vascular endothelium activates and induces the generation of allogeneic CD4+ 25+ Foxp3+ regulatory T cells[J]. J Immunol, 2005, 175: 6265. DOI:10.4049/jimmunol.175.10.6265 |
| [11] | Asano T, Meguri Y, Yoshioka T, et al. PD-1 modulates regulatory T-cell homeostasis during low-dose interleukin-2 therapy[J]. Blood, 2017, 129: 2186–2197. DOI:10.1182/blood-2016-09-741629 |
| [12] | Francavilla V. PD-L1 negatively regulates CD4+ CD25+ Foxp3+ Tregs by limiting STAT-5 phosphorylation in patients chronically infected with HCV[J]. J Clin Invest, 2009, 119: 551. DOI:10.1172/JCI36604 |
| [13] | Peligero C, Argilaguet J, Güerri-Fernandez R, et al. PD-L1 blockade differentially impacts regulatory T cells from HIV-infected individuals depending on plasma viremia[J]. PLoS Pathog, 2015, 11: e1005270. DOI:10.1371/journal.ppat.1005270 |
| [14] | Ellestad KK, Thangavelu G, Ewen CL, et al. PD-1 is not required for natural or peripherally induced regulatory T cells: severe autoimmunity despite normal production of regulatory T cells[J]. Eur J Immunol, 2014, 44: 3560–3572. DOI:10.1002/eji.201444688 |
| [15] | Koyama S, Akbay EA, Li YY, et al. Adaptive resistance to therapeutic PD-1 blockade is associated with upregulation of alternative immune checkpoints[J]. Nat Commun, 2016, 7: 10501. DOI:10.1038/ncomms10501 |
| [16] | Huang RY, Francois A, Mcgray AR, et al. Compensatory upregulation of PD-1, LAG-3, and CTLA-4 limits the efficacy of single-agent checkpoint blockade in metastatic ovarian cancer[J]. Oncoimmunology, 2017, 6: e1249561. DOI:10.1080/2162402X.2016.1249561 |
| [17] | Pentcheva-Hoang T, Egen JG, Wojnoonski K, et al. B7-1 and B7-2 selectively recruit CTLA-4 and CD28 to the immunological synapse[J]. Immunity, 2004, 21: 401–413. DOI:10.1016/j.immuni.2004.06.017 |
| [18] | Freeman GJ, Sharpe AH, Keir ME, et al. PD-1 and its ligands in tolerance and immunity[J]. Annu Rev Immunol, 2008, 26: 677–704. DOI:10.1146/annurev.immunol.26.021607.090331 |
| [19] | Dong Y, Sun Q, Zhang X. PD-1 and its ligands are important immune checkpoints in cancer[J]. Oncotarget, 2017, 8: 2171. |
| [20] | Xu W, Gu JJ, Ren QL, et al. NFATC1 promotes cell growth and tumorigenesis in ovarian cancer up-regulating c-Myc through ERK1/2/p38 MAPK signal pathway[J]. Tumor Biol, 2016, 37: 4493–4500. DOI:10.1007/s13277-015-4245-x |
| [21] | Dulos J, Carven, Gregory J, et al. PD-1 blockade augments Th1 and Th17 and suppresses Th2 responses in peripheral blood from patients with prostate and advanced melanoma cancer[J]. J Immunother, 2012, 35: 169–178. DOI:10.1097/CJI.0b013e318247a4e7 |
| [22] | Lamichhane P, Karyampudi L, Shreeder B, et al. IL-10 release upon PD-1 blockade sustains immunosuppression in ovarian cancer[J]. Cancer Res, 2017, 77: 6667–6678. DOI:10.1158/0008-5472.CAN-17-0740 |
| [23] | Nakamura K, Smyth MJ. Targeting cancer-related inflammation in the era of immunotherapy[J]. Immunol Cell Biol, 2017, 95: 325–332. DOI:10.1038/icb.2016.126 |
| [24] | Sica A, Larghi P, Mancino A, et al. Macrophage polarization in tumour progression[J]. Semin Cancer Biol, 2008, 18: 349–355. DOI:10.1016/j.semcancer.2008.03.004 |
| [25] | Denardo DG, Barreto JB, Andreu P, et al. CD4+ T cells regulate pulmonary metastasis of mammary carcinomas by enhancing protumor properties of macrophages[J]. Cancer Cell, 2009, 16: 91–102. DOI:10.1016/j.ccr.2009.06.018 |
| [26] | Allavena P, Sica A, Garlanda C, et al. The Yin-Yang of tumor-associated macrophages in neoplastic progression and immune surveillance[J]. Immunol Rev, 2008, 222: 155–161. DOI:10.1111/j.1600-065X.2008.00607.x |
| [27] | Kato S, Goodman AM, Walavalkar V, et al. Hyper-progressors after immunotherapy: analysis of genomic alterations associated with accelerated growth rate[J]. Clin Cancer Res, 2017, 23: 4242–4250. DOI:10.1158/1078-0432.CCR-16-3133 |
| [28] | Zuazo-Ibarra M, Arasanz H, Fernández-Hinojal G, et al. Senescent CD4 T cells unequivocally identify primary resistance and risk of hyperprogression to PD-L1/PD-1 immune checkpoint blockade in lung cancer[J]. bioRxiv, 2018. DOI:10.1101/320176 |
 2019, Vol. 54
2019, Vol. 54


