2. 杭州畅溪制药有限公司, 浙江 杭州 311121
2. Hangzhou Chance Pharmaceuticals Co. Ltd., Hangzhou 311121, China
载体型粉雾剂(dry powder inhaler, DPI)处方是将微粉化后的药物有效活性成分(active pharmaceutical ingredient, API)与载体乳糖进行混合, 使API颗粒黏附在乳糖载体表面以改善处方的流动性[1, 2]。载体大多为α乳糖一水合物, 其本身的物理特性如粒径大小、形状及表面粗糙度等, 皆会对处方的分散结果造成影响[3]。其中, 关于载体粒径对处方分散影响的有关研究相对较多[4-6]。
计算流体力学(computational fluid dynamics, CFD)作为一种成熟的模拟手段, 已被应用于DPI分散机制研究及DPI装置分散性能的评价中[7]。CFD方法可用于研究吸入装置Aerolizer®中装置格栅、进气口及吸嘴长度等流道几何结构的改变对粉雾剂分散结果的影响[8-11]。然而, 单纯CFD方法无法模拟颗粒解聚及颗粒间相互作用等问题, 对DPI中颗粒相的模拟有很多局限[7]。离散元(discrete element modelling, DEM)方法与CFD方法的耦合可以弥补上述缺陷[12], 如CFD-DEM耦合研究了Aerolizer®中微细颗粒分数(fine particle fraction)与载体颗粒碰撞速度和碰撞角度间的关系[13], 并成功预测了处方分散结果。相比Aerolizer®, 目前针对Handihaler®装置的分散机制研究相关报道较少。
本研究以Handihaler®为研究对象, 通过体外实验评价两种载体处方的分散性能, 结合数值模拟对两种载体处方的分散结果进行分析, 并尝试建立体外实验结果与模拟结果之间的关系。在分析比较处方分散特点的同时, 分析Handihaler®装置的分散机制。
材料与方法材料 α乳糖一水合物, 型号Lactohale 100® (LH100)和Respitose SV003® (SV003)购自DFE Pharma (荷兰); 马来酸氯苯那敏(chlorpheniramine maleate, CM)原料药购自河南仟航生物科技有限公司; 乙腈与硫酸二氢氨溶液购自国药集团化学试剂有限公司; 胶囊型粉雾剂原研装置Handihaler®购自勃林格殷格翰(德国); 羟丙甲纤维素(hydroxypropyl methylcellulose, HPMC) 3号胶囊购自苏州胶囊有限公司。
模型药物微粉化方法 模型药物CM的微粉化方法为气流粉碎, 气流粉碎机的型号为Jet Mill® Mcone 2(DEC group, 瑞士), 粉碎机的粉碎腔及文丘力压力设为1.6 bar (1 bar = 0.1 MPa)。使用激光粒度仪Helos-Rodos (新帕泰克, 德国)对粉碎后的CM样品粒径分布情况进行测量, 得到CM样品的粒径分布情况如下:中值粒径(D50)为2.00 μm, 跨度(span)为1.61, D10和D90分别为0.62和3.84 μm。粉碎过程中, 环境相对湿度控制在(50 ± 5) %, 温度为(20 ± 2) ℃。
模型药物含量的检测方法 CM含量的检测方法参考中国药典, 流动相为磷酸二氢胺溶液与乙腈的混合溶剂。配比方法:取磷酸二氢胺11.5 g, 磷酸1 mL, 加水稀释至1 L。按4:1的比例, 加入乙腈。高效液相色谱(HPLC)实验中, 色谱柱选用Zorbax SB-C18 (150 mm×4.6 mm, 5 μm), 高效液相色谱仪为1260DAD高效液相色谱仪(安捷伦科技有限公司, 美国)。
模型药物与乳糖载体的混合方法 载体乳糖选择LH100和SV003, 两种皆为筛分型乳糖, 其D50粒径分别为135和60 μm, 粒径资料来自DFE Pharma官网。载体与CM之间的混合方式为三维混合, 混合机为Tubular®三维混合机(华尔宝, 瑞士)。CM与两种载体乳糖之间的混合比例为1:67.5, 该比例为粉雾剂处方采用较多的一个比例[5, 14, 15]。混合转速设为100 r·min-1, 混合时间为45 min。将混合后的样品放入HPMC胶囊前, 对混合样品的混合均匀度进行检测, 本研究中混合均匀性的评判指标为CM的含量, 具体方法如下:将混合样品倒在铝箔纸上, 随机取出5份, 每份20 mg, 分别加流动相溶解过滤后作为待测样品。当样品中药物含量的相对标准偏差(RSD)小于5%时, 认为混合均匀性符合要求。根据混合均匀度的测试结果, LH100和SV003两种载体处方的RSD分别为0.9%和0.7%, 表明处方的混合均匀性符合要求。
装置流阻测试方法 本研究使用的DPI装置为改版后的Handihaler®, 去除原研装置中盖子和底壳, 仅保留原研装置中的核心分散结构, 包括胶囊仓(capsule chamber)、格栅(grid)及吸嘴(mouthpiece)。流阻实验测试使用剂量单位取样装置(dosage unit sampling apparatus, DUSA)组件、流量控制单元及真空泵(Copley公司, 英国), 具体操作步骤如下:将HPMC胶囊装入Handihaler®中, 按压装置一侧的按钮刺破胶囊; 通过适配器(adaptor), 将装置与DUSA管相连; 开启真空泵, 将流量计连接至流量控制单元以及真空泵, 确定真空泵此时的体积流量; 确定体积流量后, 将流量计取下, 然后将DUSA管与装置连接至流量控制系统单元与真空泵, 并记录此时对应流量下装置两端的压差。流阻测试结果显示:在30和60 L·min-1的流速条件下, 粉雾剂装置内部的压差分别为(1.69 ± 0.01) kPa和(7.00 ± 0.2) kPa。流阻实验的结果用于CFD模拟中边界条件(boundary condition)的设定。
体外实验方法 采用撞击器法, 撞击器选择快速筛选撞击器(fast screening impactor, FSI), 该撞击器为双级撞击器, 能够快速地测出药物颗粒的微细颗粒剂量(fine particle dose, FPD)[16], 该数值是用于评价粉雾剂分散性能的常用指标之一, 具体测试步骤如下:在FSI的两个收集盘及预分离器内涂上涂层(Tween 20%, 甘油80%), 并在预分离器中加入流动相10 mL; 在FSI的最后一级放入合适大小的滤纸, 同时将预分离器、对应收集盘及喉管相连。将流量计和流量控制单位系统及真空泵相连, 通过流量控制系统将流量调节至对应的工作流量。随后, 将装有制剂粉末的HPMC胶囊装入Handihaler®装置(去除底壳和盖子), 按压按钮刺破胶囊, 并通过适配器将装置与FSI相连, 然后开启真空泵进行体外实验。本次体外实验的工作流量分别为30和60 L·min-1, 与数值模拟的流速条件一致。
CFD方法 以Handihaler®装置的分散结构为研究对象, 通过建模软件NX UG 8.0 (Siemens公司, 德国)建立物理模型, 提取其中空气流经的通道并建立流道模型, 如图 1所示。使用网格划分软件Ansys ICEM-CFD 14.0及CFD计算软件Ansys fluent 14.0对建立好的粉雾剂流道三维物理模型进行网格划分及气流场计算。在CFD计算中, 气流的流动受质量和动量守恒等方程的约束, 控制方程见文献[13, 17, 18]。
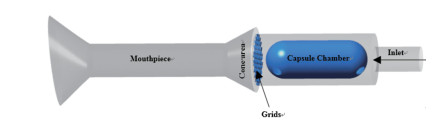
|
Figure 1 Schematic view of the flowfield of Handihaler® |
采用非结构化网格对流场区域离散化, 湍流模型的选择及近壁面网格的处理参见文献[8-10, 19-23], 选择K-ω SST湍流模型, Y+值小于5。离散格式采用二阶迎风(second up-wind), 边界条件选择压力入口(pressure inlet)与出口(pressure outlet), 压差条件来自流阻实验结果。
本研究中, 判断CFD迭代收敛与否的条件如下:各项残差指标如动量、连续方程、湍流动能K及比耗散率ω低于1×10-4, 且装置内的体积流量不再随CFD迭代而变化, 该收敛条件参见文献[20, 21]。将CFD的计算结果和理论值进行比对, 方法如下:将流阻实验测得的压差代入CFD进行运算, 得到对应压差条件下的CFD体积流量计算值。将计算值与体积流量的理论值进行比较, 当两者间的误差小于8%时, 即认为CFD的计算结果是合理的, 可用于后续的DEM耦合运算[11]。流阻实验测得的压差代入CFD, 计算所得的流量值分别为28.9和59.88 L·min-1, 与流量理论值相差在5%以内, 符合要求。
DEM方法 粉雾剂装置中颗粒的分散过程, 属于气固两相流问题。本研究中计算颗粒在气固两相中的体积占比小于1%, 根据相关文献[17]报道, 可忽略颗粒对气流的作用。基于此, 可使用CFD单向耦合DEM的计算方式。由于颗粒相的密度远大于气流密度, 因此颗粒受到的萨夫曼升力、虚拟质量力及压力梯度力等作用力相对较弱。在本次研究中, 气流对颗粒的作用仅考虑曳力与浮力, 曳力的计算公式参考Ergun等[22, 24, 25]提出的经验系数模型。
对于载体型粉雾剂药物活性成分大多黏附于载体乳糖表面, 载体乳糖的运动、受力情况直接影响药物分散表现, 其受到的气流剪切及装置壁面碰撞直接对分散的结果造成影响[12, 26]。为了简化计算模型, DEM模拟中不加入API药物颗粒。
载体颗粒的运动通过DEM计算软件EDEM 2018 (DEM solution, 英国)进行求解, 单向耦合通过软件中body force模块实现。DEM的计算区域设定与颗粒分散相关的结构, 包括胶囊仓、格栅及吸嘴。DEM中颗粒的接触模型, 采用基于软球模型的JKR模型。DEM的相关参数设定参见文献[27-30], 具体如表 1所示, 其中60 μm颗粒代表SV003载体乳糖, 135 μm颗粒代表LH100载体乳糖。DEM模拟的参数中, 碰撞能量损失作为颗粒与壁面撞击力强弱的衡量指标, 颗粒和气流间的相对速度作为气流剪切力强弱的衡量指标。
| Table 1 The properties of carrier particles in discrete element modelling (DEM) simulation |
由于目前受制于计算机的资源及计算能力, DEM还无法模拟真实数量下颗粒的运动情况, 因此需要通过颗粒数量的敏感性验证, 用有限个数量的颗粒来代替整体的颗粒群。当颗粒的数量大于某值后, DEM的计算结果不再随着颗粒数量的变化而变化, 此时可认为计算结果对颗粒数量不敏感。此外, 体外实验所用两种载体处方质量相等, 需考虑同质量下不同粒径载体颗粒的数量差异问题。查阅相关文献[28, 31], α乳糖一水合物的真实密度在1 520:1 540 kg·m-3。假设粉末堆中的空气质量不计, 估算得到两种载体乳糖同质量下的数量比约为1 (LH100):10 (SV003)。本研究以颗粒在流道出口处的平均速度为敏感性验证指标, 选择颗粒数量为100、200、250、500、1 000、5 000和10 000时进行颗粒数量敏感性验证。如表 2所示, 对于60和135 μm的颗粒分别选择10 000和1 000的颗粒数量进行模拟。
| Table 2 Sensitivity analysis of different particle number. a Particle sized of 60 μm; b Particle sized of 135 μm |
统计学方法 体外实验数据均用Graphpad prism统计软件进行统计, 各组数据间的比较采用two-way ANOVA进行分析, P < 0.05为差异具有统计学意义, P < 0.01为差异极具统计学意义。
结果 1 体外实验载体处方中CM在各级沉积结果见图 2。在相同流速下, SV003处方的FPD值高于LH100处方, 但两者间无显著性差异。对于SV003处方, 随着流速从30 L·min-1变为60 L·min-1, FPD值显著上升(P < 0.05);而LH100处方的FPD值虽然随流速增加也有所增加, 但与低流速相比无显著性差异(P=0.052 1)。LH100载体处方中CM在预分离器内残留量, 随着流速从30 L·min-1变为60 L·min-1, 出现了显著性下降(P < 0.01);而SV003载体处方中CM在预分离器内残留量, 随着流速变化未出现显著性变化。结果表明, LH100载体处方的分散结果对气流的依赖性较大。SV003处方的体外沉积表现在两种流速下优于LH100处方。
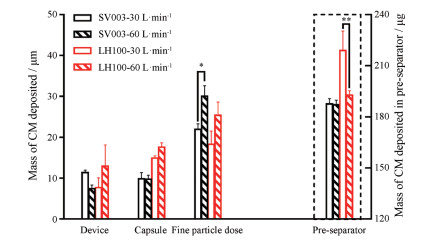
|
Figure 2 Mass deposition of chloropheniramine maleate (CM) formulated with two different carrier particles in each stage following aerosolization from the Handihaler® at 30 L·min-1 and 60 L·min-1 respectively. n = 3, *P < 0.05, **P < 0.01 |
两种载体颗粒的表观形貌见图 3。LH100载体表面比SV003更加光滑平整, SV003载体表面较为粗糙。根据相关文献[32]报道, 筛分型α乳糖一水合物的形状为战斧型。由图可见, LH100形状更加规整, 符合“战斧型”。

|
Figure 3 Scanning electron micrographs of LH100 (A) and SV003 (B). Scale bars 10 μm; magnification ×1000 |
对于LH100单个载体颗粒, 相同流速下碰撞能量损失及气流间的相对速度都要大于SV003单个颗粒(表 3), 说明前者受到的撞击力和气流剪切力高于后者。
| Table 3 DEM statistical data of average collision energy loss and relative velocity of carrier particle. The relative velocity refers to the relative velocity between air and particle |
根据两种载体颗粒的真实数量比、统计颗粒与壁面的碰撞次数及能量损失总和(图 4), 结果与表 3所述的情况有所不同。在相同流速下, SV003颗粒群与装置壁面的碰撞能量损失总和高于LH100颗粒群。由于数量较少的原因, LH100颗粒流和装置壁面的碰撞次数总和远低于SV003, 但LH100单个颗粒的碰撞能量损失要高SV003单个颗粒一个数量级(表 3)。因此, 相同流速下LH100颗粒流的碰撞能量损失总和相对维持在一个较高水平。
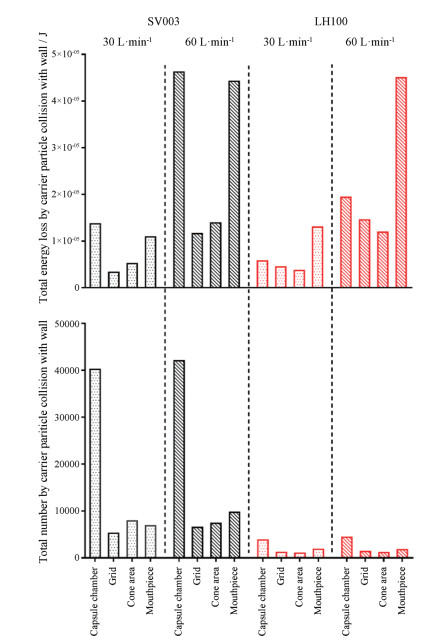
|
Figure 4 Total number and energy loss by the carrier collision with respect of the location in Handihaler®. The carrier collision with capsule shell is not included in statistical data analysis of DEM |
根据CFD-DEM计算结果, 整个Handihaler®的分散结构中, 载体颗粒与格栅的碰撞能量损失总和低于胶囊仓和吸嘴。对于粒径较大的载体颗粒, 吸嘴对其分散的作用要高于胶囊仓。由此可知, 相比胶囊仓和吸嘴, 格栅对颗粒分散的直接作用不大, 颗粒的分散主要集中在胶囊仓和吸嘴处。该结果与Donnovan等[19]和Shur等[33]的研究结果一致。
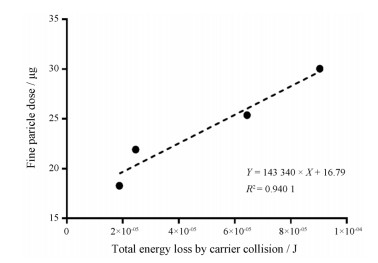
4 CFD-DEM结果与体外实验结果比对CFD-DEM与体外实验的比对结果见图 5。基于本研究对装置结构的分析, 此处碰撞能量损失总和为颗粒与胶囊仓和吸嘴壁面碰撞能量损失总和的相加值。在两种流速和两种载体粒径条件下, 载体颗粒和壁面间的碰撞能量损失总和与FPD的变化趋势一致; FPD与载体颗粒碰撞能量损失之间的线性拟合结果见图 6, 线性拟合度R2 = 0.940 1。上述两个结果说明, 体外实验结果与模拟结果之间具有一定的线性相关性。同时也表明, 在本研究条件下, Handihaler®分散结构中载体颗粒与装置壁面间的碰撞作用会直接影响粉雾剂载体处方的分散结果。由于模拟和实验的比对中, 所用的碰撞能量损失总和为颗粒与胶囊仓和吸嘴壁面碰撞能量损失总和的相加值, 该结果也从侧面反映Handihaler®的胶囊仓与吸嘴在颗粒分散过程中所起的重要作用。
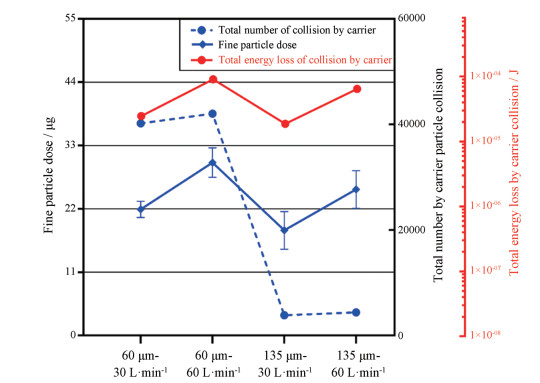
|
Figure 5 Comparison between the results of in-vitro experiments and simulation under four conditions |
|
Figure 6 Correlation between fine particle dose and total energy loss by carrier collision |
预分离器用于截留粒径较大的颗粒, LH100处方中CM在预分离器沉积量随流速增加出现显著下降的原因, 可能是由于其表面形态所致。已有文献[4, 34, 35]报道, 载体颗粒的表面形态会影响处方整体的分散性能。Tsuji等[36]将乳糖载体表面形态特征分为3种:纳观表面(nano-metered topography)、光滑表面及微观表面(micro-metered topography), 示意图见图 7。

|
Figure 7 Carrier particles with three different surface morphologies |
微观表面形态的载体乳糖, 由于其表面峰和峰之间的距离相对较大, API颗粒容易镶嵌在其中, 从而增加载体表面对API颗粒的机械锁合力; 对于光滑表面形态而言, 光滑的乳糖表面有利于气流剪切力对API颗粒的作用, 但光滑的乳糖表面也会增加API颗粒与载体间的接触面积, 使API与载体间结合得更加紧密。相比于光滑和微观表面形态特征, API颗粒与具有纳观表面形态特征的载体表面之间, 以点接触为主, 这种接触方式减少了API颗粒与载体之间的接触面积, 从而减少了载体和API颗粒间的结合力。从分散角度来说, 光滑的载体表面对于分散是不利的。由图 3可见, LH100乳糖载体的表面较为光滑, 因此API与其结合过紧, 使得低流速下API颗粒无法完全从载体表面脱落, 导致低流速下LH100载体处方中CM在预分离器内沉积量过高。随着流速增加, 气流剪切力及撞击力作用增强(表 3), CM颗粒受其影响开始出现大量的脱落, 使得在60 L·min-1流速下, LH100处方中CM颗粒在预分离的沉积量显著减少。相较之下, SV003的表面可能更接近纳观表面形态特征, 其表面的CM颗粒更容易脱落。在两种流速下, SV003载体处方中CM在预分离的残留量较低。
由表 3可见, 相同流速下LH100单个颗粒受到更强的气流剪切力及撞击力作用, 这是因为在密度相同条件下颗粒粒径越大, 受到的撞击力及气流剪切力会相应提升[37]。因此, LH100载体处方理论上应该分散得更好, 但实际体外分散表现, LH100处方却不如SV003。因为在载体处方质量相等的情况下, 除载体受到剪切力与撞击力外, 载体粒径还会影响颗粒的数量。本研究中, 相同质量下由于载体SV003的粒径较小, 在数量上要远高于LH100, 因而其颗粒流和装置壁面之间的碰撞能量损失总和及次数在相同流速下皆高于LH100 (图 4), 这对处方分散而言是有利的。因为粉末的分散行为与颗粒群在粉雾剂流道内整体的运动情况相关, 颗粒群和装置壁面的碰撞能量损失及次数总和越高, 说明颗粒群整体的碰撞强度越高, 从各载体颗粒表面脱落的药物颗粒总量可能会更高。体外实验结果也证实, 相同流速下粒径较小的SV003载体处方的分散表现更优。综上所述, 在本文的实验条件下, 粒径较小且表面接近纳观表面形态的载体乳糖在Handihaler®装置中分散得更好。
| [1] | Zhou QT, Qu L, Larson I, et al. Improving aerosolization of drug powders by reducing powder intrinsic cohesion via a mechanical dry coating approach[J]. Int J Pharm, 2010, 394: 50–59. DOI:10.1016/j.ijpharm.2010.04.032 |
| [2] | Tang Y, Zhu JB, Chen XJ. A novel pulmonary delivery system——dry powder inhalers[J]. Acta Pharm Sin (药学学报), 2009, 44: 571–574. |
| [3] | Peng TT, Lin SQ, Niu BY, et al. Influence of physical properties of carrier on the performance of dry powder inhalers[J]. Acta Pharm Sin B, 2016, 6: 308–318. DOI:10.1016/j.apsb.2016.03.011 |
| [4] | Donovan MJ, Smyth HDC. Influence of size and surface roughness of large lactose carrier particles in dry powder inhaler formulations[J]. Int J Pharm, 2010, 402: 1–9. DOI:10.1016/j.ijpharm.2010.08.045 |
| [5] | Kaialy W, Alhalaweh A, Velaga SP, et al. Influence of lactose carrier particle size on the aerosol performance of budesonide from a dry powder inhaler[J]. Powder Technol, 2012, 227: 74–85. DOI:10.1016/j.powtec.2012.03.006 |
| [6] | Hamishehkar H, Emami J, Najafabadi AR, et al. Influence of carrier particle size, carrier ratio and addition of fine ternary particles on the dry powder inhalation performance of insulin-loaded PLGA microcapsules[J]. Powder Technol, 2010, 201: 289–295. DOI:10.1016/j.powtec.2010.04.017 |
| [7] | Sommerfeld M, Cui Y, Schmalfuß S. Potential and constraints for the application of CFD combined with Lagrangian particle tracking to dry powder inhalers[J]. Eur J Pharm Sci, 2019, 128: 299–324. DOI:10.1016/j.ejps.2018.12.008 |
| [8] | Coates MS, Fletcher DF, Chan HK, et al. Effect of design on the performance of a dry powder inhaler using computational fluid dynamics. Part 1: grid structure and mouthpiece length[J]. J Pharm Sci, 2004, 93: 2863–2876. DOI:10.1002/jps.20201 |
| [9] | Coates MS, Chan HK, Fletcher DF, et al. Effect of design on the performance of a dry powder inhaler using computational fluid dynamics. Part 2: air inlet size[J]. J Pharm Sci, 2006, 95: 1382–1392. DOI:10.1002/jps.20603 |
| [10] | Coates MS, Chan HK, Fletcher DF, et al. Influence of mouthpiece geometry on the aerosol delivery performance of a dry powder inhaler[J]. Pharm Res, 2007, 24: 1450–1456. DOI:10.1007/s11095-007-9262-z |
| [11] | Zhou Y, Chen L, Lu XY, et al. Effect of inhaler grid on the aerosolization behavior of mannitol powder[J]. Chin J Pharm (中国医药工业杂志), 2016, 47: 1423–1429. |
| [12] | Tong ZB, Yu AB, Chan HK, et al. Discrete modelling of powder dispersion in dry powder inhalers - a brief review[J]. Curr Pharm Design, 2015, 21: 3966–3973. DOI:10.2174/1381612821666150820110958 |
| [13] | Tong ZB, Kamiya H, Yu AB, et al. Multi-scale modelling of powder dispersion in a carrier-based inhalation system[J]. Pharm Res, 2015, 32: 2086–2096. DOI:10.1007/s11095-014-1601-2 |
| [14] | Grasmeijer F, Hagedoorn P, Frijlink HW, et al. Drug content effects on the dispersion performance of adhesive mixtures for inhalation[J]. PLoS One, 2013, 8: e71339. DOI:10.1371/journal.pone.0071339 |
| [15] | Kaialy W, Alhalaweh A, Velaga SP, et al. Effect of carrier particle shape on dry powder inhaler performance[J]. Int J Pharm, 2011, 421: 12–23. DOI:10.1016/j.ijpharm.2011.09.010 |
| [16] | Yan CX, Jiang WM, Chen GL, et al. Critica levaluation of determination methods of the particle size of dry powder inhaler: a comparison of three impactors[J]. Chin J Pharm Anal (药物分析杂志), 2011, 31: 1296–1299. |
| [17] | Chen L, Heng RL, Delele MA, et al. Investigation of dry powder aerosolization mechanisms in different channel designs[J]. Int J Pharm, 2013, 457: 143–149. DOI:10.1016/j.ijpharm.2013.09.012 |
| [18] | Yang JC, Wu CY, Adams M. Three-dimensional DEM-CFD analysis of air-flow-induced detachment of API particles from carrier particles in dry powder inhalers[J]. Acta Pharm Sin B, 2014, 4: 52–59. DOI:10.1016/j.apsb.2013.11.003 |
| [19] | Donovan MJ, Kim SH, Raman V, et al. Dry powder inhaler device influence on carrier particle performance[J]. J Pharm Sci, 2012, 101: 1097–1107. DOI:10.1002/jps.22824 |
| [20] | Milenkovic J, Alexopoulos A H, Kiparissides C. Deposition and fine particle production during dynamic flow in a dry powder inhaler: a CFD approach[J]. Int J Pharm, 2014, 461: 129–136. DOI:10.1016/j.ijpharm.2013.11.047 |
| [21] | Milenkovic J, Alexopoulos AH, Kiparissides C. Airflow and particle deposition in a dry powder inhaler: an integrated CFD approach[M]//Obaidat MS, Filipe J, Kacprzyk J, et al. Simulation and Modeling Methodologies, Technologies and Applications. Cham: Springer, 2014: 127-140. |
| [22] | Sommerfeld M, Schmalfuß S. Numerical analysis of carrier particle motion in a dry powder inhaler[J]. J Fluids Eng, 2015, 138: 041308. |
| [23] | Mei Y, Qu JJ, Li Y. Influence of y+ on the computation of vertical axis wind turbine aerodynamic performance[J]. Electr Power Sci Eng (电力科学与工程), 2017, 33: 60–64. |
| [24] | Ergun S. Fluid flow through packed columns[J]. Chem Eng Prog, 1952, 48: 89–94. |
| [25] | Afkhami M, Hassanpour A, Fairweather M, et al. Fully coupled LES-DEM of particle interaction and agglomeration in a turbulent channel flow[J]. Comput Chem Eng, 2015, 78: 24–38. DOI:10.1016/j.compchemeng.2015.04.003 |
| [26] | Islam N, Cleary MJ. Developing an efficient and reliable dry powder inhaler for pulmonary drug delivery - a review for multidisciplinary researchers[J]. Med Eng Phys, 2012, 34: 409–427. DOI:10.1016/j.medengphy.2011.12.025 |
| [27] | Louey MD, Mulvaney P, Stewart PJ. Characterisation of adhesional properties of lactose carriers using atomic force microscopy[J]. J Pharm Biomed Anal, 2001, 25: 559–567. DOI:10.1016/S0731-7085(00)00523-9 |
| [28] | Steckel H, Markefka P, Tewierik H, et al. Functionality testing of inhalation grade lactose[J]. Eur J Pharm Biopharm, 2004, 57: 495–505. DOI:10.1016/j.ejpb.2003.12.003 |
| [29] | van Wachem B, Thalberg K, Remmelgas J, et al. Simulation of dry powder inhalers: combining micro-scale, meso-scale and macro-scale modeling[J]. AIChE J, 2017, 63: 501–516. DOI:10.1002/aic.15424 |
| [30] | Nguyen D, Remmelgas J, Björn IN, et al. Towards quantitative prediction of the performance of dry powder inhalers by multi-scale simulations and experiments[J]. Int J Pharm, 2018, 547: 31–43. DOI:10.1016/j.ijpharm.2018.05.047 |
| [31] | Liu Y, Chen L, Zou J, et al. Evaluation of dispersing performance of dry powder inhalers by single frame and single exposure imaging[J]. Chin J Pharm (中国医药工业杂志), 2016, 47: 592–596. |
| [32] | Pilcer G, Wauthoz N, Amighi K. Lactose characteristics and the generation of the aerosol[J]. Adv Drug Deliv Rev, 2012, 64: 233–256. DOI:10.1016/j.addr.2011.05.003 |
| [33] | Shur J, Lee S, Adams W, et al. Effect of device design on the in vitro performance and comparability for capsule-based dry powder inhalers[J]. AAPS J, 2012, 14: 667–676. DOI:10.1208/s12248-012-9379-9 |
| [34] | Tan BMJ, Chan LW, Heng PWS. Improving dry powder inhaler performance by surface roughening of lactose carrier particles[J]. Pharm Res, 2016, 33: 1923–1935. DOI:10.1007/s11095-016-1928-y |
| [35] | Kawashima Y, Serigano T, Hino T, et al. Effect of surface morphology of carrier lactose on dry powder inhalation property of pranlukast hydrate[J]. Int J Pharm, 1998, 172: 179–188. DOI:10.1016/S0378-5173(98)00202-6 |
| [36] | Tsuji Y, Tanaka T, Yonemura S. Cluster patterns in circulating fluidized beds predicted by numerical simulation (discrete particle model versus two-fluid model)[J]. Powder Technol, 1998, 95: 254–264. DOI:10.1016/S0032-5910(97)03349-4 |
| [37] | De Boer AH, Hagedoorn P, Gjaltema D, et al. Air classifier technology (ACT) in dry powder inhalation: part 1. Introduction of a novel force distribution concept (FDC) explaining the performance of a basic air classifier on adhesive mixtures[J]. Int J Pharm, 2003, 260: 187–200. DOI:10.1016/S0378-5173(03)00250-3 |
 2019, Vol. 54
2019, Vol. 54


