2. 北京医院药学部, 北京 100730;
3. 药物临床风险与个体化应用评价北京市重点实验室, 北京 100730
2. Department of Pharmacy, Beijing Hospital, Beijing 100730, China;
3. Assessment of Clinical Drugs Risk and Individual Application Key Laboratory, Beijing 100730, China
肺动脉高压(pulmonary hypertension, PH)是一种病理生理性疾病, 并且会使大多数的心血管和呼吸系统疾病复杂化, 最终会导致患者右心功能受损, 甚至死亡, 如果未进行及时治疗, 确诊后平均寿命约2.8年[1, 2]。正常人肺动脉平均压(mean pressure of pulmonary artery, mPAP)为(14 ± 3) mmHg, 最高不超过20 mmHg; 欧洲心脏病学会指南指出, 确诊肺动脉高压需要经过右心导管插入术证实:肺动脉平均压(mPAP)在静息状态下≥25 mmHg, 介于20~25 mmHg之间的判定为临界肺动脉高压[3]。右心导管检查是目前唯一的确诊肺动脉高压的检查手段, 尤其是患者出现明显症状, 可能需要特异性治疗即靶向治疗的患者[4]。肺动脉高压机制不明确, 起病隐匿, 发展缓慢, 确诊方式属侵入性有创且较为复杂, 导致了肺动脉高压患者不能及早诊断治疗。
sGC003 (4, 6-二氨基-2-[1-(3-氟噻吩-2-基)甲基-1H-吡唑并[3, 4-b]吡啶-3-基]-5-嘧啶基-N-甲基氨基甲酸甲酯)是以可溶性鸟苷酸环化酶(soluble guanylate cyclase, sGC)为靶标的具有全新作用机制的抗肺动脉高压化合物, 具有双重作用模式, 一是增强sGC对于NO的敏感度, 二是当NO缺少或水平低时则直接刺激sGC, 与传统的治疗肺动脉高压的药物如NO供体和磷酸二酯酶抑制剂相比, 非NO依赖性的sGC激动剂可避免有机硝酸盐和NO其他供体与生物分子非特异性相互作用的缺点[1, 5]。
代谢组学变化反映了机体整体水平的代谢状态, 有利于对复杂的体系进行整体认识。实际上细胞内许多生命活动都是与代谢物有关的, 比如机体内细胞信号的传导、能量的传递等都是受到代谢物的调控, 代谢组学研究的是生物体在某一状态下细胞内源性所有代谢物的集合[6-8]。
本课题选择脱氢野百合碱诱导的肺动脉高压比格犬模型, 利用GC-TOF-MS代谢组学分析技术的方法, 筛选肺动脉高压比格犬血清的潜在生物标志物; 此外探讨应用sGC003抗肺动脉高压化合物干预后, PH比格犬代谢特征的改变及机制。旨在寻找到PH疾病早期的代谢规律, 深入理解PH的发病机制及sGC003化合物的药效作用, 进一步为临床的肺动脉高压诊断提供可靠的指标。
材料与方法实验动物 健康比格犬34只, 雌雄各半, 体重(8.5 ± 1.0) kg, 由北京日新科技有限公司提供, 许可证号: SCXK (京) 2016-0004。饲养在军事医学科学院国家北京药物安全评价研究中心屏障设施内, 恒温(22 ± 2 ℃)、恒湿(55% ± 5%)、人工光照明暗各12 h, 自由摄水摄食。本实验中动物实验方案获得北京日新科技有限公司实验动物管理委员会批准。
仪器 Agilent 7890气相色谱仪(美国Agilent公司); Pegasus HT飞行时间质谱仪(美国Leco公司); Heraeus Fresco17离心机(美国Thermo Fisher Scientific公司)。
药品与试剂 sGC003 (纯度99.0%)与脱氢野百合碱来自于军事医学科学院毒物药物研究所化学合成实验室; L-2-氯苯丙氨酸(上海恒柏生物科技), 甲氧胺盐酸盐(日本TCI公司), 饱和脂肪酸甲酯(FAMEs) (德国Dr. Ehrenstorfer公司), N, O-双(三甲基硅烷基)三氟乙酰胺(BSTFA)、甲醇、乙腈购自上海安谱实验科技股份有限公司。
肺动脉高压比格犬模型建立 依据肺动脉高压模型建立相关文献及军事医学科学院的肺动脉高压模型复制方法[9-11]。比格犬34只, 随机分为3组:正常对照组(C组) 8只、PH模型组(M组) 11只、模型给sGC003化合物组(MHM组) 15只。犬一次性静脉注射DMCT 2 mg·kg-1, 4周后开始给药, PH模型组给大剂量sGC003 0.16 mg·kg-1, 模型组及健康对照组给安慰剂, 每天两次, 连续给药6周后进行肺动脉压力检测, mPAP≥25 mmHg判断为造模成功。
肺动脉高压指标检测及样品采集 三组比格犬饲养10周后, 采用右心导管法测定mPAP, 将约90 cm左右的小儿心脏导管(外径2.5 mm)置于盐水中, 用钢丝引导, 经股静脉插入右心室, 然后抽出钢丝再缓慢插入肺动脉, 注入肝素并与压力换能器相连, 经BIOPAC生理记录系统处理压力信号。具体方法如下:戊巴比妥钠(30 mg·kg-1)静脉注射麻醉, 将麻醉犬仰卧置于微型的手术台上, 并固定其四肢。首先游离出右侧股静脉, 股静脉的远心端用4号缝合线结扎, 近心端用止血夹夹住, 于二者中间剪口, 松开止血夹, 慢慢推进导管, 约25 cm左右可进入到右心室。一旦软管到达右心室后, 体外端管口处会有血液自动流出, 并随心脏搏动而起伏, 然后导管继续向前推进, 导管可经右心室到达肺动脉, 观察监视器出现肺动脉压力波形后, 稳定10~15 min后, 记录肺动脉压力。
待上述实验完毕后, 处死动物, 摘取心脏, 在装有冰盐水的平皿中洗净血液, 并用滤纸吸去多余水分。用眼科剪沿心房室间沟处剪去心耳、大血管和两个心房后, 沿室间隔将右心室自由壁(RV)剪下, 使左心室及室间隔(LV+S)连在一起, 用分析天平分别称量RV和LV+S重量, 通过公式RV/(LV+S)计算出右心指数(RVI)以指示右心室肥厚程度。
比格犬饲养10周后采集样本, 采血前一晚禁食, 次日早晨经前肢小隐静脉取血, 室温静置1 h进行凝固分层, 然后3 000 r·min-1室温离心取上清转移至干净的离心管中, 在4 ℃条件下12 000 r·min-1离心10 min, 取上清分装到两个1.5 mL冻存管中, 每管300 μL, -80 ℃冰箱冻存。
GC-TOF-MS分析测试样品制备将冻存样品于冰水混合物解冻后, 每个样本各取20 μL混合成QC样本, 取样本100 μL于1.5 mL EP管中, 加入提取液(甲醇) 350 μL, 再加入L-2-氯苯丙氨酸(溶于超纯水中1 mg·mL-1) 10 μL, 涡旋30 s混匀; 于20 ℃条件下静置10 min, 然后4 ℃、12 000 r·min-1离心15 min, 小心移取350 μL上清液于1.5 mL甲烷硅基化的进样瓶中, 放置在真空浓缩器中干燥提取物, 然后向干燥后的代谢物中加入甲氧胺盐试剂(甲氧胺盐酸盐, 溶于吡啶20 mg·mL-1) 60 μL, 轻轻混匀后, 放入烘箱中80 ℃孵育30 min; 向每个样品中加入BSTFA (含有1% TMCS) 80 μL, 将混合物70 ℃孵育1.5 h; 冷却至室温, 向混合的样本中加入FAMEs (溶于氯仿) 5 μL随机顺序上机检测。
分离和检测系统 Agilent 7890气相色谱-飞行时间质谱联用仪配有Agilent DB-5MS毛细管柱(30 m×250 μm×0.25 μm, J & W Scientific, Folsom, CA, USA), 选择最佳的GC-MS操作条件:柱箱采用程序升温模式: 50 ℃ (1 min), 50~310 ℃线性升温(20 ℃·min-1), 310 ℃ (6 min); 进样口温度: 280 ℃; 溶剂延迟时间4.75 min。其他参数同肺组织所用参数。
色谱图处理 使用ChromaTOF软件(V 4.3x, LECO)对质谱数据进行了峰提取、基线矫正、解卷积、峰积分、峰对齐等分析。在物质定性工作中, 使用了LECO-Fiehn Rtx5数据库, 包括质谱匹配及保留时间指数匹配[12]。最后将QC样本中检出率50%以下或RSD > 30%的峰去除[13]。
多源数据分析 为了更好地分析数据, 对原始数据进行一系列的准备和整理, 主要包括基于四分位数距对偏离值进行过滤, 对单个Peak进行过滤以去除噪音。只保留单组空值不多于50%或所有组中空值不多于50%的峰面积数据, 对单个Peak进行过滤。对原始数据中的缺失值用最小二分之一法进行模拟填补空缺值, 利用内标归一化法对数据进行标准化处理[13], 在获得整理好的数据之后, 对其进行一系列的多元变量模式识别分析, 导入SIMCA V14.1 (Umetric, Sweden)软件, 进行主成分分析(principal component analysis, PCA)、偏最小二乘法-辨别分析(orthogonal partial least squares projection to latent structures and discriminant analysis, OPLS-DA)[14, 15]。通过OPLS-DA模型筛选其中变量投影重要度(variable importance in the projection, VIP)≥1的化合物。采用SPSS 21.0进行方差分析ANOVA, 以VIP≥1且P≤0.05显著性为标准确定差异代谢物[16, 17]。
结果 1 PH模型建立成功比格犬饲养10周后右心导管测定及血液检测指标结果如表 1所示, PH模型比格犬肺动脉平均压(43.28 ± 9.01) mmHg均高于正常范围的上限, 判断建模成功, 并且t检验后比较结果表明显著高于健康对照组(P < 0.05和0.01), 给予sGC003化合物组恢复至正常水平。
| Table 1 Mean pressure of pulmonary artery (mPAP) and RVI levels of group C, M and MHM. RVI: Right ventricular index; C: Control group; M: Pulmonary hypertension model group; MHM: Model group given high dose sGC003 compound (4, 6-diamino-2-[1-(3-fluorothiophen-2-yl)methyl-1H-pyrazolo[3, 4-b]pyridin-3-yl]-5-pyrimidinyl-N-methyl methyl carbamate) |
使用PCA方法对3组血清GC-TOF-MS结果进行分析, 得到PCA的三维得分图(图 1)。图中可以清晰地看出QC样品聚类良好, 说明本次实验数据质量好, 同时健康对照组、模型组和给药组能够清晰地区分开, 同组间的样品紧密地聚集成簇, 提示3组血清代谢物存在差异。
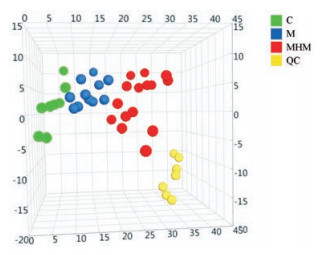
|
Figure 1 PCA scatter plot of serum metabolites among QC, C, M, MHM groups in GC-TOF-MS. QC: Quality control |
采用SIMCA 14.1进行OPLS-DA模式识别分析R2Y=0.967, Q2=0.263 (图 2a), 由图 2可见, 模型组和健康对照组可以明显分离, 说明两组间代谢物发生明显改变, 模型置换检验截距: 0.929, 结果也表明原模型稳健性良好, 不存在过拟合现象(图 2b)。在模型基础上选择VIP≥1的差异变量作为候选的潜在标志物。采用SPSS 21软件进行ANOVA分析, 筛选出存在显著性差异的化合物(P < 0.05)。两者取交集得到15个差异代谢物见表 2。Fold Change > 1表明M组与C组相比较代谢物上调, Fold Change < 1则为下调。
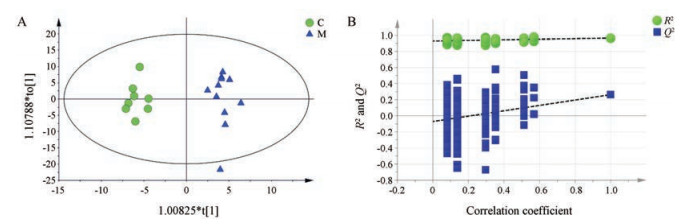
|
Figure 2 OPLS-DA score plots (A) of serum metabolites and permutation test plots (B) for OPLS-DA model validation between C and M groups in GC-TOF-MS |
| Table 2 Identification and trends of potential biomarkers. a Potential biomarkers in GC-TOF-MS; b Change trends of potential biomarkers in M compares with C groups. The levels of potential biomarkers were marked with (↓) down-regulated or (↑) up-regulated |
将上述筛选得到的15个内源性代谢物导入MetaboAnalyst 4.0中进行代谢通路分析, 其涉及乙醛酸和二羧酸代谢、柠檬酸循环和淀粉及蔗糖代谢通路3条路径(图 3)。
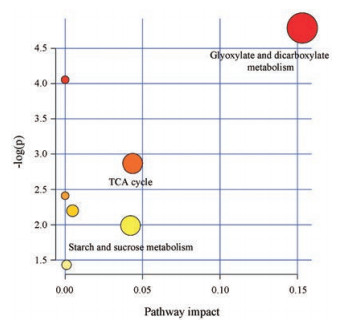
|
Figure 3 Metabolomic pathway analysis overview with MetaboAnalyst 4.0 |
运用SPSS 21软件对血清代谢物的相对峰面积进行ANOVA两两比较, 如表 3所示, 与健康对照组相比, PH模型比格犬代谢异常, 通过给予SGC003化合物干预后呈现恢复趋势或恢复至正常水平的代谢物, 包括:葡萄糖、果糖-2, 6-二磷酸、麦芽糖、D-阿糖醇、1-棕榈酸单甘油酯、刀豆氨酸、磷酸盐; 与健康对照组相比, PH模型组比格犬体内下降而经sGC003化合物治疗后下降更为显著的代谢物:花生四烯酸、甘氨酸、甲基顺丁烯二酸、戊二酸; 与健康对照组相比, PH模型组比格犬体内上升而治疗后上升显著的代谢物:十六烷、正缬氨酸、胸腺嘧啶苷。
| Table 3 Endogenous serum metabolites of C, M, MHM groups in GC-TOF-MS. Mean×10-3. *P < 0.05 vs C |
本研究成功建立了脱氢野百合碱诱导的肺动脉高压比格犬模型GC-TOF-MS代谢组学分析方法, 并利用代谢组学技术发现了比格犬PH模型潜在的差异代谢物以及涉及到的乙醛酸和二羧酸代谢、柠檬酸循环和淀粉及蔗糖代谢通路的紊乱。其中糖类代谢在肺动脉高压血管重构过程中有着很重要的作用, 本研究中肺动脉高压比格犬模型组与健康对照组相比, 葡萄糖、果糖-1, 6-二磷酸等糖类内源性代谢物均显著降低, 机体淀粉和蔗糖代谢以及柠檬酸循环代谢通路均发生紊乱, 即表现出了“Warburg”效应, 与相关研究规律相符[18-22]。
通过给予SGC003化合物干预后部分代谢物如葡萄糖、果糖-2, 6-二磷酸、麦芽糖等呈现恢复趋势或恢复至正常水平, 提示sGC003化合物对PH模型组机体代谢紊乱具有一定的药效作用。除此之外, 与健康对照组相比, PH模型组比格犬体内代谢物有改变, 而经过sGC003化合物治疗后改变更为显著, 提示sGC003化合物在一定程度上也影响着机体的正常代谢水平。
近年来随着PH发病机制的深入研究, 靶向治疗药物也层出不穷, 本研究探讨PH新型靶向治疗化合物SGC003干预后, PH比格犬代谢特征的改变, 给药组与模型组和健康对照组比较后存在差异, ANOVA统计分析结果提示给予sGC003化合物对肺动脉高压疾病比格犬的异常代谢物具有调节作用, 同时也一定程度上改变了正常机体内源性代谢物。更为全面深入地理解了PH的代谢改变及创新药物sGC003化合物的调节作用, 为代谢组学应用于肺动脉高压的早期诊断奠定了基础, 为sGC003化合物的应用提供依据。
| [1] | Grimminger F, Weimann G, Frey R, et al. First acute haemodynamic study of soluble guanylate cyclase stimulator riociguat in pulmonary hypertension[J]. Eur Respir J, 2009, 33: 785–792. DOI:10.1183/09031936.00039808 |
| [2] | Hoeper MM, McLaughlin VV, Dalaan AM, et al. Treatment of pulmonary hypertension[J]. Lancet Respir Med, 2016, 4: 323–336. DOI:10.1016/S2213-2600(15)00542-1 |
| [3] | Wang J, Cheng AQ, Wang C. Interpretation of 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension[J]. Natl Med J China (中华医学杂志), 2016, 96: 1784–1786. |
| [4] | Shi WH, Huang W, Cai L. Prospect of new treatment for pulmonary arterial hypertension[J]. Adv Cardiovasc Dis (心血管病学进展), 2017, 38: 57–59. |
| [5] | Stasch JP, Pacher P, Evgenov OV. Soluble guanylate cyclase as an emerging therapeutic target in cardiopulmonary disease[J]. Circulation, 2011, 123: 2263–2273. DOI:10.1161/CIRCULATIONAHA.110.981738 |
| [6] | Goldsmith P, Fenton H, Morris-Stiff G, et al. Metabonomics:a useful tool for the future surgeon[J]. J Surg Res, 2010, 160: 122–132. DOI:10.1016/j.jss.2009.03.003 |
| [7] | Amberg A, Riefke B, Schlotterbeck G, et al. NMR and MS methods for metabolomics[J]. Methods Mol Biol, 2017, 1641: 229–258. |
| [8] | Nicholson JK, Timbrell JA, Sadler PJ. Proton NMR spectra of urine as indicators of renal damage. Mercury-induced nephrotoxicity in rats[J]. Mol Pharmacol, 1985, 27: 644–651. |
| [9] | Guan LH, Li MF, Zhou DX, et al. Effect of sodium ferulate in attenuating monocrotaline induced pulmonary hypertension in early stage[J]. Shanghai Med J (上海医学), 2014, 37: 694–696. |
| [10] | Chen DD. Treatment of Atorvastatin on Dehydromonocrotalineinduced Pulmonary Hypertension Beagles and Its Mechanism (阿托伐他汀治疗早期脱氢野百合碱诱导肺动脉高压犬模型及其机制)[D]. Shanghai: Fudan University, 2011. |
| [11] | Zhu D, Jiang ZZ, Zhang LY. Research progress on the mechanism of monocrotaline-induced pulmonary hypertension[J]. Cent South Pharm (中南药学), 2011, 9: 456–459. |
| [12] | Kind T, Wohlgemuth G, Lee DY, et al. FiehnLib:mass spectral and retention index libraries for metabolomics based on quadrupole and time-of-flight gas chromatography/mass spectrometry[J]. Anal Chem, 2009, 81: 10038–10048. DOI:10.1021/ac9019522 |
| [13] | Dunn WB, Broadhurst D, Begley P, et al. Procedures for large-scale metabolic profiling of serum and plasma using gas chromatography and liquid chromatography coupled to mass spectrometry[J]. Nat Protoc, 2011, 6: 1060–1083. DOI:10.1038/nprot.2011.335 |
| [14] | Wiklund S, Johansson E, Sjostrom L, et al. Visualization of GC/TOF-MS-based metabolomics data for identification of biochemically interesting compounds using OPLS class models[J]. Anal Chem, 2008, 80: 115–122. DOI:10.1021/ac0713510 |
| [15] | Nitta K, Lavina WA, Pontrelli S, et al. Orthogonal partial least squares/projections to latent structures regression-based metabolomics approach for identification of gene targets for improvement of 1-butanol production in Escherichia coli[J]. J Biosci Bioeng, 2017, 124: 498–505. DOI:10.1016/j.jbiosc.2017.05.015 |
| [16] | Rosato A, Tenori L, Cascante M, et al. From correlation to causation:analysis of metabolomics data using systems biology approaches[J]. Metabolomics, 2018, 14: 37. DOI:10.1007/s11306-018-1335-y |
| [17] | Saccenti E, Smilde AK, Camacho J. Group-wise ANOVA simultaneous component analysis for designed omics experiments[J]. Metabolomics, 2018, 14: 73. DOI:10.1007/s11306-018-1369-1 |
| [18] | Zhao Y, Peng J, Lu C, et al. Metabolomic heterogeneity of pulmonary arterial hypertension[J]. PLoS One, 2014, 9: e88727. DOI:10.1371/journal.pone.0088727 |
| [19] | Peng H, Xiao Y, Deng X, et al. The Warburg effect:a new story in pulmonary arterial hypertension[J]. Clin Chim Acta, 2016, 461: 53–58. DOI:10.1016/j.cca.2016.07.017 |
| [20] | Smolders VF, Zodda E, Quax PHA, et al. Metabolic alterations in cardiopulmonary vascular dysfunction[J]. Front Mol Biosci, 2018, 5: 120. |
| [21] | Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect:the metabolic requirements of cell proliferation[J]. Science, 2009, 324: 1029–1033. DOI:10.1126/science.1160809 |
| [22] | Kolb TM, Damico RL, Hassoun PM. Linking new and old concepts:inflammation meets the Warburg phenomenon in pulmonary arterial hypertension[J]. J Mol Med (Berl), 2011, 89: 729–732. DOI:10.1007/s00109-011-0783-x |
 2019, Vol. 54
2019, Vol. 54


