2. 皖南医学院解剖学教研室, 安徽 芜湖 241002;
3. 皖南医学院法医学实验中心, 安徽 芜湖 241002;
4. 皖南医学院生物化学与分子生物学教研室, 安徽 芜湖 241002
2. Department of Anatomy, Wannan Medical College, Wuhu 241002, China;
3. Department of Forensic Medicine, Wannan Medical College, Wuhu 241002, China;
4. Department of Biochemistry and Molecular Biology, Wannan Medical College, Wuhu 241002, China
肝细胞癌(hepatocellular carcinoma, HCC)是全球最常见的恶性肿瘤之一, 在亚洲和南非具有高发病率[1], 我国肝癌患者的数量占全世界的55%。原发性肝癌恶性程度高, 易侵袭、转移及复发, 且预后差, 死亡率一直居高不下[2], 因此, 寻找和发现高效、低毒、易得的抗肝癌药物迫在眉睫。
细胞增殖失控和细胞凋亡机制受损在肝细胞肝癌的发生和发展过程中发挥着关键的作用。细胞凋亡, 又称程序性细胞死亡, 维持着多细胞生物体内存活/死亡之间的动态平衡。细胞凋亡通过激活内源性或外源性途径, 最终由凋亡相关蛋白执行, 包括细胞色素-c (cytochrome-c)的释放和caspase-3的活化(产生切割的caspase-3)[3]。细胞凋亡的特征性形态改变包括细胞皱缩、染色体凝聚和DNA的片段化[4]。细胞凋亡途径受到机体的严格调控, 而细胞凋亡机制的缺陷导致癌细胞对治疗产生抵抗和促进癌症的进展。
肿瘤转移是由癌细胞从原发肿瘤向靶器官的运动引起的, 是多种因素参与其各个环节的复杂过程[5]。最近的研究表明, 癌细胞的转移与迁移和侵袭能力密切相关。上皮细胞-间充质转化(epithelial-mesenchymal transition, EMT)通过诱导癌细胞迁移和侵袭, 是促进癌症转移和进一步发展的重要机制[6]。在迁移的过程中, 上皮细胞逐渐获得成纤维细胞特性, 包括下调E-钙黏蛋白(E-cadherin, 上皮标志物), 上调N-钙黏蛋白(N-cadherin, 间充质标记物)[7]。围绕原发肿瘤的细胞外基质和基底膜成分(extracellular matrix, ECM)的降解是癌细胞迁移和入侵的必需条件[8]。在MMP家族的20多个成员中, 基质金属蛋白酶(matrix metalloproteinase, MMP)-2/9是基底膜降解过程中最关键的蛋白酶[9, 10]。抑制MMP-2和MMP-9的表达和活性, 已被证实可以有效防止癌细胞的迁移和侵袭[11]。
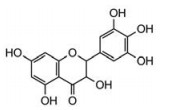
二氢杨梅素(3, 5, 7, 3'4'5'-六羟基-2, 3-二氢黄酮醇, ampelopsin, AMP, 图 1)又名双氢杨梅树皮素、福建茶素、白蔹素、蛇葡萄素等, 是植物中黄酮类化合物的重要一员[12, 13]。该化合物首次由Kotake和Kubota于1940年从葡萄科蛇葡萄属植物福建茶即楝叶玉葡萄A. Meliaefolia的叶中分离获得, 命名为蛇葡萄素[14-16]。1996年周天达等[17]从藤茶的茎叶中再次分离得到该化合物, 并命名为AMP。据报道, 蛇葡萄素具有多种药理活性, 如抗炎和抗菌活性、缓解咳嗽、抗氧化、抗高血压、保肝作用和抗癌作用[18-20]。本课题组的前期研究结果证实, 双氢杨梅素调控ERK1/2和P38的活性, 分别通过死亡受体途径和线粒体途径诱导人肝癌HepG2细胞凋亡[21]。Zhang等[22]证实AMP通过增加PKC-δ的蛋白表达, 抑制丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)的磷酸化, 减少MMP-9的表达, 阻止肝癌细胞SK-Hep-1和MHCC97L的迁移和侵袭。据文献报道, AMP亦可通过降低血管内皮生长因子和成纤维细胞生长因子的表达和释放, 抑制肝细胞癌的血管生成[23, 24]。本课题组在研究中发现, 不同分化程度和侵袭潜能的肝癌细胞株, 对AMP的敏感度不同, 而AMP发挥作用的具体分子机制亦不尽相同。SMMC-7721人肝癌细胞株属于中等分化耐药型细胞株, AMP对其是否具有抑制增殖和迁移的作用, 尚未见文献报道。
|
Figure 1 Chemical structure of ampelopsin (AMP) |
综上所述, 二氢杨梅素在肝癌发生发展的多个环节, 均能发挥抑制作用, 而且AMP来源丰富, 在植物中含量非常高, 安全无毒, 具有极高的肝癌治疗的潜能。目前, AMP对人肝癌SMMC-7721细胞系的作用, 尚未见报道。本研究拟证实AMP能够抑制SMMC-7721细胞增殖, 诱导其凋亡, 阻止细胞的迁移和侵袭, 并进一步阐明其分子机制, 为将AMP研制为临床抗肝癌药物提供实验支持和理论依据。
材料和方法主要试剂 二氢杨梅素(阿拉丁生物试剂公司), 溶解于二甲基亚砜(DMSO), 储备液浓度为100 g·L-1, 使用时用培养基稀释至工作浓度; CCK-8细胞活力/毒性试剂盒和Annexin Ⅴ-FITC/PI双染试剂盒购自南京凯基生物科技发展有限公司; p-JNK、p-ERK、p-P38MAPKs、E-cadherin、N-cadherin、MMP-2和MMP-9抗体均购自Santa Cruz公司; PARP、Caspase-3和β-actin购自CST公司。DAPI购自Sigma公司。HRP山羊抗兔二抗和HRP山羊抗鼠二抗购自上海碧云天生物技术有限公司。
细胞株和细胞培养 本研究选用的人肝癌SMMC-7721细胞株购自中国科学院典型培养物保藏委员会细胞库。用含10%胎牛血清(FBS, Hyclone公司)和抗生素(1×105 u·L-1青霉素和100 mg·L-1链霉素)的1640培养液(Gibco公司), 放置于37 ℃含5% CO2培养箱中培养, 取对数生长期细胞用于实验。
CCK-8法 SMMC-7721细胞提前24 h接种于96孔板, 细胞密度为2×104个/孔。待细胞贴壁后用不同浓度的AMP (0、12.5、25、50、75、100和150 μg·mL-1)处理细胞24 h, 同时设置溶剂对照组和空白调零孔, 每组设5个重复孔。弃尽培养液, 每孔加入含有CCK-8 (10 μL)的无血清1640培养基, 37 ℃避光继续培养2 h, 在波长450 nm处测定每孔的OD值。细胞存活率按照下面公式计算:
| $ 细胞存活率\left( \% \right) = \frac{{\left( {实验组{\rm{OD}}值 - 空白调零孔{\rm{OD}}值 } \right)}}{{\left( {空白对照组{\rm{OD}}值 - 空白调零孔{\rm{OD}}值} \right)}} $ |
细胞划痕实验 将伤口愈合2孔硅胶插件(德国Ibidi公司)放置于12孔板中, 将细胞接种于插件的2个孔中, 待细胞完全长满后拔取插件获得宽度一致的划痕, 用PBS溶液冲洗3次, 去除未贴壁的细胞, 加入含10%胎牛血清的1640培养液。用不同浓度的AMP (0、12.5、25和50 μg·mL-1)处理细胞、同时设置溶剂对照组, 置于37 ℃含5% CO2的培养箱中继续培养。分别在0、24、48和72 h倒置显微镜下采集图像。
细胞迁移实验 将细胞悬液和不同浓度的AMP (0、12.5、25和50 μg·mL-1)混匀加入24孔Transwell插件中(每个插件200 μL), 在24孔板的每个孔中加入600 μL含20%胎牛血清的1640培养基, 在5% CO2、37 ℃条件下孵育24 h, 弃去小室内的培养基, 用PBS清洗细胞, 用4%多聚甲醛固定20 min, PBS清洗, 结晶紫染色30 min, 弃去结晶紫, 用PBS洗3遍, 然后用镊子轻轻将滤膜放在玻片上。倒置显微镜下观察细胞外膜, 随机选取5个位置计算细胞平均数。
克隆形成实验 将细胞接种到6孔板中, 细胞接种密度为500~1 000个/孔, 细胞贴壁后加入不同浓度的AMP处理, 在37 ℃、5% CO2的培养箱中培养1周, 细胞集落数大于20个时, PBS清洗1遍, 用4%多聚甲醛固定集落30 min, PBS洗3遍, 用0.1%结晶紫染色, PBS清洗细胞后, 用倒置显微镜进行计数和拍照。
DAPI染色 用不同浓度的AMP处理24 h, 待12孔板中的细胞基本融合后, 用PBS清洗细胞, 4%多聚甲醛固定30 min, PBS清洗3遍, DAPI避光染色5 min, PBS洗3遍, 使用荧光显微镜观察细胞并拍摄。
细胞凋亡分析 细胞接种于12孔板(2×105个/孔), 用不同浓度AMP处理细胞24 h后, 离心收集细胞, PBS清洗后, 加入500 μL Binding buffer制成单细胞悬液, 用Annexin Ⅴ-FITC和PI避光染色15 min, 通过流式细胞仪进行检测并分析结果(BD公司)。
免疫印迹实验 用含蛋白酶抑制剂的裂解液, 收集各组细胞裂解物。在冰上孵育30 min后, 离心收上清, BCA法测定样品蛋白质浓度。取等量蛋白质用10% SDS-PAGE凝胶分离, 然后转移到硝酸纤维素膜(NC)上, 在含0.1%吐温的1×TBST配制的脱脂牛奶中室温封闭1 h, 用PBS清洗3遍后, 在4 ℃条件下加入一抗孵育过夜, 用PBS清洗3遍, 加入HRP标记的二抗, PBS清洗3遍, 用化学发光试剂使蛋白可视化, Image J分析结果。
统计学分析 实验数据均用均数±标准差表示。采用GraphPad Prism6软件对实验数据进行处理, 组间比较采用单因素方差分析(ANOVA), P < 0.05表示差异有统计学意义。
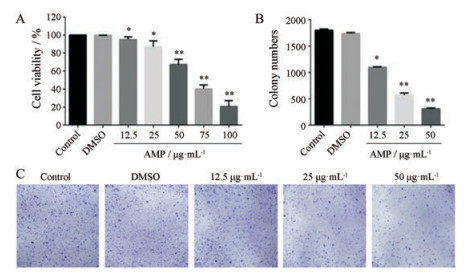
结果 1 AMP抑制SMMC-7721细胞增殖和集落形成为了探讨AMP对SMMC-7721细胞增殖的潜在影响, 用不同浓度的AMP (0、12.5、25、50、75和100 μg·mL-1)处理SMMC-7721细胞24 h, 用CCK-8法检测细胞活力值。结果表明, AMP能显著抑制SMMC-7721细胞的增殖并呈剂量依赖性, 24 h的半数有效抑制浓度(IC50)为38.98 μg·mL-1 (图 2A)。根据CCK-8法的实验结果, 将12.5、25和50 μg·mL-1作为后续实验的低、中、高剂量组。此外, 集落形成实验证实, AMP能有效地降低SMMC-7721细胞的集落形成, 在50 μg·mL-1组细胞克隆形成显著减少(图 2B)。
|
Figure 2 AMP inhibited SMMC-7721 cells proliferation. A: SMMC-7721 cells were treated with the indicated concentrations of AMP for 24 h, cell viability was determined by CCK-8 assay. n = 5, x ± s. B, C: SMMC-7721 cells were treated with the indicated concentrations of AMP for a week, colony formation assay detected the effect of AMP on the cell proliferation ability. n = 3, x ± s. *P < 0.05, **P < 0.01 vs control |
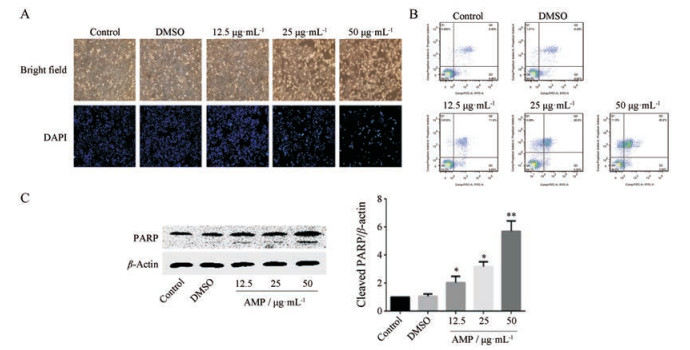
分别用0、12.5、25和50 μg·mL-1 AMP处理SMMC-7721细胞, 光镜下观察各组细胞, 对照组SMMC-7721细胞轮廓清晰, 贴壁牢固, 折光度好, 呈铺路石状生长。AMP处理后, 细胞贴壁不牢, 细胞皱缩, 悬浮细胞增多(图 3A)。DAPI染色后, 对照组细胞核呈均匀蓝染; AMP处理组细胞核浓缩, 呈蓝色高亮, 细胞核发生裂解(图 3A)。流式细胞术检测结果表明, AMP能够显著诱导SMMC-7721细胞凋亡, 对照组和溶剂对照组细胞凋亡率分别为15.0%和11.4%, AMP低、中和高剂量组细胞凋亡率分别为12.9%、30.9%和55.1% (图 3B)。Western blot结果证实, AMP显著增加PARP的切割(图 3C)。
|
Figure 3 AMP induced apoptosis in SMMC-7721. A: Cell morphology was observed using an invert microscope, nuclear morphological changes were measured by DAPI stain and observed under a fluorescent microscope; B: Cell apoptosis was measured by Annexin Ⅴ and propidium iodide (PI) stain and then detected by flow cytometry; C: Cell lysates were prepared and subjected to Western blot by using PARP antibody. Detection of β-actin was done to confirm the equal loading of the samples. n = 3, x ± s. *P < 0.05, **P < 0.01 vs control |
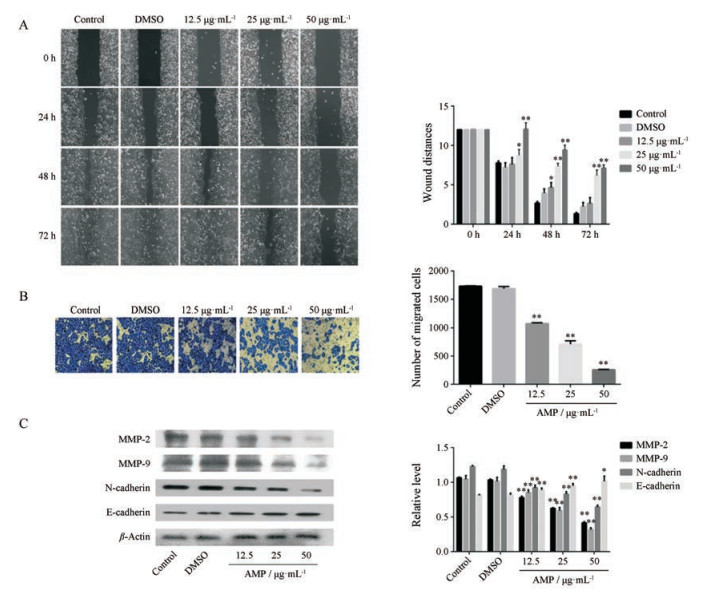
进一步探究了AMP对SMMC-7721细胞迁移能力的影响。如图 4A所示, 对照组72 h后, 划痕已经基本愈合, 不同浓度的AMP均能显著抑制SMMC-7721细胞的迁移。统计划痕愈合面积表明, 在24、48和72 h三个检测时间点, AMP实验组与对照组相比, 均有显著性差异。此外, Transwell染色结果显示AMP实验组的穿膜细胞数明显少于对照组(图 4B)。本课题组进一步探讨了迁移相关蛋白MMP-2、MMP-9、E-cadherin和N-cadherin的表达。如图 4C所示, AMP预处理24 h后, MMP-2、MMP-9和N-cadherin的蛋白水平显著下调, E-cadherin的表达明显上调。因此, AMP通过调节相关迁移蛋白的表达量, 有效地抑制SMMC-7721细胞的迁移和侵袭。
|
Figure 4 AMP suppressed SMMC-7721 cell migration and invasion. SMMC-7721 cells were treated with AMP (12.5, 25 and 50 μg·mL-1) for indicated time. A: Cell migration rate was detected by cell scratch test; B: Cell invasion rate was detected by Transwell invasion experiment; C: Protein extracts were prepared and subjected to Western blot assay using antibody against MMP-2, MMP-9, N-cadherin and E-cadherin. Protein levels of β-actin were also measured as control. n = 3, x ± s. *P < 0.05, **P < 0.01 vs control |
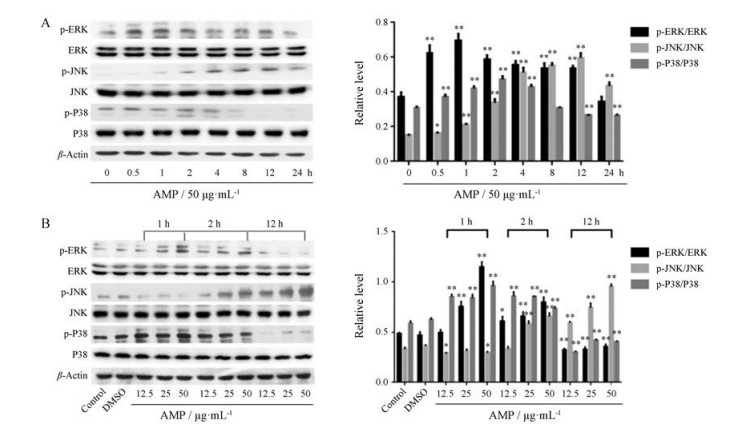
大量的研究发现, MAPKs信号通路参与调控肝癌细胞的迁移和侵袭[25]。本研究首先用AMP (50 μg·mL-1)处理SMMC-7721细胞, 如图 5A所示, ERK磷酸化在1 h达到峰值, 24 h基本恢复本底水平; JNK的最大活化时间在12 h, 24 h开始下降; P38在4 h内被AMP激活, 2 h磷酸化水平最高, 4 h后AMP反而抑制了P38的磷酸化, 抑制作用一直持续到24 h。接着用不同浓度的AMP (12.5、25和50 μg·mL-1)分别处理细胞1、2和12 h, 结果同时间梯度, ERK和JNK分别在1 h和12 h活化最强, P38在1 h和2 h被激活, 在12 h磷酸化被抑制。另外, 随着AMP浓度的增加, MAPKs的磷酸化水平呈现浓度梯度依赖性(图 5B)。AMP可能通过调控MAPKs信号分子, 调节相关蛋白的表达水平, 从而抑制SMMC-7721细胞增殖, 诱导细胞凋亡, 抑制细胞迁移和侵袭。
|
Figure 5 AMP regulated MAPKs signal pathway. A: SMMC-7721 cells were treated with 50 μg·mL-1 AMP for indicated time; B: SMMC-7721 cells were pretreated with (12.5, 25, 50 μg·mL-1) AMP for (1, 2, 12 h), respectively. Protein extracts were prepared and subjected to Western blot assay using antibody against p-ERK, p-JNK and p-P38. Protein levels of total MAPKs were also measured as control. n = 3, x ± s. *P < 0.05, **P < 0.01 vs control |
中草药藤茶(Ampelopsis grossedentata)广泛分布于华南地区, 是一种保健饮料, 主要用于治疗感冒和体癣。双氢杨梅素作为藤茶中的主要生物活性成分, 与其具有多种药理作用直接相关。双氢杨梅素与杨梅素[3, 5, 7-三羟基-2-(3, 4, 5-三羟基苯基)-4-苯并吡喃酮]具有相似的结构, 后者是广泛存在于葡萄、浆果、水果、蔬菜和草药中的黄酮类化合物, 具有一定的抗癌活性。据文献报道, AMP能够抑制人肝细胞癌细胞的血管内皮生长因子(VEGF)的分泌, 发挥抗血管生成活性, 在小鼠体内亦能抑制肝细胞癌的增殖[23]。课题组前期研究表明AMP能够通过内源性和外源性凋亡通路诱导人肝癌细胞系HepG2细胞凋亡[26]。本文证实AMP能够显著抑制人肝癌细胞系SMMC-7721细胞增殖和细胞集落的形成。不同浓度的AMP均能够有效诱导细胞凋亡, SMMC-7721细胞出现典型的凋亡形态改变(细胞皱缩、贴壁不牢、漂浮、细胞核浓缩、裂解, 呈现DAPI高亮染色区), 细胞凋亡率显著增加, PARP切割增多。因此, AMP能够通过抑制SMMC-7721细胞增殖, 诱导其凋亡, 发挥抗癌活性。
肿瘤转移作为恶性肿瘤的主要标志, 是导致癌症患者高死亡率的首要原因。肿瘤细胞迁移是肿瘤转移的必要条件, 是涉及肿瘤细胞黏附、基质降解和迁移运动等多个环节的复杂生物学行为[27, 28]。大量的研究结果表明, 肿瘤细胞的迁移速度越快, 肿瘤转移能力越强, 其恶性程度越高。本研究结果证实, AMP能够有效降低SMMC-7721细胞划痕愈合距离, 50 μg·mL-1组在72 h和对照组相比, 抑制率达到82.6%。Transwell小室中, 穿过基底膜的细胞数在AMP处理组中均显著减少, 在50 μg·mL-1组迁移细胞数仅有对照组的15%左右。因此, AMP能够有效抑制SMMC-7721细胞的迁移和侵袭。另外, AMP作用SMMC-7721细胞后, 上皮标志物E-cacherin表达量增加, 而间充质标志物N-cadherin表达量减少, 表明SMMC-7721细胞出现“钙黏蛋白转换”, 这一现象是判断EMT发生的关键性标志[29]。EMT在肿瘤的侵袭性生长发生过程中扮演着重要角色, 而发生EMT改变的肿瘤细胞最重要的行为改变是迁移和侵袭能力的增强, 本研究的划痕实验和Transwell小室实验结果也进一步证实了这一点。细胞外基质(extracellular matrix, ECM)由基底膜和细胞间质组成, 为肿瘤转移的重要组织屏障。MMPs是蛋白水解酶家族, 具有许多重要的生理功能, 包括ECM修饰、加速细胞迁移和切割细胞因子[30]。在MMP家族中, MMP-2/9被报道为底物特异性明胶酶, 这对ECM降解至关重要[31, 32]。MMP-2/9水平上调与各种类型癌症的侵袭、转移和预后不良密切相关[33]。因此, 抑制MMP-2/9的表达, 是预防癌细胞侵袭的重要策略[34]。在本研究中, AMP预处理SMMC-7721细胞24 h后, MMP-2和MMP-9的表达水平显著下降。
MAPKs信号通路由4个不同的级联组成, 目前鉴定的主要成员有:胞外信号相关激酶1/2 (ERK1/2)、c-Jun氨基末端激酶(JNK/SAPK)、P38MAPK和ERK5, 它们与细胞增殖、分化、迁移、衰老和凋亡有关[35]。研究证实, MAPKs在诱导蛋白酶水解、降解基底膜和促进细胞迁移以及启动促生存基因、维持肿瘤生长中发挥着关键作用。在多种人类肿瘤中检测到MAPKs的过度激活, 提示可能在肿瘤发展和转移中扮演重要角色[36, 37]。在转移细胞中, ERK的活性显著高于非转移细胞[25]。在多种蛋白水解酶的启动子中, 例如MMP-1和MMP-9等具有AP-1共有序列[38, 39]。本研究发现, 在SMMC-7721细胞中, ERK1/2、JNK和P38均能被不同浓度的AMP激活, 且活化时间并不完全相同, 提示MAPKs信号通路参与AMP调控肿瘤细胞增殖、凋亡和迁移, 但具体的调控机制以及ERK1/2、JNK和P38的作用是否相同, 还需要进一步的验证。
综上所述, AMP能够有效抑制人肝癌细胞系SMMC-7721的增殖, 诱导其发生细胞凋亡, 并且显著抑制SMMC-7721细胞的迁移和侵袭, 调控相关蛋白MMP-2/9、E-cadherin和N-cadherin的表达。另外, AMP作用后, MAPKs的3个主要成员ERK1/2、JNK和P38均被显著激活。因此, AMP可能通过调控MAPKs信号通路发挥抗肝癌作用, 具有开发为抗肝癌治疗药物的潜能。本文为拓宽AMP的临床用药范围和解析AMP的药理机制提供了一些实验依据和理论参考。
| [1] | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132: 2557–2576. DOI:10.1053/j.gastro.2007.04.061 |
| [2] | Comijn J, Berx G, Vermassen P, et al. The two-handed E box binding zinc finger protein SIP1 downregulates E-cadherin and induces invasion[J]. Mol Cell, 2001, 7: 1267–1278. DOI:10.1016/S1097-2765(01)00260-X |
| [3] | Lossi L, Castagna C, Merighi A. Caspase-3 mediated cell death in the normal development of the mammalian cerebellum[J]. Int J Mol Sci, 2018. DOI:10.3390/ijms19123999 |
| [4] | Hassan M, Watari H, AbuAlmaaty A, et al. Apoptosis and molecular targeting therapy in cancer[J]. Biomed Res Int, 2014, 2014: 150845. |
| [5] | Fitzmorris P, Shoreibah M, Anand BS, et al. Management of hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2015, 141: 861–876. DOI:10.1007/s00432-014-1806-0 |
| [6] | Thiery JP. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer, 2002, 2: 442–454. DOI:10.1038/nrc822 |
| [7] | Liu JB, Qi M, Li QQ, et al. The mechanism of cordycepin in inhibition of pancreatic cancer stem cells proliferation and metastasis[J]. Acta Pham Sin (药学学报), 2017, 52: 1404–1409. |
| [8] | Singh D, Srivastava SK, Chaudhuri TK, et al. Multifaceted role of matrix metalloproteinases (MMPs)[J]. Front Mol Biosci, 2015, 2: 19. |
| [9] | Alexander SP, Benson HE, Faccenda E, et al. The concise guide to pharmacology 2013/14: enzymes[J]. Br J Pharmacol, 2013, 170: 1797–1867. DOI:10.1111/bph.12451 |
| [10] | Yang SF, Chen MK, Hsieh YS, et al. Antimetastatic effects of Terminalia catappa L. on oral cancer via a down-regulation of metastasis-associated proteases[J]. Food Chem Toxicol, 2010, 48: 1052–1058. DOI:10.1016/j.fct.2010.01.019 |
| [11] | Yang F, Yu N, Wang H, et al. Downregulated expression of hepatoma-derived growth factor inhibits migration and invasion of prostate cancer cells by suppressing epithelial-mesenchymal transition and MMP2, MMP9[J]. PLoS One, 2018, 13: e0190725. DOI:10.1371/journal.pone.0190725 |
| [12] | Sun WJ, Shen JF. Natural Active Ingredients Concise Manual (天然活性成分简明手册)[M]. Beijing: China Medical Science Press, 1998: 564. |
| [13] | Jiang JW, Xiao QX. Botanical Active Ingredient Handbook (植物活性成分手册)[M]. Beijing: National Medicine Administration China Herbal Medicine Information Center, 1986: 1301. |
| [14] | Institute of Materia Medica Chinese Academy of Medical Sciences. Chinese Medicine (中药志)[M]. Beijing: People's Health Publishing House, 1979: 367-369. |
| [15] | Lin QS. Chinese Herbal Medicine Chemistry (中草药成分化学)[M]. Beijing: Science Press, 1977: 292-293. |
| [16] | Laboratory of Plant Chemistry, Shanghai Institute of Materia Medica, Chinese Academy of Sciences. Flavonoid Compound Identification Manual (黄酮体化合物鉴定手册)[M]. Beijing: Science Press, 1981: 655-656. |
| [17] | Zhou TD, Zhou XX. Isolation, structure determination and pharmacological activity of flavanonol from Ampelopsis grossedentata[J]. Chin Pharm J (中国药学杂志), 1996, 31: 458–461. |
| [18] | Liu JH, Gao SL, Zhu DN, et al. Studies on antibacterial activity of ampelopsin[J]. J China Pharm Univ (中国药科大学学报), 2002, 33: 439–441. |
| [19] | Zhang YS, Ning ZX, Yang SZ, et al. Antioxidation properties and mechanism of action of dihydromyricetin from Ampelopsis grossedentata[J]. Acta Pharm Sin (药学学报), 2003, 38: 241–244. |
| [20] | Zheng HQ, Liu DY. Anti-invasive and anti-metastatic effect of ampelopsin on melanoma[J]. Chin J Cancer (癌症), 2003, 22: 363–367. |
| [21] | Qi S, Kou X, Lv J, et al. Ampelopsin induces apoptosis in HepG2 human hepatoma cell line through extrinsic and intrinsic pathways: involvement of P38 and ERK[J]. Environ Toxicol Pharmacol, 2015, 40: 847–854. DOI:10.1016/j.etap.2015.09.015 |
| [22] | Zhang QY, Li R, Zeng GF, et al. Dihydromyricetin inhibits migration and invasion of hepatoma cells through regulation of MMP-9 expression[J]. World J Gastroenterol, 2014, 20: 10082–10093. DOI:10.3748/wjg.v20.i29.10082 |
| [23] | Luo GQ, Zeng S, Liu DY. Inhibitory effects of ampelopsin on angiogenesis[J]. J Chin Med Mater (中药材), 2006, 29: 146–150. |
| [24] | Gao QQ, Yang XF, Ou M. Effect of serum containing Tengcha total flavonoid and dihydromyricetin on proliferation and apoptosis of HepG2 cells[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 500–503. |
| [25] | Adeyinka A, Nui Y, Cherlet T, et al. Activated mitogen-activated protein kinase expression during human breast tumorigenesis and breast cancer progression[J]. Clin Cancer Res, 2002, 8: 1747–1753. |
| [26] | Qi S, Xin Y, Guo Y, et al. Ampelopsin reduces endotoxic inflammation via repressing ROS-mediated activation of PI3K/Akt/NF-κB signaling pathways[J]. Int Immunopharmacol, 2012, 12: 278–287. DOI:10.1016/j.intimp.2011.12.001 |
| [27] | Shen SL, Qiu FH, Dayarathna TK, et al. Identification of dermcidin as a novel binding protein of Nck1 and characterization of its role in promoting cell migration[J]. Biochim Biophys Acta, 2011, 1812: 703–710. DOI:10.1016/j.bbadis.2011.03.004 |
| [28] | Luo X, Zhao X, Cheng C, et al. The implications of signaling lipids in cancer metastasis[J]. Exp Mol Med, 2018, 50: 127. DOI:10.1038/s12276-018-0150-x |
| [29] | Li M, Bu X, Cai B, et al. Biological role of metabolic reprogramming of cancer cells during epithelial-mesenchymal transition[J]. Oncol Rep, 2019, 41: 727–741. |
| [30] | Elkington PT, Friedland JS. Matrix metalloproteinases in destructive pulmonary pathology[J]. Thorax, 2006, 61: 259–266. DOI:10.1136/thx.2005.051979 |
| [31] | Chen T, Li M, Zhang R, et al. Dihydroartemisinin induces apoptosis and sensitizes human ovarian cancer cells to carboplatin therapy[J]. J Cell Mol Med, 2009, 13: 1358–1370. DOI:10.1111/j.1582-4934.2008.00360.x |
| [32] | Androutsopoulos VP, Mahale S, Arroo RR, et al. Anticancer effects of the flavonoid diosmetin on cell cycle progression and proliferation of MDA-MB 468 breast cancer cells due to CYP1 activation[J]. Oncol Rep, 2009, 21: 1525–1528. |
| [33] | Hurst DR, Welch DR. Metastasis suppressor genes at the interface between the environment and tumor cell growth[J]. Int Rev Cell Mol Biol, 2011, 286: 107–180. DOI:10.1016/B978-0-12-385859-7.00003-3 |
| [34] | Hidalgo M, Eckhardt SG. Development of matrix metalloproteinase inhibitors in cancer therapy[J]. J Natl Cancer Inst, 2001, 93: 178–193. DOI:10.1093/jnci/93.3.178 |
| [35] | Sun Y, Liu WZ, Liu T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35: 600–604. DOI:10.3109/10799893.2015.1030412 |
| [36] | Sivaraman VS, Wang H, Nuovo GJ, et al. Hyperexpression of mitogen-activated protein kinase in human breast cancer[J]. J Clin Invest, 1997, 99: 1478–1483. DOI:10.1172/JCI119309 |
| [37] | Mueller H, Flury N, Eppenberger-Castori S, et al. Potential prognostic value of mitogen-activated protein kinase activity for disease-free survival of primary breast cancer patients[J]. Int J Cancer, 2000, 89: 384–388. DOI:10.1002/1097-0215(20000720)89:4<384::AID-IJC11>3.0.CO;2-R |
| [38] | Overall CM, Lopez-Otin C. Strategies for MMP inhibition in cancer: innovations for the post-trial era[J]. Nat Rev Cancer, 2002, 2: 657–672. DOI:10.1038/nrc884 |
| [39] | Mazumdar A, Adam L, Boyd D, et al. Heregulin regulation of urokinase plasminogen activator and its receptor: human breast epithelial cell invasion[J]. Cancer Res, 2001, 61: 400–405. |
 2019, Vol. 54
2019, Vol. 54


