随着我国药学领域科研水平的不断提高, 各学科交叉融合更加紧密, 中国天然产物研究在2018年取得了丰硕的研究成果, 继续保持了该领域的主导地位。2018年, 我国学者在Org Lett和J Nat Prod上分别发表了123个新颖骨架化合物和712个新化合物, 73个化合物被国际权威期刊Nat Prod Rep评为热点化合物。在研究发现的新天然产物中, 来源于陆地生物的化合物占据主要地位, 萜类及其聚合物是研究的重点和热点, 生物活性集中于抗肿瘤、抗炎、抗菌、神经保护等方面。本文以来源和生物活性作为主要的分类依据, 对2018年我国学者发表在国内外著名期刊的123个在结构或生物活性方面具有特点的天然产物进行简要概括, 以便读者了解2018年中国天然产物的研究亮点。
1 陆生动植物 1.1 抗肿瘤活性(细胞毒)从十字花科诸葛菜(Orychophragmus violaceus)种子中分离得到3个具有新颖2-哌嗪酮稠合2, 4-二羰基六氢-1, 3, 5-三嗪骨架的生物碱类化合物, 其中orychophragine A (1)具有明显的细胞毒性, 其抑制HepG2、A549、HeLa、HCT-116细胞IC50值分别为7.73、10.79、11.91、9.93 μmol·L-1[1]。Selaginedorffone B (2)是从卷柏科植物卷柏(Selaginella moellendorffii)中分离得到的松香烷型二萜二聚体, 其对MCF-7人乳腺癌细胞系具有较强的细胞毒性(IC50=9.0 μmol·L-1)[2]。从姜科植物圆瓣姜花(Hedychium forrestii)根茎中分离得到6、7位形成过氧桥的半日花烷型二萜hedychin B (3), 对HepG2和XWLC-05细胞的IC50值分别为8.0和19.7 μmol·L-1[3]。另一个由松香烷骨架演变具有7/5/6/3环系统的新颖二萜salviyunnanone A (4)从唇形科云南鼠尾草(Salvia yunnanensis)全草中被发现, 其对人体肿瘤细胞MCF-7、SMMC-7721、HL-60、SW480、A549具有较好的细胞毒活性(IC50=1.18、2.52、2.63、3.23、4.84 μmol·L-1)[4]。应用手性拆分从藤黄科大苞藤黄(Garcinia bracteata)叶中分离得到一系列笼状多异戊烯基取代的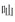
Nicotabaflavonoidglycoside (7)是从茄科植物烟草(Nicotiana tabacum)叶中分离得到的由cembrane型大环二萜与黄酮苷聚合而成的异质二聚体, 其对癌细胞HeLa、HepG2细胞具有一定的抗增殖活性[7]。从唇形科植物川藏香茶菜(Isodon pharicus)中分离到一系列7α, 20:14, 20-二环氧-对映-贝壳杉烷型二萜, pharicusin C (8)等具有这类结构的化合物均对癌细胞HL-60、SMMC-7721、A549、MCF-7、SW480细胞具有显著抑制作用, 其同类物的IC50可达0.37~6.03 μmol·L-1[8], 这为研究该类化合物的构效关系提供了重要参考。Ervadivamine A (9)是从夹竹桃科狗牙花属植物单瓣狗牙花(Ervatamia divaricata)中分离得到的萜类-吲哚生物碱三聚体, 对癌细胞株A549、HT-29、MCF-7、HepG2具有良好的抑制活性, IC50值为10.25 ± 0.4~12.55 ± 0.54 μmol·L-1[9]; 从该植物中分离得到的单萜类双吲哚生物碱19, 20-dihydrovobparicine (10), 对抑制癌细胞A549和MCF-7具有更显著的抑制作用, IC50值分别为8.1和0.8 μmol·L-1, 另一化合物deoxytubulosine (11)对这两种癌细胞抑制作用的IC50值分别达0.002和0.09 μmol·L-1[10]。Cimitriteromone B (12)是从毛茛科植物升麻(Cimicifuga foetida)根茎中分离得到的7个环菠萝蜜烷型三萜皂苷-色原酮糖苷通过糖苷键杂合的二聚体之一, 该化合物对肺癌细胞A549有一定抑制作用(IC50=15.73 ± 0.59 μmol·L-1)[11]。从同科兔儿风属植物杏香兔儿风(Ainsliaea fragrans)中发现的愈创木烷型倍半萜三聚体ainsliatriolide A (13), 该化合物通过Diels-Alder环加成反应聚合, 其对癌细胞A549、HT-29、BEL-7402、HL-60的细胞毒活性平均IC50值为1.17 μmol·L-1[12]。
|
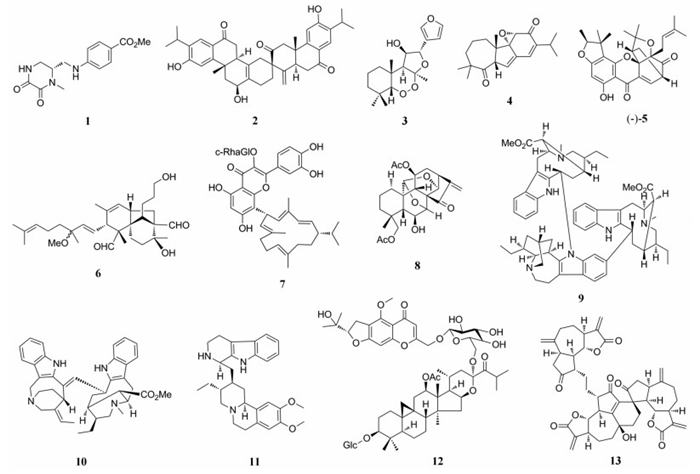
从菊科另一植物长叶火绒草(Leontopodium Longifolium)根中分离到的一个重排后的三并五元环结构的降倍半萜化合物longifodiol (14), 其对脂多糖(lipopolysaccharide, LPS)活化的RAW264.7细胞株产生NO有一定抑制作用[13]。
(±)-Cajanusflavanol A (15)是从豆科植物木豆(Cajanusc ajan)叶中分离得到的flavonostilbene对映异构体, 其具有5个手性中心的环戊烷并[1, 2, 3-de]异苯并吡喃-1-酮三环结构, 其对LPS诱导的RAW264.7巨噬细胞具有显著的NO抑制率(IC50=13.62 ± 0.49 μmol·L-1)[14]。Hongkonoid A (16)是从楝科植物香港樫木(Dysoxylum hongkongense)中发现的具有独特的5, 5, 5-稠合三环螺酮缩丁内酯的植烷型二萜, 以该化合物作为NF-κB抑制剂能够对RAW246.7和原发性BMDM细胞中LPS诱导的炎症反应表现出明显的抑制作用(IC50=16.3± 0.7 μmol·L-1)。值得关注的是, 发现者根据其可能的生源途径成功进行了该类化合物的仿生合成, 在此过程中发现了一系列活性更加良好的类似物(IC50=0.28 ± 0.08 μmol·L-1)[15]。从罂粟科植物紫金龙(Dactylicapnos scandens)中分离得到一个经过重排和重构D环的异喹啉生物碱dactyllactone A (17), 能够显著抑制体外抗炎活性因子IL-1β和PGE2的表达, 并存在一定剂量依赖性[16]。Fartefreynisin A (18)是从菊科植物绿栉齿叶蒿(Artemisia freyniana)中分离得到的一个由愈创木烷型单体与另一个艾里莫芬烷型单体通过Diels-Alder[4+2]环加成的倍半萜二聚体, 该化合物表现出较弱的NO抑制活性(IC50=38.3 ± 0.6 μmol·L-1)[17]。(+)-Cochlactone A (19)是从多孔菌科紫灵芝(Ganoderma cochlear)里分离得到一对具有双环[4.4.0]癸烷及γ-内酯环结构的对映异构体, 从该植物中还发现另一种具有罕见的羊毛甾烷型三萜经3, 4-裂环后重排实现3/5/6/5稠合的四元环新颖三萜ganolearic acid A (20), 其中(+)-cochlactone A可以很好地抑制NO产生(IC50=5.9± 0.1、6.1 ± 0.2 μmol·L-1)[18, 19]
|
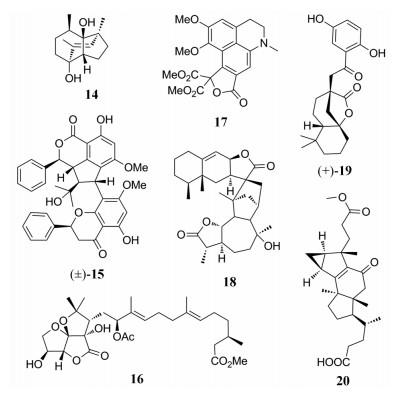
Gelsecorydine A (21)是从马钱科植物钩吻(Gelsemium elegans)果实中分离得到具有笼状6/5/7/6/5/6六环结构单萜类双吲哚生物碱二聚体, 它由gelsedine型单体和corynanthe型单体聚合而得的异二聚体, 其对LPS诱导的RAW 264.7细胞株NO产生具有显著的抑制活性(IC50=14.7 ± 1.8 μmol·L-1)[20]。从大戟科植物曼哥龙巴豆(Croton mangelong)中分离得到一对大环二萜对映异构体(±)-mangelonoid A (22), 表现出较好的NF-κB抑制活性, IC50值为7.27 ± 1.30 μmol·L-1[21]。Eucalyptusdimer A (23)是从桃金娘科植物大叶桉(Eucalyptus robusta)果实中发现由两个水芹烯和两个酰基间苯三酚单体通过一系列氧化和Diels-Alder[4+2]环加成聚合而得的二聚体, 该类化合物的发现丰富了间苯三酚-萜类衍生物的多样性。该类化合物其抗炎活性不显著, 但表现出对乙酰胆碱酯酶良好的抑制作用(IC50=17.71μmol·L-1)[22]。倍半萜二聚体hedyorienoids A (24)和B (25)均从金粟兰科植物雪香兰(Hedyosmum orientale)中分离得到, 24是乌药烷倍半萜与香木榄烷倍半萜通过1, 3-二氧戊环相连的二聚体, 而25是两个愈创木烷型倍半萜通过[2+2]环化加成得到, 其中24对NF-κB通路下的抗炎活性不显著, 25具有显著抗炎活性(IC50=5.34 ± 2.21 μmol·L-1)[23]。
|
从大戟科植物麻疯树(Jatropha curcas)根皮中分离得到curcusone型二萜通过D-A环加成的二聚体dimericursone B (26), 其能够显著抑制LPS诱导的RAW264.7巨噬细胞NO产生(IC50=5.65 μmol·L-1)[24]。Findlayine A (27)为裂环dendrobine骨架, 具有七元内酰胺片段, 是从兰科棒节石斛(Dendrobium findlayanum)中分离得到的, 其抗炎抗肿瘤活性都较弱[25]。从藤黄科植物金丝梅(Hypericum patulum)叶中分离得到的高金刚烷型酰基间苯三酚化合物hypatulone A (28), 其具有三环[4.3.1.13, 8]十一烷和独特的5/5/7/6/6环系统, 该化合物的发现充分展现了该类化合物的复杂多样性, 其对LPS诱导的RAW264.7细胞NO产生具有一定抑制作用(IC50 = 18.8± 1.75 μmol·L-1)[26]。
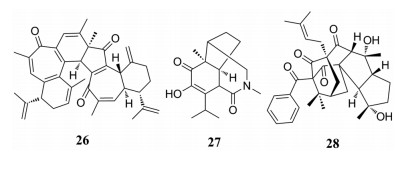
|
从夹竹桃科植物非洲马铃果(Voacanga africana)果实中分离得到具有单萜吲哚生物碱voacafricine A (29), 该化合物具有5个杂环稠合骨架, 其对金葡球菌和伤寒沙门氏菌具有一定抑制作用(MIC=3.12、6.25 μg·mL-1), 抗菌活性优于常用药物小檗碱和黄藤素[27]。Erchinine A (30)是从同科植物中国狗牙花(Ervatamia chinensis)中发现的单萜吲哚生物碱, 该化合物具有噁唑烷结构与三个半缩醛胺结合的独特1, 4-二氮杂环, 其对常见的枯草芽孢杆菌、伤寒沙门氏菌、大肠杆菌、红色毛癣菌均具有不同程度的抑制作用(MIC=0.78、25、50、12.5 μg·mL-1)[28]。Emericelactone A (31)是从五加科植物三七(Panax notoginseng)叶中分离得到的聚酮类化合物, 其分别对三种农业病原菌和两种人类致病菌均有一定的抗菌活性(MIC=25~50 μg·mL-1)[29]。从菊科植物箭叶橐吾(Ligularia sagitta)地上部分分离得到一系列由艾里莫芬型倍半萜二聚体和三聚体, 其中ligusaginoid C (32)为三聚体, 但这些聚合物均未表现出显著的抗菌活性[30]。
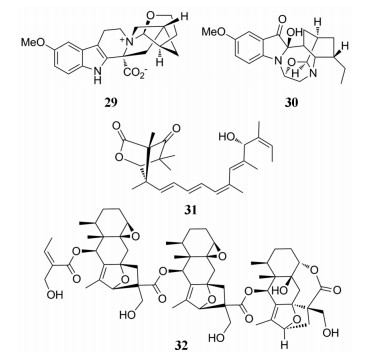
|
从菊科蟹甲草属植物无毛蟹甲草(Parasenecio albus)中分离得的arasubindole A (33), 具有12H-环戊烷[b]-萘-1, 3'-吲哚新颖骨架, 该化合物由艾里莫芬烷型倍半萜与吲哚生物碱通过螺环连接, 其对抑制癌细胞HepG2、PC3、HeLa和HT-29活性不显著[31]。从菊科植物黄花蒿(Artemisia annua)中分离得到的杜松烷倍半萜二聚体arteannoide A (34), 该化合物具有新颖的稠6, 8-二氧杂双环[3.2.l]辛烷-7-酮系统, 其结构可视为倍半萜单体经杂化Diels-Alder环加成进行聚合而成[32]。Stachyodin A (35)是从豆科植物茸毛木蓝(Indigoferasta chyodes)根中分离得到由紫檀烷型黄酮重排后具有6/5/5/6环结构与四氢呋喃环螺合的新颖化合物, 其抗炎活性并不显著[33]。从十字花科植物大青(Isatis indigotica)根中发现的isatindolignanoside A (36), 是首次从自然界中分离到具有葡萄糖苷吲哚生物碱与木脂素偶联的天然产物, 对柯萨奇B3病毒具有一定抑制作用(IC50=25.9×10-6 mol·L-1)[34]。从桃金娘科植物水翁花(Cleistocalyx operculatus)叶中分离得到一种具有抗病毒的间苯三酚衍生物(±)-cleistoperlone A (37), 该化合物具有多环骨架间苯三酚二聚体结合二氢吡喃并[3, 2-d]氧杂蒽四环结构的对映体, 其在体外抗HSV-1病毒的IC50值为7.50 ± 1.25 μmol·L-1[35]。
Aconicarmisulfonine A (38)从毛茛科植物乌头(Aconitum carmichaelii)根中分离得到的一种具有新颖骨架的磺化C20-二萜类生物碱, 该化合物在0.3 mg·kg-1剂量条件下, 与吗啡镇痛效果相当。在剂量为1.0、0.3和0.1 mg·kg时, 小鼠的镇痛率分别为83.0%、61.1%和46.7%, 具有显著的剂量依赖性[36]。从大戟科植物白饭树(Flueggea virosa)中分离得到两个具有新颖五环吲哚嗪生物碱fluvirosaones A (39)和B (40), 它们具有一定减少3T3-L1细胞中甘油三酯积累的作用[37]。
从大戟科另一植物鸡骨香(Croton crassifolius)中分离得到一个具有5/5/5/6环二萜norcrassin A (41), 药理活性显示虽比NMDA受体非竞争性拮抗药美金刚(memantine)抗AD活性低(P < 0.05)[38], 但也提示该类化合物具有治疗该类疾病的潜在价值。从橄榄科植物没药(Resina commiphora)中发现了一系列具有新颖结构的倍半萜二聚体, 其中commiphoroid A (42)通过环加成聚合而得, 在10 μmol·L-1时可促进脂肪干细胞中约60%角蛋白细胞特异性标记的表达[39]; 而另一类由杜松烷型倍半萜通过独特的D环形成类似马鞍形状的新颖二聚体commiphoratone A (43), 生物活性表明, 其对脂质代谢具有明显的抑制作用且呈浓度依赖性[40]。从杜鹃花科植物杜鹃花(Rhododendron molle)中分离得到高度修饰和功能化的二萜化合物mollebenzylanol A (44), 具有9-苄基-8, 10-二氧杂三环[5.2.1.01, 5]癸烷新颖骨架, 能够显著抑制PTP1B活性(IC50=22.99 ± 0.43μmol·L-1)[41]。从木兰科植物厚朴(Magnolia officinalis var. biloba)中分离得到的magterpenoid A (45)具罕见的4, 6, 11-三氧杂三环[5.3.1.01, 5]十一烷骨架的杂萜化合物, 其对抑制PTP1B活性较为显著(IC50=1.44 μmol·L-1)[42]。Dysohonin A (46)从楝科香港樫木(Dysoxylum hongkongense)中分离得到, 具有新颖的6, 15, 6-稠合杂环的单萜骨架, 其抑制PTP1B的IC50值为22.3 ± 0.8 μmol·L-1[43]。从大戟科植物南欧大戟(Euphorbia peplus)中分离得到二萜pepluanol C (47), 其具有新颖的5/5/10稠合[7.2.1]环十二烷骨架化合物, pepluanols C在30 μmol·L-1时对Kv1.3钾通道的峰电流抑制率为31.6%±8.3% [44]。
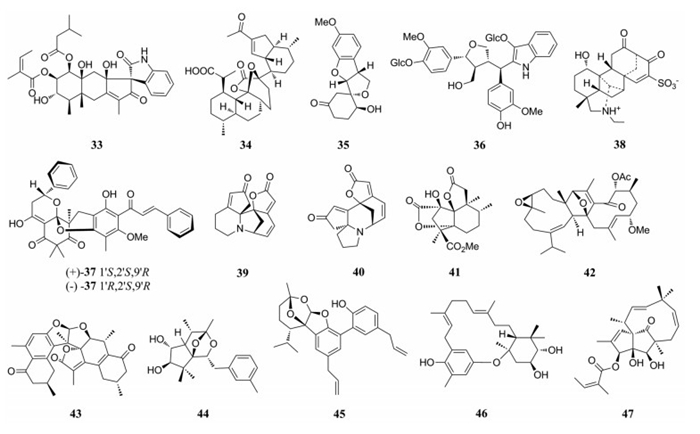
|
从桑科植物大麻(Cannabis sativa)果实中分离得到的(±)-sativamides A (48)为降木脂素酰胺类对映异构体, 其具有独特的苯并三嗪骨架, 能显著降低内质网应激诱导的细胞毒性[45]。
(S, E)-2-((3-(4-Hydroxy-3-methoxyphenyl)allyl) amino)-3-phenylpropanoic acid (49)是从伞形科植物川芎(Ligusticum chuanxiong)根茎中发现的一系列氨基酸衍生物之一, 其结构均具有苯基丙酸基团, 该类化合物通过合成的方法确定了其绝对构型, 但这类化合物的神经保护作用并不显著[46]。Camellimidazole A (50)为一个亚甲基相连的咪唑生物碱二聚体, 从山茶科祁山红茶(Keemum Black Tea)中分离得到, 在1.0 μmol·L-1浓度下其对H2O2诱导的神经元损伤显示出显著的保护作用[47]。
从藤黄科植物金丝桃(Hypericum monogynum)叶和细枝中分离出两个6-去聚丙烯酰间苯三酚hypermonin A (51), 该化合物具有十氢茚并[1, 7-bc]呋喃环系统对皮质酮诱导的PC12细胞损伤具有明显的保护作用[48]。Nototroneside B (52)为6/6/9环具有tetranordammarane骨架的三萜皂苷, 从五加科三七(Panax notoginseng)叶子中分离得到, 该化合物对游离血清诱导的人神经母细胞瘤PC12细胞损伤具有神经保护作用, 其增加了处理组的细胞活力, 细胞存活率为79.33%[49]。
从菊科植物川木香(Vladimiria souliei)根中分离得到一个具有神经保护作用的倍半萜二聚体vlasoulamine A (53)[50]。Schincalactone A (54)是从木兰科兴山五味子(Schisandra incarnata)中分离得到, 具有5/5/6/11/3环schinortriterpenoid萜类结构, 该化合物显示出抗T细胞增殖的活性(IC50=50.91 μmol·L-1)和B细胞增殖(IC50=36.84 μmol·L-1)[51]。从茜草科植物日本蛇根草(Ophiorrhiza japonica)中分离得到一个杂萜ophiorrhine A (55), 它表现出显著的特异性抑制LPS诱导的B淋巴细胞, IC50值18.6 μmol·L-1[52]。Heliojatrone B (56)是从大戟科泽漆(Euphorbia helioscopia)中分离得到的Jatrophane型二萜, 具有反式-二环[8.3.0]十三烷骨架, 通过测量ADM抗性人乳腺癌细胞系(MCF-7)中细胞内多柔比星积累的变化来评价化合物对P-糖蛋白抑制活性, 环孢菌素A (CsA)用作阳性对照。结果显示56有浓度依赖显著抑制P-糖蛋白的活性, 与CsA相比其抑制活性相当[53]。
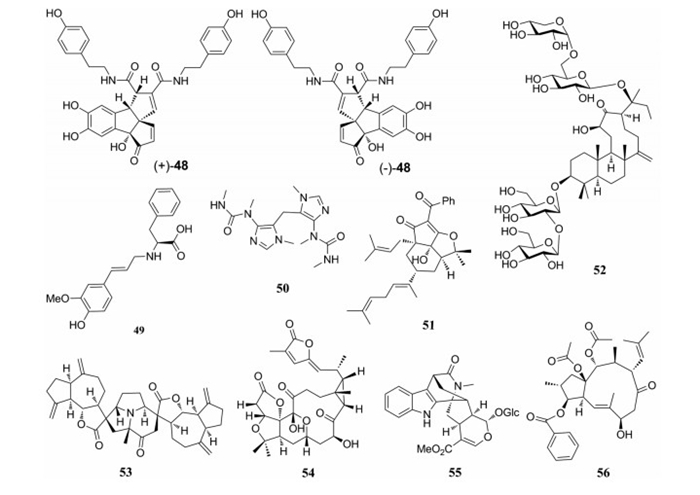
|
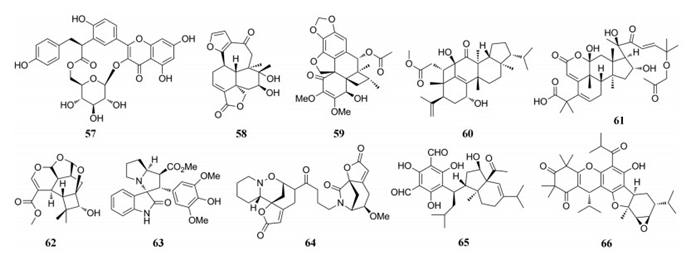
从胡颓子科植物沙枣(Elaeagnus angustifolia)花朵中分离得到一个大环黄酮苷angustifolinoid A (57), 对环氧合酶COX-1和COX-2有抑制作用[54]。从唇形科植物蓝花鼠尾草(Salvia farinacea)地上部分分离得到一类新克罗烷型二萜salvifarinin B (58), 其对减轻肝脂肪变性有显著作用[55]。从木兰科植物南五味子(Kadsura longipedunculata)根中分离得到四氢环丁基蒽呋喃酮型的酚类化合物kadsuraol C (59), 对n-乙酰-对氨基苯酚(APAP)诱导的肝毒性具有保护作用[56]。Belamchinane A (60)为具有4/6/6/6/5环的belamchinane骨架化合物, 是从鸢尾科植物射干(Belamcanda chinensis)种子中分离得到, 该化合物在低至0.5~1 μmol·L-1的浓度下对线粒体功能具有保护作用, 表明其可能具有抗衰老作用[57]。从葫芦科植物药西瓜(Citrullus colocynthis)中分离得到的colocynthenin A (61), 具有不常见的2, 11内酯片段, 并显示具有抑制乙酰胆碱酶(AChE)活性, IC50值为2.6 μmol·L-1, 其活性略低于石杉碱甲(huperzine A, IC50=0.4 μmol·L-1)[58]。从羽苔科植物圆叶羽苔中(Plagiochila duthiana)分离得到对映-香木兰烷型二萜plagiochianin A (62), 具有新颖的2, 3:6, 7-di-seco-6, 8-环-丙烯酰胺碳骨架并与三个环状缩醛形成共轭体系; 与加兰他敏(0.1 μg)对照, 该化合物在最小抑制检测量(MID)为5 μg时表现出抗AChE活性[59]。从马鞭草科植物大青(Isatis indigotica)中分离得到一类螺吡咯烷酮新吲哚类生物isatindigotindoline A (63), 在浓度20 μmol·L-1时表现出抑制Aβ1-42聚合的能力85.8%[60]。Flueggeacosine B (64)是从大戟科植物一叶萩(Flueggea suffruticosa)中分离得到的, 为首例C-3-C-15'相连的一叶秋碱型二聚体生物碱, 其可以显著促进Neuro-2a神经元细胞分化[61]。桃金娘科植物蓝桉(Eucalyptus globulus)果实中分离得到的eucalypglobulusal A (65)为间苯三酚杂萜类化合物, 显示了一定的抑制Top1切割DNA的活性[62]。从桃金娘科植物桃金娘(Rhodomyrtus tomentosa)中分离得到具有独特的6/5/5/9/4新颖骨架化合物rhodomyrtusials A (66), 首次从自然界中得到由双呋喃环连接的间苯三酚杂萜类化合物。由于该化合物无法获得晶体, 为了解决其绝对构型和获得足够的量以开展后续的生物活性研究, 作者对其通过内过氧化物和石竹烯(caryophyllene)分别通过逐步迈克尔加成(Michael Addition, MA)和杂-狄尔斯-阿尔德(hetero-Diels-Alder, HDA)环化加成反应而全合成了该化合物。生物活性筛选结果表明, 该化合物表现出较好的乙酰胆碱酯酶抑制活性, 其IC50值为8.8 μmol·L-1[63]。
|
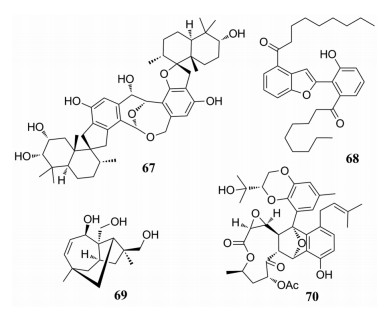
从纸葡萄穗霉(Stachybotrys chartarum)中分离得到了3个基于phenylspirodrimane结构的二聚体, 它们具有2, 10-dioxabicyclo[4.3.1]decan-7-ol母核, 其中bistachybotrysin A (67)对Daoy、HCT-116、NCI-H460和BGC823细胞株具有显著的抗肿瘤活性, 其IC50值在2.8~7.5 μmol·L-1[64]。从壮观丝衣霉真菌(Byssochlamys spectabilis)中分离到一个聚酮octaketide类衍生物二聚体bysspectin A (68), 二聚体68可通过竞争方式抑制人肝微粒体(HLM)中hCE2介导的FD水解[65]。从真菌烟色拟盘多毛孢(Pestalotiopsis adusta)中分离得到倍半萜pestalustaine A (69)具有不常见的5/6/7三环结构, 其绝对构型通过CD谱结合TD-DFT计算测定的, 69具有良好的细胞毒活性, 对HeLa、HCT-116和A549细胞株都具有一定的抑制活性[66]。从深海真菌拟茎点霉属(Phomopsis lithocarpus)分离得到4个高度氧化的tenellone大环内酯的衍生物二聚体, 它们是单体通过[4+2]环加成反应得到的, 其中lithocarpin A (70)对SF-268、MCF-7和HepG2细胞株具有一定抑制活性[67]。
|
从球毛壳菌(Chaetomium globosum)中分离得到的3个杂二聚体, 它们是chaetoglobosin与aureonitol类似物以[4+2]的方式聚合形成的杂二聚体, 其中aureochaeglobosin B (71)对人体MDA-MB-231癌细胞显示出显著的细胞毒活性, IC50值为7.6 μmol·L-1[68]。从真菌(Paraconiothyrium hawaiiense)中分离得到4个高度氧化的三联苯, 其中hawaiienol A (72)为第一个天然存在的具有4, 7-二氧杂三环[3.2.1.03, 6]辛烷母核的对位三联苯, 其对人源肿瘤细胞SH-SY5Y具有较好的抑制作用, IC50值为9.3 μmol·L-1[69]。从北极高纬度土壤的弯孢聚壳属(Eutypella sp. D-1)中分离得到了一系列新颖的海松烷型二萜, eutypellenone A (73)及一个已知的二萜libertellenone H (74), 他们对HeLa、MCF-7、HCT-116、PANC-1及SW1990细胞株具有显著的抑制活性, 其IC50值0.3~13.1 μmol·L-1[70]。
从海洋微生物散囊菌属(Eurotium sp. SCSIO F452)中分离到3个二酮哌嗪衍生物, 其中variecolortin A (75)具有2-oxa-7-氮杂双环[3.2.1]辛烷母核, 对DPPH具有显着的自由基清除活性(IC50=58.4μmol·L-1)[71]。从球毛壳霉(Chaetomium globosum)和黄柄曲霉(Aspergillus flavipes)共培养菌中得到的一系列具有2H, 1, 4-噻嗪官能团的merocytochalasan类化合物, 其中cytochathiazine B (76)具有抑制NB4和HL-60肿瘤细胞株的活性, IC50值分别为9.6和12.5 μmol·L-1[72]。
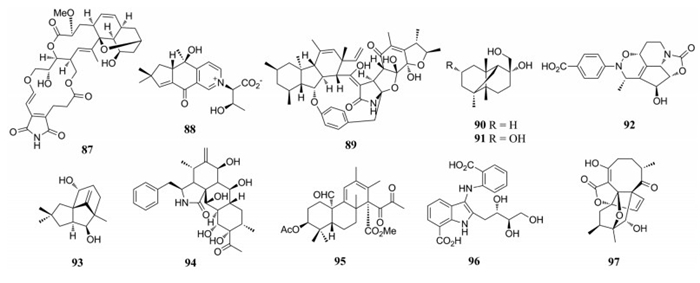
2.2 抗炎从曲霉菌属(Aspergillus sp. AWG 1-15)分离得到了通过[3+2]或[3+3]环化形成的聚酮二聚体asperone B (77), 其绝对构型通过化学衍生化、X-单晶衍射法、计算ECD等方法测得, 该化合物对LPS诱导的RAW246.7细胞NO释放量有一定的抑制作用(IC50=16.0 μmol·L-1)[73]。Griseofamines A (78)和B (79)是从灰黄青霉(Penicillium griseofulvum)分离得到的两种新颖的吲哚-tetramic acid类生物碱, 分别具有6/5/6/5或6/5/7/5环结构, 其中78具有较微弱的抑制NO、TNF-α释放的活性[74]。从腐皮镰孢菌(Fusarium solani)中分离得到结构较新颖的化合物, 一个具有pentaleno[1, 2-c]吡喃环的聚酮类和一个A/B环降碳的甾类化合物, fusopoltide A (80)对COX-2表现出显著的抑制作用, IC50值为3.45 μmol·L-1[75]。从海洋真菌棘孢曲霉(Aspergillus versicolor)中分离得到一系列多异戊烯基取代的线型吲哚生物碱, 运用X-单晶衍射、计算ECD、计算旋光度确定它们的绝对构型, 其中asperversiamide B (81)显示出潜在的iNOS抑制活性并抑制LPS诱导的RAW264.7细胞中NO的释放, IC50值分别为9.95 ± 0.46、17.24 ± 1.32 μmol·L-1[76]。从地花菌(Albatrellus confluens)中分离得到了一系列含N原子的杂环类化合物, 其中conflamides D (82), 对LPS诱导的B淋巴细胞增殖具有较好的抑制活性(IC50值为1.48 μmol·L-1)[77]。Alterbrassicene A (83)具有5/9/4稠环和2-环丁烯-1-酮片段的fusicoccane二萜类化合物, 是从芸薹生链格孢(Alternaria brassicicola)中分离得到的, 可以紧密结合IKKβ, 导致NF-κB信号通路失活显示显著的抗炎活性[78]。
从拟茎点霉(Diaporthe sp. SYSU-HQ3)中分离得到了4个2, 3-二氢-1H-茚类化合物、两个异戊烯基异吲哚生物碱以及一个苯甲酮衍生物, 其中diaporindene A (84)具有显著的抑制LPS诱导的RAW264.7细胞株释放NO的活性(IC50=8.5 ± 0.1 μmol·L-1)[79]。从娄地青霉菌(Penicillium roqueforti YJ-14)中分离得到3个5/6/5/6/5环二倍半萜, 并运用13C同位素标记法追踪这些化合物的生源合成途径, 其中peniroquesine A (85)具有良好的抑制LPS诱导的RAW264.7细胞NO释放作用(IC50=16.13±1.61 μmol·L-1)[80]。从真菌曲霉属(Aspergillus flocculosus 16D-1)中分离得到的两个具有dioxatetraheterocyclic环系统的11(9→10)-abeo-5, 10-裂环甾体类化合物和一个ergosteroid类化合物, 其中裂环甾体类化合物aspersecosteroid A (86)对LPS诱导的THP 1细胞产生TNF-α和IL-6具有抑制作用, 其IC50值分别为28和21 μmol·L-1[81]。

|
从海洋微生物首尔链霉菌(Streptomyces seoulensis)中分离得到具有5/14/10/6/6环系统的streptoseomycin (87), 该化合物对金葡球菌、藤黄微球菌、枯草芽孢杆菌具有较弱的抑制活性(MIC值分别为32、32和64 μg·mL-1)[82]。从毛韧革菌(Stereum hirsutum)分离得到4个季铵倍半萜与α-氨基酸缀合物, 其中stereumamide A (88)对大肠杆菌、金葡球菌和鼠伤寒沙门氏菌具有良好的抑制作用, 其最低抑菌浓度(MIC)分别为12.5、12.5和25.0 μg·mL-1[83]。Penicipyrrodiether A (89)为GKK1032和phenol A缀合物, 它是从青霉菌属(Penicillium sp. ZZ380)里分离得到的, 具有良好的抑制耐甲氧西林金葡球菌(MRSA)、大肠杆菌的生物活性, MIC值分别为5.0、34.0 μg·mL-1[84]。
从三七叶子上的真菌裸胞壳属(Emericella sp. XL 029)中分离得到了emericellins A (90)和B (91), 具有三环[4, 4, 2, 1]十一烷骨架, 两个化合物对3种真菌菌株(大丽轮枝菌、玉蜀黍长蠕孢和葡萄座腔菌)和3种细菌菌株(枯草芽孢杆菌、蜡状芽孢杆菌和大肠杆菌)表现出中等的抑制活性(MIC=25~50 μg·mL-1)[85]。从海洋真菌(Streptomyces chartreusis NA02069)中分离得到具有6/6/5/5环的生物碱chartrenoline (92), 是streptazolin与4-nitrosobenzoic acid发生分子内DA反应生成, 其抗菌活性不显著[86]。Antroalbocin A (93)是从白黄小薄孔菌(Antrodiellaal bocinnamomea)中分离得到具有三环结构的倍半萜, 有一定的抑制金葡球菌活性(MIC=169 μmol·L-1)[87]。从白鳞炭角菌(Xylariacurta E10)中分离得到的curtachalasin A (94), 具有5/6/6/6环骨架, 它对石膏样小孢子菌(Microsporum gypseum)显示出较弱的抗真菌活性(在200 μmol·L-1浓度下抑制率为70.3% ± 0.4%)[88]。
2.4 其他从红树型青霉属(Mangrove-derived Penicillium simplicissimum MA-332)中分离得到的simpterpenoid A (95)为高度重排的杂萜, 具有显著的体外流感神经氨酸酶抑制活性, IC50值为8.1 nmol·L-1[89]。从海绵衍生链霉属(sponge derived Streptomyces sp. CMN-62)中分离得到两个anthranilate基团与呋喃果糖通过C-N键相连的化合物, 以及一个含有吲哚片段的anthranoside C (96), 对甲型H1N1流感病毒表现出抑制活性IC50 =171.0 μmol·L-1 (利巴韦林为阳性对照, IC50=133μmol·L-1)[90]。从链霉菌属(Koyangensis SCSIO 5802)中分离得到3个abyssomicin单体及两个二聚体, 其中单体neoabyssomicin D (97)具有8/5/5/7环结构, 对单纯疱疹病毒表现出轻微的抗病毒活性, 在10 μmol·L-1浓度下显示31% ± 10%病毒复制[91]。
|
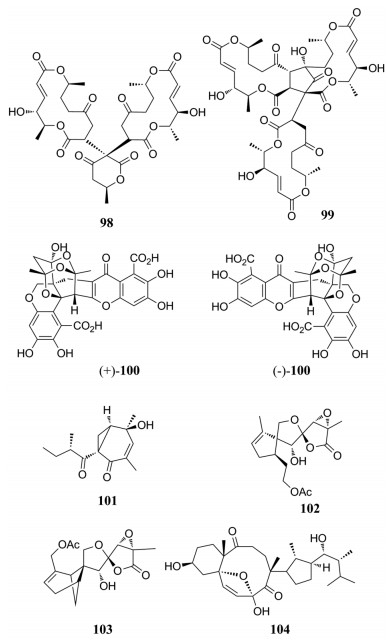
从无茎真菌属(Acaulium sp. H-JQSF)中分离得到了macrodiolides二聚体大环双内酯acaulide (98)以及三聚体acaulin A (99), 推测其生源是通过迈克尔加成反应生成, 泼尼松龙诱导的斑马鱼骨质疏松模型测定生物活性结果表明, 98在浓度为0.4和2.0 μmol·L-1时能够减轻骨质疏松症斑马鱼的颅骨损失, 但99以0.4、2.0和10.0 μmol·L-1的剂量依赖减少骨质疏松斑马鱼的颅骨损失[92, 93]。从毡毛青霉(Penicillium velutinum)中分离得到了一对对映异构体(±)-citrofulvicin (100), 运用手性HPLC将其分开, 推测其生源合成途径是通过非酶催化中间体heptaketide发生DA加成反应形成的, 在泼尼松龙诱导的骨质疏松斑马鱼中, 在浓度为0.1 μmol·L-1时具有成骨作用, (+)-100效果最好[94]。
从真菌(Ophiosphaerella korrae)分离得到一系列具有双环[4.1.0]庚烯酮结构, 使用薄层色谱-生物自动测定法初步评估AChE抑制活性, 其中ophiosphaerellin A (101)具有非常弱的抑制AChE活性[95]。从产紫青霉属(Penicillium purpurogenum)中分离得到了一个5/5/5螺环倍半萜内酯以及两个6/4/5/5螺环倍半萜内酯, 其中purpurolide A (102)和B (103)对胰脂肪酶有显著的抑制活性, IC50值分别为2.83 ± 0.52、5.45 ± 0.69 μmol·L-1 [96]。Tricholumin A (104)为麦角甾醇衍生物, 是从海洋褐藻中的棘孢木霉(Trichoderma asperellum)中分离得到的, 该化合物对海洋中的浮游植物(Chattonella marina、Heterosigma akashiwo、Karlodinium veneficum和Prorocentrum donghaiense)有一定的抑制作用, IC50值分别为0.56、0.37、0.59、0.27 μg·mL-1[97]。
|
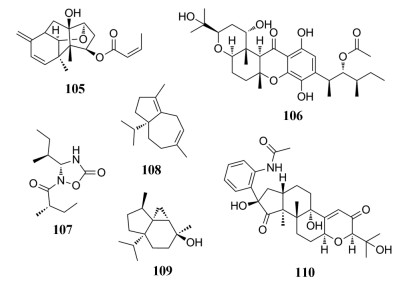
从土豆内生真菌单端孢属(Trichothecium crotocinigenum)中分离得到了两个trichothecene型倍半萜, 其中trichothecrotocin A (105), 对植物病原体A. solani和F. oxysporum具有良好的抑制活性, MIC值分别为16.0和32.0 μmol·L-1[98]。从菌株Arthrinium sp. NF2194和Nectria sp. Z14-w中分离鉴定一系列杂萜, 并运用基因失活、异源表达和生化分析揭示了一种新的聚酮-萜类化合物生源合成新途径, 其中arthripenoids C (106)抑制伴刀豆球蛋白(ConA)诱导的T细胞的增殖, IC50值为8.8 μmol·L-1[99]。从食用地花菌(edible mushroom Albatrellus confluens)中分离得到两个具有五元1, 2, 4-oxadiazolidin-5-酮杂环骨架化合物, 环孢菌素A (CsA)作为阳性对照, 化合物albatredine A (107)对伴刀豆球蛋白A诱导的T淋巴细胞增殖表现出较弱活性, IC50值为2.99 μmol·L-1[100]。
来自禾谷镰刀菌(Fusarium graminearum)的倍半萜合成酶FgJ03939在法尼基二磷酸酯过量表达的酿酒酵母(Saccharomyces cerevisiae)中被充分利用, 从中分离得到的化合物fusariumdiene (108)和fusagramineol (109)分别为5/7和5/6/3环系统的倍半萜类化合物[101]。从真菌青霉菌属(Penicillium camemberti OUCMDZ-1492)中分离得到一个具有C-N键断裂骨架的吲哚二萜衍生物secopaxilline A (110)[102]。
|
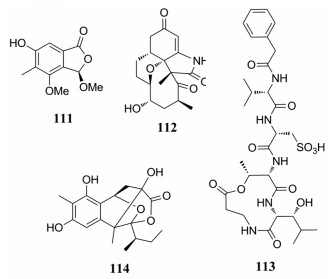
敲除构巢曲美(Aspergillus nidulans)中的LaeB基因后, 分离出一系列以3-methoxyporriolide (111)为代表的聚酮化合物[103]。在小单孢菌属(Micromono spora sp.)中特异性过表达正调节基因mas13激活隐蔽基因簇mas, 分离出了一系列pentaketide ansamycins类化合物, 并以microansamycins A (112)为例揭示了pentaketide ansamycins的生物合成基因簇, 而且还呈现了安莎霉素生物合成中多种PKS后修饰的结果[104]。从林肯链霉菌(Streptomyces lincolnensis)中分离得到一种新的以cysteoamide (113)为代表的含半胱氨酸的内酯产物, 通过生物信息学分析和体内遗传研究, 在林肯链霉菌的基因组中找到了该化合物的生物合成基因簇[105]。从派伦霉(Peyronellaea glomerata)中分离得到四环笼状azaphilone类化合物peyronellone B (114), 通过X-Ray、Rh2(OCOCF3)4诱导ECD谱、计算CD、改良Mosher等方法确定了绝对构型; 在5 μmol·L-1时, 具有显著的缺氧保护作用, 可以将缺氧/复氧处理的人脐静脉内皮细胞的存活率从35%提高至70%[106]。
|
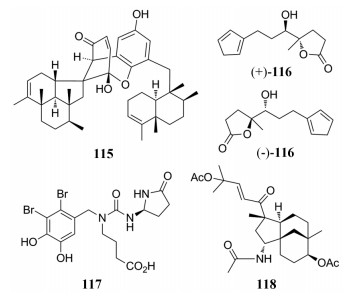
从海绵属(Dysidea arenaria)中分离得到一个二聚的C21杂萜dysiarenone (115), 抗炎活性结果显示, 该化合物以剂量依赖性方式选择性抑制LPS刺激的COX-2表达, 而对COX-1表达没有显着影响, 其降低了LPS诱导的RAW264.7细胞的PGE2产生, IC50值为6.4 μmol·L-1[107]。从北海产海绵(Spongia officinalis)中分离得到的两对含有呋喃环的trinorsesquiterpene类外消旋, 运用手性HPLC将其分开, 其中(±)-sponalisolide A (116)具有抗LasR的抑制活性, 并可以起到铜绿假单胞菌群体感应抑制剂的作用[108]。
从一种海洋红藻——松节藻(Rhodomelacon fervoides)中分离得到化合物rhodomelin A (117), 其绝对构型通过合成对映异构体后用手性HPLC分离后确定; 它对DPPH有显著的清除活性(IC50=3.82 μmol·L-1), 比阳性对照BHT (IC50=82.13μmol·L-1)活性高21.5倍[109]。从中国南海的软珊瑚——漏斗肉芝软珊瑚(Sarcophyton infundibuliforme)中分离到两个含氮的二萜类化合物, 具有三环[6.3.1.01, 5]十二烷骨架, 在免疫学测定中, 化合物sarinfacetamide A (118)在10 μmol·L-1时可以促进ConA诱导的T淋巴细胞增殖, 增殖率为36.18%[110]。
|
综上所述, 2018年我国天然产物化学领域取得了诸多引人注目的可喜成果, 一大批化学结构新颖复杂、生物活性突出的天然化学成分被发现, 诸多科研成果获得世界同行的广泛关注和认可, 在一定程度上代表了国际天然产物化学研究的水平。本领域权威期刊Nat Prod Rep中的Hot off the Press收录的2018年发现热点化合物中, 我国科学家发现的有73个, 占同期总体的53.64%, 充分显示了我国新颖天然产物发现方面的国际地位。在此基础上, 一大批抗肿瘤、抗炎、抗菌等活性显著的分子被发现, 为创新药物的研发提供了优良的先导化合物。例如岳建民课题组从楝科香港樫木(Dysoxylum hongkongense)中分离得到一类具有显著抗炎活性的5, 5, 5三环螺酮丁内酯片段的的长链二萜与抗坏血酸的加成物(hongkonoids A-D)并发表于化学的顶级期刊J Am Chem Soc, 为治疗代谢紊乱和心血管疾病提供了一类全新的先导分子[17]。在取得这些研究结果的同时, 我国的天然产物研究也存在着诸如化合物生物活性研究不够深入系统、天然产物合成生物学研究较薄弱等不足。
伴随着中药现代化的进程, 国家更加重视中药和天然药物化学的研究, 科研投入也在不断增加。我国天然产物化学工作者要充分利用优越的设备条件, 发挥我国特色和优势, 深入挖掘我国特有的中药和天然药物资源, 发现更多结构新颖、生物活性显著的天然化合物, 为创新药物的研究与开发提供更多更优的先导化合物, 从源头上推动我国具有自主知识产权的新药创制。
| [1] | Zhang GJ, Li B, Cui HM, et al. Orychophragines A-C, three biologically active alkaloids from Orychophragmus violaceus[J]. Org Lett, 2018, 20: 656–659. DOI:10.1021/acs.orglett.7b03801 |
| [2] | Ke LY, Zhang Y, Xia MY, et al. Modified abietane diterpenoids from whole plants of Selaginella moellendorffii[J]. J Nat Prod, 2018, 81: 418–22. DOI:10.1021/acs.jnatprod.7b00909 |
| [3] | Zhao Q, Gao JJ, Qin XJ, et al. Hedychins A and B, 6, 7-dinorlabdane diterpenoids with a peroxide bridge from Hedychium forrestii[J]. Org Lett, 2018, 20: 704–707. DOI:10.1021/acs.orglett.7b03836 |
| [4] | Xia F, Zhang DW, Wu CY, et al. Isolation, structural elucidation, and synthetic study of salviyunnanone A, an abietane derived diterpenoid with a 7/5/6/3 ring system from Salvia yunnanensis[J]. Org Chem Front, 2018, 5: 1262–1266. DOI:10.1039/C7QO01140G |
| [5] | Niu SL, Li DH, Li XY, et al. Bioassay- and chemistry-guided isolation of scalemic caged prenylxanthones from the leaves of Garcinia bracteata[J]. J Nat Prod, 2018, 81: 749–757. DOI:10.1021/acs.jnatprod.7b00454 |
| [6] | Ni G, Li JY, Yu DQ. Belamchinenin A, an unprecedented tricyclic-fused triterpenoid with cytotoxicity from Belamcanda chinensis[J]. Org Biomol Chem, 2018, 16: 3754–3759. DOI:10.1039/C8OB00789F |
| [7] | Yang CY, Lin Y, Yuan HX, et al. Nicotabaflavonoidglycoside, the first example of cembranoid and flavonoid heterodimer from Nicotiana tabacum[J]. Fitoterapia, 2018, 128: 242–246. DOI:10.1016/j.fitote.2018.05.028 |
| [8] | Hu ZX, Xu HC, Hu K, et al. Structurally diverse diterpenoids from Isodon pharicus[J]. Org Chem Front, 2018, 5: 2379–2389. DOI:10.1039/C8QO00477C |
| [9] | Liu ZW, Zhang J, Li ST, et al. Ervadivamines A and B, two unusual trimeric monoterpenoid indole alkaloids from Ervatamia divaricata[J]. J Org Chem, 2018, 83: 10613–10618. DOI:10.1021/acs.joc.8b01371 |
| [10] | Cai YS, Sarotti AM, Zhou TL, et al. Flabellipparicine, a flabelliformide-apparicine-type bisindole alkaloid from Tabernaemontana divaricata[J]. J Nat Prod, 2018, 81: 1976–1983. DOI:10.1021/acs.jnatprod.8b00191 |
| [11] | Shi QQ, Lu J, Peng XR, et al. Cimitriteromone A-G, macromolecular triterpenoid-chromone hybrids from the Rhizomes of Cimicifuga foetida[J]. J Org Chem, 2018, 83: 10359–10369. DOI:10.1021/acs.joc.8b01466 |
| [12] | Zhang R, Tang C, Liu HC, et al. Ainsliatriolides A and B, two guaianolide trimers from Ainsliaea fragrans and their cytotoxic activities[J]. J Org Chem, 2018, 83: 14175–14180. DOI:10.1021/acs.joc.8b02346 |
| [13] | Shen T, Qian H, He YL, et al. Longifodiol, a novel rearranged triquinanenorsesquiterpene from the root of Leontopodium longifolium[J]. Chem Lett, 2018, 47: 461–463. DOI:10.1246/cl.171046 |
| [14] | He QF, Wu ZL, Huang XJ, et al. Cajanusflavanols A-C, three pairs of flavonostilbene enantiomers from Cajanusc ajan[J]. Org Lett, 2018, 20: 876–879. DOI:10.1021/acs.orglett.8b00010 |
| [15] | Zhao JX, Yu YY, Wang SS, et al. Structural elucidation and bioinspired total syntheses of ascorbylated diterpenoid hongkonoids A-D[J]. J Am Chem Soc, 2018, 140: 2485–2492. DOI:10.1021/jacs.7b10135 |
| [16] | Wang B, Yang ZF, Zhao YL, et al. Anti-inflammatory isoquinoline with bis-seco-aporphine skeleton from Dactylicapnos scandens[J]. Org Lett, 2018, 20: 1647–1650. DOI:10.1021/acs.orglett.8b00400 |
| [17] | Zhang C, Wen R, Ma XL, et al. Nitric oxide inhibitory sesquiterpenoids and its dimers from Artemisia freyniana[J]. J Nat Prod, 2018, 81: 866–878. DOI:10.1021/acs.jnatprod.7b00947 |
| [18] | Peng XR, Lu SY, Shao LD, et al. Structural elucidation and biomimetic synthesis of (+/-)-cochlactone a with anti-inflammatory activity[J]. J Org Chem, 2018, 83: 5516–5522. DOI:10.1021/acs.joc.8b00525 |
| [19] | Peng XR, Huang YJ, Lu SY, et al. Ganolearic acid a, a hexanorlanostane triterpenoid with a 3/5/6/5-fused tetracyclic skeleton from Ganoderma cochlear[J]. J Org Chem, 2018, 83: 13178–13183. |
| [20] | Li NP, Liu M, Huang XJ, et al. Gelsecorydines A-E, five gelsedine-corynanthe-type bisindole alkaloids from the fruits of Gelsemium elegans[J]. J Org Chem, 2018, 83: 5707–5714. DOI:10.1021/acs.joc.8b00736 |
| [21] | Zhang WY, Zhao JX, Sheng L, et al. Mangelonoids A and B, two pairs of macrocyclic diterpenoid enantiomers from Croton mangelong[J]. Org Lett, 2018, 20: 4040–4043. DOI:10.1021/acs.orglett.8b01608 |
| [22] | Qin XJ, Feng MY, Liu H, et al. Eucalyptusdimers A-C, dimeric phloroglucinol-phellandrene meroterpenoids from Eucalyptus robusta[J]. Org Lett, 2018, 20: 5066–5070. DOI:10.1021/acs.orglett.8b02259 |
| [23] | Fan YY, Sun YL, Zhou B, et al. Hedyorienoids A and B, two sesquiterpenoid dimers featuring different polycyclic skeletons from Hedyosmum orientale[J]. Org Lett, 2018, 20: 5435–5438. DOI:10.1021/acs.orglett.8b02340 |
| [24] | Liu JQ, Xu Y, Xiao Q, et al. Dimericursones A and B: two unprecedented hexacyclic dimeric diterpenoids from the root barks of Jatropha curcas[J]. Org Biomol Chem, 2018, 16: 8305–8310. DOI:10.1039/C8OB02082E |
| [25] | Yang D, Cheng ZQ, Yang L, et al. Seco-dendrobine-type alkaloids and bioactive phenolics from Dendrobium findlayanum[J]. J Nat Prod, 2018, 81: 227–235. DOI:10.1021/acs.jnatprod.7b00150 |
| [26] | Liu YY, Ao Z, Xue GM, et al. Hypatulone A, a homoadamantane-type acylphloroglucinol with an intricately caged core from Hypericum patulum[J]. Org Lett, 2018, 20: 7953–7956. DOI:10.1021/acs.orglett.8b03523 |
| [27] | Ding CF, Ma HX, Yang J, et al. Antibacterial indole alkaloids with complex heterocycles from Voacanga africana[J]. Org Lett, 2018, 20: 2702–2706. DOI:10.1021/acs.orglett.8b00913 |
| [28] | Yu HF, Qin XJ, Ding CF, et al. Nepenthe-like indole alkaloids with antimicrobial activity from Ervatamia chinensis[J]. Org Lett, 2018, 20: 4116–4120. DOI:10.1021/acs.orglett.8b01675 |
| [29] | Pang XJ, Zhang SB, Chen HL, et al. Emericelactones A-D: four novel polyketides produced by Emericella sp. XL 029, a fungus associated the leaves of Panax notoginseng[J]. Tetrahedron Lett, 2018, 59: 4566–4570. DOI:10.1016/j.tetlet.2018.11.032 |
| [30] | Hang YL, Zai QZ, Wen JW, et al. Ligusaginoids A-D, four eremophilane-type sesquiterpenoid dimers and trimers from Ligularia sagitta[J]. Tetrahedron Lett, 2018, 59: 3461–3466. DOI:10.1016/j.tetlet.2018.08.009 |
| [31] | Zhou M, Zhou J, Liu J, et al. Parasubindoles A-G, seven eremophilanyl indoles from the whole plant of Parasenecio albus[J]. J Org Chem, 2018, 83: 12122–12128. DOI:10.1021/acs.joc.8b02089 |
| [32] | Qin DP, Pan DB, Xiao W, et al. Dimeric cadinane sesquiterpenoid derivatives from Artemisia annua[J]. Org Lett, 2018, 20: 453–456. DOI:10.1021/acs.orglett.7b03796 |
| [33] | Zhang YF, Zhu ZX, Sun H, et al. Stachyodin A, a pterocarpan derivative with unusual spirotetrahydrofuran ring from the roots of Indigoferasta chyodes[J]. Tetrahedron Lett, 2018, 59: 4514–4516. DOI:10.1016/j.tetlet.2018.11.024 |
| [34] | Meng L, Guo Q, Chen M, et al. Isatindolignanoside A, a glucosidic indole-lignan conjugate from an aqueous extract of the Isatis indigotica roots[J]. Chin Chem Lett, 2018, 29: 1257–1260. DOI:10.1016/j.cclet.2017.12.001 |
| [35] | Su JC, Wang S, Cheng W, et al. Phloroglucinol derivatives with unusual skeletons from Cleistocalyx operculatus and their in vitro antiviral activity[J]. J Org Chem, 2018, 83: 8522–8632. DOI:10.1021/acs.joc.8b01050 |
| [36] | Guo Q, Xia H, Shi G, et al. Aconicarmisulfonine A, a sulfonated C20-diterpenoid alkaloid from the lateral roots of Aconitum carmichaelii[J]. Org Lett, 2018, 20: 816–819. DOI:10.1021/acs.orglett.7b03956 |
| [37] | Luo XK, Cai J, Yin ZY, et al. Fluvirosaones A and B, two indolizidine alkaloids with a pentacyclic skeleton from Flueggea virosa[J]. Org Lett, 2018, 20: 991–994. DOI:10.1021/acs.orglett.7b03935 |
| [38] | Zhang ZX, Wu PQ, Li HH, et al. Norcrassin A, a novel C16 tetranorditerpenoid, and bicrotonol A, an unusual dimeric labdane-type diterpenoid, from the roots of Croton crassifolius[J]. Org Biomol Chem, 2018, 16: 1745–1750. DOI:10.1039/C7OB02991H |
| [39] | Liu JW, Zhang MY, Yan YM, et al. Characterization of sesquiterpene dimers from Resina Commiphora that promote adipose-derived stem cell proliferation and differentiation[J]. J Org Chem, 2018, 83: 2725–2733. DOI:10.1021/acs.joc.7b03182 |
| [40] | Liu JW, Liu Y, Yan YM, et al. Commiphoratones A and B, two sesquiterpene dimers from Resina commiphora[J]. Org Lett, 2018, 20: 2220–2223. DOI:10.1021/acs.orglett.8b00561 |
| [41] | Zhou J, Liu J, Dang T, et al. Mollebenzylanols A and B, highly modified and functionalized diterpenoids with a 9-benzyl-8, 10-dioxatricyclo[5.2.1.0(1, 5)]decane core from Rhododendron molle[J]. Org Lett, 2018, 20: 2063–2066. DOI:10.1021/acs.orglett.8b00606 |
| [42] | Li C, Li CJ, Ma J, et al. Magterpenoids A-C, three polycyclic meroterpenoids with PTP1B inhibitory activity from the bark of Magnolia officinalis var. biloba[J]. Org Lett, 2018, 20: 3682–3686. DOI:10.1021/acs.orglett.8b01476 |
| [43] | Zhao JX, Liu CP, Zhang MM, et al. Dysohonin A, a meroditerpenoid incorporating a 6, 15, 6-fused heterotricyclic ring system from Dysoxylumhong kongense[J]. Org Chem Front, 2018, 5: 2202–2207. DOI:10.1039/C8QO00469B |
| [44] | Wan LS, Nian Y, Peng XR, et al. Pepluanols C-D, two diterpenoids with two skeletons from Euphorbia peplus[J]. Org Lett, 2018, 20: 3074–3078. DOI:10.1021/acs.orglett.8b01114 |
| [45] | Zhu GY, Yang J, Yao XJ, et al. (+/-)-Sativamides A and B, two pairs of racemic nor-lignanamide enantiomers from the fruits of Cannabis sativa[J]. J Org Chem, 2018, 83: 2376–2381. DOI:10.1021/acs.joc.7b02765 |
| [46] | Zhang X, Han B, Feng ZM, et al. Novel phenylpropanoid-amino acid adducts from Ligusticum chuanxiong[J]. Org Chem Front, 2018, 5: 1423–1430. DOI:10.1039/C8QO00012C |
| [47] | Wang W, Tang X, Hua F, et al. Camellimidazole A-C, three methylene-bridged dimeric imidazole alkaloids from Keemun Black Tea[J]. Org Lett, 2018, 20: 2672–2675. DOI:10.1021/acs.orglett.8b00878 |
| [48] | Zeng YR, Yi P, Gu W, et al. Hypermonins A and B, two 6-norpolyprenylated acylphloroglucinols with unprecedented skeletons from Hypericum monogynum[J]. Org Biomol Chem, 2018, 16: 4195–4198. DOI:10.1039/C8OB00650D |
| [49] | Liu XY, Li CJ, Chen FY, et al. Nototronesides A-C, three triterpene saponins with a 6/6/9 fused tricyclic tetranordammarane carbon skeleton from the leaves of Panax notoginseng[J]. Org Lett, 2018, 20: 4549–4553. DOI:10.1021/acs.orglett.8b01848 |
| [50] | Wu ZL, Wang Q, Wang JX, et al. Vlasoulamine A, a neuroprotective[3.2.2]cyclazine sesquiterpene lactone dimer from the roots of Vladimiria souliei[J]. Org Lett, 2018, 20: 7567–7570. DOI:10.1021/acs.orglett.8b03306 |
| [51] | Song J, Zhou M, Zhou J, et al. Schincalactones A and B, two 5/5/6/11/3 fused schinortriterpenoids with a 13-membered carbon ring system from Schisandra incarnata[J]. Org Lett, 2018, 20: 2499–2502. DOI:10.1021/acs.orglett.8b00889 |
| [52] | Feng T, Duan KT, He SJ, et al. Ophiorrhines A and B, two immunosuppressive monoterpenoid indole alkaloids from Ophiorrhiza japonica[J]. Org Lett, 2018, 20: 7926–7928. DOI:10.1021/acs.orglett.8b03489 |
| [53] | Mai ZP, Ni G, Liu YF, et al. Heliojatrones A and B, two jatrophane-derived diterpenoids with a 5/10 fused-ring skeleton from Euphorbia helioscopia: structural elucidation and biomimetic conversion[J]. Org Lett, 2018, 20: 3124–3127. DOI:10.1021/acs.orglett.8b01215 |
| [54] | Chen X, Liu Y, Chen G, et al. Angustifolinoid A, a macrocyclic flavonoid glycoside from Elaeagnus angustifolia flowers[J]. Tetrahedron Lett, 2018, 59: 2610–2613. DOI:10.1016/j.tetlet.2018.05.074 |
| [55] | Fan M, Chen XJ, Wu XD, et al. Salvifarinin A, a neo-clerodane diterpenoid with a 6/5/7 tricyclic skeleton from Salvia farinacea[J]. Tetrahedron Lett, 2018, 59: 3065–3068. DOI:10.1016/j.tetlet.2018.06.015 |
| [56] | Wang X, Liu J, Pandey P, et al. Computationally assisted assignment of the kadsuraols, a class of chemopreventive agents for the control of liver cancer[J]. Org Lett, 2018, 20: 5559–5563. DOI:10.1021/acs.orglett.8b02207 |
| [57] | Song YY, Miao JH, Qin FY, et al. Belamchinanes A-D from Belamcanda chinensis: triterpenoids with an unprecedented carbon skeleton and their activity against age-related renal fibrosis[J]. Org Lett, 2018, 20: 5506–5509. DOI:10.1021/acs.orglett.8b02490 |
| [58] | Liu Y, Chen G, Chen X, et al. Colocynthenins A-D, ring-A seco-cucurbitane triterpenoids from the fruits of Citrullus colocynthis[J]. J Nat Prod, 2018, 81: 2115–2119. DOI:10.1021/acs.jnatprod.8b00461 |
| [59] | Han JJ, Zhang JZ, Zhu RX, et al. Plagiochianins A and B, two ent-2, 3-seco-aromadendrane derivatives from the liverwort Plagiochila duthiana[J]. Org Lett, 2018, 20: 6550–6553. DOI:10.1021/acs.orglett.8b02888 |
| [60] | Liu SF, Lin B, Xi YF, et al. Bioactive spiropyrrolizidine oxindole alkaloid enantiomers from Isatis indigotica Fortune[J]. Org Biomol Chem, 2018, 16: 9430–9439. DOI:10.1039/C8OB02046A |
| [61] | Wu ZL, Huang XJ, Xu MT, et al. Flueggeacosines A-C, dimeric securinine-type alkaloid analogues with neuronal differentiation activity from Flueggea suffruticosa[J]. Org Lett, 2018, 20: 7703–7707. DOI:10.1021/acs.orglett.8b03432 |
| [62] | Qin XJ, Jin LY, Yu Q, et al. Eucalypglobulusals A-J, formyl-phloroglucinol-terpene meroterpenoids from Eucalyptus globulus fruits[J]. J Nat Prod, 2018, 81: 2638–2646. DOI:10.1021/acs.jnatprod.8b00430 |
| [63] | Xu JQ, Rauwolf TJ, Pan PL, et al. Isolation and synthesis of novel meroterpenoids from Rhodomyrtus tomentosa: investigation of a reactive enetrione intermediate[J]. Angew Chem Int Ed, 2019, 58: 4291–4296. DOI:10.1002/anie.201814421 |
| [64] | Zhao J, Feng J, Tan Z, et al. Bistachybotrysins A-C, three phenylspirodrimane dimers with cytotoxicity from Stachybotrys chartarum[J]. Bioorg Med Chem Lett, 2018, 28: 355–359. DOI:10.1016/j.bmcl.2017.12.039 |
| [65] | Wu YZ, Zhang HW, Sun ZH, et al. Bysspectin A, an unusual octaketide dimer and the precursor derivatives from the endophytic fungus Byssochlamys spectabilis IMM0002 and their biological activities[J]. Eur J Med Chem, 2018, 145: 717–725. DOI:10.1016/j.ejmech.2018.01.030 |
| [66] | Xiao J, Lin LB, Hu JY, et al. Pestalustaines A and B, unprecedented sesquiterpene and coumarin derivatives from endophytic fungus Pestalotiopsis adusta[J]. Tetrahedron Lett, 2018, 59: 1772–1775. DOI:10.1016/j.tetlet.2018.03.078 |
| [67] | Xu J, Tan H, Chen Y, et al. Lithocarpins A-D: four tenellone-macrolide conjugated[4+2] hetero-adducts from the deep-sea derived fungus Phomopsis lithocarpus FS508[J]. Org Chem Front, 2018, 5: 1792–1797. DOI:10.1039/C8QO00095F |
| [68] | Yang MH, Gu ML, Han C, et al. Aureochaeglobosins A-C, three[4+2] adducts of chaetoglobosin and aureonitol derivatives from Chaetomium globosum[J]. Org Lett, 2018, 20: 3345–3348. DOI:10.1021/acs.orglett.8b01243 |
| [69] | Ren F, Chen S, Zhang Y, et al. Hawaiienols A-D, highly oxygenated p-terphenyls from an insect-associated fungus Paraconiothyrium hawaiiense[J]. J Nat Prod, 2018, 81: 1752–1759. DOI:10.1021/acs.jnatprod.8b00106 |
| [70] | Yu HB, Wang XL, Zhang YX, et al. Libertellenones O-S and eutypellenones A and B, pimarane diterpene derivatives from the Arctic Fungus Eutypella sp. D-1[J]. J Nat Prod, 2018, 81: 1553–1560. DOI:10.1021/acs.jnatprod.8b00039 |
| [71] | Zhong W, Wang J, Wei X, et al. Variecolortins A-C, three pairs of spirocyclic diketopiperazine enantiomers from the marine-derived fungus Eurotiumsp. SCSIO F452[J]. Org Lett, 2018, 20: 4593–4596. DOI:10.1021/acs.orglett.8b01880 |
| [72] | Wang W, Zeng F, Bie Q, et al. Cytochathiazines A-C: three merocytochalasans with a 2H-1, 4-thiazine functionality from coculture of Chaetomium globosum and Aspergillus flavipes[J]. Org Lett, 2018, 20: 6817–6821. DOI:10.1021/acs.orglett.8b02942 |
| [73] | Yin GP, Wu YR, Han C, et al. Asperones A-E, five dimeric polyketides with new carbon skeletons from the fungus Aspergillus sp. AWG 1-15[J]. Org Chem Front, 2018, 5: 2432–2436. DOI:10.1039/C8QO00070K |
| [74] | Zang Y, Genta-Jouve G, Zheng Y, et al. Griseofamines A and B: two indole-tetramic acid alkaloids with 6/5/6/5 and 6/5/7/5 ring systems from Penicillium griseofulvum[J]. Org Lett, 2018, 20: 2046–2050. DOI:10.1021/acs.orglett.8b00584 |
| [75] | Chen K, Sun W, Bie Q, et al. Fusopoltide A and fusosterede A, a polyketide with a pentaleno[1, 2-c]pyran ring system and a degraded steride, from the fungus Fusarium solani[J]. Tetrahedron Lett, 2018, 59: 2679–2682. DOI:10.1016/j.tetlet.2018.05.082 |
| [76] | Li H, Sun W, Deng M, et al. Asperversiamides, linearly fused prenylated indole alkaloids from the marine-derived fungus Aspergillus versicolor[J]. J Org Chem, 2018, 83: 8483–8492. DOI:10.1021/acs.joc.8b01087 |
| [77] | Zhang S, Huang Y, He S, et al. Heterocyclic compounds from the mushroom Albatrellus confluens and their inhibitions against lipopolysaccharides-induced B lymphocyte cell proliferation[J]. J Org Chem, 2018, 83: 10158–10165. DOI:10.1021/acs.joc.8b01420 |
| [78] | Hu Z, Sun W, Li F, et al. Fusicoccane-derived diterpenoids from Alternaria brassicicola: investigation of the structure-stability relationship and discovery of an IKKβ inhibitor[J]. Org Lett, 2018, 20: 5198–5202. DOI:10.1021/acs.orglett.8b02137 |
| [79] | Cui H, Liu Y, Li J, et al. Diaporindenes A-D: four unusual 2, 3-dihydro-1H-indene analogues with anti-inflammatory activities from the mangrove endophytic fungus Diaporthe sp. SYSU-HQ3[J]. J Org Chem, 2018, 83: 11804–11813. DOI:10.1021/acs.joc.8b01738 |
| [80] | Wang JP, Yu J, Shu Y, et al. Peniroquesines A-C: sesterterpenoids possessing a 5-6-5-6-5-fused pentacyclic ring system from Penicillium roqueforti YJ-14[J]. Org Lett, 2018, 20: 5853–5856. DOI:10.1021/acs.orglett.8b02534 |
| [81] | Gu BB, Wu W, Jiao FR, et al. Aspersecosteroids A and B, two 11 (9 > 10)-abeo-5, 10-secosteroids with a dioxatetraheterocyclic ring system from Aspergillus flocculosus 16D-1[J]. Org Lett, 2018, 20: 7957–7960. DOI:10.1021/acs.orglett.8b03530 |
| [82] | Zhang B, Wang KB, Wang W, et al. Discovery, biosynthesis, and heterologous production of streptoseomycin, an anti-microaerophilic bacteria macrodilactone[J]. Org Lett, 2018, 20: 2967–2971. DOI:10.1021/acs.orglett.8b01006 |
| [83] | Duan YC, Feng J, Bai N, et al. Four novel antibacterial sesquiterpene-alpha-amino acid quaternary ammonium hybrids from the mycelium of mushroom Stereum hirsutum[J]. Fitoterapia, 2018, 128: 213–217. DOI:10.1016/j.fitote.2018.05.026 |
| [84] | Song T, Chen M, Ge ZW, et al. Bioactive penicipyrrodiether A, an adduct of GKK1032 analogue and phenol a derivative, from a marine-sourced fungus Penicillium sp. ZZ380[J]. J Org Chem, 2018, 83: 13395–13401. DOI:10.1021/acs.joc.8b02172 |
| [85] | Pang XJ, Zhang SB, Xian PJ, et al. Emericellins A and B: two sesquiterpenoids with an unprecedented tricyclo[4, 4, 2, 1]hendecane scaffold from the liquid cultures of endophytic fungus Emericella sp. XL 029[J]. Fitoterapia, 2018, 131: 55–58. DOI:10.1016/j.fitote.2018.10.022 |
| [86] | Liu C, Yang C, Zeng Y, et al. Chartrenoline, a novel alkaloid isolated from a marine Streptomyces chartreusis NA02069[J]. Chin Chem Lett, 2019, 30: 44–46. DOI:10.1016/j.cclet.2018.10.030 |
| [87] | Li W, He J, Feng T, et al. Antroalbocin A, an antibacterial sesquiterpenoid from higher fungus Antrodiella albocinnamomea[J]. Org Lett, 2018, 20: 8019–8021. DOI:10.1021/acs.orglett.8b03595 |
| [88] | Wang WX, Li ZH, Feng T, et al. Curtachalasins A and B, two cytochalasans with a tetracyclic skeleton from the endophytic fungus Xylariacurta E10[J]. Org Lett, 2018, 20: 7758–7761. DOI:10.1021/acs.orglett.8b03110 |
| [89] | Li HL, Xu R, Li XM, et al. Simpterpenoid A, a meroterpenoid with a highly functionalized cyclohexadiene moiety featuring gem-propane-1, 2-dione and methylformate groups, from the mangrove-derived Penicillium simplicissimum MA-332[J]. Org Lett, 2018, 20: 1465–1468. DOI:10.1021/acs.orglett.8b00327 |
| [90] | Che Q, Qiao L, Han X, et al. Anthranosides A-C, anthranilate derivatives from a sponge-derived Streptomyces sp. CMN-62[J]. Org Lett, 2018, 20: 5466–5469. DOI:10.1021/acs.orglett.8b02382 |
| [91] | Huang H, Song Y, Li X, et al. Abyssomicin monomers and dimers from the marine-derived Streptomyces koyangensis SCSIO 5802[J]. J Nat Prod, 2018, 81: 1892–1898. DOI:10.1021/acs.jnatprod.8b00448 |
| [92] | Wang TT, Wei YJ, Ge HM, et al. Acaulide, an osteogenic macrodiolide from Acaulium sp. H-JQSF, an isopod-associated fungus[J]. Org Lett, 2018, 20: 1007–1010. DOI:10.1021/acs.orglett.7b03949 |
| [93] | Wang TT, Wei YJ, Ge HM, et al. Acaulins A and B, trimeric macrodiolides from Acaulium sp. H-JQSF[J]. Org Lett, 2018, 20: 2490–2493. DOI:10.1021/acs.orglett.8b00883 |
| [94] | Chen Y, Jiang N, Wei YJ, et al. Citrofulvicin, an antiosteoporotic polyketide from Penicillium velutinum[J]. Org Lett, 2018, 20: 3741–3744. DOI:10.1021/acs.orglett.8b01272 |
| [95] | Li Y, Zhu R, Zhang J, et al. Ophiosphaerellins A-I, polyketide-derived compounds from the endolichenic fungus Ophiosphaerella korrae[J]. ACS Omega, 2018, 3: 176–180. DOI:10.1021/acsomega.7b01668 |
| [96] | Wang YN, Xia GY, Wang LY, et al. Purpurolide A, 5/5/5 spirocyclic sesquiterpene lactone in nature from the endophytic fungus Penicillium purpurogenum[J]. Org Lett, 2018, 20: 7341–7344. DOI:10.1021/acs.orglett.8b03323 |
| [97] | Song YP, Shi ZZ, Miao FP, et al. Tricholumin A, a highly transformed ergosterol derivative from the alga-endophytic fungus Trichoderma asperellum[J]. Org Lett, 2018, 20: 6306–6309. DOI:10.1021/acs.orglett.8b02821 |
| [98] | Yang HX, Ai HL, Feng T, et al. Trichothecrotocins A-C, antiphytopathogenic agents from potato endophytic fungus Trichothecium crotocinigenum[J]. Org Lett, 2018, 20: 8069–8072. DOI:10.1021/acs.orglett.8b03735 |
| [99] | Zhang X, Wang TT, Xu QL, et al. Genome mining and comparative biosynthesis of meroterpenoids from two phylogenetically distinct fungi[J]. Angew Chem Int Ed, 2018, 57: 8184–8188. DOI:10.1002/anie.201804317 |
| [100] | Zhang S, Huang Y, He S, et al. Albatredines A and B, a pair of epimers with unusual natural heterocyclic skeletons from edible mushroom Albatrellus confluens[J]. RSC Adv, 2018, 8: 23914–23918. DOI:10.1039/C8RA04226H |
| [101] | Bian G, Hou A, Yuan Y, et al. Metabolic engineering-based rapid characterization of a sesquiterpene cyclase and the skeletons of fusariumdiene and fusagramineol from Fusarium graminearum[J]. Org Lett, 2018, 20: 1626–1629. DOI:10.1021/acs.orglett.8b00366 |
| [102] | Fan Y, Wang Y, Fu P, et al. Secopaxilline A, an indole-diterpenoid derivative from an aciduric Penicillium fungus, its identification and semisynthesis[J]. Org Chem Front, 2018, 5: 2835–2839. DOI:10.1039/C8QO00756J |
| [103] | Lin H, Lyu H, Zhou S, et al. Deletion of a global regulator LaeB leads to the discovery of novel polyketides in Aspergillus nidulans[J]. Org Biomol Chem, 2018, 16: 4973–4976. DOI:10.1039/C8OB01326H |
| [104] | Wang J, Li W, Wang H, et al. Pentaketide ansamycin microansamycins A-I from Micromonospora sp. reveal diverse post-PKS modifications[J]. Org Lett, 2018, 20: 1058–1061. DOI:10.1021/acs.orglett.7b04018 |
| [105] | Wang M, Chen D, Zhao Q, et al. Isolation, structure elucidation, and biosynthesis of a cysteate-containing nonribosomal peptide in Streptomyces lincolnensis[J]. J Org Chem, 2018, 83: 7102–7108. DOI:10.1021/acs.joc.8b00044 |
| [106] | Li TX, Liu RH, Wang XB, et al. Hypoxia-protective azaphilone adducts from Peyronellaea glomerata[J]. J Nat Prod, 2018, 81: 1148–1153. DOI:10.1021/acs.jnatprod.7b00663 |
| [107] | Jiao WH, Cheng BH, Chen GD, et al. Dysiarenone, a dimeric C21 meroterpenoid with inhibition of COX-2 expression from the marine sponge Dysidea arenaria[J]. Org Lett, 2018, 20: 3092–3095. DOI:10.1021/acs.orglett.8b01148 |
| [108] | Sun DY, Han GY, Yang NN, et al. Racemic trinorsesqui terpenoids from the Beihai sponge Spongia officinalis: structure and biomimetic total synthesis[J]. Org Chem Front, 2018, 5: 1022–1027. DOI:10.1039/C7QO01091E |
| [109] | Li K, Wang YF, Li XM, et al. Isolation, synthesis, and radical-scavenging activity of rhodomelin a, a ureidobromophenol from the marine red alga Rhodomela confervoides[J]. Org Lett, 2018, 20: 417–420. DOI:10.1021/acs.orglett.7b03716 |
| [110] | Ye F, Li J, Wu Y, et al. Sarinfacetamides A and B, nitrogenous diterpenoids with tricyclo[6.3.1.0(1, 5)]dodecane scaffold from the South China Sea soft coral Sarcophyton infundibuliforme[J]. Org Lett, 2018, 20: 2637–2640. DOI:10.1021/acs.orglett.8b00842 |
 2019, Vol. 54
2019, Vol. 54


