2. 沈阳药科大学 生命科学与生物制药学院, 辽宁 沈阳 110016;
3. 德国拜耳公司化学与药物研发部, 德国 D-42117;
4. 德国拜耳公司化学与药物研发部, 北京 100020
2. School of Life Sciences and Biological Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China;
3. Chemical and Pharmaceutical Development, Bayer AG D-42117, Germany;
4. Chemical and Pharmaceutical Development, Bayer AG, Beijing 100020, China
对于呼吸系统疾病, 肺部药物递送系统具有全身递药系统不可替代的优势, 其能够将药物直接递送到肺内, 较少的给药剂量即可发挥疗效, 同时降低了药物对全身的不良作用[1]。然而, 目前的市售吸入产品均为速释制剂[2], 药物在肺内停留时间较短, 需通过频繁给药维持药物治疗浓度, 大大降低了患者依从性[3]。因而, 科研人员尝试开发肺部缓控释药物递送系统, 以期延长药物治疗时间, 降低给药频次, 提高患者顺应性[4, 5]。
以聚乳酸羟基乙酸共聚物(polylactic acid-glycolic acid, PLGA)为载体构建的微球体系在肺部缓控释递药系统中具有独特优势[6, 7]。PLGA具有很好的生物相容性和生物可降解性, 研究表明其在体外对人气道细胞不存在毒性, 同时在小鼠体内也显示出安全性[8]。结合吸入粒子在肺内的沉积规律, 即直径较大的粒子(> 5 μm)容易沉积在口咽部, 而较小的粒子(< 0.5 μm)易随气流呼出, 吸入用微球通常设计在1~5 μm内, 以实现较为理想的肺沉积效果[9]。然而, 以巨噬细胞吞噬为主导的肺清除机制限制了吸入药物的肺内滞留。如何规避肺巨噬细胞的吞噬清除现已成为肺部缓控释制剂开发的主要挑战[10]。
聚乙二醇化(PEGylation)作为规避单核巨噬细胞系统清除的“隐身衣” (stealth), 在全身给药系统中得到了广泛应用[11]。其形成的水化云/水化壳大大减弱了粒子与血液成分(如调理素)的非特异性作用, 抑制补体系统激活, 使粒子不被识别, 从而避免被免疫系统清除[12]。基于聚乙二醇(polyethylene glycol, PEG)这一逃逸清除机制, 越来越多的研究者将其应用于肺部缓控释药物的递送[13, 14]。
本实验在以PLGA为载体的微球体系中, 引入聚乙二醇-二硬脂酰磷脂酰乙醇胺(polyethylene glycol-distearoyl-glycero-phosphoethanolamine, PEG-DSPE), 制备了表面包裹有PEG的PLGA微球。通过选用不同分子量的PEG-DSPE材料, 考察PEG-DSPE链长及不同包裹比例对巨噬细胞(RAW264.7细胞系)摄取粒子的影响。
材料与方法仪器 Ultra Turrax T25高速剪切器[IKA® (广州)仪器设备有限公司]; 外压式膜乳化器(日本SPG集团); HELOS/KP激光粒度仪(德国新帕泰克公司); 全波长多功能酶标仪(美国Thermo Scientific公司); XDS-1B倒置显微镜(重庆光电仪器有限公司); Quanta SC流式细胞仪(美国Beckman Coulter公司)。
材料 聚乳酸-羟基乙酸共聚物[PLGA, Resomer® RG 503H, 赢创德固赛(中国)投资有限公司上海分公司]; 聚乙烯醇(PVA 205, 日本可乐丽株式会社); 聚乙二醇单甲醚-二硬脂酰磷脂酰乙醇胺(mPEG-DSPE, 上海艾伟拓医药科技有限公司); 香豆素-6 (coumarin 6)、RPMI-1640培养基(RPMI medium 1640)、双抗灭菌液(青霉素/链霉素溶液)、磷酸盐缓冲液(PBS, 细胞培养级)、D-Hanks平衡盐溶液(不含酚红) (大连美仑生物技术有限公司); 胰蛋白酶(Trypsin, 美国Amresco公司); 标准胎牛血清(fetal bovine serum, FBS, 德国SeraPro公司); 色谱级二氯甲烷和甲醇(山东禹王实业有限公司); 其他化学试剂, 无特殊说明, 均为分析纯级别。
细胞与培养 本文所选用的细胞系为鼠源性巨噬细胞RAW264.7 (中国科学院上海细胞库)。将细胞接种于培养瓶中, 加入RPMI-1640培养液(含10% FBS)于37 ℃、5% CO2培养箱中培养。
包载荧光探针香豆素-6吸入微球的制备 本文选用优化的预混膜乳化联合溶剂挥发法制备PEG磷脂包裹的PLGA微球, 并将香豆素-6包载于其中, 具体方法如下:首先精确称取6.0 mg香豆素-6, 与600.0 mg PLGA及一定量的PEG磷脂一起溶于3 mL二氯甲烷中得到油相。在8 000 r·min-1剪切条件下, 将该油相缓慢注入50 mL含有0.1% (w/v) PVA稳定剂的水相中, 乳化40 s, 随后, 该乳液在一定氮气压力下挤压过SPG膜(膜孔5 μm) 3次。所得终乳快速转移至250 mL水相中, 在25 ℃恒温水浴中连续搅拌4 h以挥发溶剂。离心(2 000 r·min-1)收集固化的PLGA微粒, 并用水充分洗涤3次。最后冷冻干燥得到干粉样品。
吸入微球粒径及理论空气动力学径的表征 通过激光粒度仪测定各处方中粒子的粒径, 用体积平均粒径(Dv, 50)表示粒子的几何直径, 并计算跨度值(Span)以衡量粒径分布状态, 公式(1)如下:
| ${\mathop{\rm Span}\nolimits} = \frac{{{D_{{\rm{v}},90}} - {D_{{\rm{v}},10}}}}{{{D_{{\rm{v}},50}}}} $ | (1) |
式中, Dv, 90和Dv, 10是粒径累积分布频率在90%和10%处的粒径。
粒子的质量中值空气动力学直径(mass median aerodynamic diameter, MMAD)相当于单位密度在静止空气中的终端速度与粒子相同的球体的直径, 由公式(2)计算得到[4]:
| ${\rm{MMAD}} = d{\left( {\rho /{\rho _0}\chi } \right)^{\frac{1}{2}}} $ | (2) |
式中, d为粒径测量项中得到的粒子的几何直径, ρ代表样品的振实密度(已知质量的粉末经敲击500次体积达到恒定后的密度), ρ0为单位密度, χ为颗粒的动力学形态系数, 表示粒子形状与球形度的偏差, 此处视为理想化的球形。
粒子体外沉积性质的考察 根据美国药典第<601>章中吸入气溶胶颗粒检测的相关内容, 吸入粒子的体外空气动力学性质可通过配有人工喉和预分离器的新一代撞击器(next generation impactor, NGI)进行评价[15]。具体方法如下:将含有10% (v/v) Tween-20的乙醇溶液加入NGI的各收集盘中, 挥发掉溶剂形成薄膜涂层。选用3号HPMC胶囊装填药物粉末, 并将胶囊装入Cyclohaler给药装置。连接NGI仪器, 设定流速为100 L·min-1, 每个胶囊的触发时间为2.4 s。待粒子沉降完毕后, 收集各盘中药物微粒, 测定其内药物含量(M)。根据NGI各级粒子沉降的百分比, 利用NGI附带软件计算MMAD与几何标准偏差(geometric standard deviation, GSD), 喷射剂量(emitted fraction, EF)与可吸入细粉量(fine particulate fraction, FPF)由分别通过公式(3)和公式(4)计算得到[16]:
| ${\rm{EF\% = }}\frac{{{M_{({\rm{ Induction port }} + {\rm{ Pre - separator }} + {\rm{ all stages }})}}}}{{{M_{({\rm{ Capsule }} + {\rm{ Induction\;port }} + {\rm{ Pre }} - {\rm{ separator }} + {\rm{ all stages }}}})}} $ | (3) |
| ${\rm{FPF\% = }}\frac{{{M_{{\rm{ stage\;}}1 - 5}}}}{{{M_{({\rm{ Induction\;port }} + {\rm{ Pre - separator }} + {\rm{ all stages }}}})}} $ | (4) |
香豆素-6包封产率的测定 各处方中香豆素-6在微球中的包封产率按照以下方法进行测定:精密称取10.0 mg样品, 将其充分溶解于1 mL二氯甲烷中, 并用甲醇稀释至50 mL。将混合物以10 000 r·min-1离心10 min, 取上清液通过酶标仪测定荧光强度(λex = 466 nm, λem = 504 nm)。包封产率(encapsulation efficiency, EE)通过公式(5)计算:
| ${\rm{EF}}\left( \% \right) = \frac{{{M_{{\rm{ actual\;drug\;loaded }}}}}}{{{M_{{\rm{ theoretical\;drug\;loaded }}}}}} \times 100\% $ | (5) |
形貌观察 通过S-3400N型扫描电子显微镜来观察微球形貌。将少量粉末铺散在带有双面胶的铝质载样台上并真空喷金。在一定电压下, 观察微粒的表面形态并拍照。
香豆素-6体外泄漏的测定 精确称量包载荧光素样品10.0 mg分散于2 mL细胞培养液(不含酚红)中, 并置于气浴恒温振荡器中连续孵育(37 ℃, 80 r·min-1)。在预定时间点内取出样品, 离心收集上清液进行酶标仪分析(λex= 466 nm, λem = 504 nm)。弃去剩余上清液, 并补加培养液2 mL, 涡旋以使样品重新分散后放入气浴振荡器中继续孵育。
体外细胞毒性的考察 采用MTT分析法评估各PEG磷脂包裹微粒对RAW264.7巨噬细胞存活率的影响。将RAW264.7细胞接种到96孔板中(每孔5×104个细胞), 制剂以预定浓度(0.2 mg·mL-1)加入到各孔中, 与巨噬细胞共孵育24 h。随后将MTT储备液(5 mg·mL-1)添加到各孔中, 继续孵育4 h, 再用100 μL二甲基亚砜替换培养基, 并在570 nm处用酶标仪测定溶液的吸光度值(A)。实验组(experiment)为加药孵育的细胞, 对照组(control)为未加药孵育的细胞, 空白组(blank)为不含细胞的溶液。最后, 根据公式(6)计算细胞存活率(CV):
| ${\rm{CV}}\left( \% \right) = \frac{{{A_{{{experiment}}}} - {A_{{{blank}}}}}}{{{A_{{{control}}}} - A_{{{blank}}}^\prime }} \times 100\% $ | (6) |
巨噬细胞摄取实验 将对数生长期的巨噬细胞(RAW264.7)以每毫升5×105个细胞接种于6孔板中, 加入RPMI-1640培养液(含10% FBS), 并置于37 ℃、5% CO2培养箱中平衡24 h使其贴壁生长。随后取出培养板, 更换新鲜培养液。将制备好的香豆素-6各处方均匀地分散到细胞培养基中(每孔相当于4 μg香豆素-6), 并在37 ℃下与巨噬细胞共孵育。分别在4、12和24 h后, 去除培养基, 用PBS洗涤细胞3次, 离心收集细胞。弃去上清液, 将细胞重分散到PBS中, 用流式细胞仪测定荧光强度。另外, 使用光学显微镜观察并拍摄24 h巨噬细胞对各制剂的摄取情况。
统计学方法 数据以至少3次独立测量的平均值±标准差(x ± s)表示。使用Prism 5 (美国GraphPad软件)和单因素方差分析法进行统计分析, P < 0.05被认为具有统计学意义。
结果与讨论 1 微球的理化性质本文通过优化的预混膜乳化-溶剂挥发法制备PEG-DSPE包裹的PLGA微球。通过预实验对工艺参数的筛选, 确定工艺参数为PLGA 600.0 mg、油:水相比例3:300、剪切转速8 000 r·min-1、均质时间40 s、膜孔径5 μm和过膜次数3次。
各处方理化性质的表征结果如表 1所示。经过膜整粒, 各制剂粒子粒径成功控制在3~5 μm内, 且呈现均匀的粒径分布。粒子形貌如图 1所示(选取未包裹PLGA微球及PEG2000-DSPE/PLGA 1:1微球制剂为代表), 观察到的粒子大小及粒径分布与表 1结果基本一致, 球形度良好。载体对香豆素-6的包封产率为90%左右。综上, PEG-DSPE分子量及比例的不同未对微球理化性质产生显著影响。
| Table 1 Physicochemical properties of coumarin 6-loaded, PEG-DSPE-coated PLGA microparticles prepared by premix membrane emulsification (PME)/solvent evaporation. n = 3, x ± s. PEG-DSPE: Polyethylene glycol-distearoyl-glycero-phosphoethanolamine; PLGA: Polylactic acid-glycolic acid; MMADt: Theoretical mass median aerodynamic diameter |

|
Figure 1 Morphology characteristics of the PLGA microparticles (MP) |
PEG-DSPE是一种被广泛使用的两亲性材料, 在乳化过程中, 经油水相混合, 其疏水端自发分散到PLGA疏水性材料表面, 暴露出PEG亲水端, 随着溶剂挥发, 其疏水端与固化的PLGA骨架相互缠绕, 达到包裹目的[17]。实验中, 选取多种分子量的PEG-DSPE材料, 以考察PEG链长对细胞摄取的影响。同时, 每种分子量材料固定高、低两种比例, 从而探究PEG-DSPE比例对细胞摄取的影响。
鉴于粒径在2~5 μm的微球更易被巨噬细胞吞噬[18], 为了消除粒径对细胞摄取的干扰并突出PEG磷脂包裹的作用, 需要制备粒径在此范围内的微球。由于微球粒径大小及分布与其固化前液滴的大小密切相关, 因而在传统溶剂挥发法基础上, 联合使用“预混膜乳化法” (premix membrane emulsification, PME), 以期通过对液滴大小的控制来调控微球大小[19]。通过这一制备方法, 将脂溶性荧光染料(香豆素-6)包载到PLGA微球中, 对微球进行荧光标记, 以便于流式细胞仪定量细胞摄取粒子情况[20]。考虑到荧光素荧光强度与检测系统的适应性, 其理论载药量固定为1% (w/w)。
2 微球的空气动力学径及体外沉积如表 1所示, 各处方粒子的理论空气动力学径(theoretical mass median aerodynamic diameter, MMADt)均处于3~5 μm。通常, 大颗粒(MMAD > 5 μm)受惰性撞击作用沉积在上呼吸道(口咽部); 1~5 μm粒子以重力沉降方式沉积在中心和远端束气道中; 小粒子(MMAD < 0.1 μm)往往会随气流呼出体外[4]。本研究中各处方的粒子可以以重力沉降方式沉积在肺深部, 符合干粉吸入的要求[15]。
在得到理论的粒子空气动力学径基础上, 利用NGI对粒子进行体外肺模拟沉积实验, 以比较各处方粒子沉积行为的差异。经NGI实验测定, 粒子在各级的沉降水平如图 2所示。根据粒子在NGI各级的沉积量, 结合公式计算得到各制剂空气动力学参数, 如表 2所示。经计算, 各制剂喷射剂量相近, 均高于60%, 可吸入细粉量均达到要求(> 20%), 实际测定的质量中值空气动力学径(practical mass median aerodynamic diameter, MMADp)均处于3~5 μm, 符合规定[15]。可以看到各制剂均具有较好的体外沉积行为, 可用于肺部吸入药物递送。

|
Figure 2 In vitro aerodynamic diameter distributions of PLGA microparticles coated by PEG-DSPE with different molecular weights of PEG in low molar ratio (PEG-DSPE/PLGA 0.25:1) (A) or high molar ratio (PEG-DSPE/PLGA 1:1) (B) as measured by next generation impactor (NGI). n = 3, x ± s |
| Table 2 Aerodynamic parameters of the tested formulations.n = 3, x ± s. MMADp: Practical mass median aerodynamic diameter; GSD: Geometric standard deviation |
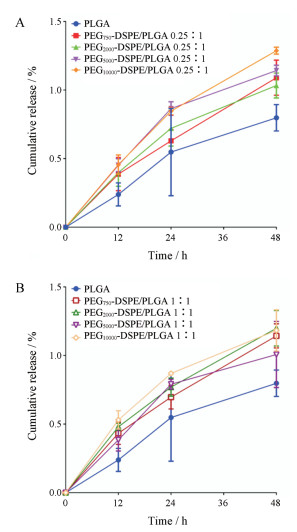
荧光探针常被包载于微粒给药系统中用于制剂结构、细胞摄取及转运、体内示踪及分布的研究, 其出现促进了新型给药系统的迅速发展[20], 其中, 香豆素-6是广泛使用的脂溶性荧光染料。为排除香豆素-6泄漏造成细胞摄取定量假阳性, 需在细胞液中考察制剂中香豆素-6的泄漏情况。选取不含酚红的细胞液进行实验以避免介质对香豆素-6荧光检测产生干扰。孵育48 h后, 各制剂香豆素-6释放行为如图 3所示。各制剂48 h内香豆素-6累积释放均小于1.5%, 表明该荧光素能够稳定地包载于微球中, 不易泄漏, 可作为荧光标记物较准确地定量微球被巨噬细胞摄取程度, 游离香豆素-6的细胞摄取可以忽略。
|
Figure 3 In vitro drug release behavior of coumarin 6-loaded PLGA microparticles coated by PEG-DSPE with different molecular weights of PEG in low molar ratio (PEG-DSPE/PLGA 0.25:1) (A) or high molar ratio (PEG-DSPE/PLGA 1:1) (B). n = 3, x ± s |
通过MTT法测定了各制剂对巨噬细胞RAW264.7的毒性[21]。各制剂组孵育细胞存活率如图 4所示。各组细胞存活率均在90%以上, 说明在预定浓度下(0.2 mg·mL-1), 各制剂对细胞几乎没有毒性。因此, 采用相同浓度的制剂进行后续细胞摄取实验, 确保细胞可以正常发挥吞噬功能, 避免细胞活性对结果的干扰[22]。

|
Figure 4 Cell viability of RAW264.7 cells incubated with coumarin 6-loaded microparticles for 24 h. n = 3, x ± s |
选用被广泛使用的鼠源性RAW264.7巨噬细胞系进行体外细胞摄取实验[23], 探究PEG-DSPE包裹及其链长对细胞摄取的影响, 同时选用流式技术对细胞摄取的荧光标记制剂进行定量分析, 通过流式细胞分析对区域的划门处理(gated), 可以将被测细胞与未洗净的非吞噬性微粒(体积小、荧光强度高)区分开来[24]。
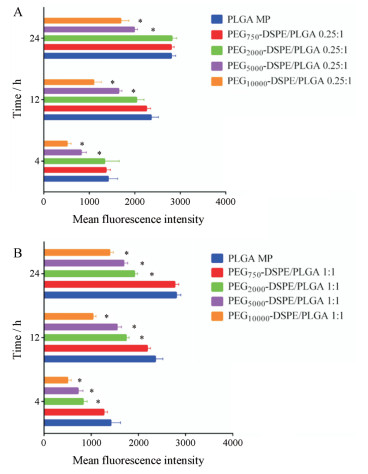
各低比例制剂组(PEG-DSPE/PLGA 0.25:1)在4、12和24 h的细胞摄取量如图 5A所示。随着孵育时间的延长, 细胞内荧光强度逐渐增强。PEG750-DSPE和PEG2000-DSPE的包裹与未包裹PLGA微球(对照组)相比, 各时间点细胞摄取量均无显著差异。随着PEG分子量的增加, 相比于对照组, PEG5000-DSPE与PEG10000-DSPE组显著减弱了细胞对粒子的吞噬程度(P < 0.05)。孵育24 h后, PEG5000-DSPE组与PEG10000-DSPE组细胞的荧光强度分别为对照组的71%和60%。
|
Figure 5 Mean fluorescence intensity in RAW264.7 cell line as quantified by flow cytometry after 4, 12 and 24 h of incubation at 37 ℃ with PLGA microparticles coated by PEG-DSPE with different molecular weights of PEG in (A) low (0.25:1) or (B) high (1:1) molar ratio (PEG-DSPE/PLGA). n= 3, x ± s. *P < 0.05 vs PLGA MP group |
各高比例制剂组(PEG-DSPE/PLGA 1:1)在4、12和24 h的细胞摄取量如图 5B所示。与对照组相比, 高比例PEG750-DSPE包裹没有显著改变细胞的吞噬程度, 而高比例PEG2000-DSPE包裹显著减弱了巨噬细胞对粒子的摄取。同样地, 高比例的PEG5000-DSPE与PEG10000-DSPE包裹微球后均可显著减弱细胞对粒子的摄取能力, 但对应的高/低比例组之间无统计学差异(P > 0.05)。
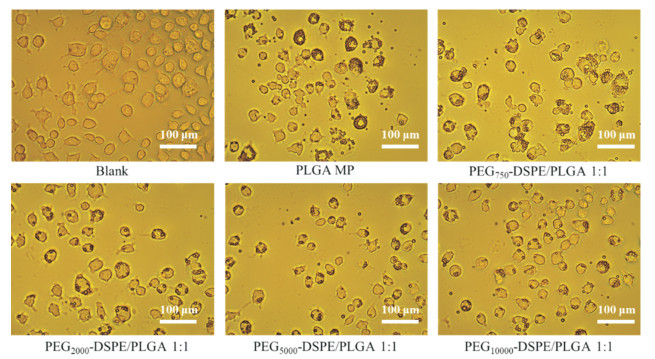
通过显微镜成像进一步观察孵育24 h RAW264.7巨噬细胞对各低比例制剂(图 6)和各高比例制剂(图 7)的摄取情况, 各制剂细胞摄取趋势与定量分析结果基本一致。

|
Figure 6 Images of RAW264.7 cells cultivated with coumarin 6-loaded PLGA microparticles coated by PEG-DSPE with different molecular weights of PEG in low molar ratio (PEG-DSPE/PLGA 0.25:1) after 24 h at 37 ℃ (scale bar = 100 μm) |
|
Figure 7 Images of RAW264.7 cells cultivated with coumarin 6-loaded PLGA microparticles coated by PEG-DSPE with different molecular weights of PEG in high molar ratio (PEG-DSPE/PLGA 1:1) after 24 h at 37 ℃ (scale bar = 100 μm) |
本文中PEG分子量对于粒子的巨噬细胞摄取具有显著影响。随着PEG分子量的增加, 在达到5 kDa及以上时, PEG-DSPE的包裹可显著减弱巨噬细胞吞噬粒子的能力。这是由于此时PEG链所形成的空间位阻阻碍了细胞对粒子的进一步接触, 从而抑制粒子被巨噬细胞内化的过程[25]。聚乙二醇化(PEGylation)通过减少粒子与血浆蛋白及单核巨噬细胞的相互作用改善粒子体内循环半衰期[26]。该“聚乙二醇化效应” (PEGylated effect)高度依赖于聚乙二醇(PEG)的分子量、链结构及表面分布密度[27]。PEG分子量的大小表示PEG链的长短, 这一参数直接反映了PEG分子形成空间位阻的程度[28]。研究表明, PEG链产生的空间位阻能够干扰所修饰物的生物作用, 且随着链长的不断变化, 2 kDa与5 kDa PEG分子质量之间存在一个临界值使生物活性达到最佳[29]。另有文献[30]报道, PEG分子量对调节药物体内循环时间具有重要作用, 药代动力学参数可随着PEG分子量的增加而逐渐改善。基于以上研究, 可以看到PEG分子量对于减弱包裹粒子被巨噬细胞吞噬的重要意义。
经PEG-DSPE高比例(PEG-DSPE/PLGA 1:1)包裹的PLGA微球, 当所用PEG分子质量达到2 000 Da及以上时, 均可显著减弱巨噬细胞的吞噬作用(与对照组相比); 对于PEG分子质量2 000 Da的PEG-DSPE材料而言, 可通过增加PEG在粒子表面的分布比例达到减弱巨噬细胞吞噬的效果。根据PEG链长及链与链间距离等参数, PEG链构象通常分为“蘑菇状” (mushroom)与“刷子状” (brush)两种。“蘑菇状”构象是由低密度PEG覆盖形成的, PEG链没有完全从颗粒表面延伸, 形成的PEG层较薄。当PEG密度达到一定程度后, PEG链从颗粒表面向外伸展, 呈“刷子状”排列, 形成一层较厚的膜[27]。基于以上了解, 本文在探究PEG分子量对巨噬细胞摄取影响基础上, 设定了高、低两种摩尔比(PEG-DSPE/PLGA)处方, 以考察PEG比例对减弱细胞吞噬微粒的作用。大量研究表明, 分子质量在2~10 kDa的高密度聚乙二醇包裹能够实现粒子的“隐身”性能[31]。因而, 在设计防止肺巨噬细胞摄取的吸入聚乙二醇化缓控释制剂时, PEG-DSPE链长及比例对其与巨噬细胞相互作用的影响应是重点关注的问题。本文为肺部缓控释递药系统构建提供了新的思路。
结论本文以减弱肺巨噬细胞吞噬为出发点, 制备了一种经PEG-DSPE包裹的PLGA吸入微球, 并考察了PEG-DSPE链长及比例对粒子细胞摄取的影响。结果显示, 与未包裹制剂相比, PEG5000-DSPE与PEG10000-DSPE包裹的制剂可显著减弱细胞的吞噬行为; 对于PEG2000-DSPE包裹的微球, 可通过增加PEG在粒子表面的比例达到同样的减弱巨噬细胞吞噬效果。这说明PEG-DSPE链长及比例是影响巨噬细胞吞噬的关键因素, 在肺部缓控释递药系统中, 可通过选用高分子量PEG-DSPE (PEG5000-DSPE、PEG10000-DSPE)或高比例(PEG-DSPE/PLGA 1:1) PEG2000-DSPE包裹微球, 达到减弱肺巨噬细胞吞噬、延长药物作用时间的目的。
致谢: 感谢德国拜耳公司对本课题的支持。
| [1] | Larsson K, Menzies-Gow A, Panettieri Jr R. Severe asthma: challenges and precision approaches to therapy[J]. Pulm Ther, 2018, 2: 139–152. |
| [2] | Mehta P. Dry powder inhalers: a focus on advancements in novel drug delivery systems[J]. J Drug Deliv, 2016, 2016: 8290963. |
| [3] | Dhand R. Aerosol therapy for asthma[J]. Curr Opin Pulm Med, 2000, 6: 59–70. DOI:10.1097/00063198-200001000-00012 |
| [4] | Loira-Pastoriza C, Todoroff J, Vanbever R. Delivery strategies for sustained drug release in the lungs[J]. Adv Drug Deliv Rev, 2014, 75: 81–91. DOI:10.1016/j.addr.2014.05.017 |
| [5] | Liang ZL, Ni R, Zhou JY, et al. Recent advances in controlled pulmonary drug delivery[J]. Drug Discov Today, 2015, 20: 380–389. DOI:10.1016/j.drudis.2014.09.020 |
| [6] | Ni R, Muenster U, Zhao J, et al. Exploring polyvinylpyrrolidone in the engineering of large porous PLGA microparticles via single emulsion method with tunable sustained release in the lung: in vitro and in vivo characterization[J]. J Control Release, 2017, 249: 11–22. DOI:10.1016/j.jconrel.2017.01.023 |
| [7] | Zhang L, Yang LL, Zhang XF, et al. Sustained therapeutic efficacy of budesonide-loaded chitosan swellable microparticles after lung delivery: influence of in vitro release, treatment interval and dose[J]. J Control Release, 2018, 283: 163–174. DOI:10.1016/j.jconrel.2018.05.031 |
| [8] | Weers JG, Miller DP. Formulation design of dry powders for inhalation[J]. J Pharm Sci, 2015, 104: 3259–3288. DOI:10.1002/jps.24574 |
| [9] | Kawakami K, Sumitani C, Yoshihashi Y, et al. Investigation of the dynamic process during spray-drying to improve aerodynamic performance of inhalation particles[J]. Int J Pharm, 2010, 390: 250–259. DOI:10.1016/j.ijpharm.2010.02.018 |
| [10] | Mowat AM, Scott CL, Bain CC. Barrier-tissue macrophages: functional adaptation to environmental challenges[J]. Nat Med, 2017, 23: 1258–1270. DOI:10.1038/nm.4430 |
| [11] | Suk JS, Xu Q, Kim N, et al. PEGylation as a strategy for improving nanoparticle-based drug and gene delivery[J]. Adv Drug Deliv Rev, 2016, 99: 28–51. DOI:10.1016/j.addr.2015.09.012 |
| [12] | Guichard MJ, Leal T, Vanbever R. PEGylation, an approach for improving the pulmonary delivery of biopharmaceuticals[J]. Curr Opin Colloid Interface Sci, 2017, 31: 43–50. DOI:10.1016/j.cocis.2017.08.001 |
| [13] | Luo T, Loira-Pastoriza C, Patil HP, et al. PEGylation of paclitaxel largely improves its safety and anti-tumor efficacy following pulmonary delivery in a mouse model of lung carcinoma[J]. J Control Release, 2016, 239: 62–71. DOI:10.1016/j.jconrel.2016.08.008 |
| [14] | Muralidharan P, Mallory E, Malapit M, et al. Inhalable PEGylated phospholipid nanocarriers and PEGylated therapeutics for respiratory delivery as aerosolized colloidal dispersions and dry powder inhalers[J]. Pharmaceutics, 2014, 6: 333–353. DOI:10.3390/pharmaceutics6020333 |
| [15] | Ziffels S, Bemelmans NL, Durham PG, et al. In vitro dry powder inhaler formulation performance considerations[J]. J Control Release, 2015, 199: 45–52. DOI:10.1016/j.jconrel.2014.11.035 |
| [16] | Liang ZL, Wang XH, Ni R, et al. Preparation of budesonide sustained-release dry powder for inhalation and influence of lactose content[J]. Acta Pharm Sin (药学学报), 2015, 50: 1180–1185. |
| [17] | Takami T, Murakami Y. Development of PEG-PLA/PLGA microparticles for pulmonary drug delivery prepared by a novel emulsification technique assisted with amphiphilic block copolymers[J]. Colloids Surf B Biointerfaces, 2011, 87: 433–438. DOI:10.1016/j.colsurfb.2011.06.004 |
| [18] | Gordon S. Phagocytosis: an immunobiologic process[J]. Immunity, 2016, 44: 463–475. DOI:10.1016/j.immuni.2016.02.026 |
| [19] | Vladisavljević GT. Structured microparticles with tailored properties produced by membrane emulsification[J]. Adv Colloid Interface Sci, 2015, 225: 53–87. DOI:10.1016/j.cis.2015.07.013 |
| [20] | Rivolta I, Panariti A, Lettiero B, et al. Cellular uptake of coumarin-6 as a model drug loaded in solid lipid nanoparticles[J]. J Physiol Pharmacol, 2011, 62: 45–53. |
| [21] | Ahmadian S, Barar J, Saei AA, et al. Cellular toxicity of nanogenomedicine in MCF-7 cell line: MTT assay[J]. J Vis Exp, 2009, 26: 1191–1196. |
| [22] | Hittinger M, Juntke J, Kletting S, et al. Preclinical safety and efficacy models for pulmonary drug delivery of antimicrobials with focus on in vitro models[J]. Adv Drug Deliv Rev, 2015, 85: 44–56. DOI:10.1016/j.addr.2014.10.011 |
| [23] | Zheng HL, Li JQ, Luo X, et al. Murine RAW264.7 cells as cellular drug delivery carriers for tumor therapy: a good idea?[J]. Cancer Chemother Pharmacol, 2019, 83: 361–374. DOI:10.1007/s00280-018-3735-0 |
| [24] | Rasola A, Geuna M. A flow cytometry assay simultaneously detects independent apoptotic parameters[J]. Cytometry, 2001, 45: 151–157. DOI:10.1002/(ISSN)1097-0320 |
| [25] | Badkas A, Frank E, Zhou Z, et al. Modulation of in vitro phagocytic uptake and immunogenicity potential of modified Herceptin®-conjugated PLGA-PEG nanoparticles for drug delivery[J]. Colloids Surf B Biointerfaces, 2018, 162: 271–278. DOI:10.1016/j.colsurfb.2017.12.001 |
| [26] | Xu Y, Shi L, Deng YH. Effect of polyethylene glycol-lipid derivatives on the stability of grafted liposomes[J]. Acta Pharm Sin (药学学报), 2011, 46: 1178–1186. |
| [27] | Perry JL, Reuter KG, Kai MP, et al. PEGylated PRINT nanoparticles: the impact of PEG density on protein binding, macrophage association, biodistribution, and pharmacokinetics[J]. Nano Lett, 2012, 12: 5304–5310. DOI:10.1021/nl302638g |
| [28] | Knop K, Hoogenboom R, Fischer D, et al. Poly(ethylene glycol) in drug delivery: pros and cons as well as potential alternatives[J]. Angew Chem Int Ed, 2010, 49: 6288–6308. DOI:10.1002/anie.200902672 |
| [29] | Youn YS, Kwon MJ, Na DH, et al. Improved intrapulmonary delivery of site-specific PEGylated salmon calcitonin: optimization by PEG size selection[J]. J Control Release, 2008, 125: 68–75. DOI:10.1016/j.jconrel.2007.10.008 |
| [30] | Mehta D, Leong N, Mcleod VM, et al. Reducing dendrimer generation and PEG chain length increases drug release and promotes anticancer activity of PEGylated polylysine dendrimers conjugated with doxorubicin via a cathepsin-cleavable peptide linker[J]. Mol Pharm, 2018, 15: 4568–4576. DOI:10.1021/acs.molpharmaceut.8b00581 |
| [31] | Benhabbour SR, Sheardown H, Adronov A. Protein resistance of PEG-functionalized dendronized surfaces: effect of PEG molecular weight and dendron generation[J]. Macromolecules, 2008, 41: 4817–4823. DOI:10.1021/ma8004586 |
 2019, Vol. 54
2019, Vol. 54


