2. 清华大学深圳研究生院, 广东 深圳 518055;
3. 中山大学药学院·深圳, 广东 深圳 510275
2. Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055, China;
3. School of Pharmaceutical Sciences(Shenzhen), Sun Yat-Sen University, Shenzhen 510275, China
癌症的免疫治疗是指通过人为的方法刺激免疫系统, 提高免疫系统对肿瘤细胞识别和杀伤能力的一种治疗手段[1, 2]。过去10年间癌症免疫治疗得到不断发展, 它已经在众多临床试验中取得突破, 这也使癌症免疫治疗领域受到了前所未有的关注, 2018年的诺贝尔生理学或医学奖更是授予了两位研究癌症免疫治疗的科学家。目前癌症免疫治疗的手段主要包括免疫检查点阻断[3, 4]、肿瘤疫苗[5]和CAR-T细胞治疗[6]等。
肿瘤疫苗作为免疫治疗重要的组成部分之一也取得了巨大突破, 越来越多的疫苗正在进行Ⅱ期或Ⅲ期临床试验, 主要包括针对黑色素瘤[7]和前列腺癌[8]等。然而, 目前肿瘤抗原的鉴定还是十分困难[9], 并且其免疫原性较低, 引起的免疫反应弱, 这大大阻碍了肿瘤疫苗的发展。机体内的抗原提呈细胞摄取肿瘤疫苗中的抗原, 并对肿瘤抗原进行加工以抗原肽-MHC分子复合物的形式将抗原呈递给T细胞, 进而启动机体的免疫应答杀伤肿瘤细胞。树突状细胞(DC)是人体中最有效的抗原提呈细胞[10], 对免疫系统的激活至关重要, 通常一般的抗原提呈细胞只可以将内源性抗原-MHC Ⅰ复合体呈递给CD8+ T细胞或外源性抗原-MHC Ⅱ复合体递呈给CD4+ T细胞, 但是DC细胞不但可以完成这种传统的抗原提呈方式, 而且可以通过交叉提呈的方式将外源性抗原与MHC Ⅰ复合体结合呈递给CD8+ T细胞。因此, DC细胞能更有效地激活CD4+和CD8+ T细胞的活性, 加强DC细胞的活性能够增强肿瘤疫苗引起的免疫应答。
黑磷是一种新型的半导体二维材料, 具有非常好的光热转换效应[11], 由于它具有良好生物相容性, 能够在体内降解为无毒的磷酸盐和磷酸酯, 已经广泛用于光热治疗的研究中[12-14]。虽然随着全基因组测序技术的进步, 肿瘤抗原已可以被筛选出来, 但是成本太高、耗费时间过长, 要想普及还有一定的难度[15]。就算肿瘤抗原被鉴定出来, 大部分的肿瘤抗原的免疫原性较弱, 不足以引起免疫反应。因此, 基于作者前期的研究结果提出设想, 将癌细胞膜作为肿瘤抗原的来源, 用它包裹黑磷量子点(black phosphorus quantum dots, BPQDs), 当DC细胞吞噬后, 通过红外照射引起的光热效应刺激DC细胞的成熟, 使它能够激活机体的免疫系统对抗癌症。本研究以生物相容性非常好的BPQDs作为光热材料刺激DC细胞成熟, 希望能为癌症疫苗的研究提供一种新的思路。
材料与方法材料 黑磷(奥地利Smart Elements公司); N-甲基吡咯烷酮(N-methypyrrolidine, NMP, 美国Aladdin公司); RPMI-1640培养基、胎牛血清(FBS) (美国Gibco公司); Cy5.5、白介素-4 (IL 4) (美国Invitrogen公司); Fluorescein isothiocyanate (FITC, 上海拓旸生物科技有限公司); 细胞培养瓶、细胞培养板(美国Thermo Fisher Scientific公司); BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司); 小鼠乳腺癌细胞4T1 (南京科佰生物科技有限公司); 粒细胞巨噬细胞集落刺激因子(北京义翘神州生物科技有限公司)。
仪器 细胞超声破碎仪(美国Sonics公司); KQ-300GDV水浴超声仪(昆山超声设备股份有限公司); FEI spirit T12透射电子显微镜(TEM, 日本日立公司); 纳米粒度及Zeta电位仪(英国Malvern公司); Leica DMIL倒置光学显微镜(德国Leica公司); FV1000激光扫描共聚焦显微镜(日本奥林巴斯公司)。
动物 Balb/c小鼠, SPF级, 雌性, 6~8周, 体重15~17 g, 购自广东省实验动物中心, 许可证号为SCKX (粤) 2013-0002。所有动物实验均经过清华大学动物伦理委员会批准。
BPQDs的制备 将黑磷晶体20 mg加入到装有40 mL NMP的离心管中, 置于冰水浴中用探头进行超声, 功率为500 W, 超声振幅为25%, 超声20 s, 间歇10 s, 连续超声8 h。然后进行水浴超声, 功率为300 W, 超声功率为100%, 连续超声8 h。超声结束后将样品先6 000 ×g离心30 min, 去除大片的黑磷纳米片, 再27 000 ×g离心1.5 h, 去除上清, 保留沉淀, 保存于NMP中, 4 ℃保存。
BPQDs浓度的测定 采用电感耦合等离子体原子发射光谱仪测定BPQDs的浓度。取终浓度BPQDs悬液500 μL加ddH2O 500 μL定容至1 mL。在样品中加入浓硝酸2 mL, 消化过夜使其成为原子状态。第2天将样品玻璃小瓶开盖敞口, 放入加热套中100 ℃加热, 蒸发至500 μL溶液, 然后加ddH2O 2 mL继续蒸发, 至500 μL液体。再在500 μL样品中加ddH2O 4.5 mL定容至5 mL, 相当于稀释了10倍, 此样品用于检测。测试前需要配置梯度标准磷元素溶液用于做标准曲线。
癌细胞的提取 为了得到癌细胞的细胞膜, 用150 mm皿培养癌细胞。4T1-luc细胞的培养条件: 1640培养基+10%胎牛血清+1%双抗+1 μg·mL-1嘌呤霉素。待细胞长满后用0.25%胰酶消化, 采用磷酸盐缓冲液(PBS)洗1~2次, 最后用含有0.1 mmol·L-1 PMSF (phenylmethanesulfonyl fluoride)蛋白酶抑制剂的HM溶液重悬。将细胞转移到匀浆器中, 在冰上杵200次, 将得到的匀浆1 000 ×g离心5 min (去掉细胞核), 取上清液3 000 ×g离心5 min, 得到的上清继续20 000 ×g离心30 min, 取沉淀。用含0.1 mmol·L-1 PMSF蛋白酶抑制剂的HM溶液重悬, 置于4 ℃保存。
癌细胞膜蛋白浓度的测定 用BCA法测定蛋白的浓度。在96孔板中将标准品按比例稀释成0、25、50、100、200、300、400和500 mg·mL-1质量浓度用于做标准曲线。将含有癌细胞膜的样品稀释10倍后, 加样品20 μL到96孔板中。每孔中加入BCA工作液200 μL, 在37 ℃培养箱中放置30 min。用酶标仪测定波长562 nm下的吸光度值, 最后根据标准曲线和样品稀释的倍数来确定样品的蛋白浓度。
BPQD-CCNVs的制备 将含有BPQDs的NMP液体以27 000 ×g离心1.5 h, 去除NMP, 加入PBS重悬、吹打分散均匀, 再用探头超声, 功率为500 W, 超声振幅为25%, 超声20 s, 间歇10 s, 连续超声5 min。将BPQDs质量浓度为200 μg·mL-1的PBS悬液500 μL与癌细胞膜蛋白质量浓度为200 μg·mL-1 HM溶液500 μL混合, 水浴超声5 min (300 W, 100%功率), 即可获得BPQD-CCNVs。
BPQD-CCNVs的表征 取BPQD-CCNVs 10 μL滴于有支持膜的铜网上, 静置30 min, 用滤纸吸走多余液体, 重复2次。吸取醋酸铀10µL滴于铜网上染色2 min, 蒸馏水洗3次, 真空干燥后用透射电子显微镜进行观察。取适量含有BPQD-CCNVs的悬液, 稀释后用纳米粒度及Zeta电位仪测其粒径。
温度上升曲线的测定 将1 mL BPQDs质量浓度为50 μg·mL-1的BPQDs PBS悬液和1 mL BPQD-CCNVs PBS悬液加入到24孔板中, 用1 W·cm-2的808 nm近红外光照射10 min, 红外热成像仪记录温度的变化, 以PBS作为对照组。
骨髓来源的树突状细胞(BMDC)的体外培养 用颈椎脱臼法将Balb/c小鼠(6~10周龄)处死, 取出所有股骨和胫骨并将骨周围的肌肉组织用剪刀剔除。将骨移至超净台内, 在70%酒精中浸泡5 min进行消毒灭菌, 然后用无菌PBS清洗2次。再将骨移入另一个盛有PBS的新培养皿中, 剪去骨的两端, 将含有PBS的注射器的针头插入骨髓腔中反复冲洗出骨髓直至骨头全部变白。将骨髓悬液转移到离心管中, 用200目尼龙网滤去小碎片和肌肉组织, 1 200 r·min-1离心5 min, 弃上清, 用红细胞裂液重悬细胞, 在室温下孵育5 min, 再1 200 r·min-1离心5 min, 弃红色上清, 将得到的细胞用含10% FBS的1640完全培养基(含20 ng·mL-1 GM-SF和10 ng·mL-1 IL 4)进行培养, 对骨髓细胞进行细胞计数, 将浓度调整为每毫升1×106个细胞, 加到12孔板中, 每孔1 mL。此后每两天更换3/4体积的新鲜培养液。第6天, 轻轻吹打培养液, 收集悬浮细胞及疏松贴壁生长的细胞; 1 200 r·min-1离心5 min, 弃上清; 用上面提到的培养基重悬细胞并计数, 重新调整浓度至每毫升1×106个细胞, 加到24孔板中继续培养1~2天。
细胞摄取实验 将癌细胞膜和BPQDs分别用cy5.5和FITC进行荧光标记制备BPQD-CCNVs。将DC细胞以每孔1×105个接种于12孔板中, 加入荧光标记的BPQD-CCNVs, 于37 ℃培养箱中孵育2 h; 用DAPI (4', 6-diamidino-2-phenylindole)对细胞核进行染色10 min, 吸取培养基于1 200 r·min-1离心5 min, PBS重悬, 重复3次; 取10 µL滴于载玻片上, 盖上盖玻片, 置于激光扫描共聚焦显微镜下观察拍照。
细胞活性检测 收集10 000个DC细胞加到96孔板中, 分别加入BPQDs和BPQD-CCNVs的PBS悬液, 共同孵育24 h后, 加入MTS 20 µL继续孵育2 h, 用490 nm波长在酶标仪上检测各孔的吸光度值。
DC细胞的体外激活实验 为了验证基于BPQD-CCNVs的光热效应对DC的激活作用, 设置了4个组, 分别是: blank (#1)、BPQD-CCNVs (#2)、BPQD-CCNVs+ NIR (#3)和LPS (#4)。将100 µL加到含有DC细胞的24孔板中, 放入37 ℃恒温培养箱中培养24 h。对于需要进行红外光热组, 用1 W·cm-2的808 nm近红外光照射10 min, 再放回培养箱。24 h后收集各组的细胞悬液, 1 200 r·min-1离心5 min, 弃上清, 用PBS重悬, 重复3遍。用staining buffer重悬, 取1×105个细胞, 用anti-CD11c-APC、anti-CD80-FITC、anti-CD86-PE和anti-MHC Ⅱ-Percp/Cy5.5抗体按体积比1:100对各组的DC细胞在冰上避光染色30 min, 1 200 r·min-1离心5 min, staining buffer重悬, 重复3次, 用流式分析仪进行检测, 采用FlowJo进行分析。
统计学方法 用GraphPad Prism 5.0软件进行数据处理, 所有实验数据均用x ± s表示, 各组之间比较采用单因素方差分析(one-way ANOVA), P < 0.05表示具有统计学差异。
结果 1 BPQD-CCNVs的表征用TEM观察了BPQD-CCNVs的形态, 如图 1所示, BPQD-CCNVs呈球形的结构, 里面有很多的小黑点(BPQDs), 说明此方法能够成功包被BPQDs。用动态散射(DLS)法对BPQD-CCNVs的粒径和zeta电位进行分析, 结果如图 2所示, BPQD-CCNVs的粒径大约在220 nm左右, zeta电位为-23 mV。此zeta电位远高于BPQDs, 因为zeta电位越高, 粒子之间的静电排斥越强, 悬液中粒子的稳定性就越高, 这说明通过癌细胞膜的包被, BPQDs在分散剂中的稳定性增强了。
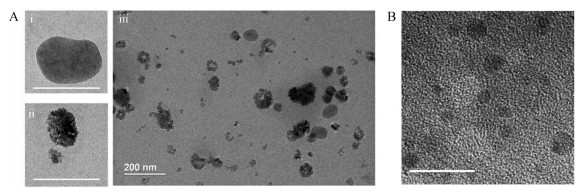
|
Figure 1 (A) Transmission electron microscope image of i) single CCNV (scale bar, 100 nm), ii) single BPQD-CCNV (scale bar, 100 nm) and iii) BPQD-CCNVs. (B) Transmission electron microscope image of BPQDs (scale bar, 20 nm). CCNV: Cancer cell membrane nanovesicle; BPQD: Black phosphorus quantum dot |
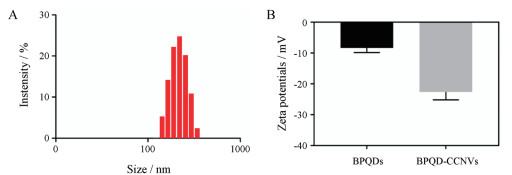
|
Figure 2 Size distribution of BPQD-CCNVs (A). Zeta potentials of BPQDs and BPQD-CCNVs (B). n = 3, x± s |
用MTS法验证了BPQDs和BPQD-CCNVs对DC细胞的毒性, 如图 3所示, 可以看到不同黑磷制剂对DC细胞存活率几乎没有变化。因此, 可以判断BPQDs和BPQD-CCNVs对细胞没有太大的毒性, 具有非常良好的生物相容性。并且在经过NIR照射之后, DC细胞的存活率也没有明显的变化, 证明了此方法的安全性。
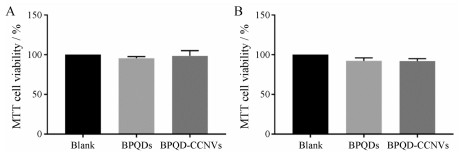
|
Figure 3 Cell viability of dendritic cells (DCs) after incubated with different formulations (A) and DCs 24 h after irradiated with 808 nm near infrared radiation (NIR) for 10 min when incubated with different formulations (B). n = 3, x± s |
采用共聚焦荧光显微镜观察DC细胞对BPQD-CCNVs的摄取情况, 结果如图 4所示, 蓝色荧光为细胞核, 绿色荧光为BPQDs, 紫色荧光为细胞膜, 可以看到在细胞核周围有许多紫色荧光和绿色荧光的重叠, 即被DC细胞摄取的CCNVs, 绿色荧光为CCNVs内的BPQDs, 说明BPQD可通过CCNVs被DC细胞摄取。
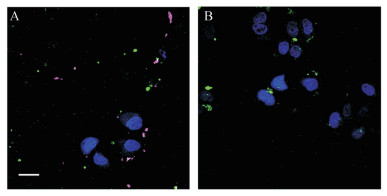
|
Figure 4 Confocal images of cell uptake of BPQD-CCNVs (A) and BPQDs (B). Scale bar, 10 μm |
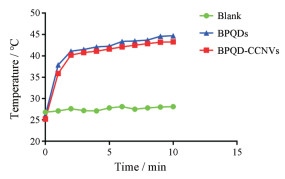
当DC细胞摄取BPQD-CCNVs后, 用808 nm近红外光对培养基进行照射, 如图 5所示, 随着时间的推移, BPQDs和BPQD-CCNVs组的培养基的温度逐渐升高, 最后都稳定在43 ℃左右, 而加入PBS组的温度并没有变化, 说明包裹细胞膜后对BPQDs的光热作用没有影响。
|
Figure 5 Time-dependent temperature increase of BPQDs and BPQD-CCNVs dispersed in phosphate buffer saline (PBS) and irradiated with 808 nm laser (1 W·cm-2) for 10 min |
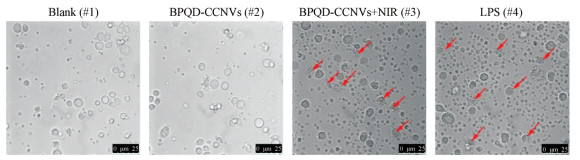
设置了4个组来验证光热效应对树突状细胞的激活作用, 分别是: blank (#1), BPQD-CCNVs (#2), BPQD-CCNVs + NIR (#3)和LPS (#4)。首先, 用倒置显微镜观察各孔中DC细胞的成熟情况, 如图 6所示。Blank (#1)和BPQD-CCNVs (#2)组的悬浮细胞形态没有变化, 始终保持圆形, 而BPQD-CCNVs + NIR (#3)和LPS (#4)组都可以看到许多有树突状结构的细胞(见红色箭头)。因此, 初步判断光热作用可以刺激DC细胞成熟。
|
Figure 6 Microscope image of DCs at 24 h after different treatments. The red arrow marked mature DCs. Scale bar, 25 μm |
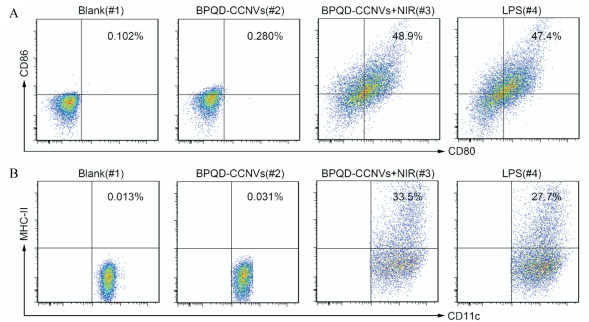
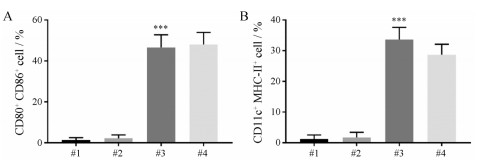
为了进一步验证DC细胞的成熟情况, 采用流式细胞分析仪对获得的细胞进行检测。对于流式分析的结果, 首先将anti-CD11c-APC标记的细胞圈出来作为DC细胞, 再分别对它的CD80、CD86和MHC-Ⅱ的表达情况进行分析。流式结果如图 7和8所示, 与blank(#1)相比, BPQD-CCNVs (#2)组的DC细胞中MMHC-Ⅱ、CD80和CD86的表达量并没有明显的变化, 而BPQD-CCNVs + NIR (#3)组和LPS (#4)组都有明显地上升, 这与倒置显微镜下观察的结果一致, 说明基于BPQD光热效应可以促进DC细胞的成熟。
|
Figure 7 Representative flow cytometry plots of CD80+ CD86+ DCs (gated on CD11C+) (A), CD11c+ MMHC-Ⅱ+ cells (gated on CD11c+) (B) from different treatment groups |
|
Figure 8 Quantitative analysis of CD80+ CD86+ DCs (gated on CD11c+ cells) (A) and CD11c+ MMHC-Ⅱ+ cells (B) from different groups. n = 3, x± s. #1: Blank; #2: BPQD-CCNVs; #3: BPQD-CCNVs+NIR; #4: LPS. ***P < 0.001 vs blank group |
免疫治疗是现今癌症治疗研究中最热门的领域, 主要包括免疫检查点阻断、CAR-T细胞治疗和肿瘤疫苗等。针对PD1/PDL-1和CTLA4的免疫检查点阻断剂在多种癌症的治疗中都取得了非常好的效果, 自2011年起, FDA已经批准5种PD1/PDL-1阻断剂药物上市[16]。而肿瘤疫苗作为癌症免疫治疗最活跃的领域之一, 也一直受到广泛的关注。目前的肿瘤疫苗主要包括: DC细胞疫苗[17]、多肽疫苗[18]和基因疫苗[19]。
DC细胞是哺乳动物中最有效的抗原提呈细胞[20], 在启动适应性免疫应答中发挥着重要的作用, 它能够通过交叉提呈的方式将外源性抗原MHC-Ⅰ复合物呈递给CD8+ T细胞, 因此它的激活程度对于抗肿瘤免疫反应的启动和强度至关重要。CD80又称为B7, CD86又称为B7-2, 两者均表达于活化的树突状细胞表面, 能够联合提供T细胞活化的共刺激信号; MMHC-Ⅱ是主要组织相容性复合体Ⅱ, 能够将胞外抗原通过抗原提呈的方式呈递给T细胞, 激活免疫系统[21]。经过光热作用后, DC细胞表面的MMHC-Ⅱ分子表达量升高了, 说明DC细胞的抗原提呈增加, 且CD80和CD86的表达量也都明显上升, 说明DC细胞刺激T细胞成熟的能力也增强了。本研究证明, 基于BPQD光热效应可以刺激DC细胞的成熟, 作者猜测这可能是因为它模拟了机体内发烧的过程[22]。
在本研究中, 将癌细胞膜作为载体包裹黑磷量子点制备了BPQD-CCNVs, 使它能够被树突状细胞吞噬, 再用808 nm近红外照射, 可以刺激树突状细胞成熟, 希望可以为肿瘤疫苗的开发提供一种新的策略。
| [1] | Wang RF, Wang HY. Immune targets and neoantigens for cancer immunotherapy and precision medicine[J]. Cell Res, 2017, 27: 11–37. DOI:10.1038/cr.2016.155 |
| [2] | Zhao ZJ, Chen Y, Francisco NM, et al. The application of CAR-T cell therapy in hematological malignancies: advantages and challenges[J]. Acta Pharm Sin B, 2018, 8: 539–551. DOI:10.1016/j.apsb.2018.03.001 |
| [3] | Baumeister SH, Freeman GJ, Dranoff G, et al. Coinhibitory pathways in mmunotherapy for cancer[J]. Annu Rev Immunol, 2016, 34: 539–573. DOI:10.1146/annurev-immunol-032414-112049 |
| [4] | Hwang WL, Pike L, Royce TJ, et al. Safety of combining radiotherapy with immune-checkpoint inhibition[J]. Nat Rev Clin Oncol, 2018, 15: 477–494. DOI:10.1038/s41571-018-0046-7 |
| [5] | Sahin U, Tureci O. Personalized vaccines for cancer immunotherapy[J]. Science, 2018, 359: 1355–1360. DOI:10.1126/science.aar7112 |
| [6] | Newick K, O'Brien S, Moon E, et al. CAR T cell therapy for solid tumors[J]. Annu Rev Med, 2017, 68: 139–152. DOI:10.1146/annurev-med-062315-120245 |
| [7] | Drake CG, Lipson EJ, Brahmer JR. Breathing new life into immunotherapy: review of melanoma, lung and kidney cancer[J]. Nat Rev Clin Oncol, 2014, 11: 24–37. DOI:10.1038/nrclinonc.2013.208 |
| [8] | Lubaroff DM. Prostate cancer vaccines in clinical trials[J]. Expert Rev Vaccines, 2012, 11: 857–868. DOI:10.1586/erv.12.54 |
| [9] | Coulie PG, Van den Eynde BJ, van der Bruggen P, et al. Tumour antigens recognized by T lymphocytes: at the core of cancer immunotherapy[J]. Nat Rev Cancer, 2014, 14: 135–146. DOI:10.1038/nrc3670 |
| [10] | Liu YF, Xue XX, Li ZY, et al. Effect of apigenin on dendritic cells maturation and function in murine splenocytes[J]. Acta Pharm Sin (药学学报), 2017, 52: 397–402. |
| [11] | Gusmao R, Sofer Z, Pumera M. Black phosphorus rediscovered: from bulk material to monolayers[J]. Angew Chem Int Ed Engl, 2017, 56: 8052–8072. DOI:10.1002/anie.v56.28 |
| [12] | Gui R, Jin H, Wang Z, et al. Black phosphorus quantum dots: synthesis, properties, functionalized modification and applications[J]. Chem Soc Rev, 2018, 47: 6795–6823. DOI:10.1039/C8CS00387D |
| [13] | Tao W, Zhu X, Yu X, et al. Black phosphorus nanosheets as a robust delivery platform for cancer theranostics[J]. Adv Mater, 2017. DOI:10.1002/adma.201603276 |
| [14] | Liang X, Ye X, Wang C, et al. Photothermal cancer immunotherapy by erythrocyte membrane-coated black phosphorus formulation[J]. J Control Release, 2019, 296: 150–161. DOI:10.1016/j.jconrel.2019.01.027 |
| [15] | Yee C, Lizee GA. Personalized therapy: tumor antigen discovery for adoptive cellular therapy[J]. Cancer J, 2017, 23: 144–148. DOI:10.1097/PPO.0000000000000255 |
| [16] | Mahoney KM, Rennert PD, Freeman GJ. Combination cancer immunotherapy and new immunomodulatory targets[J]. Nat Rev Drug Discov, 2015, 14: 561–584. DOI:10.1038/nrd4591 |
| [17] | Kastenmuller W, Kastenmüller K, Kurts C, et al. Dendritic cell-targeted vaccines--hope or hype?[J]. Nat Rev Immunol, 2014, 14: 705–711. DOI:10.1038/nri3727 |
| [18] | Yamada A, Sasada T, Noguchi M, et al. Next-generation peptide vaccines for advanced cancer[J]. Cancer Sci, 2013, 104: 15–21. DOI:10.1111/cas.2013.104.issue-1 |
| [19] | Aurisicchio L, Ciliberto G. Genetic cancer vaccines: current status and perspectives[J]. Expert Opin Biol Ther, 2012, 12: 1043–1058. DOI:10.1517/14712598.2012.689279 |
| [20] | Steinman RM. Decisions about dendritic cells: past, present, and future[J]. Annu Rev Immunol, 2012, 30: 1–22. DOI:10.1146/annurev-immunol-100311-102839 |
| [21] | Song Q, Zhang CD, Wu XH. Therapeutic cancer vaccines: from initial findings to prospects[J]. Immunol Lett, 2018, 196: 11–21. DOI:10.1016/j.imlet.2018.01.011 |
| [22] | Evans SS, Repasky EA, Fisher DT. Fever and the thermal regulation of immunity: the immune system feels the heat[J]. Nat Rev Immunol, 2015, 15: 335–349. DOI:10.1038/nri3843 |
 2019, Vol. 54
2019, Vol. 54


