介孔硅纳米材料由于比表面积大、生物相容性好、表面易于改性及低毒等特性, 成为一种新型的药物基因纳米储存器[1]。自从本世纪初科学家提出MCM-41型(mobil composition of matters N. 41)介孔硅可用于药物释放体系以来, 介孔硅纳米材料在药物缓释、控释及靶向输送等方面得到了长足发展[2, 3]。研究发现, 直径小于200 nm的介孔硅纳米粒(MSN), 可通过增强的渗透性和保留效应进入肿瘤组织[4, 5]。为了增强药物进入靶细胞的效率, 应避免其到达靶部位之前过早释放, 同时增强其在靶部位的精准释放[6]。利用肿瘤微环境的一些独特性质, 如缺氧[7]、低pH值[8]、高还原性[9]等, 可以开发和设计智能纳米递送系统, 以提高治疗效果[10-12]。
近年来, 随着癌症病例的急剧增加[13], 越来越多研究者把注意力放在了个性化癌症治疗及可示踪癌症治疗方面[14]。基于多种成像技术引导的癌症治疗, 如核磁成像[15]、PET/CT成像[16, 17]、光声成像[18, 19]和荧光共振能量转移成像[20]等有大量报道。其中, 得益于商品化荧光试剂的多样性及荧光成像技术的日趋精湛, 荧光成像技术已成为不可或缺的示踪手段[21]。然而, 商品化试剂的研发重点在于试剂的荧光效率, 不能满足肿瘤治疗过程中的多功能需求。乙醛化胱氨酸(AC)含有两个席夫碱, 其自发荧光是由席夫碱中两个C=N键的n-π*跃迁而诱导产生的[22, 23]。另外, AC具有二硫键, 癌细胞内高浓度谷胱甘肽可以使其断裂, 从而使得其功能多样化。
本研究构建了一种对肿瘤微环境敏感的智能荧光纳米复合物MSN-AC-PEI (图 1), 用于共同递送化疗药物多柔比星(DOX)和基因药物siBcl-2。AC含有两个席夫碱和-S-S-键, 赋予MSN优异的可示踪性和生物降解性。此外, 聚乙烯亚胺(PEI)的包覆不仅实现了堵孔作用, 而且可以负载siRNA。通过观察纳米载体材料在细胞质中的荧光, 可以实时捕获药物释放过程, 并明确药物作用的亚细胞位点。进一步研究表明, MSN-AC-PEI@DOX/siBcl-2可以被有效地递送到乳腺癌细胞MCF-7中以抑制Bcl-2表达, 促进细胞凋亡并抑制肿瘤细胞增殖。本研究通过引入具有自发荧光的化合物来修饰载体, 从而将药物载体递送过程的可视化和肿瘤治疗过程有机联系起来, 提高载体材料在杀伤癌症细胞过程中精准递送的能力。
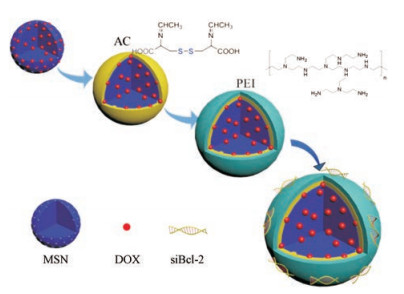
|
Figure 1 The representation of the formation of mesoporous silica-acetaldehyde modified cystine-polyethyleneimine (MSN-AC-PEI) nanocarriers for the co-delivery of small interfering RNA (siBcl-2) and doxorubicin (DOX) |
材料与试剂 十六烷基三甲基溴化铵(CTAB, 98%, 国药集团化学试剂有限公司); 正硅酸乙酯(TEOS, 98%)、3-氨丙基三乙氧基硅烷(APTES, 98%)、二乙醇胺(DEA)、肝素钠(≥185 u·mg-1, USP)、5, 5'二硫代双(2-硝基苯甲酸) (DTNB, 98%)、还原型谷胱甘肽(GSH, 98%)、支链聚乙烯亚胺(PEI1.8, 1.8 kDa) (阿拉丁化学试剂有限公司); 支链聚乙烯亚胺[PEI25, 25 kDa, 西格玛奥德里奇(上海)贸易有限公司]; 核糖核酸酶A [ > 50 U·mg-1, 生工生物工程(上海)股份有限公司]; 多柔比星(DOX, 98%, 大连美仑生物科技有限公司); Bcl-2 siRNA的序列为: CCGGGAGAUAGUGAUGAA GdTdT (正义链)、CUUCAUCACUAUCUCCCGGdTdT (反义链)、FAM-siBcl-2 (上海吉玛制药技术有限公司); 3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)、DMEM培养基(索莱宝科技有限公司); 胰蛋白酶-EDTA、Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术公司); 胎牛血清(FBS, 泽塔生命公司); 超纯水(MiliQ公司); 所有其他化学品和试剂均为分析级。
主要仪器 透射电子显微镜HT7700 (日立公司); 激光散射粒度仪Nano-ZS90 (英国马尔文公司); 荧光分光光度计Cary Eclipse (美国安捷伦公司); 酶标仪FLx800 (美国伯腾仪器有限公司); 热重分析仪Q50 (美国TA仪器); 激光共聚焦显微镜FLUOVIEW FV3000 (日本Olympus公司); 流式细胞仪FACSCalibur (美国BD公司); 冷冻干燥机BenchTop Pro (美国Virtis公司)。
细胞模型 人乳腺癌细胞MCF-7由郑州大学药学院惠赠, 培养于含10%胎牛血清DMEM培养液中, 在37 ℃、5% CO2培养箱中培养。每1~2天更换1次培养液。待细胞融合至80%后, 用0.25%胰蛋白酶作为消化液进行消化传代。
AC的合成 取胱氨酸1 g, 加去离子水50 mL, 超声搅拌均匀, 充分溶解。使用0.1 mol·L-1 NaOH溶液调pH值至10。快速滴加2 mL乙醛到胱氨酸溶液中, 然后室温搅拌24 h。再用0.1 mol·L-1 HCl溶液调pH值至7, 静置过夜。取上清液, 经12 000 r·min-1离心10 min后弃去沉淀, 冷冻干燥得到AC粉末。
MSN-AC-PEI的制备 ①称取2 g CTAB, 加去离子水200 mL, 95 ℃搅拌均匀后, 加DEA 320 μL, 接着滴加TEOS 16 mL, 95 ℃回流反应3 h, 用甲醇和去离子水交替洗涤6次, 12 000 r·min-1离心弃去上清, 60 ℃真空干燥12 h, 得白色MSN粉末; ②向0.5 g MSN中加无水乙醇50 mL, 搅拌使其分散, 然后滴加APTEs 4 mL, 36 ℃搅拌冷凝回流24 h。反应完毕, 用去离子水和乙醇交替洗涤6次, 按上述方法干燥; ③称量AC 320 mg, 加入400 mg EDC和NHS, 用0.1 mmol·L-1 PBS (pH 7.4)溶解, 室温下搅拌30 min, 加入NH2-MSN 240 mg, 室温搅拌12 h。反应结束后, 12 000 r·min-1离心10 min, 用上述PBS溶液反复洗涤3次后冷冻干燥得到NH2-MSN-AC; ④称取NH2-MSN-AC 10 mg, 加入20 mg NHS和EDC, 使用10 mL PBS溶液(10 mmol·L-1, pH 7.4)分散, 室温下搅拌30 min, 加入PEI, 室温下继续搅拌8 h。反应结束后, 再用0.1 mmol·L-1 PBS溶液(pH 7.4)反复离心洗涤3次后冷冻干燥, 得MSN-AC-PEI。
DOX的包载 称取NH2-MSN 15 mg, 加PBS (0.2 mol·L-1, pH 7.4) 10 mL, 再加入DOX (母液质量浓度5 mg·mL-1) 1.5 mL, 室温搅拌24 h后, DOX以物理吸附的方式进入NH2-MSN的介孔, 12 000 r·min-1离心10 min, 收集上清液, 于480 nm测吸光度(A)值, 带入标准曲线A = 0.011 6 C+ 0.047 1, 求得上清中DOX的浓度(C)。计算包载率= (DOX总 - DOX上清)/纳米材料总重。参照MSN-AC-PEI的制备方法再进行AC和PEI的修饰。
透射电镜的表征 取MSN及MSN-AC-PEI各3 mg, 分散于3 mL无水乙醇中, 制备成1 mg·mL-1溶液。超声分散20 min后, 取1滴样品滴覆在碳支持膜的铜网上, 等待其自然干燥后用透射电镜进行表征。
载体材料的粒径与电位 分别取MSN、NH2-MSN、NH2-MSN-AC和MSN-AC-PEI各2 mg分散在2 mL水中, 超声分散后, 用马尔文Nanosizer测定材料的粒径和电位。
材料的热重分析 分别取MSN、NH2-MSN、NH2-MSN-AC和MSN-AC-PEI各12 mg于试管中, 将试样填装紧密并轻敲以形成均匀薄层, 使试样间接触良好(有利于其热传导), 待机器预热结束, 把样品依次放入, 采用热重分析仪来对材料的性质进行表征。
MSN-AC-PEI的GSH消耗实验 为了研究MSN-AC-PEI对GSH消耗能力, 首先将0.5 mL各质量浓度的MSN-AC-PEI (0、62.5、125、187.5或250 μg·mL-1)溶液与等体积300 μmol·L-1还原型GSH溶液混合, 于25 ℃反应2 h, 再使用0.22 μm滤膜过滤, 加入DTNB试剂(终浓度150 μmol·L-1)作用10 min, 测定溶液在412 nm处A值。标准曲线的制作按上述方法进行。
空载体材料中PEI分子质量选择 为了探究PEI1.8与PEI25对siRNA的负载能力, 分别制备MSN-AC:PEI1.8 = 1:0.1和MSN-AC:PEI25 = 1:0.1两种载体材料。并设置载体材料与siRNA的质量比分别为0:1、10:1、20:1、40:1、60:1和80:1, 置于金属浴中(温度: 37 ℃, 转速: 300 r·min-1)孵育30 min, 取5 μL样品与1 μL上样缓冲液混合, 点样于1%的琼脂糖凝胶板。为了保证实验的统一性, 各个点样孔中siRNA质量固定为0.2 μg, 于110 V电泳20 min后, 进行凝胶成像。
RNA酶保护实验 为了验证载体材料对siRNA的保护能力, RNA酶被用于降解未被保护的siRNA, 肝素钠被用于置换结合在材料上的siRNA。设置了4组实验, 每组实验有4个样品, 分别为载体材料与siRNA的质量比分别为0:1、60:1、70:1和80:1。第1组实验未加RNA酶和肝素钠; 第2组实验中只加RNA酶; 第3组实验中只加肝素钠; 第4组实验中分别加入RNA酶和肝素钠。具体来说, 37 ℃孵育30 min, 完成载体材料对siRNA的负载; 每5 μL样品中加入RNA酶2.5 ng, 37 ℃孵育30 min进行酶解反应, 再通过80 ℃加热30 min终止RNA酶的活性; 每5 μL样品中加入肝素钠5 μg, 50 ℃孵育30 min, 置换已被结合的siRNA。再点样于1%的琼脂糖凝胶板, 进行电泳实验。
DOX释放行为研究 为了研究DOX的响应性释放行为, 分别称取氨基化介孔硅15 mg, 用4种不同缓冲液分别为0.1 mol·L-1 PBS (pH 5.0)、0.1 mol·L-1 PBS (pH 7.4)、含有10 mol·L-1 GSH的PBS (pH 5.0或7.4)各1.2 mL进行分散。然后将材料混悬液置于透析袋(MWCO = 3 500)中, 再将透析袋浸入对应的PBS (40 mL)中, 37 ℃、100 r·min-1避光振荡。于预先设定的时间点, 取样1 mL并于480 nm处测A值, 代入标准曲线得各时间点的释放量。为了保证溶液总体积恒定, 取样同时补充新鲜PBS缓冲液1 mL。
体外细胞毒性实验 将细胞以每孔1×104个铺于96孔板, 5% CO2、37 ℃条件下孵育过夜。待细胞贴壁后, 加入药液, 37 ℃条件下进行孵育(每隔一天细胞换液1次)。药物作用规定的时间后, 弃去旧的培养基, 加入MTT溶液(终质量浓度0.5 mg·mL-1) 200 μL, 继续培养4 h。小心弃去MTT残液, 每孔加入二甲基亚砜100 μL, 置于摇床上低速振荡10 min, 使结晶物充分溶解。于490 nm处测量各孔A值, 并计算细胞存活率。
细胞摄取实验 将细胞铺于激光共聚焦专用培养板, 5% CO2、37 ℃条件下孵育过夜, 待细胞贴壁后给药, 药物作用规定时间后, 吸去残液, 用PBS清洗3次后, 置于激光共聚焦荧光显微镜下进行拍照。
细胞凋亡实验 将细胞以每孔3×105个铺于6孔板, 5% CO2、37 ℃条件下孵育过夜, 待细胞贴壁后给药, 药物作用48 h后, 弃去药物残液。使用胰酶消化细胞, 加入培养基1~2 mL, 充分吹打细胞至单个分散, 1 000 r·min-1离心5 min后, 收集细胞。分别用预冷的PBS 2 mL和binding buffer 1 mL洗涤细胞沉淀1次。加入binding buffer 100 μL, 重悬细胞。按照Annexin V-FITC/PI凋亡检测试剂盒, 加FITC 5 μL, 涡旋; 再加PI 5 μL, 涡旋; 25 ℃水浴5 min; 最后按细胞密度加入PBS 100~500 μL, 采用流式细胞仪进行检测。
Western blot检测蛋白表达 将细胞以每孔3×105个铺于6孔板, 5% CO2、37 ℃条件下孵育过夜, 细胞贴壁后, 加入配制好的药液, 继续培养8 h, 换为完全培养基再培养64 h后, 提取各组的细胞总蛋白。根据蛋白浓度进行调整, 100 ℃煮沸5 min, 4 ℃冰箱保存, 备用。通过Western blot方法进行实验, 恒压120 V条件下电泳2.5 h, 恒流200 mA条件下转膜2 h、4 ℃条件下孵育抗体, 再通过曝光显影分析药物作用72 h后肿瘤细胞中Bcl-2蛋白的表达情况。
统计学方法 实验数据以x±s表示, 采用Origin进行统计学分析, 不同组别之间进行双侧t检验, 统计学的显著、非常显著和极非常显著差异分别表示为P < 0.05、P < 0.01和P < 0.001。
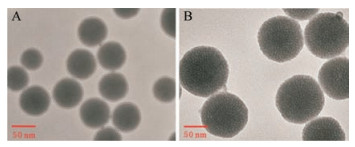
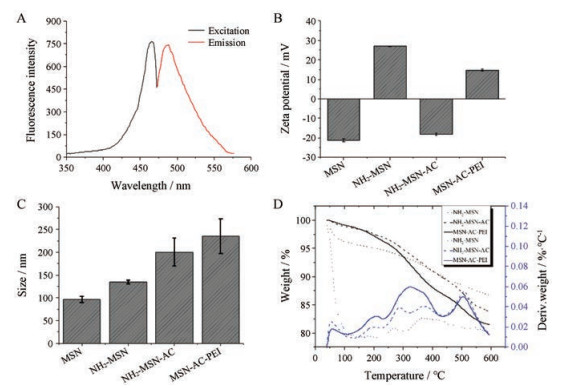
结果 1 纳米载体的制备与表征本文设计的载体材料MSN-AC-PEI是以MSN为中心, 通过共价键进行逐层修饰而获得的(图 1)。因MSN具有高度有序的介孔结构, 且在外层结合有阳离子聚电解质PEI, 因而该纳米载体材料可用作化疗药物和基因药物的载体。从图 2A、B的TEM图像中可以看出, 本研究合成了大小平均为58 nm、介孔大小一致、高度有序且分散均匀的MSN。图 3A为AC的荧光光谱, 其最大激发波长为465 nm, 最大发射波长为484 nm。随着AC和PEI的成功接枝, 使得纳米颗粒尺寸变大, 介孔变得模糊。AC和PEI在MSNs上的沉积过程也可以通过zeta电位的连续变化来监测。如图 3B, MSN的ζ电位为-21.27 mV, 氨基化后为26.97 mV。连接上AC后, ζ电位降至-18.13 mV, 聚电解质PEI的沉积使ζ电位增加至14.63 mV。另外, 通过动态光散射纳米激光粒度仪的测定数据, 可以反映纳米粒的直径随修饰物涂覆而发生变化的过程。MSN的水合粒径为96.27 nm, NH2-MSN为134.53 nm (图 3C)。在成功修饰AC并接枝PEI后, 纳米粒的水合直径分别增加至200.3和235.53 nm。从热重分析数据(图 3D)也可以看出, 当加热至600 ℃时, NH2-MSN、NH2-MSN-AC和MSN-AC-PEI的总重量损失分别为13.32%、16.13%和18.52%。因此, AC和PEI在MSN上的修饰量约为2.81%和2.39%。
|
Figure 2 TEM characterization of mesoporous silicon nanoparticles (MSN) (A) and MSN-AC-PEI nano-carriers (B) |
|
Figure 3 The fluorescence spectra of acetaldehyde cystine (AC) in aqueous suspension (A). The representative zeta potential (B), hydrodynamic diameters (C) and thermogravimetric analysis-differential thermal analysis (TG-DTA) of MSN, NH2-MSN, NH2-HMSN-AC and MSN-AC-PEI (D). n = 3, x±s |
siRNA的转染效率取决于纳米载体材料对siRNA的负载效率及MSN-AC-PEI@siBcl-2纳米复合物的稳定性。如图 4A所示, 为了提高siRNA的负载能力, 对不同分子质量PEI的负载水平进行了研究, 当使用PEI1.8时, 载体材料对siRNA的负载质量比可达到80:1, 而选择PEI25时, 载体材料对siRNA的负载质量比可以达到60:1。因而高分子量的PEI25对siRNA负载能力更好。
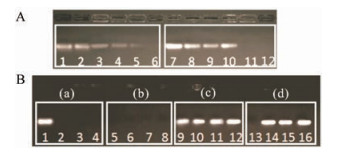
|
Figure 4 Agarose gel electrophoresis retardation assay of MSN-AC-PEI@siRNA complexes under various vector/siRNA mass ratios (0:1, 10:1, 20:1, 40:1, 60:1 and 80:1 from left to right). PEI1.8 was used for lane 1-6, and PEI25 was used for lane 7-12 (A). RNase protection assay of nanocomplexes (B). a: The MSN-AC-PEI@siRNA complexes with various vector/siRNA mass ratios (0:1, 60:1, 70:1, 80:1 from left to right); b: 5 ng·μL-1 RNase was added; c: 2 Heparin sodium (2 mg·mL-1) was added; d: 5 ng·μL-1 RNase and 2 mg·mL-1 heparin sodium were added |
众所周知, 裸siRNA在生理条件下不稳定, 容易受到体内RNA酶的降解, 而失去活性。因而为了提高基因沉默的效率, 纳米材料对siRNA的保护能力是极为重要的。如图 4B所示, 由于裸siRNA可以自由电泳, 且被Red plus染色, 故出现明亮条带(泳道1);合成的载体材料表面带正电荷, siRNA带有负电荷, 通过正负电荷吸引, siRNA被负载不能自由电泳, 不出现明亮条带(泳道2~4);加入RNA酶可降解裸siRNA, 条带消失(泳道5), 而泳道6~8亦未出现条带, 猜测是由于siRNA被载体负载, 不受酶降解作用; 裸siRNA被Red plus染色亦出现亮条带(泳道9), 加入肝素钠用于置换siRNA, 材料负载的siRNA被置换出来, 出现条带(泳道10~12);同时加入RNA酶和肝素钠, 没有材料保护时RNA酶降解siRNA, 条带消失(泳道13), 由于材料的保护作用, RNA酶不能降解材料表面的siRNA, 肝素钠将材料表面吸附的siRNA置换出来(泳道14~16)。结果证实, 本文制备的纳米载体材料可以有效保护siRNA免受RNA酶降解。
3 DOX的刺激响应性释放在不同的释放介质中DOX累积释放曲线如图 5A所示。由于AC结构的不稳定性, 在酸性条件和高浓度的GSH作用下, 酰胺键及二硫键会发生断裂, 从而引起介孔内部以物理吸附形式结合的DOX释放。在pH 7.4 PBS中, DOX在120 h的释放率仅1.87%, 这也保证了纳米载药系统在到达作用位点之前, 在生理环境下的“零释放”; 在pH 5的酸性环境下, 药物释放率增加至7.65%, 这体现了药物的pH值依赖型释放行为。当遇到10 mmol·L-1 GSH时, 药物释放可迅速上升至62.73%, 这表明AC结构内的二硫键可以在肿瘤微环境中裂解, 为药物的释放提供可能; 当同时存在低pH值、高GSH时, 累积释放进一步提高至65.57%, 这一点可以被AC消耗GSH的事实佐证。如图 5B所示, MSN-AC-PEI与GSH作用2 h后离心, 检测上清中GSH发现, 纳米载体以剂量依赖性方式导致GSH水平显著降低, 为DOX在肿瘤高浓度GSH微环境中的响应性释放提供保证。
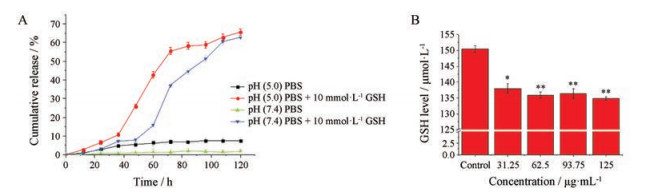
|
Figure 5 In vitro DOX release profiles of MSN-AC-PEI@DOX complexes in phosphate buffer saline (pH 5 or 7.4) with or without 10 mmol·L-1 glutathione (GSH) (A). GSH depletion by MSN-AC-PEI. The reduced GSH (150 μmol·L-1) was incubated with different concentrations of MSN-AC-PEI for 2 h and the free GSH was determined (B). n = 3, x±s. *P < 0.05, **P < 0.01 vs control |
本课题构建的MSN-AC-PEI纳米载药体系是一个具有示踪能力的纳米载体。其示踪能力来源于AC发射的荧光, 其最大激发波长为465 nm, 最大发射波长为484 nm。如图 6A所示, 给药6 h后, 具有绿色荧光的纳米载体材料进入细胞, 同时包埋在介孔中的具有红色荧光的DOX也一同被细胞摄取, 然后均匀分布在细胞质中。为了进一步验证纳米材料进入细胞的荧光强度, 将给药6 h后细胞进行了消化处理, 流式结果表明(图 6B), 对照组99.34%的细胞分布在第三象限, 表明没有药物处理的情况下, 细胞既不具有AC的绿色荧光, 也不具有DOX的红色荧光。当细胞摄取了具有绿色荧光的空载体MSN-AC-PEI后, 其绿色荧光强度比对照组增强了100倍。当载体材料携带DOX进入细胞后, 细胞同时具有AC的绿色荧光和DOX的红色荧光。图 7的激光共聚焦结果显示, 荧光纳米载体材料的示踪能力至少可持续24 h。给药24 h后, 仍可以清晰看到其在胞内的分布情况。
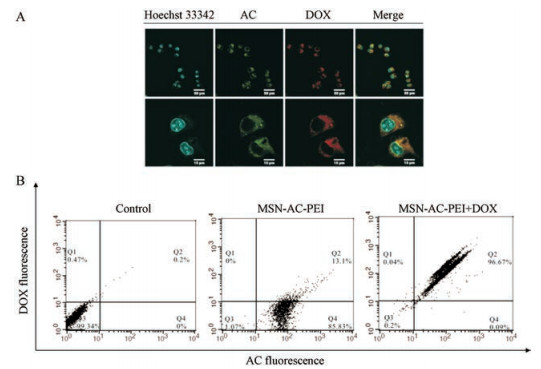
|
Figure 6 CLSM images of MCF-7 cells after incubation with MSN-AC-PEI@DOX complexes for 6 h (A). Scale bar: 50 μm (upper), 15 μm (bottom). Cellular uptake of different nanoparticles in MCF-7 cells for 6 h was determined by flow cytometry (B) |

|
Figure 7 CLSM images of MCF-7 cells after incubation with MSN-AC-PEI@DOX complexes for 2, 6 and 24 h |
通过MTT法测定了裸纳米载体, DOX或siBcl-2复合物及DOX和siBcl-2共递送纳米系统的细胞毒性。如图 8A所示, 随着空载体MSN-AC-PEI的给药浓度增大, 细胞对空载体的毒性显示出浓度依赖性。考虑到提高纳米载体浓度, 可以提高载药量, 并结合凝胶阻滞实验结果, 决定采用25 μg·mL-1空载体来进行下一步实验。如图 8B所示, 在与MCF-7细胞共培养24、48和72 h后, MCF-7细胞的细胞活力随培养时间的延长逐渐降低, 表明裸纳米载体材料MSN-AC-PEI具有时间依赖的细胞毒性。与裸纳米载体组相比, DOX或siBcl-2复合纳米系统的细胞活力, 在72 h分别降低至45.01%和55.90%。然而, DOX和siBcl-2共递送纳米系统显示出最佳的细胞毒性, 细胞存活率显著下降至35.32%。这些结果表明, 与单一DOX递送相比, siBcl-2和DOX的共递送可以增强化学治疗效果。
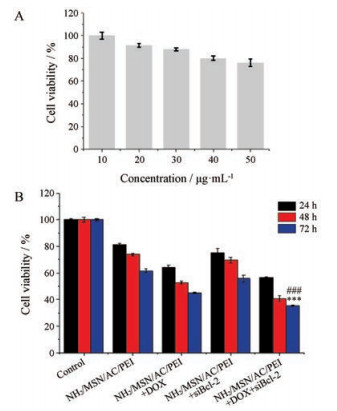
|
Figure 8 Cell viabilities of MCF-7 cells treated with different concentration of MSN-AC-PEI (A) and different formulations of DOX/ siBcl-2 for 24, 48 and 72 h (B). n = 4, x±s. ***P < 0.001 vs MSN-AC-PEI+DOX group, ###P < 0.001 vs MSN-AC-PEI+siBcl-2 group |
为了进一步研究不同纳米递送系统对MCF-7细胞的促凋亡作用, 采用膜联蛋白V-FITC凋亡检测试剂盒测定凋亡效率。结果如图 9所示, DOX和siBcl-2共递送纳米系统导致晚期凋亡细胞百分比为60.84%, 显著高于单独DOX (20.05%)或siBcl-2 (15.21%)递送系统的晚期凋亡率, 这可归因于基因/化学协同治疗对乳腺癌的影响。另外, 如图 10所示, 与对照组相比, MSN-AC-PEI@DOX和MSN-AC-PEI@siBcl-2均可显著抑制Bcl-2表达, 其抑制率分别达到69.33%和62.49%, 而化疗药物和基因药物的共递送系统MSN-AC-PEI@ DOX/siBcl-2对Bcl-2表达的抑制率可以达到93.46%, 综上所述, 纳米递药系统对肿瘤细胞增殖抑制能力与Bcl-2表达水平降低直接相关。
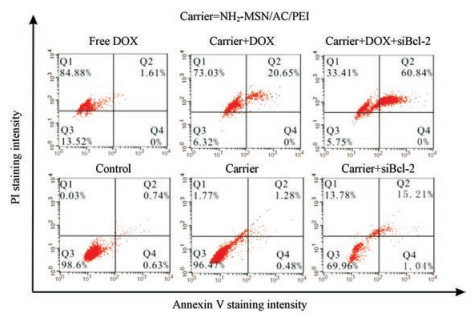
|
Figure 9 Annexin V-FITC apoptosis assay for the determination of apoptotic/necrotic cells in MCF-7 cells treated with different formulations for 48 h was detected by flow cytometry. Untreated cells were used as a control |

|
Figure 10 The expression level of Bcl-2 for control (1), naked carrier MSN-AC-PEI (2), MSN-AC-PEI@DOX nano system (3), MSN-AC-PEI@siBcl-2 nano system (4) and DOX/siBcl-2 co-delivery nano system (5) was evaluated by Western blot (A). Semi-quantitative analysis of immunoblotting assay (B). n = 3, x±s. ***P < 0.001 vs control |
介孔硅纳米粒具有有序的介孔结构, 且表面易于被修饰, 为其在可控释放领域的发展奠定了基础[24]。从DOX释放行为可以看出, 纳米药物在正常生理条件下(pH 7.4 PBS)的释放极低, 仅有1.874%, 主要原因在于介孔硅外层有高分子聚合物包覆, 作为门控元素, 对介孔进行堵孔, 可有效阻碍DOX到达作用位点前释放。在偏酸环境下(pH 5), DOX释放升高至7.65%, 这可能与AC结构中酸敏感的化学键“C=N”有关。而当遇到高浓度GSH时, DOX释放迅速升高至65.57%, 这是由于AC具有二硫键, 其可被谷胱甘肽消耗, 使DOX得到迅速释放。总之, 纳米材料具有酸性敏感性和GSH敏感性, 为DOX在细胞内的大量集聚奠定了基础。
本研究构建的荧光纳米载体MSN-AC-PEI, 可用于肿瘤细胞的示踪。由于纳米载体具有强烈的绿色荧光, 其在细胞内的分布可以被追溯至24 h, 这是由于AC的结构中含有席夫碱结构, 赋予材料良好的示踪能力。其荧光强度稳定, 且不易受复杂的细胞微环境影响, 具有一定的示踪优势。另外, 载体材料中PEI可提高siRNA的负载效率, 每微克纳米材料的siRNA负载率可以达到0.016 μg, 且该材料具有保护siBcl-2不受酶降解的作用, 这使得纳米材料基因药物复合体在细胞内可以实现基因沉默作用, 并抑制Bcl-2抗凋亡蛋白的表达, 进而促进肿瘤细胞的凋亡。
综上所述, 本文构建的载药体系MSN-AC-PEI是一种多功能的荧光标记的硅基纳米载体, 以MSN为本体材料, 并对此进行功能化修饰, 借助于荧光物质AC的标记, 完成对抗癌药物DOX的包埋和siBcl-2的负载, 从而实现对乳腺癌细胞的示踪, 并能显著抑制肿瘤细胞增殖作用。
| [1] | Zhou Y, Quan G, Wu Q, et al. Mesoporous silica nanoparticles for drug and gene delivery[J]. Acta Pharm Sin B, 2018, 8: 165–177. DOI:10.1016/j.apsb.2018.01.007 |
| [2] | Baeza A, Colilla M, Vallet-Regi M. Advances in mesoporous silica nanoparticles for targeted stimuli-responsive drug delivery[J]. Expert Opin Drug Del, 2015, 12: 319–337. DOI:10.1517/17425247.2014.953051 |
| [3] | Song Y, Li Y, Xu Q, et al. Mesoporous silica nanoparticles for stimuli-responsive controlled drug delivery: advances, challenges, and outlook[J]. Int J Nanomed, 2017, 12: 87–110. |
| [4] | Zhong Y, Meng F, Deng C, et al. Ligand-directed active tumor-targeting polymeric nanoparticles for cancer chemotherapy[J]. Biomacromolecules, 2014, 15: 1955–1969. DOI:10.1021/bm5003009 |
| [5] | Kobayashi H, Watanabe R, Choyke PL. Improving conventional enhanced permeability and retention (EPR) effects; what is the appropriate target?[J]. Theranostics, 2014, 4: 81–89. DOI:10.7150/thno.7193 |
| [6] | Du J, Lane LA, Nie S. Stimuli-responsive nanoparticles for targeting the tumor microenvironment[J]. J Control Release, 2015, 219: 205–214. DOI:10.1016/j.jconrel.2015.08.050 |
| [7] | Semenza GL. The hypoxic tumor microenvironment: a driving force for breast cancer progression[J]. Biochim Biophys Acta, 2016, 1863: 382–391. DOI:10.1016/j.bbamcr.2015.05.036 |
| [8] | Liu J, Huang Y, Kumar A, et al. pH-Sensitive nano-systems for drug delivery in cancer therapy[J]. Biotechnol Adv, 2014, 32: 693–710. DOI:10.1016/j.biotechadv.2013.11.009 |
| [9] | Quinn JF, Whittaker MR, Davis TP. Glutathione responsive polymers and their application in drug delivery systems[J]. Polym Chem, 2017, 8: 97–126. DOI:10.1039/C6PY01365A |
| [10] | Wen J, Yang K, Liu F, et al. Diverse gatekeepers for mesoporous silica nanoparticle based drug delivery systems[J]. Chem Soc Rev, 2017, 46: 6024–6045. DOI:10.1039/C7CS00219J |
| [11] | Dai Y, Xu C, Sun X, et al. Nanoparticle design strategies for enhanced anticancer therapy by exploiting the tumour microenvironment[J]. Chem Soc Rev, 2017, 46: 3830–3852. DOI:10.1039/C6CS00592F |
| [12] | Li R, He Y, Zhang S, et al. Cell membrane-based nanoparticles: a new biomimetic platform for tumor diagnosis and treatment[J]. Acta Pharm Sin B, 2018, 8: 14–22. DOI:10.1016/j.apsb.2017.11.009 |
| [13] | Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394–424. DOI:10.3322/caac.v68.6 |
| [14] | Li X, Kim J, Yoon J, et al. Cancer-associated, stimuli-driven, turn on theranostics for multimodality imaging and therapy[J]. Adv Mater, 2017, 29: 1606857. DOI:10.1002/adma.201606857 |
| [15] | Abdalla MO, Karna P, Sajja HK, et al. Enhanced noscapine delivery using uPAR-targeted optical-MR imaging trackable nanoparticles for prostate cancer therapy[J]. J Control Release, 2011, 149: 314–322. DOI:10.1016/j.jconrel.2010.10.030 |
| [16] | Garrigue P, Tang J, Ding L, et al. Self-assembling supramolecular dendrimer nanosystem for PET imaging of tumors[J]. Proc Natl Acad Sci USA, 2018, 115: 11454–11459. DOI:10.1073/pnas.1812938115 |
| [17] | Zhou M, Zhang R, Huang M, et al. A chelator-free multifunctional Cu-64 CuS nanoparticle platform for simultaneous micro-PET/CT imaging and photothermal ablation therapy[J]. J Am Chem Soc, 2010, 132: 15351–15358. DOI:10.1021/ja106855m |
| [18] | Zhong J, Wen L, Yang S, et al. Imaging-guided high-efficient photoacoustic tumor therapy with targeting gold nanorods[J]. Nanomed-Nanotechnol Biol Med, 2015, 11: 1499–1509. DOI:10.1016/j.nano.2015.04.002 |
| [19] | Qin H, Zhou T, Yang S, et al. Fluorescence quenching nanoprobes dedicated to in vivo photoacoustic imaging and high-efficient tumor therapy in deep-seated tissue[J]. Small, 2015, 11: 2675–2686. DOI:10.1002/smll.v11.22 |
| [20] | Yang J, Zhang R, Radford DC, et al. FRET-trackable biodegradable HPMA copolymer-epirubicin conjugates for ovarian carcinoma therapy[J]. J Control Release, 2015, 218: 36–44. DOI:10.1016/j.jconrel.2015.09.045 |
| [21] | Zhao J, Chen J, Ma S, et al. Recent developments in multimodality fluorescence imaging probes[J]. Acta Pharm Sin B, 2018, 8: 320–338. DOI:10.1016/j.apsb.2018.03.010 |
| [22] | Du X, Shi B, Tang Y, et al. Label-free dendrimer-like silica nanohybrids for traceable and controlled gene delivery[J]. Biomaterials, 2014, 35: 5580–5590. DOI:10.1016/j.biomaterials.2014.03.051 |
| [23] | Hu LL, Meng J, Zhang DD, et al. Functionalization of mesoporous organosilica nanocarrier for pH/glutathione dual-responsive drug delivery and imaging of cancer therapy process[J]. Talanta, 2018, 177: 203–211. DOI:10.1016/j.talanta.2017.07.017 |
| [24] | Yang B, Chen Y, Shi J. Exogenous/endogenous-triggered mesoporous silica cancer nanomedicine[J]. Adv Healthc Mater, 2018, 7: 1800268. DOI:10.1002/adhm.v7.20 |
 2019, Vol. 54
2019, Vol. 54


