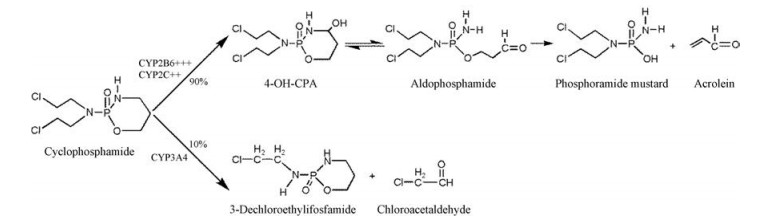
环磷酰胺(cyclophosphamide, CPA)是经典的烷化剂氮芥类衍生物, 在临床上广泛应用于恶性淋巴瘤、多发性骨髓瘤、白血病、乳腺癌等的治疗[1, 2]。环磷酰胺是一种需要代谢活化的前体药物[3], 如图 1[4]所示, 约90%的环磷酰胺在体内经由细胞色素P450酶体系CYP2B6、CYP2C9等羟基化产生4-羟基环磷酰胺, 并与其开环后形成的互变异构体醛磷酰胺共存, 醛磷酰胺通过非酶催化的β-消除反应生成两种化合物, 即磷酰胺氮芥和丙烯醛[5, 6]。磷酰胺氮芥通过释放烷基化的氮形成链间和链内DNA交联来干扰DNA复制, 阻滞快速增殖组织中的有丝分裂活动, 从而发挥抗肿瘤和免疫抑制的作用, 而丙烯醛是引起出血性膀胱炎等毒性症状的原因[7]。此外, 约10%的环磷酰胺经CYP3A4代谢产生无治疗作用的2-去氯乙基环磷酰胺[8]。
|
图 1 The metabolic pathway of cyclophosphamide[4] |
高剂量环磷酰胺可导致多器官毒性如血液(骨髓抑制)、肝毒性、生殖器官(性腺衰竭)、心脏毒性、膀胱毒性等[9]。据报道, 有临床患者在初始剂量给药后短时间内即出现肝损伤, 最早的不良反应在给药3 h后出现[9]。此外, 已有研究发现高剂量CPA诱导的肝损伤与其毒性代谢物丙烯醛相关[10, 11]。目前, 丙烯醛诱导肝损伤的机制尚不完全清楚, 但有研究表明丙烯醛能迅速消耗正常细胞内的还原型谷胱甘肽(glutathione, GSH), 导致活性氧(reactive oxygen species, ROS)的大量累积, 可攻击生物功能大分子, 随后引起氧化应激损伤和脂质过氧化, 进而破坏细胞的正常生理功能, 最终导致细胞死亡[12]。
核因子红细胞系相关因子-2 (nuclear factor-erythroid 2-related factor 2, NRF2)是调节和诱导细胞抗氧化基因和肝解毒酶基因表达的一种转录因子[13]。在生理状态下, NRF2与Kelch样ECH相关蛋白-1 (Kelch-like ECH-associated protein-1, Keap1)的偶联, 锚定在胞浆中。在氧化应激状态下, Keap1被氧化或共价修饰而与NRF2解偶联使得NRF2活化并易位至细胞核, 与抗氧化剂反应元件(antioxidative response element, ARE)异二聚化, 启动Ⅱ相解毒酶、Ⅲ相转运蛋白和抗氧化蛋白的转录[14, 15]。因此, NRF2信号通路在细胞抵御氧化应激反应的机制中具有重要作用。
综上所述, 氧化应激可能是CPA诱导肝损伤的关键, 而NRF2抗氧化应激信号通路对CPA所致肝损伤可能具有保护效应。本研究旨在阐明CPA在体内诱导肝损伤的动态变化过程, 以及NRF2通路在CPA所致肝损伤过程的变化, 为CPA所致肝损伤的基础研究提供科学数据。
材料与方法仪器 5417-R低温高速离心机(德国Eppendorf公司); AE260电子天平(美国Mettler公司); 酶标仪(美国Thermo公司); 普通梯度PCR仪(德国Eppendorf公司); ABI7500实时荧光定量PCR仪(美国Applied Biosystems公司); XW-80A型旋涡混合器(上海精科实业有限公司); HH数显恒温水浴锅(中国金城国胜公司); 台式微量高速离心机(日本Hitachi Koki Co公司); 微量移液器(德国Eppendorf公司)。
试剂与材料 环磷酰胺(批号: WXBC5093V, 纯度≥97%), 美国Sigma-Aldrich公司; 兔抗小鼠GCLC一抗(批号: AD03071727)和兔抗小鼠GCLM一抗(批号: NG25), 爱必信(上海)生物科技有限公司; 兔抗小鼠NRF2一抗(批号: 0072280202), 美国ABclonal公司; 兔抗小鼠NQO1一抗(批号: GR195043-18)和兔抗小鼠HO-1一抗(批号: GR325245-3), 美国Abcam公司; SYBR Premix Ex TaqTM II (批号: AIF1405A)和PrimeScriptTM RT reagent Kit (批号: AHE3187A), 日本TaKaRa公司; MDA试剂盒(批号: 20181101)和GSH试剂盒(批号: 20181031), 南京建成生物工程研究所。
实验动物 SPF级雄性BABL/c小鼠, 8~9周龄, 体重22~24 g, 购于广东省医学实验动物中心, 动物生产许可证号为SCXK (粤) 2016-0029, 使用许可证号为SCXK (粤) 2016-0112。小鼠于标准实验条件下饲养:温度(20~24 ℃), 湿度(55%~60%), 明暗交替各12 h, 自由摄取水和食物。动物方案经中山大学实验动物伦理委员会批准。
造模与分组 30只小鼠随机分为5组, 每组6只, 实验前适应性饲养1周。CPA加至0.9%生理盐水中配制成20 mg·mL-1的新鲜溶液。每只小鼠单次腹腔注射CPA溶液200 mg·kg-1。小鼠分别于给药0、2、6、12和24 h后处死, 收集血样和肝脏组织。取同一部位大致相同的一小块肝组织, 用预冷生理盐水清洗, 并将其固定于10%福尔马林做病理切片检查, 其余肝脏组织于液氮中速冻后置-80 ℃保存。
组织病理学检查 肝组织经福尔马林固定后, 包埋于石蜡中, 切片(厚度约3 μm), 置60 ℃烘箱过夜, 用透明剂脱蜡, 依次经无水乙醇及梯度酒精水化、苏木精-伊红染色(HE)染色、梯度酒精脱水、透明剂透明及中性树胶封片。使用LEICA DM5000B光学显微镜观察肝细胞受损情况。
ALT、AST水平的检测 CPA给药0、2、6、12和24 h后检测血清丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)活力。按照试剂盒说明书操作, 采用Beckman Synchron CX5全自动生化分析仪测定ALT和AST酶活力。
GSH、MDA水平的检测 根据试剂盒说明书使用比色法对肝脏组织匀浆液及肝脏线粒体的还原型谷胱甘肽(GSH)和丙二醛(MDA)进行检测, 从而考察肝细胞氧化应激和抗氧化水平的变化。
RT-qPCR检测 根据Trizol试剂操作说明, 从小鼠肝脏组织中提取总RNA。按照逆转录试剂盒(Primer Script RT reagent Kit with gDNA eraser)的说明纯化RNA并将其逆转录得到cDNA。按照实时荧光定量PCR试剂盒(SYBR Premix Ex Taq II)的说明进行实验, 定量分析目的基因表达水平。引物序列如列表 1所示。
| 表 1 The primer sequence of real-time PCR |
Western blot检测 参照实验室先前的报道进行Western blot检测[16]。简单而言, 提取总蛋白或核蛋白后按照BCA法进行蛋白定量。等量的蛋白经SDS-PAGE凝胶电泳分离后转印至PVDF膜上, 用5%脱脂牛奶封闭1 h, 加入NRF2、GCLC、GCLM等一抗抗体于4 ℃孵育过夜, 加入相应的二抗于室温孵育1 h, 运用电化学发光法及X射线显影技术检测抗体-蛋白复合物。Image J软件分析蛋白条带强度。
统计学方法 采用GraphPad Prism 5软件分析数据, 结果以Mean ± SD表示。通过unpaired Student's t-test作两组间比较, P < 0.05表示差异有统计学意义。
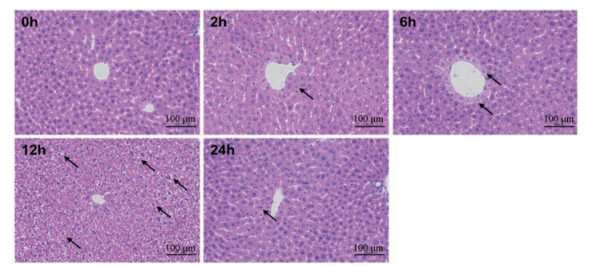
结果 1 肝组织病理学的动态变化小鼠给予CPA 12 h后, 观察到肝组织中肝细胞广泛的重度水肿, 细胞肿胀, 胞质呈空泡状(图 2)。在2、6和24 h均可见肝组织中少量肝细胞轻度水肿, 细胞肿胀, 胞质疏松淡染。上述结果表明, CPA能造成小鼠肝损伤, 引起肝脏大面积水肿, 部分出现肝细胞核空泡变性, 并呈现时间依赖性, 在12 h损伤最为严重, 24 h有所缓解。
|
Figure 2 Representative HE-stained liver sections at 0 to 24 h after 200 mg·kg-1 cyclophosphamide (CPA) challenge (n = 6, x ± s). Hepatic vacuolation of fat type was indicated with arrow |
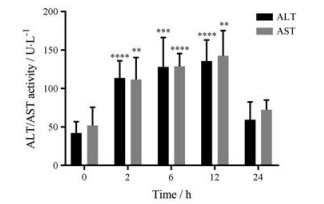
血清转氨酶(ALT、AST)是反映肝细胞损伤和坏死程度的重要指标。小鼠单次注射CPA 200 mg·kg-1后, 其血清ALT、AST水平逐渐升高(图 3)。ALT、AST均在12 h达到峰值, 之后则开始下降。在CPA所致的肝损伤过程中, ALT、AST值呈先升高后降低, 逐渐恢复的趋势。
|
Figure 3 Serum alanine aminotransferase (ALT) and aspartate aminotransferase (AST) activities at 0 to 24 h after 200 mg·kg-1 CPA challenge (n = 6, x ± s). **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs 0 h |
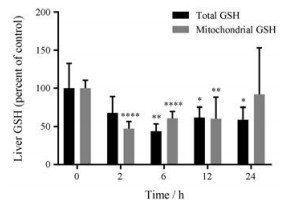
给予CPA后, 小鼠肝脏总GSH和线粒体GSH水平显著地降低(图 4), 这提示CPA所致肝损伤的发生过程中肝细胞内源性GSH迅速耗竭, 在6 h下降至最低值。线粒体GSH比肝脏总GSH更为敏感, 其在2 h已降至最低。随着时间的推移, 肝脏总GSH有逐渐恢复的趋势。
|
Figure 4 Total liver and mitochondrial glutathione (GSH) levels at 0 to 24 h after 200 mg·kg-1 CPA challenge (n = 6, x ± s). *P < 0.05, **P < 0.01, ****P < 0.000 1 vs 0 h |
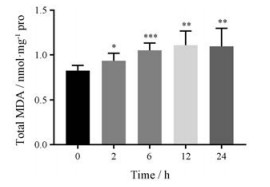
MDA是脂质过氧化的关键指标。肝脏MDA含量测定的结果表明(图 5), 小鼠肝脏MDA水平在给予CPA后逐渐上升, 在24 h依然高于正常水平。从肝脏MDA水平变化趋势可以看出在CPA所致肝损伤的发生过程中, 氧化应激程度很高, 随着GSH的耗竭, 脂质过氧化逐渐加重, MDA在肝细胞内累积。
|
Figure 5 Total liver malondialdehyde (MDA) levels at 0 to 24 h after 200 mg·kg-1 CPA challenge (n = 6, x ± s). *P < 0.05, **P < 0.01, ***P < 0.001 vs 0 h |
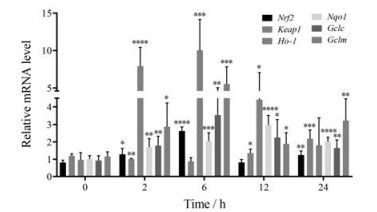
小鼠给予CPA后肝脏组织的Keap1基因的mRNA表达水平被下调, 6 h下降到最低值, 随后开始上升, 24 h逐渐高于正常水平。CPA可以诱导小鼠肝脏Nrf2表达, 并在6 h出现峰值, Nrf2在后续时间点逐渐降低但仍高于0 h。此外, NRF2下游的抗氧化基因和二相代谢酶的mRNA表达显示, Ho-1、Gclc和Gclm在给予CPA后显著上升, 并在6 h达到峰值, 随后逐渐降低。Nqo1表达结果显示在给予CPA后2~12 h呈上调趋势, 12 h达到峰值, 24 h仍高于正常水平(图 6)。这些结果表明Nrf2及下游靶基因的mRNA在CPA产生肝损伤时均被上调, 以抵抗CPA所致的氧化应激损伤, 从而促进肝修复。
|
Figure 6 Q-PCR analysis of Nrf2, Keap-1, Nqo1, Ho-1, Gclc, Gclm mRNA expression in CPA-treated mice liver after CPA challenge (n = 6, x ± s). *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs 0 h |
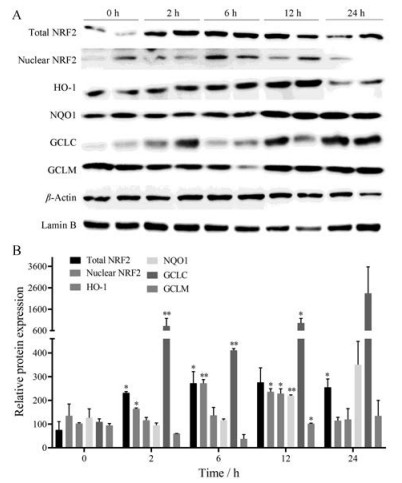
小鼠给予CPA后肝脏NRF2和NQO1蛋白表达上调, 与mRNA的变化一致, 并分别在6和12 h出现峰值, NRF2在后续时间点逐渐降低, 但仍高于正常水平。NRF2蛋白表达结果显示在CPA肝损伤过程中呈先上调后降低的现象, 在给予CPA后2~6 h呈上调趋势, 12 h开始下降。表明NRF2及下游靶基因被显著上调以抵抗CPA所致的氧化应激性肝损伤, 其中HO-1、NQO1、GCLM蛋白在12 h被显著上调, 而GCLC蛋白在2 h被显著上调; HO-1蛋白表达在12 h达峰值, 在24 h表达显著下调(图 7)。
|
Figure 7 Dynamic regulation of NRF2 signaling pathway was involved in CPA-induced liver injury. (A) Western blot analysis of total NRF2, nuclear NRF2, HO-1, NQO1, GCLC, GCLM, β-actin, Lamin B protein expression in CPA-treated mice liver after CPA challenge. (B) Densitometric analysis of western blots and normalized to β-actin. n = 6, x± s. *P < 0.05, **P < 0.01 vs 0 h |
环磷酰胺(CPA)具有显著的抗肿瘤疗效和强免疫抑制作用, 预后良好, 因此在临床上被广泛使用, 其主要不良反应是骨髓抑制和生殖毒性。近年来, 研究发现CPA会引发不同程度的肝损伤[17]。相关临床病例报道表明[9, 18-25], 大多数患者在第1次服药后造成轻微肝损伤, 而连续第2次服药会导致急性肝炎的发生。如果早期停药, 药源性肝损伤的预后通常较好。但当表现为急性肝损伤时, 可能出现不可逆的暴发性肝衰竭, 导致高死亡率。因此, 了解CPA产生肝损伤的发生过程, 对于早诊断早治疗CPA所致肝损伤具有重要意义。本研究给予小鼠一次性腹腔注射(200 mg·kg-1)环磷酰胺溶液, 并分别于不同时间点检测肝功能各项指标, 以充分考察CPA所致肝损伤的动态变化, 并在分子水平探究NRF2通路对CPA所致肝损伤的保护机制。
首先基于血清中ALT、AST动态变化的结果表明CPA在12 h内引发明显的肝损伤。肝细胞中AST、ALT逸出导致其在血液中的水平升高[26]。在2 h血清中ALT、AST较空白组显著升高, 在12 h达到峰值, 24 h下降至接近正常水平, 这表明给予环磷酰胺能造成急性肝损伤, 2~12 h是肝损伤发生的关键时间。研究发现[27]用不同剂量的CPA在小鼠上造模, 剂量为200 mg·kg-1时小鼠肝脏中肝细胞肿胀、血窦充血、肝细胞呈气球样变性、门静脉和中央静脉正常, 未见炎性浸润。同样地, 本文研究结果也表明在给予环磷酰胺2 h后出现明显的肝细胞水肿, 在12 h肝细胞可见广泛的重度水肿、细胞肿胀、胞质呈空泡状变性, 这与血清中AST、ALT变化趋势一致。GSH在保护细胞免受氧化损伤方面起着至关重要的作用, 已有研究表明[28, 29], 环磷酰胺的毒性代谢产物丙烯醛能迅速耗竭肝脏GSH, 导致细胞抵抗自由基能力下降, 引起细胞坏死或凋亡[26, 30, 31]。检测氧化应激指标结果显示, 在给予小鼠环磷酰胺2 h后, 肝脏总GSH和线粒体GSH水平显著降低, 在6 h达到最低值, 直至24 h未能恢复到正常水平。CPA引起的自由基激增可以攻击脂质并导致细胞膜结构和功能的严重改变, 从而引起脂质过氧化[32], MDA是细胞损伤和氧化应激的可靠指标[33]。因此, 进一步检测了肝脏中脂质过氧化代谢产物MDA的含量, 结果表明给予CPA后肝脏中MDA水平在24 h内持续上升。上述结果表明环磷酰胺造成肝脏氧化应激损伤并引起了脂质过氧化。
已有研究表明细胞氧化应激和ROS累积均可激活NRF2, NRF2入核与DNA结合并诱导抗氧化基因的转录[34, 35]。进一步检测了小鼠体内抗氧化应激通路NRF2信号在给予环磷酰胺后的变化情况, 结果发现2 h开始NRF2的基因和蛋白的表达均被上调。此外在6 h细胞核内NRF2表达也在给予CPA后增加, 同时其下游靶基因的表达增加, 逆转GSH耗竭, 清除ROS, 帮助机体抵抗氧化应激损伤。
综上所述, 环磷酰胺给药后, 小鼠在2 h开始出现肝损伤, 在12 h时肝损伤最严重, 24 h后肝损伤有显著改善。氧化应激在CPA所致的肝损伤中具有重要作用, 机体在氧化应激刺激下, 抗氧化通路NRF2被激活, 从而抵抗氧化应激损伤。这些研究结果为CPA所致肝损伤的基础研究提供了科学数据, 为预防和治疗CPA所致肝损伤提供了潜在的用药策略。
| [1] | Jones SE, Collea R, Paul D, et al. Adjuvant docetaxel and cyclophosphamide plus trastuzumab in patients with HER2-amplified early stage breast cancer:a single-group, open-label, phase 2 study[J]. Lancet Oncol, 2013, 14: 1121–1128. DOI:10.1016/S1470-2045(13)70384-X |
| [2] | Geisler CH. Cyclophosphamide for CLL:to be or not CYP2B activated?[J]. Blood, 2013, 122: 4156–4157. DOI:10.1182/blood-2013-10-534115 |
| [3] | Chen LY, Wang XD, Huang M. Advances in the research of pharmacogenomics of cyclophosphamide[J]. Acta Pharm Sin (药学学报), 2014, 49: 971–976. |
| [4] | Zhang J, Tian Q, Zhou SF. Clinical pharmacology of cyclophosphamide and ifosfamide[J]. Curr Drug Ther, 2006, 1: 55–84. DOI:10.2174/157488506775268515 |
| [5] | Xie HJ, Yasar U, Lundgren S, et al. Role of polymorphic human CYP2B6 in cyclophosphamide bioactivation[J]. Pharmacogenomics J, 2003, 3: 53–61. |
| [6] | Ekhart C, Gebretensae A, Rosing H, et al. Simultaneous quantification of cyclophosphamide and its active metabolite 4-hydroxycyclophosphamide in human plasma by high-performance liquid chromatography coupled with electrospray ionization tandem mass spectrometry (LC-MS/MS)[J]. J Chromatogr B, 2007, 854: 345–349. DOI:10.1016/j.jchromb.2007.04.024 |
| [7] | Lehman TJ, Singh C, Ramanathan A, et al. Prolonged improvement of childhood onset systemic lupus erythematosus following systematic administration of rituximab and cyclophosphamide[J]. Pediatr Rheumatol Online J, 2014, 12: 3. DOI:10.1186/1546-0096-12-3 |
| [8] | de Jonge ME, Huitema AD, Rodenhuis S, et al. Clinical pharmacokinetics of cyclophosphamide[J]. Clin Pharmacokinet, 2005, 44: 1135–1164. DOI:10.2165/00003088-200544110-00003 |
| [9] | Subramaniam SR, Cader RA, Mohd R, et al. Low-dose cyclophosphamide-induced acute hepatotoxicity[J]. Am J Case Rep, 2013, 14: 345–349. DOI:10.12659/AJCR.889401 |
| [10] | de Jonge ME, Huitema ADR, Beijnen JH, et al. High exposures to bioactivated cyclophosphamide are related to the occurrence of veno-occlusive disease of the liver following high-dose chemotherapy[J]. Br J Cancer, 2006, 94: 1226–1230. DOI:10.1038/sj.bjc.6603097 |
| [11] | McDonald GB, Slattery JT, Bouvier ME, et al. Cyclophosphamide metabolism, liver toxicity, and mortality following hematopoietic stem cell transplantation[J]. Blood, 2003, 101: 2043–2048. DOI:10.1182/blood-2002-06-1860 |
| [12] | Hauck AK, Bernlohr DA. Oxidative stress and lipotoxicity[J]. J Lipid Res, 2016, 57: 1976–1986. DOI:10.1194/jlr.R066597 |
| [13] | Ishii T, Itoh K, Takahashi S, et al. Transcription factor Nrf2 coordinately regulates a group of oxidative stress-inducible genes in macrophages[J]. J Biol Chem, 2000, 275: 16023–16029. DOI:10.1074/jbc.275.21.16023 |
| [14] | Kwak MK, Wakabayashi N, Kensler TW. Chemoprevention through the Keap1-Nrf2 signaling pathway by phase 2 enzyme inducers[J]. Mutat Res, 2004, 555: 133–148. DOI:10.1016/j.mrfmmm.2004.06.041 |
| [15] | Min KJ, Kim JH, Jou I, et al. Adenosine induces hemeoxygenase-1 expression in microglia through the activation of phosphatidylinositol 3-kinase and nuclear factor E2-related factor 2[J]. Glia, 2008, 56: 1028–1037. DOI:10.1002/(ISSN)1098-1136 |
| [16] | Fan X, Chen P, Tan H, et al. Dynamic and coordinated regulation of KEAP1-NRF2-ARE and p53/p21 signaling pathways is associated with acetaminophen injury responsive liver regeneration[J]. Drug Metab Dispos, 2014, 42: 1532–1539. DOI:10.1124/dmd.114.059394 |
| [17] | Uskudar Cansu D, Oztas E, Yilmaz E, et al. Cyclophosphamide-induced severe acute hepatitis in a rheumatic disease:case-based review[J]. Rheumatol Int, 2019, 39: 377–385. DOI:10.1007/s00296-018-4189-8 |
| [18] | Snyder LS, Heigh RI, Anderson ML. Cyclophosphamide-induced hepatotoxicity in a patient with Wegener's granulomatosis[J]. Mayo Clin Proc, 1993, 68: 1203–1204. DOI:10.1016/S0025-6196(12)60074-3 |
| [19] | Pinto N, Ludeman SM, Dolan ME. Drug focus:pharmacogenetic studies related to cyclophosphamide-based therapy[J]. Pharmacogenomics, 2009, 10: 1897–1903. DOI:10.2217/pgs.09.134 |
| [20] | Naranjo CA, Busto U, Sellers EM, et al. A method for estimating the probability of adverse drug reactions[J]. Clin Pharmacol Ther, 1981, 30: 239–245. DOI:10.1038/clpt.1981.154 |
| [21] | Mok CC, Wong WM, Shek TW, et al. Cumulative hepatotoxicity induced by continuous low-dose cyclophosphamide therapy[J]. Am J Gastroenterol, 2000, 95: 845–846. DOI:10.1111/j.1572-0241.2000.01875.x |
| [22] | Martinez-Gabarron M, Enriquez R, Sirvent AE, et al. Hepatotoxicity following cyclophosphamide treatment in a patient with MPO-ANCA vasculitis[J]. Nefrologia, 2011, 31: 496–498. |
| [23] | Gustafsson LL, Eriksson LS, Dahl ML, et al. Cyclophosphamide-induced acute liver failure requiring transplantation in a patient with genetically deficient debrisoquine metabolism:a causal relationship?[J]. J Intern Med, 1996, 240: 311–314. DOI:10.1046/j.1365-2796.1996.42867000.x |
| [24] | Cleland BD, Pokorny CS. Cyclophosphamide related hepatotoxicity[J]. Aust N Z J Med, 1993, 23: 408. DOI:10.1111/imj.1993.23.issue-4 |
| [25] | Bacon AM, Rosenberg SA. Cyclophosphamide hepatotoxicity in a patient with systemic lupus erythematosus[J]. Ann Intern Med, 1982, 97: 62–63. DOI:10.7326/0003-4819-97-1-62 |
| [26] | Meister A, Anderson ME. Glutathione[J]. Annu Rev Biochem, 1983, 52: 711–760. DOI:10.1146/annurev.bi.52.070183.003431 |
| [27] | Bhat N, Kalthur SG, Padmashali S, et al. Toxic effects of different doses of cyclophosphamide on liver and kidney tissue in swiss albino mice:a histopathological study[J]. Ethiop J Health Sci, 2018, 28: 711–716. |
| [28] | Weijl NI, Cleton FJ, Osanto S. Free radicals and antioxidants in chemotherapy-induced toxicity[J]. Cancer Treat Rev, 1997, 23: 209–240. DOI:10.1016/S0305-7372(97)90012-8 |
| [29] | Bhatia K, Kaur M, Atif F, et al. Aqueous extract of Trigonella foenum-graecum L. ameliorates additive urotoxicity of buthionine sulfoximine and cyclophosphamide in mice[J]. Food Chem Toxicol, 2006, 44: 1744–1750. DOI:10.1016/j.fct.2006.05.013 |
| [30] | Srivastava A, Shivanandappa T. Hepatoprotective effect of the root extract of Decalepis hamiltonii against carbon tetrachloride-induced oxidative stress in rats[J]. Food Chem, 2010, 118: 411–417. DOI:10.1016/j.foodchem.2009.05.014 |
| [31] | Anderstam B, Vaca C, Harms-Ringdahl M. Lipid peroxide levels in a murine adenocarcinoma exposed to hyperthermia:the role of glutathione depletion[J]. Radiat Res, 1992, 132: 296–300. DOI:10.2307/3578237 |
| [32] | Fraiser LH, Kanekal S, Kehrer JP. Cyclophosphamide toxicity. Characterising and avoiding the problem[J]. Drugs, 1991, 42: 781–795. DOI:10.2165/00003495-199142050-00005 |
| [33] | Gutteridge JMC. Lipid peroxidation and antioxidants as biomarkers of tissue damage[J]. Clin Chem, 1995, 41: 1819–1828. |
| [34] | Farombi EO, Shrotriya S, Na HK, et al. Curcumin attenuates dimethylnitrosamine-induced liver injury in rats through Nrf2-mediated induction of heme oxygenase-1[J]. Food Chem Toxicol, 2008, 46: 1279–1287. DOI:10.1016/j.fct.2007.09.095 |
| [35] | Copple IM, Goldring CE, Kitteringham NR, et al. The keap1-nrf2 cellular defense pathway:mechanisms of regulation and role in protection against drug-induced toxicity[J]. Handb Exp Pharmacol, 2010, 196: 233–266. DOI:10.1007/978-3-642-00663-0 |
 2019, Vol. 54
2019, Vol. 54


