神经病理性疼痛(neuropathic pain, NP)是一种严重影响患者生存质量的慢性疾病, 在一般人群中的发病率为6.9%~10%[1]。NP的发病机制尚未被完全阐述清楚, 近年提出的“神经炎症学说”认为胶质细胞活化诱发神经炎症因子释放, 导致神经元异常兴奋, 进而介导NP[2, 3]。越来越多的证据表明, 长期不能平息的神经炎症反应通过激活胶质细胞、募集炎症因子等多种途径诱发神经系统疾病[4, 5]。小胶质细胞是中枢神经系统应对感染和刺激的第一反应细胞, 研究者发现, 激活状态的小胶质细胞通过启动MAPK、NFκB等多条信号通路诱发神经炎症[6, 7]。此外, NP相关的活化因子及其受体激活星形胶质细胞后可启动MAPK等信号通路, 进而分泌趋化因子、炎症因子; 同时, 它们通过调控细胞内特异性元件使星形胶质细胞持续敏化, 该过程在NP的慢性化中发挥重要作用[8]。可见, 神经炎症在NP的发生、发展过程中具有重要作用。目前, NP的主要治疗手段是药物干预, 临床一线用药加巴喷丁、普瑞巴林等通过阻断疼痛信号的传递在一定程度上可缓解疼痛程度, 但存在药物耐受、作用靶点单一、价格昂贵等局限性, 据统计仅50% NP患者可达到30%疼痛缓解程度[9-11]。因此, 针对NP的发病机制中具有重要意义的神经炎症探寻治疗NP的镇痛药物具有必要性。
NP属于中医“痛痹”范畴, 乌头汤始载于张仲景所著《金匮要略》, 是治疗痛痹的经方之一。临床研究表明, 乌头汤可有效用于三叉神经痛、癌性疼痛等不同类型NP的治疗, 总有效率约为80%[12, 13]。本课题组前期基于脊神经结扎(spinal nerve ligation, SNL)模型, 采用全基因组表达谱芯片检测技术, 分别获得NP疾病相关的基因表达谱和乌头汤干预NP发挥镇痛药效相关的基因表达谱, 通路富集分析显示NP相关的基因主要调控神经炎症而乌头汤镇痛相关基因主要作用于神经炎症反应[14]。本研究基于上述结果, 采用网络药理学方法开展“疾病基因-药物效应基因”互作网络分析, 并结合实验验证, 进一步探究乌头汤缓解NP的炎症网络调控机制。
材料与方法全基因表达谱芯片检测及差异表达基因筛选 采用RNeasy micro kit (Cat#74004, 德国QIAGEN公司)提取并纯化RNA, 采用安捷伦生物分析仪2100 (美国Agilest Technologies公司)检测RNA的完整性, 使用NanoDrop ND-2000分光光度计(美国Thermo Fisher Scientific公司)和安捷伦生物分析仪2100 (美国Agilest Technologies公司)检测RNA的浓度和纯度。应用全基因表达谱芯片(美国Agilest Technologies公司)检测对照组、SNL组及乌头汤组动物脊髓背角组织的全基因组表达谱。采用R软件(版本1.0.2, 奥地利R Core Team公司)检测原始数据、计算差异基因的表达倍数及t检验, 筛选|log2-fold change (FC)| > 0.5、P < 0.05的基因分别为NP疾病相关基因(SNL组vs对照组)和乌头汤镇痛效应基因(乌头汤组vs SNL组)。
已知NP靶标的收集 分别从以下两个数据库收集已知NP靶标: DrugBank数据库(http://www.drugbank.ca/, 版本5.0)和OMIM数据库(http://www.omim.org/, 最近更新时间2014年10月31日)。
网络构建与分析 基于String数据库(http://string-db.org/, 版本10.0)进行网络构建, 选择结合分数高于所有结合分数中值的基因-基因相互作用进行下一步研究, 采用Navigator软件(版本2.2.1)进行网络可视化。网络中的节点代表基因, 边代表基因之间的相互作用, 根据节点的4个网络拓扑特征值(连接度、紧密度、介度和K-Core值)筛选在网络中具有重要意义的hub节点。
基因功能和通路富集分析 本研究从KEGG (http://www.genome.jp/kegg/, 最近更新时间: 2012年10月16日)中选择P < 0.05的信号通路, 基于DAVID (http://david.abcc.ncifcrf.gov/home.jsp, 版本6.7)进行通路富集分析。
实验动物 健康雄性SD大鼠36只, 6~8周龄, 体重(180 ± 20) g, 清洁级, 购自北京维通利华实验动物技术有限公司。动物许可证: SCXK (京) 2016-0006。动物饲养于中国中医科学院中医基础理论研究所实验动物中心, 饲养条件为恒温(23 ± 1) ℃、恒湿(55 ± 5) %, 光照/黑暗周期为12 h, 固体饲料饲养、期间自由饮水。本研究中的动物实验获得中国中医科学院实验动物伦理委员会批准, 按照实验需求尽可能地减少动物只数并减轻动物因实验所致的痛苦。
实验药品、试剂及仪器 制川乌(Aconitum carmichaelii Debx.)、麻黄(Ephedra sinica Stapf)、黄芪[Astragalus membranaceus (Fisch.) Bunge.]、芍药(Paeonia lactiflora Pall.)、甘草(Glycyrrhiza uralensis Fisch.)购自北京华邈中药工程技术开发中心, 经中国中医科学院中药研究所张村研究员鉴定上述药材均合格。普瑞巴林胶囊(每粒75 mg, 辉瑞制药有限公司, 国药准字J20100102);丙酮(北京化工厂, 批号: 20101223); Von frey hair疼痛测试仪(美国Stoeltingco公司); AKT磷酸化抗体(ab131443, 1:1 000)、JNK磷酸化抗体(ab124956, 1:2 000)、JUN磷酸化抗体(ab30620, 1:1 000) (Abcam公司); MKK4磷酸化抗体(Cell Signaling, #9155, 1:1 000)。
药品的制备 乌头汤的制备:按照原方比例称取药材(制川乌6 g, 麻黄、黄芪、白芍及炙甘草各9 g), 加入10倍量的水浸泡1 h, 煮沸后煎煮1.5 h并收集煎出液, 加8倍量的水待煮沸后继续煎煮1 h, 合并2次煎出液用纱布过滤, 将上述煎液浓缩至0.75 g·mL-1备用。普瑞巴林的溶解:使用蒸馏水溶解至12.5 mg·mL-1。
动物分组与给药 雄性SD大鼠36只, 随机分为6个组(n = 6), 组别设置为正常组(Con)、模型组(SNL)、乌头汤低剂量组(Low)、乌头汤中剂量组(Mid)、乌头汤高剂量组(High)和普瑞巴林组(PGB)。乌头汤的低、中、高剂量为3.75、7.5、15 g·kg−1, 分别相当于1、2、4倍临床等效剂量, 普瑞巴林的给药剂量为100 mg·kg−1, 约为4倍临床等效剂量[15]。大鼠给药体积按照1 mL/100 g, 正常组和模型组灌服等体积蒸馏水, 大鼠SNL手术3天后开始灌胃给药, 连续给药3天。
SNL模型的构建 根据文献[16]方法构建大鼠SNL模型, 具体过程为将大鼠使用异氟烷麻醉后, 动物放置在俯卧位, 在显微镜下取出左L6椎体横突, 然后小心剥离L4、L5脊神经, 并用6—0丝线结扎L5脊神经。
疼痛检测方法 机械痛的检测方法:采用文献[17]方法检测左足机械痛阈值, 将大鼠静置于金属笼内30 min后, 用不同压力的von Frey丝(美国Stoelting公司)垂直刺激鼠足掌面, 力度以von Frey丝轻微弯曲为准, 持续5 s或直至出现缩足反应。若出现缩足反应, 记为阳性。采用up-and-down方法计算50%缩足反应阈值, 每次测量维持3个周期, 中间间隔5 min, 最后取平均值。冷痛阈值的检测方法:将大鼠置入铁丝笼中适应30 min, 用1 mL注射器对准大鼠左侧足背中心给予0.05 mL丙酮。阳性反应为大鼠接触丙酮后30 s内出现迅速的抬足反射, 记录30 s内左足抬足反射的次数, 每只重复3次求和, 每组动物再取平均值。
组织取材 于最后一次疼痛阈值检测完毕后, 使用戊巴比妥钠麻醉动物, 并在显微镜下取患侧脊髓L5节段, 冰PBS迅速清洗血污后, 用铝铂纸包好放置于-80 ℃冰箱中保存备用。
统计学分析 采用SPSS (美国, 版本15.0)进行统计学分析, 计量资料以均数±标准差(x ± s)表示, P < 0.05作为统计学具有显著性差异的标准。采用GraphPad Prism 5.0和Adobe Photoshop CS6软件制作图表。
结果 1 乌头汤干预SNL的关键网络靶标及其作用机制挖掘前期, 本项目组基于乌头汤给药和未给药处理的SNL模型动物的脊髓组织样本, 开展全基因组表达谱芯片检测, 分别获得SNL疾病相关基因集(SNL组vs对照组, 共567个差异表达基因, 其中, 331个上调表达基因和236个下调表达基因)和乌头汤干预SNL药效相关基因集(乌头汤组vs SNL组, 共442个差异表达基因, 其中, 171个上调表达基因和271个下调表达基因)[14]。为进一步探索乌头汤干预SNL的作用机制, 本研究基于SNL发病相关基因和乌头汤干预SNL药效相关基因的相互作用信息, 建立“疾病基因-药物效应基因”互作网络, 由592个节点和4 066对相互作用组成。通过计算各节点的连接度、紧密度、介度和K-core值, 选取4个拓扑特征值均大于其相应中位数的节点作为乌头汤干预SNL的候选关键网络靶标, 共计170个基因。进一步, 建立乌头汤镇痛候选网络靶标的直接相互作用网络, 并基于其GO功能和KEGG通路信息的富集结果进行网络功能模块划分。如图 1所示, 乌头汤的镇痛候选网络靶标主要参与丝裂原活化蛋白激酶信号通路(mitogen-activated protein kinase, MAPK signaling pathway, P = 4.04E-12);此外, 还参与趋化因子信号通路(chemokine signaling pathway, P = 7.43E-12)、钙离子信号通路(calcium signaling pathway, P = 9.04E-12)、受体酪氨酸蛋白激酶信号通路(ErbB signaling pathway, P = 4.99E-09)、缝隙连接(gap junction, P = 5.79E-09)和细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction, P = 2.89E-05)。其中, MAPK信号通路的药物候选网络靶标中包含AKT-MKK4-JNK-JUN信号轴, 上述4个分子在网络中具有拓扑特征重要性, 且已有文献报道, 上述分子在磷酸化后被激活, 参与神经炎症反应[18, 19], 而神经炎症在NP的发生、发展和转归中具有重要意义[20-23]。接下来, 本研究拟基于SNL大鼠模型, 考察乌头汤对AKT-MKK4-JNK-JUN信号轴的调控作用。
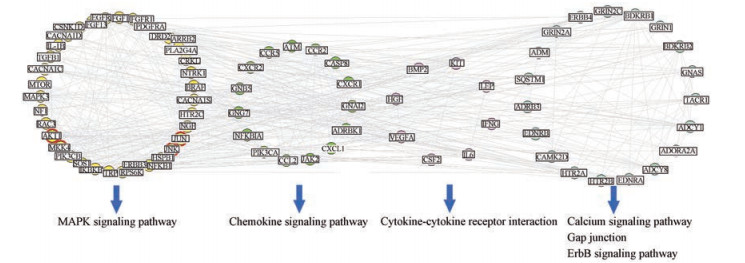
|
Figure 1 Interaction network of candidate targets of Wu-tou decoction (WTD) acting on neuropathic pain (NP), and the involved pathways by these target genes |
本研究成功构建了SNL大鼠模型, 与正常组相比, SNL大鼠的机械痛阈值显著降低(P < 0.01)。乌头汤低、中、高剂量可不同程度地升高SNL大鼠的机械痛阈值, 其中高剂量药效与普瑞巴林无统计学差异。为观察乌头汤的药效作用特点, 第一天给药后检测不同时间点(0.5、1、1.5、2 h)各组动物的机械痛阈值, 发现大鼠灌胃乌头汤后, 1 h后机械痛阈值升高最明显, 药效可以持续至少2 h, 故后续机械痛的检测时间点为乌头汤给药后1 h。此外, 与正常组相比, SNL大鼠对丙酮所致冷刺激的反应次数明显增加; 与模型组相比, 乌头汤和普瑞巴林均可有效降低SNL大鼠对冷刺激的反应次数, 其中乌头汤中剂量和高剂量组具有统计学意义。上述结果表明, 乌头汤对SNL大鼠镇痛药效确切, 且乌头汤高剂量的镇痛药效最佳(图 2)。
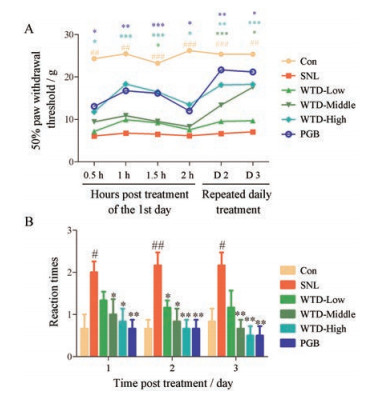
|
Figure 2 Anti-hyperalgesia effects of WTD against NP. Spinal nerve ligation (SNL) induced obvious mechanical allodynia and cold hyperalgesia of rats. WTD (7.5-15 g·kg-1) markedly reversed SNL-induced mechanical allodynia (A) and cold hyperalgesia (B), the anti-hyperalgesia effects of high dosage of WTD (15 g·kg-1) were similar to that of pregabalin (PGB, 100 mg·kg-1, p.o.). n = 6, x ± s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs control group (Con); *P < 0.05, **P < 0.01, ***P < 0.001 vs SNL group |
为了考察乌头汤发挥镇痛作用的分子机制, 基于SNL大鼠患侧脊髓L5样本, 采用Western blot方法, 检测AKT/MKK4/JNK/JUN磷酸化蛋白的表达水平。根据文献报道, 上述指标磷酸化之后被激活并参与炎症反应[24, 25]。结果表明, 与Con相比, SNL导致大鼠脊髓组织中具有神经保护作用的AKT磷酸化蛋白(pAKT)的表达水平升高, 乌头汤给药后可进一步升高该因子的表达水平; 与Con相比, SNL导致大鼠脊髓组织中MKK4、JNK、JUN磷酸化蛋白(pMKK4、pJNK、pJUN)的表达水平异常升高, 乌头汤给药后可显著下调上述分子磷酸化蛋白的表达水平(图 3)。
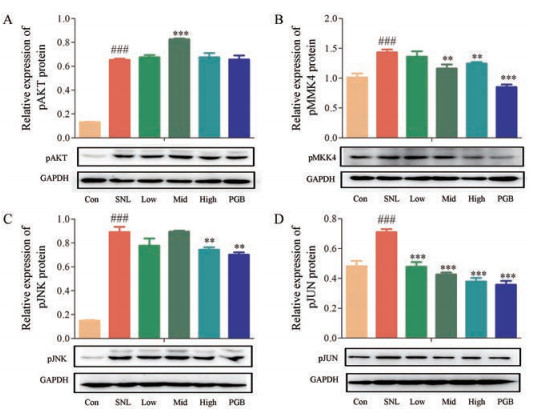
|
Figure 3 Regulation effects of WTD acting on MAPK signaling pathway. SNL induced increasement of pAKT and WTD further increased the protein expression level of pAKT (A); SNL resulted in the upregulation of pMKK4 (B), pJNK (C) and pJUN (D), WTD significantly reduced their expression levels. n = 6, x ± s. ###P < 0.001 vs control group; **P < 0.01, ***P < 0.001 vs SNL group |
中药复方具有多成分、多靶点、多途径发挥作用的特点, 而网络药理学从系统的角度揭示不同中药及其化学成分之间的相互作用, 近年来, 被广泛而有效地用于中药复方作用机制的研究[26-29]。本项目组基于前期全基因组表达谱芯片检测结果获取的SNL疾病相关基因集及乌头汤干预SNL药效相关基因集, 进一步开展网络药理学分析, 并发现乌头汤的镇痛网络靶标参与MAPK信号通路的富集显著性最高, 根据网络拓扑特征值筛选出在“疾病基因-药物效应基因”互作网络中具有重要意义的4个分子, 分别是AKT、MKK4、JNK和JUN。文献表明, 上述分子与NP发生、发展中具有重要意义的神经炎症密切相关, 因此, 本研究选择AKT-MKK4-JNK-JUN信号轴作为后续机制研究的对象。基于SNL模型的药效学结果表明, 乌头汤可以显著提高SNL大鼠的机械痛阈值和冷痛阈值, 其中高剂量即4倍临床等效剂量的镇痛药效最佳。乌头汤中君药制川乌温经散寒、通痹止痛; 臣药麻黄发汗宣表、散寒止痛; 佐药黄芪固表敛汗、补中益气; 佐使药白芍、甘草酸甘化阴、缓急止痛, 全方配伍精妙, 共奏温经散寒, 除湿止痛之功效[30]。药理研究表明, 乌头汤可有效缓解炎症的严重程度, 显著降低多种与炎症密切相关的因子表达水平如白介素-1β、辣椒素受体-V1等[31-33]。本研究中采用的阳性对照药为临床一线镇痛药物普瑞巴林, 用量为临床4倍等效剂量, 乌头汤高剂量组也为4倍临床等效剂量, 药效学实验结果表明, 二者的镇痛药效无显著性差异。在药物安全性方面, 临床研究发现, 普瑞巴林在使用过程中出现眩晕、嗜睡口干、周围性水肿、视力模糊、体重增加和注意力难以集中等不良反应, 且呈剂量相关[34], 此外, 普瑞巴林有肝毒性的个案报道[35]。本课题组前期对乌头汤的不良反应进行评估, 未发现乌头汤有药物耐受性、胃肠道反应及其他毒性, 也未发现有动物体重和协调功能方面的影响变化[33]。因此, 痛痹要方乌头汤不仅具有多成分、多途径、多靶点作用于NP发生、发展过程中重要病理环节的特点, 在药物安全性方面还具有一定的优势。
本研究根据网络拓扑特征的重要性筛选出乌头汤镇痛的关键候选靶标AKT-MKK4-JNK-JUN, 上述4个分子是MAPK信号通路的重要成员分子MAPK信号通路的重要组成部分。MAPK是一个转导细胞外刺激到细胞内翻译后引起转录反应的丝氨酸/苏氨酸蛋白激酶家族, 包括p38、JNK和ERK。研究表明, MAPK信号通路与NP密切相关, NP大鼠鞘内注射MAPK信号通路的抑制剂(p38抑制剂、JNK抑制剂和ERK抑制剂)之后, 可以部分降低模型诱发的机械性痛觉异常, 并显著下调MAPK家族成员的蛋白和mRNA表达水平[36]。蛋白水平的检测结果表明, 乌头汤可以矫正SNL大鼠患侧脊髓L5中上述4个分子蛋白表达水平的异常表达。其中, AKT属于丝氨酸/苏氨酸蛋白激酶, 包括AKT1/AKT2/AKT3三种亚型, 主要参与调节细胞生长、增殖和血管再生等。研究表明, AKT磷酸化(pAKT)可抑制双重特异性丝裂原活化蛋白激酶激酶4 (MKK4)磷酸化蛋白的表达水平[18]。神经损伤发生时, 神经组织中pAKT的蛋白和mRNA表达水平均升高, 发挥神经保护作用; 给予神经保护作用的药物之后pAKT蛋白表达水平进一步显著升高[37]。本研究同样发现SNL大鼠脊髓L5组织中pAKT表达水平升高, 乌头汤给药后pAKT的表达水平显著增加, 该结果与文献相符。研究表明, MKK4的过度磷酸化会升高下游JNK (应激活化蛋白激酶)和JUN (转录因子AP-1)磷酸化蛋白的表达水平, 伴随pJUN的靶基因mRNA表达水平的上调, 进而导致神经系统的疾病[25]。MKK4-JNK可被致炎因子、物理或者化学压力以及凋亡信号激活, 在非炎症状态下存在于细胞质中, 在炎症因子刺激后的滑膜成纤维细胞中JNK迁移到细胞核从而功能性地激活磷酸化状态的JUN[38-40]。此外, NP状态下JNK的长期持续激活并可能参与星形胶质细胞中的信号传导[41-44]。本研究发现, NP大鼠脊髓L5组织中与神经炎症密切相关的MKK4、JNK、JUN磷酸化蛋白的表达量显著升高, 痛痹要方乌头汤给药后明显降低了上述3种磷酸化蛋白的表达水平, 提示痛痹要方乌头汤通过调控AKT-MKK4-JNK-JUN信号轴抑制神经炎症进而发挥镇痛作用(图 4)。
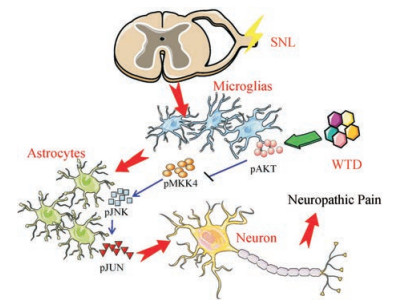
|
Figure 4 Simplified schematic illustration of anti-hyperalgesia mechanisms of WTD acting on NP. In the spinal tissue of SNL rats, the protein expression levels of pMKK4/pJNK/pJUN were increased, however, WTD could reduce the protein expression levels of them through increasing the protein expression level of pAKT |
综上所述, 本研究通过SNL大鼠模型证明了乌头汤可有效缓解NP症状, 并采用全基因表达谱和网络药理学分析加上实验验证的方法, 初步揭示了其通过调节AKT-MKK4-JNK-JUN信号轴而发挥镇痛抗炎作用的机制。相关研究结果将有利于丰富痛痹要方乌头汤开痹镇痛功效的科学内涵, 也为针对NP发病机制的多靶点镇痛药物的研发提供方法学参考。针对本研究存在的一些不足, 课题组目前正在开展以下两方面工作, 一是研究乌头汤所含活性成分的暴露特征、血药浓度和达靶浓度, 另外是探讨乌头汤活性成分不同配比对不同靶标的调控作用, 以便明确其药效物质, 从分子层面揭示复方的作用机制。
| [1] | Van HO, Austin SK, Khan RA, et al. Neuropathic pain in the general population:a systematic review of epidemiological studies[J]. Pain, 2014, 155: 654–662. DOI:10.1016/j.pain.2013.11.013 |
| [2] | Colloca L, Ludman T, Bouhassira D, et al. Neuropathic pain[J]. Nat Rev Dis Primers, 2017, 3: 1–45. |
| [3] | Gao YJ, Ji RR. Chemokines, neuronal-glial interactions, and central processing of neuropathic pain[J]. Pharmacol Ther, 2010, 126: 56–68. DOI:10.1016/j.pharmthera.2010.01.002 |
| [4] | Skaper SD, Facci L, Zusso M, et al. An inflammation-centric view of neurological disease:beyond the neuron[J]. Front Cell Neurosci, 2018, 12: 1–26. |
| [5] | Qiu AW, Liu Z, Guo J, et al. Relationship between neuroinflammation and neurodegenerative diseases[J]. Prog Physiol Sci (生理科学进展), 2011, 42: 353–358. |
| [6] | Wu HG, Gao Z, Luo FW, et al. Signaling pathways associated with neuroinflammation in microglia[J]. Curr Immunol (现代免疫学), 2014, 34: 501–505, 496. |
| [7] | Skaper SD, Facci L. Mast cell-glia axis in neuroinflammation and therapeutic potential of the anandamide congener palmitoylethanolamide[J]. Philos Trans R Soc Lond B Biol Sci, 2012, 367: 3312–3325. DOI:10.1098/rstb.2011.0391 |
| [8] | Cao RL, Yuan B, Gu YL, et al. Research progress on molecular mechanism of astrocyte-mediated neuroinflammation regulating neuropathic pain and the intervention of traditional Chinese medicine[J]. E J Transl Med (转化医学电子杂志), 2018, 9: 20–25. |
| [9] | Gao YJ, Zhang ZJ, Cao DL. Chemokine mediated neuroinflammatory response and neuropathic pain[J]. Chin J Cell Biol (中国细胞生物学学报), 2014, 36: 297–307. |
| [10] | Hurley RW, Adams MC, Benzon HT. Neuropathic pain:treatment guidelines and updates[J]. Curr Opin Anaesthesiol, 2013, 26: 580–587. DOI:10.1097/ACO.0b013e328363b4bf |
| [11] | Guo QY, Zhang YQ, Lin N. Research progress on mechanism of Chinese medicine acting on neuropathic pain[J]. E J Transl Med (转化医学电子杂志), 2017, 4: 1–6. |
| [12] | Bai GH, Zhang JH. Clinical observation of 28 cases of trigeminal neuralgia treated with modified Wu tou Decoction[J]. Mod J Integr Tradit Chin West Med (现代中西医结合杂志), 2003, 4: 385. |
| [13] | Zhou H, He XY, Zou QF. Clinical observation of 48 cases of metastatic bone cancer pain treated by Wu tou Decoction[J]. J Sichuan Tradit Chin Med (四川中医), 2013, 31: 92–93. |
| [14] | Zhang YQ, Wang Chao, Guo QY, et al. Molecular mechanisms of the analgesic action of Wu-tou Decoction on neuropathic pain in mice revealed using microarray and network analysis[J]. Acta Pharmacol Sin, 2018, 39: 988–997. DOI:10.1038/aps.2017.110 |
| [15] | Le CC, Castagné V. Face-to-face comparison of the predictive validity of two models of neuropathic pain in the rat:analgesic activity of pregabalin, tramadol and duloxetine[J]. Eur J Pharmacol, 2014, 735: 17–25. DOI:10.1016/j.ejphar.2014.04.003 |
| [16] | Kim S, Chung J. An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J]. Pain, 1992, 50: 355–363. DOI:10.1016/0304-3959(92)90041-9 |
| [17] | Chaplan SR, Bach FW, Pogrel JW, et al. Quantitative assessment of tactile allodynia in the rat paw[J]. J Neurosci Meth, 1994, 53: 55–63. DOI:10.1016/0165-0270(94)90144-9 |
| [18] | Wang R, Zhang QG, Han D. Inhibition of MLK3-MKK4/7-JNK1/2 pathway by Akt1 in exogenous estrogen-induced neuroprotection against transient global cerebral ischemia by a non-genomic mechanism in male rats[J]. J Neurochem, 2006, 99: 1543–1554. DOI:10.1111/jnc.2006.99.issue-6 |
| [19] | Ji RR, Suter MR. p38 MAPK, microglial signaling, and neuropathic pain[J]. Mol Pain, 2007, 3: 33. |
| [20] | Ellis A, Bennett DL. Neuroinflammation and the generation of neuropathic pain[J]. Br J Anaesth, 2013, 111: 26–37. DOI:10.1093/bja/aet128 |
| [21] | Yu HM, Wang Q, Sun WB. Silencing of FKBP51 alleviates the mechanical pain threshold, inhibits DRG inflammatory factors and pain mediators through the NF-κB signaling pathway[J]. Gene, 2017, 627: 169–175. DOI:10.1016/j.gene.2017.06.029 |
| [22] | Leung L, Cahill CM. TNF-α and neuropathic pain-a review[J]. J Neuroinflammation, 2010, 7: 27. DOI:10.1186/1742-2094-7-27 |
| [23] | Nakanishi M, Nakae A, Kishida Y. Go-sha-jinki-Gan (GJG) ameliorates allodynia in chronic constriction injury-model mice via suppression of TNF-α expression in the spinal cord[J]. Mol Pain, 2016. DOI:10.1177/1744806916656382 |
| [24] | Calvo M, Zhu N, Grist J, et al. Following nerve injury neuregulin-1 drives microglial proliferation and neuropathic pain via the MEK/ERK pathway[J]. Glia, 2011, 59: 554–568. DOI:10.1002/glia.21124 |
| [25] | Chen CY, Weng YH, Chien KY, et al. (G2019S) LRRK2 activates MKK4-JNK pathway and causes degeneration of SN dopaminergic neurons in a transgenic mouse model of PD[J]. Cell Death Differ, 2012, 19: 1623–1633. DOI:10.1038/cdd.2012.42 |
| [26] | Xu HY, Peng XJ, Chen YB, et al. Exploration of "principle-recipe-composition-target-activity" association of Bupleuri Radix and Scutellariae Radix drug pair for diabetes treatment based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2018, 53: 1414–1421. |
| [27] | Li JL, Liang Hui, Cai SZ, et al. Mechanism of detoxification of Chebulae Fructus against Aconiti kusnezoffii radix toxicity based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2018, 53: 1670–1679. |
| [28] | Chai X, Meng YK, Bai ZF, et al. Mechanism of anti-hepatitis B virus activity of tonkinensis based on biological targets network[J]. Acta Pharm Sin (药学学报), 2018, 53: 396–402. |
| [29] | Li WJ, Lu JQ, Mao X, et al. A comparative study on the mechanisms of two classical herbal formulae for rheumatoid arthritis applying cold and heat patterns based on target network[J]. Acta Pharm Sin (药学学报), 2018, 53: 1387–1397. |
| [30] | Wang DH, Liu CF, Tan SF, et al. Analgesic effect of Wutou Decoction on rats and its preliminary mechanism[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2014, 20: 109–112. |
| [31] | He LH, Liu CF, Sun CC, et al. Wu-Tou Decoction inhibits angiogenesis in experimental arthritis by targeting VEGFR2 signaling pathway[J]. Rejuv Res, 2018, 21: 442–455. DOI:10.1089/rej.2017.2011 |
| [32] | Mao ZY, Xu QH, Zhu CY, et al. Mechanism of Wutoutang in alleviating neuropathic pain by improving damages of descending inhibitory system[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 82–87. |
| [33] | Wang C, Liu C, Wan H, et al. Wu-tou decoction inhibits chronic inflammatory pain in mice:participation of TRPV1 and TRPA1 ion channels[J]. Biomed Res Int, 2015, 2015: 328707. |
| [34] | Chen BQ, Li CW, Shi YP, et al. Pharmacological effects and clinical evaluation of pregabalin[J]. Chin J New Drugs Clin Rem (中国新药与临床杂志), 2010, 29: 11–14. |
| [35] | Toth C. Pregabalin:latest safety evidence and clinical implications for the management of neuropathic pain[J]. Ther Adv Drug Saf, 2014, 5: 38–56. DOI:10.1177/2042098613505614 |
| [36] | Qu Y, Jia L, Zhang X, et al. MAPK pathways are involved in neuropathic pain in rats with chronic compression of the dorsal root ganglion[J]. Evid Based Complement Alternat Med, 2016, 2016: 6153215. |
| [37] | Liu BN, Han BX, Liu F. Neuroprotective effect of pAkt and HIF-1 on ischemia rats[J]. Asian Pac J Trop Med, 2014, 7: 221–225. DOI:10.1016/S1995-7645(14)60025-0 |
| [38] | Hietakangas V, Elo I, Rosenstr m H. Activation of the MKK4-JNK pathway during erythroid differentiation of K562 cells is inhibited by the heat shock factor 2-β isoform[J]. FEBS Lett, 2001, 505: 168–172. DOI:10.1016/S0014-5793(01)02810-1 |
| [39] | Yamasaki T, Kawasaki H, Nishina H. Diverse roles of JNK and MKK pathways in the brain[J]. J Signal Transduct, 2012, 2012: 459265. |
| [40] | Sundarrajan M, Boyle DL, Chabaud-Riou M, et al. Expression of the MAPK kinases MKK-4 and MKK-7 in rheumatoid arthritis and their role as key regulators of JNK[J]. Arthritis Rheum, 2003, 48: 2450–2460. DOI:10.1002/(ISSN)1529-0131 |
| [41] | Sanna MD, Stark H, Lucarini L, et al. Histamine H4 receptor activation alleviates neuropathic pain through differential regulation of ERK, JNK, and P38 MAPK phosphorylation[J]. Pain, 2015, 156: 2492–2504. DOI:10.1097/j.pain.0000000000000319 |
| [42] | Cao J, Wang JS, Ren XH, et al. Spinal sample showing p-JNK and P38 associated with the pain signaling transduction of glial cell in neuropathic pain[J]. Spinal Cord, 2015, 53: 92–97. DOI:10.1038/sc.2014.188 |
| [43] | Mei XP, Zhang H, Wang W, et al. Inhibition of spinal astrocytic c-Jun N-terminal kinase (JNK) activation correlates with the analgesic effects of ketamine in neuropathic pain[J]. J Neuroinflammation, 2011, 8: 6. DOI:10.1186/1742-2094-8-6 |
| [44] | Zhuang ZY, Wen YR, Zhang DR, et al. A peptide c-Jun N-terminal kinase (JNK) inhibitor blocks mechanical allodynia after spinal nerve ligation:respective roles of JNK activation in primary sensory neurons and spinal astrocytes for neuropathic pain development and maintenance[J]. J Neurosci, 2006, 26: 3551–3560. DOI:10.1523/JNEUROSCI.5290-05.2006 |
 2019, Vol. 54
2019, Vol. 54


