2. 福建医科大学, 福建 福州 350122
2. Fujian Medical University, Fuzhou 350122, China
蛇毒是一类含有多种活性多肽、酶和非酶蛋白的混合物, 主要包括4类组分: ①酶类:蛋白水解酶、磷脂酶、凝血酶样酶和纤溶酶原激活剂等; ②具有特殊生物活性的组分:膜毒素、神经毒素和解离素等; ③生物活性因子:神经生长因子等; ④其他组分:一些糖类、唾液酸及金属离子等[1]。
整合素(integrin)为细胞黏附分子家族的重要成员之一[2], 是普遍存在于细胞中的一类跨膜糖蛋白, 是连接细胞外基质环境和细胞内信号传导的纽带, 参与许多重要的生理过程如胚胎形成、止血、免疫反应和维持体内器官的完整性等[3]。血小板膜受体多数属于整合素, 其中整合素GPⅡb-Ⅲa (纤维蛋白原受体)是各种原因诱导的血小板聚集的共同通路, 当它与RGD三肽或含RGD三肽的多肽结合时, 这些肽类就与纤维蛋白原竞争GPⅡb-Ⅲa的结合位点, 阻断GPⅡb-Ⅲa与其配体的结合, 从而抑制其作用。因此, 在分离纯化含RGD三肽的多肽或蛋白质时, 常用抗血小板聚集作用作为活性鉴定指标。整合素除参与上述的生理过程外, 还在多种病理过程中发挥重要作用, 如慢性炎症、血栓、恶性肿瘤都和整合素的功能失调有关。
解离素(disintegrins)为一类从蛇毒中分离的能够拮抗整合素的小分子多肽, 具有拮抗整合素依赖的血小板聚集、肿瘤生长以及肿瘤转移等效应, 已成为国内外关注的研究领域[4-6]。Fry等[7]发现从Agkistrodon contortrix蛇毒中分离的解离素contortrostatin, 可抑制高度转移性的人乳腺癌细胞(MDA-MB-435)与静止的人Fn及玻璃连接蛋白的黏附以及MDA-MB-435细胞对多层基底膜的入侵。从Echis carinatus蛇毒中提取的解离素eristostatin可抑制小鼠黑色素瘤细胞B16-F10的实验性肺转移, 也能通过结合整合素α4β1阻断人黑色素瘤细胞与血管黏附分子VCAM-1相结合, 抑制人黑色素瘤的实验性转移[8]。
迄今为止, 国内外学者已从蝰科和蝮科蛇毒中分离或克隆得到超过40个解离素, 如kistrin、salmosin、triflavin、rhodostomin等, 但江浙产短尾蝮蛇(Gloydius brevicaudus)毒解离素的分离尚未见报道, 本研究拟从江浙产短尾蝮蛇毒中分离纯化解离素, 并测定其理化性质, 了解其生物学活性, 为进一步研发提供实验依据。
材料与方法试剂与仪器 ÄKTA Explorer蛋白纯化和Superdex 75 prep grade、Sephadex G-25、DEAE Sepharose Fast Flow 16/10预填充柱购自美国Pharmacia Bio; 紫外-2501PC分光光度计购自日本SHIMADZ; 600E型高效液相色谱仪购自美国Waters公司; C18 4.6/250预填充柱购自德国默克公司; LBY-NJ4血小板聚集机购自北京力普生仪器有限公司。短尾蝮蛇蛇毒(Gloydius brevicaudus venom, GBV)淡黄色冻干粉, 福建医科大学蛇毒研究所提供; ADP购自瑞士Fluka公司; 乙腈和三氟乙酸购自德国默克公司。
短尾蝮蛇粗毒的提取 取短尾蝮蛇粗毒0.5 g溶于5 mL 0.01 mol·L-1 Tris-HCl缓冲液, 4 ℃过夜; 低温(4 ℃) 10 000 r·min-1离心15 min, 取上清液上Superdex 75 pg柱(26 mm×800 mm), 用含0.15 mol·L-1 NaCl的0.01 mol·L-1 Tris-HCl (pH 8.0)缓冲液洗脱, 紫外分光光度计测定洗脱液, 根据OD280nm值的大小绘出洗脱曲线。
分离组分对ADP诱导的血小板聚集的影响 参照Born方法[9], 取人的静脉血样采自健康者的肘正中静脉, 抗凝并100 r·min-1离心15 min, 取上层血浆为富血小板血浆(platelet rich plasma, PRP), 小心吸出PRP上清, 剩余血液再经2 000 r·min-1离心10 min得到贫血小板血浆(platelet poor plasma, PPP)作为参比液。聚集实验前, 用PPP稀释PRP, 使血小板终浓度为每升3×105个。取PRP 270 μL加入组分27 μL (以pH 7.4的PBS稀释成适当浓度), 对照组加PBS 27 μL, 在LBY-NJ4血小板聚集仪中磁力搅拌, 预热3 min后, 分别加入ADP (0.3 mmol·L-1) 3 μL, 测试分离组分对血小板聚集抑制率(%) = (1-抑制剂组最大聚集率/对照组最大聚集率)×100%。
蛇毒解离素的纯化 经鉴定具有抑制血小板聚集活性的组分, 经低温真空浓缩到适当体积后用Superdex G-25凝胶过滤纯化。Superdex G-25用A液为0.05 mol·L-1 pH 8.5的Tris缓冲液平衡色谱柱(29 mm×490 mm), 样品上样后用A液洗脱。以HiPrep DEAE Sepharose Fast Flow 16/10预装柱对经Superdex G-25凝胶过滤的组分进行离子交换色谱。洗脱液配制: A液为0.05 mol·L-1 pH 8.5的Tris缓冲液; B液为含1 mol·L-1氯化钠的A液; 上样后以A液洗脱未结合的组分, 之后增加B液进行线性梯度洗脱。将上述具有血小板聚集抑制活性的组分经Lichrospher C18 (4.6 mm×250 mm)反相色谱柱, 在Waters 600E高效液相色谱仪上进行色谱分离; 流动相A: 0.1% TFA+5% ACN; 流动相B: 0.08% TFA + 80% ACN, 线性梯度洗脱, 0~50 min从100% A到100% B。以上3个步骤均根据OD280 nm的数值, 手工收集各洗脱。
GBV-Ⅳ4 (Gloydius brevicaudus venom, 江浙短尾蝮蛇毒)的蛋白纯度测定 采用Bradford法蛋白浓度测定试剂盒, 测定解离素的蛋白浓度; 采用SDS-PAGE (Tris-Tricine系统)碱性不连续电泳, 鉴定纯度。
高效液相色谱分析解离素纯度 将纯化到的GBV-Ⅳ4上样于Lichrospher C18 (4.6 mm×250 mm)反相色谱柱, 在Waters 600E高效液相色谱仪上进行纯度检测。流动相A: 0.1% TFA于5% CAN中; 流动相B: 0.08% TFA于80% ACN中。流速1 mL·min-1, 线性梯度洗脱, 0~60 min从100% A到100% B, 检测波长为230 nm。
GBV-Ⅳ4的蛋白浓度测定 采用Bradford法蛋白浓度测定试剂盒, 测定解离素的蛋白浓度:将标准品按0、1、2、4、8、12、16和20 μL加到96孔板的标准品孔中, 加标准品稀释液补足到20 μL; 取PBS稀释一定倍数的解离素20 μL加到96孔板的样品孔中; 各孔加入染色液200 μL, 37 ℃放置10 min, 测定A550, 根据标准曲线计算出蛋白浓度。
GBV-Ⅳ4的相对分子质量测定 凝胶成像法:将SDS-PAGE (Tris-Tricine系统)样品凝胶, 在Image Master VDS凝胶成像系统上成像, 以Marker为对照, 通过系统软件计算样品的相对分子质量。质谱法:对GBV-Ⅳ4进行相对分子质量的精确测定, 由同济大学蛋白质研究所协助完成。
GBV-Ⅳ4的等电点测定 采用盘状等电聚焦电泳测定等电点。制备含2.4% Ampholine (pH 3.5~10)的聚丙烯酰胺凝胶(T = 7.5%, C = 2.6%), 样品混入凝胶, 同时做不含样品的空白胶。电极溶液:正极为0.5 mol·L-1醋酸, 负极为0.5 mol·L-1氢氧化钠。电泳条件:稳压150 V, 电泳至电流降至最小值且不再改变即结束电泳。取胶, 将含有样品的胶柱, 用12.5%三氯醋酸固定过夜, 然后用0.125%考马斯亮蓝R-250 (含乙酸10%, 乙醇25%)染色1 h, 10%冰醋酸脱色过夜。将不含样品的胶柱从正极到负极按每0.5 cm分段切割, 每段胶加入1 mL双蒸水放置24 h后测定pH值, 制作不同位置凝胶段的pH值参照曲线。根据样品在凝胶条中的位置, 测出样品的pI值。
蛋白酶活力测定 参考文献[10]方法, 反应系统如下:组分溶液1 mL, 2%热变性酪蛋白溶液(pH 7.6) 5 mL, 反应总体积6 mL。37 ℃水浴10 min后加入5%三氯乙酸5 mL停止反应, 放置20 min后过滤, 取滤液1 mL加0.5 mol·L-1 NaOH 2 mL, 1:3稀释的Folin试剂0.6 mL, 37 ℃放置20 min后在660 nm比色, 测定酪氨酸生成, 对照酪氨酸标准曲线得出水解产生的酪氨酸量(每分钟酶的作用产生相当于1 μg酪氨酸产生的光吸收的活力定为1个活力单位)。
磷脂酶A2 (PLA2)活力测定 参照文献[11]等方法:称取卵磷脂500 mg, 加入0.01 mol·L-1脱氧胆酸钠10 mL, 研磨使之乳化, 然后加入0.01 mol·L-1 CaCl2 10 mL, 1 mol·L-1 NaCl 10 mL, 混匀后用2 mol·L-1 KOH调pH为8.0, 用水稀释至100 mL, 每次取10 mL供测定用。加待测的解离素溶液100 μL (含蛋白约1 mg), 37 ℃恒温, 用0.02 mol·L-1 KOH滴定游离脂肪酸, 记录0.5 h的不同时间消耗的KOH的mL数, 换算成脂肪酸的μmol数, 作图。以初速的直线部分计算比活, 单位为游离脂肪酸的μmol·mg-1(pro)·min-1。
氨基酸序列的测定 由同济大学蛋白质研究所协助测定, 测序结果用BLAST程序进行同源性比较。
GBV-Ⅳ4对ADP及凝血酶诱导的血小板聚集的影响 方法同前(分离组分对ADP诱导的血小板聚集的影响), 测定GBV-Ⅳ4对终浓度为10 μmol·mL-1的ADP诱导的血小板聚集的影响。绘制剂量-效应曲线, 求得半数抑制浓度(IC50), IC50定义为聚集抑制率为最大抑制率一半时所需GBV-Ⅳ4的终浓度。方法同前, 测定GBV-Ⅳ4对终浓度0.145 u·L-1的凝血酶诱导的血小板聚集的影响。绘制剂量-效应曲线, 求得IC50。
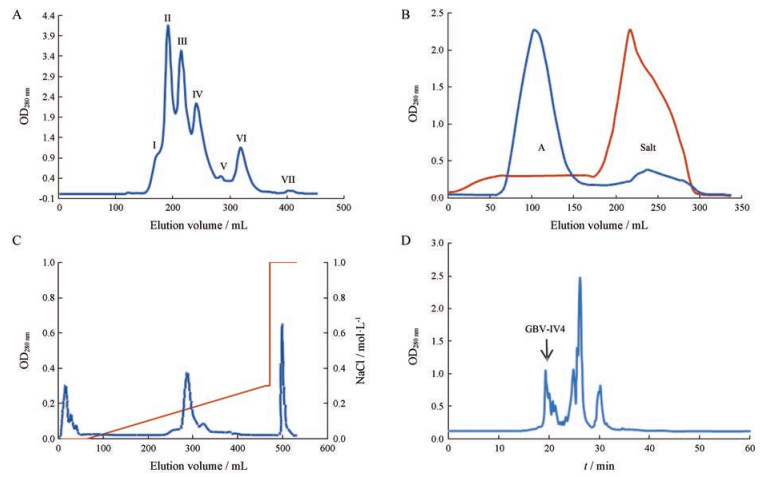
结果 1 蛇毒解离素的提取短尾蝮蛇毒粗毒的凝胶过滤色谱及分离组分对血小板聚集的影响短尾蝮蛇粗毒经Superdex 75柱色谱, 分离得到7个蛋白峰, 分别记为GBV-Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ (图 1)。测定各洗脱峰对血小板聚集的影响, 发现组分Ⅳ具有抑制血小板聚集的活性, 初步鉴定为解离素组分(其余蛋白峰对血小板聚集没有明显影响)。粗毒经Superdex 75后, 有活性的组分GBV-Ⅳ以光密度计算得率约占粗毒的10% (图 1A)。
|
Figure 1 Isolation and purification of the disintegrin from GBV crude venom. A: Gel filtration of Gloydius brevicaudus venom (GBV) on superdex 75. The inhibitory effect of human platelet aggregation was eluted in peak Ⅳ; B: Gel filtration of GBV-Ⅳ on Sephadex G-25 column. The inhibitory effect of human platelet aggregation was eluted in peak A; C: Ion-exchange chromatography of GBV-Ⅳ on DEAE Sepharose Fast Flow. The inhibitory effect of human platelet aggregation was eluted in peak 4; D: Reversed phase liquid chromatography of GBV-Ⅳ4 on Lichrospher C18 |
具有解离素活性的组分GBV-Ⅳ, 用Sephadex G-25凝胶进行纯化, 使等电点相近、相对分子质量不同的其他蛋白质与目的组分分离, 并去除收集组分中所含的盐, 得到主蛋白峰1个。主蛋白峰A峰得率约为57.2% (图 1B)。离子交换色谱经Sephadex G-25纯化的峰GBV-Ⅳ, 用HiPrep DEAE Sepharose Fast Flow 16/10柱进一步纯化, 得到8个蛋白峰, 分别记为GBV-Ⅳ1~8 (图 1C)。经鉴定GBV-Ⅳ4具有抑制血小板聚集作用。GBV-Ⅳ4蛋白得率约为1.2%。反相色谱活性峰GBV-Ⅳ4浓缩后上样于预装柱Lichrospher C18 (4.6 mm×250 mm)反相色谱柱, 得到7个蛋白峰。分别测定这些洗脱峰的血小板聚集抑制活性, 结果发现第一个主峰具有强烈的血小板聚集抑制活性, 暂定名为GBV-Ⅳ4 (图 1D) (注:后面所指GBV-Ⅳ4均为反相色谱得到的主峰)。GBV-Ⅳ4蛋白得率约为15.2%。
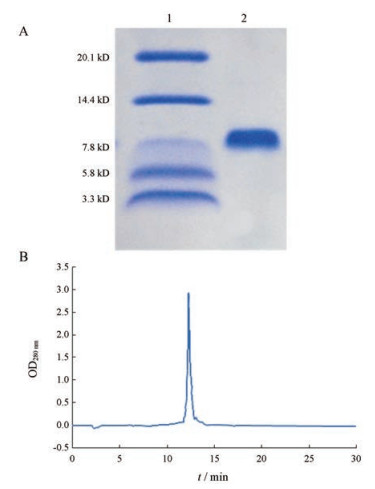
3 GBV-Ⅳ4蛋白的纯度测定Bradford法测定GBV-Ⅳ4纯度, 经SDS-PAGE (Tris-Tricine系统)鉴定, GBV-Ⅳ4呈单一蛋白条带, 其条带迁移距离较长, 位于7.8 kDa附近(图 2A)。高效液相色谱分析GBV-Ⅳ4纯度, 经前述步骤分离得到的GBV-Ⅳ4经HPLC分析, 呈现单峰型, 说明分离得到的解离素GBV-Ⅳ4为单一组分(图 2B)。
|
Figure 2 Purity of GBV-Ⅳ4. A: SDS-PAGE (Tris-Tricine system) analysis of GBV-Ⅳ4. Lane 1 is marker. Lane 2 is GBV-Ⅳ4. The molecular weight standards are indicated by the lines. B: Purity checking of GBV-Ⅳ4 by HPLC method |
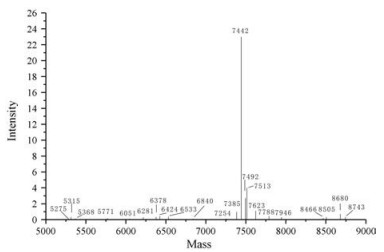
根据GBV-Ⅳ4和Marker在凝胶上的相对位置, 利用Image Master VDS凝胶成像系统中的软件计算得出GBV-Ⅳ4的相对分子质量大约为8.746 kDa。质谱法测定GBV-Ⅳ4相对分子质量为7 442 Da (图 3)。
|
Figure 3 Mass spectrography detection of GBV-Ⅳ4 |
在聚丙烯酰胺凝胶等电聚焦圆盘电泳中GBV-Ⅳ4呈现单一条带, 经测定GBV-Ⅳ4的等电点(pI)约为6.3。
6 GBV-Ⅳ4蛋白酶活力测定蛋白酶活力测定结果显示蛋白酶主要分布在GBVⅠ、Ⅱ、Ⅲ, 含量最高的是Ⅱ, 比活力是26.5 μgTyr·min-1·mg-1, GBVⅣ比活力是4 μgTyr·min-1·mg-1, GBV-Ⅳ4不含有蛋白酶。
7 GBV-Ⅳ4氨基酸序列分析测序结果显示GBV-Ⅳ4由70个氨基酸(GEEC DCGSPGNPCCDAATCKLRQGAQCAWGLCCDQCRI MKKGTVVRI-ARGD-DMDCYYNGISAGCPRNNF*)组成, 其中含12个半胱氨酸, 可以组成6对二硫键, 符合中链解离素特征。
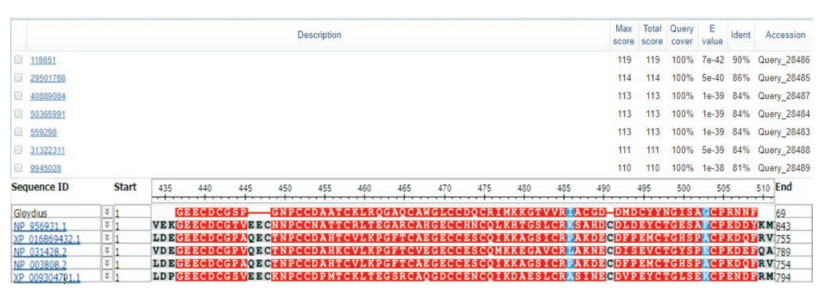
将测序结果输入GenBank中进行同源性分析, 发现500个blast hits具有同源性。根据Blast的结果, 可以得出三点结论: ① GBV-Ⅳ4分子中含有特征性RGD三肽基序; ②有7种已知解离素的氨基酸序列与GBV-Ⅳ4序列的同源性达到了80%以上(表 1); ③未查到与GBV-Ⅳ4 70个氨基酸完全一致的蛋白质序列, 表明这是一种新的蛋白质。
| Table 1 Comparison of amino acid sequence from GBV-Ⅳ4 with other disintegrins. *: The blank signal is uncertain |
将Blast结果输入NCBI的Protein BLAST程序对目标氨基酸序列与7种已知解离素序列进行对比, 对比结果显示:同源性均达到80%以上, 与GenBank中进行同源性分析结果一致(图 4)。
|
Figure 4 Comparison of amino acid sequence from GBV-Ⅳ4 with other disintegrins with Blast |
采用经典的Born法, 测定GBV-Ⅳ4对终浓度10 mol·L-1的ADP诱导的血小板聚集的影响。结果显示, GBV-Ⅳ4在0.2 g·mL-1即可抑制ADP诱导的血小板聚集, 当GBV-Ⅳ4浓度达到1.0 g·mL-1时其抑制作用达到最大, 且抑制效应呈明显的剂量-效应关系, IC50为0.339 g·mL-1 (图 5A)。
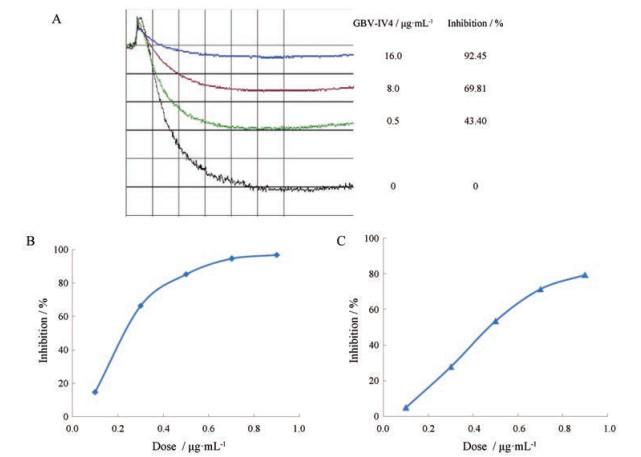
|
Figure 5 Inhibitory effect of GBV-Ⅳ4 on the platelet aggregation. A: Various concentrations of GBV-Ⅳ4 were preincubated with platelet rich plasma (PRP) for 3 min at 37 ℃ prior to the addition of ADP (10 μmol·L-1). Platelet aggregation was quantitated by measuring the total amplitude on a chart recorder. GBV-Ⅳ4 could inhibit platelet aggregation in a dose-dependent manner. B: Various concentrations of GBV-Ⅳ4 were preincubated with PRP for 3 min at 37 ℃ prior to the addition of ADP (10 μmol·L-1). n =3, |
采用经典的Born法, 测定GBV-Ⅳ4对终浓度1.2 u·mL-1的凝血酶诱导的血小板聚集的影响。结果显示, GBV-Ⅳ4对凝血酶诱导的血小板聚集同样有抑制作用, 在0.2 μg·mL-1即可抑制凝血酶诱导的血小板聚集, 当浓度达到1.0 μg·mL-1时其抑制率为80%, 且抑制作用呈明显的剂量-效应关系, IC50为0.577 μg·mL-1 (图 5B)。
讨论蛇毒是多种酶或非酶蛋白质或多肽的混合物, 含有多种相对分子质量不等, 等电点各异的蛋白质或多肽分子。分离蛇毒中活性成分有多种色谱方法:根据相对分子质量差异分离蛋白的凝胶过滤色谱法, 根据等电点差异分离蛋白的离子交换色谱法, 以及根据疏水性差异分离蛋白的疏水色谱和反相色谱法等。本文首先根据大部分解离素的相对分子质量较小(7~8 kDa)的特点[12], 将粗毒先经Superdex 75凝胶过滤色谱去除大分子组分, 得到含解离素的主要蛋白峰; 但此蛋白峰仍然是多种成分的混合物, 再选用根据等电点差异分离蛋白的离子交换色谱法进一步分离。据研究报道大多数解离素等电点在5左右[13], 因此采用弱阴离子DEAE sepharose作为介质、三羟甲基氨基甲烷(Tris)缓冲液(pH 8.5)作为洗脱液, 使带负电荷的解离素与色谱柱上正电荷基团结合, 再通过增加离子强度使带负电荷的无机离子置换结合在色谱柱上的解离素, 使洗脱液在pH和盐浓度都不太高的条件下, 即可获得较好的分离效果。结果表明在缓冲液pH接近中性(pH = 8.5), 盐浓度达0.05 mol·L-1时解离素组分全部被洗脱, 收集的组分可直接进行生化及药理活性的测定。
应用凝胶过滤, 再经离子交换色谱所得的活性组分, 并非是单一蛋白的组分, 它是相对分子质量和等电点相近的蛋白质或多肽的混合物。对于蝮蛇蛇毒, 可抑制ADP诱导的血小板聚集, 相对分子质量较小, 等电点在5左右的除解离素外还有PLA2。对于混有PLA2的解离素组分, 依据解离素与PLA2的疏水性有较大差异:解离素疏水性小于PLA2, 选用反相高效液相色谱法(RP-HPLC), 在C18柱上用乙腈梯度洗脱将它们分离(疏水性小的应先出峰)。应用RP-HPLC除了能去除解离素组分中的PLA2外, 由于RP-HPLC纯化得到的蛋白质可以通过冻干去除有机溶剂(乙腈)和离子对试剂(三氟乙酸)而得到蛋白质纯品, 与离子交换色谱的纯化产物需要透析、浓缩相比, 大大缩短了实验时间, 减少了样品失活的可能性; 解离素含4~8对二硫键, 性质十分稳定, 即使在高浓度的有机溶剂中也不致失活, 这都是采用RP-HPLC纯化解离素的依据所在。
本研究即依据上述技术路线, 采用Superdex 75、DEAE Sepharose Fast Flow离子交换色谱、Lichrospher C18反相色谱从短尾蝮蛇蛇毒粗毒中分离得到了一个解离素纯品GBV-Ⅳ4。采用Bradford法测定每一步分离到的具有抑制血小板聚集活性的蛋白的浓度, 计算得率(活性蛋白量/总蛋白量), 得到解离素GBV-Ⅳ的得率约为粗毒的万分之一。
在已发现的80余种解离素中, 有41种报道有抑制血小板聚集的作用, 其中35种解离素的氨基酸序列中含有RGD序列[14], 可见解离素分子活性中心的RGD三肽活性基元对维持抑制血小板聚集的活性是必需的。解离素抑制血小板聚集的活性在应用中有两点意义, 一是可能找到适合于临床应用的具有抑制血小板聚集活性的解离素, 二是可以将抑制血小板聚集的活性作为活性检测目标, 跟踪蛇毒解离素的分离纯化。
解离素的分子结构特征是在多肽分子中含有能与整合素结合的三基肽, 如RGD、KGD、MLD (蛋氨酸-亮氨酸-天冬氨酸, Met-Leu-Asp)和KTS (赖氨酸-苏氨酸-天冬氨酸, Lys-Thr-Ser)等, 同时含有一定数量的二硫键。根据分子大小和二硫键数目分为4类: ①短链解离素(41~51个氨基酸, 4对二硫键); ②中链解离素(约70个氨基酸, 6对二硫键); ③长链解离素(83个氨基酸, 7对二硫键); ④双链解离素(同双链和异双链)。目前已发现的解离素大部分为中链解离素。本研究从短尾蝮蛇毒分离得到的GBV-Ⅳ4, 经氨基酸序列分析发现它由70个氨基酸组成, 含有RGD序列, 有6对二硫键。根据SDS-PAGE的结果初步得出多肽分子的相对分子质量大约为8.746 kDa, 且为单一条带, 可以推算出相对分子质量在5 000~9 000 Da范围。虽然在测序过程中, 最后一个氨基酸的序列未测出, 但可由已得知的69个氨基酸相对分子质量之和, 除去缩合过程的69个H2O及可能存在的二硫键形成中的12个H, 最后一个未知氨基酸的相对分子质量存在可变范围, 因此可推测出目标多肽的相对分子质量范围在7.384 4~7.513 5 kDa之间。质谱法测定GBV-Ⅳ4相对分子质量为7.442 kDa, 在目标多肽相对分子质量推测的范围内。
用Genbank的protein-protein blast软件分析, 发现GBV-IV4与多种解离素蛋白有着很高的同源性, 尤其是与来自Gloydius blomhoffi蛇毒的解离素Halysin (71个氨基酸)同源性高达89%。说明GBV-Ⅳ4符合中链解离素分子结构特征, 是一种新的中链解离素。作者还发现GBV-Ⅳ4有很强的抑制ADP和凝血酶诱导的血小板聚集活性, 这是因为它阻断了血小板膜受体GPⅡb-Ⅲa的结合位点, 从而阻断纤维蛋白原与GPⅡb-Ⅲa的结合而抑制血小板的聚集。这又从功能上说明GBV-Ⅳ4是一种新的解离素。
解离素主要的生物学活性之一就是抑制血小板聚集活性。目前普遍认为, 血小板膜表面的糖蛋白受体分两类, 即整合素类和非整合素类。整合素类糖蛋白受体由α和β两个亚单位组成, 每个亚单位有其独立的基因编码, 共同参与血小板的黏附与聚集。参与血小板聚集的糖蛋白受体为糖蛋白Ⅱb-Ⅲa (α2bβ3), 为整合素类, 它存在于血小板膜表面, 在血小板激活时大量表达, 是各种原因引起血小板聚集的最后共同通路, 常见的血小板聚集剂有5-羟色胺(5-HT)、ADP、凝血酶、血栓素(TXA2)、去甲肾上腺素等, 它们与各自受体结合, 使血小板表面的糖蛋白Ⅱb-Ⅲa受体暴露增加, 血小板通过该受体与其配体如纤维蛋白原、von Willebrand因子、纤维连接蛋白等结合而聚集[12]。RGD是糖蛋白Ⅱb-Ⅲa受体特异性的识别、结合位点。不论哪种聚集剂, 最后通过激活血小板糖蛋白Ⅱb-Ⅲa受体与分子中含有多个RGD序列的纤维蛋白原/纤维蛋白结合而聚集, 阻断此受体即可有效抑制各种聚集剂诱发的血小板聚集。解离素因含有RGD序列, 能和纤维蛋白原等竞争结合血小板膜GPⅡb-Ⅲa受体, 拮抗以纤维蛋白原为纽带的血小板聚集, 产生广谱抗血小板聚集作用。在本实验中, ADP及凝血酶通过不同的启动因素激活血小板, 诱导血小板聚集, 而GBV-Ⅳ4对两者诱导的血小板聚集均可抑制, 这是因为GBV-Ⅳ4含有RGD序列, 与GPⅡb-Ⅲa受体结合而阻止纤维蛋白原-GPⅡb-Ⅲa复合物的形成, 抑制血小板聚集。这也从功能上说明GBV-IV4是整合素的拮抗剂。
以往报道的解离素抑制ADP诱导的血小板聚集其IC50多在30~300 nmol·L-1之间。如saxatilin (从Gloydius saxatilis中提取)、salmosin (从Agkistrodon Halys Brevicaudus中提取)和kistrin (从Agkistrodon rhodostoma中提取)抑制ADP诱导血小板聚集的IC50分别为127、131和128 nmol·L-1 [15, 16]。本实验发现GBV-Ⅳ4抑制血小板聚集的IC50为0.339 μg·mL-1 (40 nmol·L-1)。这提示同样是从蝮蛇属纯化而来的GBV-Ⅳ4比其他解离素的抑制血小板聚集活性强, 效价较高。另外, GBV-Ⅳ4抑制凝血酶诱导的血小板聚集的IC50为0.577 μg·mL-1 (80 nmol·mL-1), 与对ADP诱导的血小板聚集抑制强度相比, GBV-Ⅳ4对凝血酶诱导的血小板聚集抑制强度弱, 这可能与凝血酶诱导血小板的聚集作用强于ADP有关。
综上所述, 通过凝胶过滤、离子交换和反相色谱从江浙短尾蝮蛇毒中分离得到一个由70个氨基酸组成、含有RGD三肽序列和六对二硫键的中链解离素GBV-Ⅳ4可抑制ADP及凝血酶诱导的血小板聚集, 推测GBV-Ⅳ4可能通过抑制整合素和其配体的结合而实现其发挥抗血小板聚集活性, 但其中具体的机制及可能是通过何种整合素亚型发挥作用仍需进一步研究。
| [1] | Mackessy SP. The field of reptile toxinology: snakes, lizards, and venoms their[M]//Handbook of Venoms and Toxins of Reptiles. Boca Rotan: CRC Press/Taylor & Francis Group, 2010: 3-23. |
| [2] | Plow EF, Haas TA, Zhang L. Ligand binding to integrins[J]. J Biol Chem, 2000, 275: 21785–21788. DOI:10.1074/jbc.R000003200 |
| [3] | Tome Y, Kimura H, Kiyuna T, et al. Disintegrin targeting of an αvβ3 integrin-over-expressing high-metastatic human osteosarcoma with echistatin inhibits cell proliferation, migration, invasion and adhesion in vitro[J]. Oncotarget, 2016, 7: 46315–46320. |
| [4] | Hung YC, Kuo YJ, Huang SS, et al. Trimucrin, an Arg-Gly-Asp containing disintegrin, attenuates myocardial ischemia-reperfu sion injury in murine by inhibiting platelet function[J]. Eur J Pharmacol, 2017, 813: 24–32. DOI:10.1016/j.ejphar.2017.07.039 |
| [5] | Lucena S, Castro R, Lundin C, et al. Inhibition of pancreatic tumoral cells by snake venom disintegrins[J]. Toxicon, 2015, 93: 136–143. DOI:10.1016/j.toxicon.2014.11.228 |
| [6] | Lucena SE, Jia Y, Soto JG, et al. Anti-invasive and anti-adhesive activities of a recombinant disintegrin, r-viridistatin 2, derived from the Prairie rattlesnake (Crotalus viridis viridis)[J]. Toxicon, 2012, 60: 31–39. DOI:10.1016/j.toxicon.2012.03.011 |
| [7] | Fry B, Ritter MR, Markland FS. Inhibitory effects of a snake venom protein on the binding of breast cancer cells to extracelluar matrix components[J]. Proc Am Assoc Cancer Res, 1996, 37: 65–71. |
| [8] | Danen EH, Marcinkiewicz C, Cornelissen IM, et al. The disin tegrin eristostatin interferes with integrin α4β1 function and with experimental metastasis of human melanoma cells[J]. Exp Cell Res, 1998, 238: 188–196. DOI:10.1006/excr.1997.3821 |
| [9] | Born GVR. Aggregation of blood platelets by adenosine diphos phate and its reversal[J]. Nature, 1962, 194: 927–929. |
| [10] | Laroratory Fourth, Yunan Institute of Zoology. Studies on snake venoms and their utilization I, estimation of enzymatic activities of the venoms of some common venomous snakes in China[J]. J Biochem Biophys (生物化学与生物物理学报), 1976, 2: 151–156. |
| [11] | Wu XL, Chen YC. A comparison of phospholipase A activity from the snake venoms of ten species in China[J]. Zool Res (动物学研究), 1981, 4: 24–28. |
| [12] | Moreno-Murciano MP, Monleon D, Calvete JJ, et al. Amino acid sequence and homology modeling of obtustatin, a novel nonRGD-containing short disintegrin isolated from the venom of Vipera lebetina obtusa[J]. Protein Sci, 2003, 12: 366–371. DOI:10.1110/ps.0230203 |
| [13] | Marcinkiewicz C, Vijay-Kumar S, Mclane MA, et al. Signifi cance of RGD loop and C-terminal domain of echistatin for recognition of α Ⅱb β 3 and α v β 3 integrins and expression of ligand-induced binding site[J]. Blood, 1997, 90: 1565–1575. |
| [14] | Xu W, Li ZQ, Wu SY, et al. Structural and functional charac terization of snake venom disintegrins[J]. Chin Pharmacol Bull (中国药理学通报), 2005, 21: 17–22. |
| [15] | Dennis MS, Henzel WJ, Pitti RM, et al. Platelet glycoprotein Ⅱb -Ⅲa protein antagonists from snake venoms:evidence for a family of platelet-aggregation inhibitors[J]. Proc Natl Acad Sci U S A, 1990, 87: 2471–2475. DOI:10.1073/pnas.87.7.2471 |
| [16] | Hong SY, Koh YS, Chung KH, et al. Snake venom disintegrin, saxatilin, inhibits platelet aggregation, human umbilical vein endothelial cell proliferation, and smooth muscle cell migration[J]. Thromb Res, 2002, 105: 79–86. DOI:10.1016/S0049-3848(01)00416-9 |
 2019, Vol. 54
2019, Vol. 54


