2. 新疆维吾尔自治区药物研究所, 新疆 乌鲁木齐 830002;
3. 中国医学科学院、北京协和医学院医药生物技术研究所, 国家卫生健康委抗生素生物工程重点实验室, 北京 100050
2. Xinjiang Institute of Materia Medica, Urumqi 830002, China;
3. NHC Key Laboratory of Biotechnology of Antibiotics, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
心血管疾病(cardiovascular diseases, CVD)已经成为发达国家及我国人口死亡的主要原因[1]。血脂异常特别是低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)水平升高是CVD的主要危险因素[2]。血浆中约有70%的LDL-C是经低密度脂蛋白受体(LDL receptor, LDLR)介导而被各组织细胞摄取清除。肝脏是胆固醇代谢消除的主要场所, 血浆LDL-C被肝脏LDLR摄入后, 胆固醇转化成胆汁酸排出肝脏或直接经胆管进入小肠, 是机体清除LDL-C的主要方式[3]。上调肝细胞表面LDLR的表达成为降低血脂和治疗CVD的有效策略之一, 而LDLR的表达在转录水平主要受到固醇调节元件结合蛋白2 (sterol-regulatory element binding protein-2, SREBP-2)的调控[4]。
金合欢素(acacetin)又名刺槐素, 化学名为5, 7-二羟基-4'-甲氧基黄酮, 研究发现它具有广泛的生物学活性, 如抗氧化、抗炎抑菌和免疫调节等[5]。近期文献报道了金合欢素分别在帕金森疾病模型和心梗后心脏重塑模型中表现出了神经保护[6]和心脏保护作用[7], 提示这一植物来源的化合物在神经退行性疾病和心血管疾病中具有潜在的应用前景。金合欢素能与多种糖分子结合形成黄酮苷类化合物, 其中田蓟苷(金合欢素-7-O-葡萄糖苷)具有降血压和抗动脉粥样硬化的作用[8]。Hong等[9]研究发现田蓟苷可显著抑制内皮细胞中肿瘤坏死因子α诱导的血管细胞黏附分子-1的表达及炎症转录因子NF-κB的激活。Nam等[10]研究证实田蓟苷能显著减少高脂饲料喂养的LDLR-/-小鼠的动脉斑块面积, 同时降低血浆中肿瘤坏死因子α和白介素1β的水平。田蓟苷和金合欢素由于溶解性低导致其口服后在肠道吸收差, 体内生物利用度偏低。Dai等[11]研究发现田蓟苷口服后在肠道中被黄酮苷水解酶水解成其苷元金合欢素, 经肠道上皮细胞重新吸收进入肝脏代谢, 之后由胆汁流入肠腔, 进行肝肠循环。肝肠循环的存在有利于提高药物在肝肠局部生物利用度, 发挥其药理活性。
肠道菌群是定植于宿主体内最大的微生态系统, 与机体健康联系紧密。研究发现菌群组成的变化及其产生的一些代谢产物对动脉粥样硬化的发生发展具有影响[12]。王琰等[13]认为肠道菌群对口服药物的药代-药效特性也存在重要影响, 金合欢素的药代特性是否提示它能与肠道菌发生相互作用, 进而产生抗动脉粥样硬化的代谢收益, 引起了本课题组的研究兴趣。考虑到金合欢素对于血脂代谢及动脉粥样硬化影响的研究尚未见诸报道, 因此, 本研究首先从肝脏脂质代谢角度研究金合欢素调节血脂的作用和机制, 进而评价了其抗动脉粥样硬化的作用及对动脉粥样硬化模型小鼠肠道菌群的影响, 为金合欢素进一步的研究与应用提供理论基础。
材料与方法 材料金合欢素(HPLC纯度98%)购自南京春秋生物工程有限公司; MEM培养基(Gibco公司), 加入终浓度10% (v/v)的标准胎牛血清(Gibco公司), 1%非必需氨基酸和1%丙酮酸钠, 用于HepG2细胞的培养; 总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、LDL-C、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)检测试剂盒均购自中生北控生物科技股份有限公司; 兔抗LDLR (ab30532)购自Abcam公司; 鼠抗SREBP-2 (557037)购自BD公司; 鼠抗GAPDH (货号TA-08)、辣根酶标记山羊抗兔IgG (H+L) (ZB-2301)、辣根酶标记山羊抗小鼠IgG (H+L) (ZB-2305)均购自北京中杉金桥生物技术有限公司; 增强型HRP底物化学发光, 购自Millipore公司; 抗体稀释液Can Get Signal, 购自Toyobo公司; 小鼠高脂饲料和普通饲料均购自南通特洛菲饲料科技有限公司; ReliaPrep™ RNA Tissue Miniprep System动物组织总RNA提取试剂盒购自Promega公司; Fast DNA Spin Kit for Feces购自美国MP Biomedicals生物医学公司; 其余试剂购自北京普利莱基因技术有限公司。
细胞实验HepG2细胞用0.25%胰酶消化后, 以每毫升8×105个铺板, 铺板12~16 h后用金合欢素(0、10、100、200 μmol·L-1)处理48 h, RT-qPCR检测mRNA水平变化情况, Western blot检测LDLR和SREBP-2蛋白水平变化情况。人LDLR, 上游引物: 5'-GCG AAG ATG CGA AGA TAT CGA TG-3', 下游引物: 5'-CCG GTT GGT GAA GAA GAG GTA G-3'。人GAPDH, 上游引物: 5'-AGC CAC ATC GCT CAG ACA C-3', 下游引物: 5'-GCC CAA TAC GAC CAA ATC C-3'。
实验动物及分组给药SPF级健康雄性C57BL/6J小鼠由斯贝福(北京)生物技术有限公司提供, 许可证号: SCXK (京) 2016-0002。体重21.8 ± 0.6 g, 适应性饲养1周后, 随机分为3组, 对照组(Ctrl, n=5)、金合欢素组(50 mg·kg-1·d-1, n=5)、阿托伐他汀组(15 mg·kg-1·d-1, n=5), 清洁级普通大小鼠维持饲料喂养, 药物溶于0.5%羟甲基纤维素钠(CMC-Na)灌胃给药, 对照组给予相同体积的0.5% CMC-Na灌胃, 连续给药5周。
SPF级健康雄性载脂蛋白ApoE基因敲除(apolipoprotein E knockout, ApoE KO)小鼠由北京华阜康生物科技股份有限公司提供, 许可证号: SCXK (京) 2017-0004。体重24.4 ± 1.3 g, 适应性喂养1周后, 随机分为4组, 即普通饮食组(Chow, n=5)、高脂饮食模型组(high-fat diet, HFD, n=5)、高脂饮食模型组+金合欢素组(HFD+Acacetin, 30 mg·kg-1·d-1, n=5), 高脂饮食模型组+阿托伐他汀组(HFD+Atorvastatin, 15 mg·kg-1·d-1, n=5), 普通饮食对照组给予普通饲料LAD 0011 (脂肪13%、蛋白质22%和碳水化合物65%), 高脂饮食模型组给予高脂饲料TP 26304 (脂肪42%、蛋白质14%、碳水化合物44%和胆固醇含量0.2%)。金合欢素组和阿托伐他汀组每天用0.5% CMC-Na溶解的相应药物灌胃, 普通饮食组及高脂饮食模型组每天灌胃相同体积的0.5% CMC-Na, 连续给药12周。
所有小鼠均饲养于SPF级屏障环境, 自由进食与饮水。全部动物实验饲养及操作严格遵守中国医学科学院医药生物技术研究所以及国家和北京市动物福利伦理与保护相关规定。
血脂检测禁食过夜后, 5%戊巴比妥麻醉后取血, 1 600 ×g离心10 min分离出血清, 全自动生化分析仪日立7600按试剂盒说明书检测血清中TC、LDL-C、HDL-C、TG、AST和ALT的水平。
肝脏mRNA提取和检测PBS灌流后, 提取肝脏, 及时冻存于-80 ℃。称取20 mg组织采用ReliaPrep™ RNA Tissue Miniprep System (Promega公司)提取试剂盒提取总RNA, 逆转录成cDNA, 设定PCR反应条件, 用SYBR Green Master Mix试剂检测待测基因的mRNA水平, 共重复测定3次。小鼠LDLR, 上游引物: 5'-GAT GGC TAT ACC TAC CCC TCA A-3', 下游引物: 5'-TGC TCA TGC CAC ATC GTC-3'。小鼠GAPDH, 上游引物: 5'-TGA TGA CAT CAA GAA GGT GGT GAA G-3', 下游引物: 5'-TCC TTG CAG GCC ATG TAG GCC AT-3'。
肝脏总蛋白提取和Western blot分析称取肝脏组织约50 mg至1 mL T-PER/cocktail组织蛋白裂解液, 生物样品均质器破碎40 s, 16 000 ×g离心10 min, 吸取上清, BCA定量。SDS-PAGE电泳分离蛋白, 采用湿转的方法将蛋白转至PVDF膜上。5%脱脂奶粉封闭1 h, 孵育相应的一抗, 4 ℃过夜, TBST洗3次。加入相应的二抗, 室温孵育1 h, TBST洗3次。使用增强化学发光液在Bio-Rad化学发光图像采集系统成像, 检测肝脏组织LDLR和SREBP-2蛋白水平的变化。
油红染色4%多聚甲醛灌流固定后取肝脏、主动脉及主动脉根部组织, 4%多聚甲醛浸泡48 h后, 浸泡液换为20%蔗糖, OCT包埋剂(optimal cutting temperature compound, OCT)包埋组织。连续冰冻切片, 单片厚度为10 μm, 油红O染色分析脂质沉积面积, 使用Leica Q500IW图像分析系统采集图像并定量。在解剖镜下将主动脉外周多余的脂肪剥离, 纵向剪开, 油红O染色, 拍照, 用Image J分析计算主动脉斑块面积占比。
肠道内容物基因组提取采用Fast DNA Spin Kit for Feces试剂盒, 按说明书提取盲肠内容物菌群DNA, 再以获得的细菌DNA为模板进行细菌16S rDNA V3-V4可变区PCR扩增。上下游引物分别为338F 5'-ACT CCT ACG GGA GGC AGC AG-3'和806R 5'-GGA CTA CHV GGG TWT CTA AT-3'。采用Illumina MiSeq测序技术对16S rDNA PCR产物进行测序(上海美吉生物医药科技有限公司)。得到的原始数据和reads进行去除接头序列、低复杂度序列和低质量序列的处理, 得到高通量下机原始碱基序列, 采用I-Sanger云平台完成数据分析, 主要包括操作分类单元(operational taxonomic units, OTU)的生成及主成分分析(principal component analysis, PCA)、菌群结构多样性分析、群落组成分析、菌群间差异比较分析(LEfSe物种差异判别分析)等。
统计学方法采用Graphpad Prism 5.0软件对数据进行统计学分析。计量资料均以mean ± SEM表示, 多组比较采用单因素方差分析(one-way ANOVA)和Bonferroni's post hoc test检验对实验数据进行统计与整理, 两组间比较采用非配对t检验, P < 0.05为差异有统计学意义。
结果 1 金合欢素对HepG2细胞中LDLR表达的影响不同浓度(0、10、100、200 μmol·L-1)的金合欢素处理HepG2细胞48 h, 可以显著地增加LDLR mRNA (图 1A)和蛋白表达水平(图 1B)。为了明确金合欢素在转录水平上调LDLR的表达, 本研究对调控LDLR的关键转录因子SREBP-2的蛋白水平进行了检测, 结果显示高浓度的金合欢素作用48 h后, SREBP-2的蛋白水平较对照组明显升高(图 1C)。
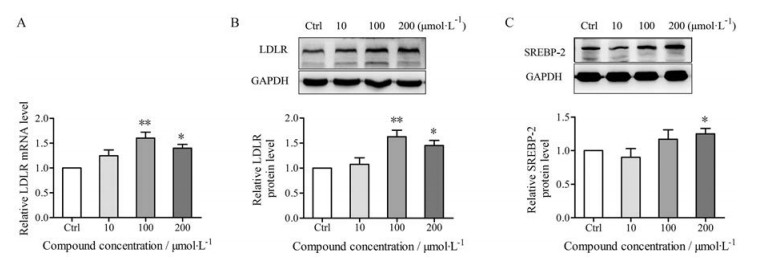
|
Figure 1 Acacetin increases the expression of LDLR in vitro. HepG2 cells were cultured with different concentrations of acacetin for 48 h, total RNA and whole protein extracts were isolated. A: The relative level of LDLR mRNA was analyzed by real-time PCR and mRNA levels were normalized to those of GAPDH; B: Whole cell extracts were subjected to SDS-PAGE and immunoblotting with anti-LDLR and anti-GAPDH antibodies. The signals were quantified and normalized by GAPDH signal; C: Whole cell extracts were subjected to SDS-PAGE and immunoblotting with anti-SREBP-2 and anti-GAPDH antibodies. All data are expressed as mean ± SEM, n = 3. *P < 0.05, **P < 0.01 vs control (Ctrl) group. LDLR: Low-density lipoprotein receptor; SREBP-2: Sterol-regulatory element binding protein-2 |
C57BL/6J小鼠金合欢素给药处理5周后, 同对照组相比, 血清中TC和LDL-C水平显著降低, 分别下降了34%和57% (P < 0.01, 图 2A), 与阿托伐他汀对照组的血脂水平相当(图 2A)。金合欢素组血清中HDL-C和TG水平变化均无统计学显著性(图 2A)。此外, 血清中AST和ALT水平无明显变化, 提示金合欢素对肝脏无明显毒性。小鼠肝组织蛋白Western blot结果显示, 金合欢素组的肝组织中LDLR蛋白水平显著上调(P < 0.01, 图 2B), 与阿托伐他汀组观察到的情况类似。同时, 金合欢素组肝组织中的SREBP-2蛋白水平较对照组也显著升高, 与细胞水平的实验结果一致(图 2C)。

|
Figure 2 Effects of acacetin on blood lipid levels and gene expression in C57BL/6J mice. Serum lipid concentrations and the expression of hepatic LDLR were analyzed after 5 weeks supplementation with acacetin (50 mg·kg-1·d-1) in C57BL/6J. The levels of serum lipids (A) were measured by an automatic biochemical analyzer; Western blot analysis was used to assess the expression of LDLR (B) and SREBP-2 (C) in the liver. All data are expressed as mean ± SEM, n = 4-5. *P < 0.05, **P < 0.01, ***P < 0.001 vs Ctrl |
ApoE KO小鼠由于脂代谢存在异常, 造成多余脂质在血管中累积, 可自发形成动脉粥样硬化斑块, 而高脂饮食能加速这一进程, 其斑块分布及病理特征与人体动脉粥样硬化斑块较为相似, 是研究动脉粥样硬化常用的动物模型[14]。高脂饮食喂养12周后, 血清中TC和LDL-C水平较普通饮食组显著升高, HDL-C水平明显降低(图 3A), 主动脉及主动脉根部斑块沉积显著增多(图 3D和E)。说明高脂饮食诱导小鼠的血脂水平升高, 加剧了动脉粥样硬化的发展。同高脂饮食组相比, 金合欢素给药组和他汀组对血清中TC、LDL-C、HDL-C和TG水平均无显著影响(图 3A), 金合欢素组小鼠肝组织LDLR mRNA水平变化不大, 蛋白水平比高脂饮食组略有增加, 但是差异无统计学意义(图 3B和C), 阿托伐他汀组LDLR mRNA变化情况和金合欢素组相似, 但LDLR和SREBP-2蛋白水平均显著性升高(图 3C, P < 0.05, P < 0.01)。金合欢素组主动脉斑块面积存在减少趋势, 平均下降达30% (P=0.078, 图 3D), 主动脉根部斑块面积无明显变化(图 3E), 阿托伐他汀组的主动脉斑块及主动脉根部斑块面积均明显减少(图 3D和E, P < 0.005, P < 0.01)。

|
Figure 3 Effect of acacetin on atherosclerosis in ApoE KO mice. Serum lipids, LDLR expression and the aorta lesion were analyzed after 12 weeks supplementation with acacetin (30 mg·kg-1·d-1) in ApoE KO mice. A: The levels of serum lipids were measured by an automatic biochemical analyzer; B: The relative levels of LDLR mRNA were analyzed by real-time PCR and normalized to GAPDH (n = 3); C: Representative Western blot analysis with corresponding quantifications of hepatic LDLR and SREBP-2. The protein expression levels were normalized to GAPDH; D: Representative photographs and quantifications of en face atherosclerotic lesions in the entire aorta stained with oil red O; E: Representative images of aortic root lesions stained by oil red O and quantitative analysis. a. Chow; b. HFD; c. HFD+Acacetin; d. HFD+Atorvastatin. All data are expressed as mean ± SEM, n = 4-5. *P < 0.05, **P < 0.01, ***P < 0.001. HFD: High-fat diet; ApoE: Apolipoprotein E |
肠道菌群分析结果显示, 与普通饮食组相比, 高脂饮食组小鼠中反映肠道菌群多样性的Shannon指数、反映菌群均匀度的Heip指数显著下降。而反映菌群实际观测丰富度Sobs指数变化不大。与高脂饮食组相比, 金合欢素组对肠道菌群多样性无显著影响(图 4A)。OTU水平的主成分分析结果显示, 普通饮食组和高脂饮食组明显分离(图 4B), 而金合欢素处理后, 能使肠道菌群结构远离高脂饮食组、更接近他汀处理组和普通饮食组。小鼠肠道菌群在门水平的分析结果表明, 各组小鼠肠道菌群构成均以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)为主。高脂饮食后厚壁菌门的相对丰度明显增加, 拟杆菌门的相对丰度随之下降。金合欢素给药后, 厚壁菌门的相对丰度下降, 而变形菌门(Proteobacteria)和放线菌门(Actinobacteria)相对丰度有所增加(图 4C)。运用LEfSe分析比较各组间差异菌属, 属水平的结果显示共存在29个差异表达菌属, 高脂饮食组中艾克曼菌属(Akkermansia)、葡萄球菌属(Staphylococcus)、Romboutsia属等菌群较多; 金合欢素组嗜胆菌属(Bilophila)、乳酸杆菌属(Lactobacillus)、理研菌属(Rikenella)较多; 而他汀处理后, 肠道菌群中若干属于拟杆菌目中S24-7科(Bacteroidales_S24-7_ group)、毛螺旋菌科(Lachnospiraceae)及瘤胃球菌科(Ruminococcaceae)下的菌属丰度增加, 同时瘤胃梭菌属(Ruminiclostridium)等菌群也较多(图 4D), 说明各处理组菌群优势物种丰度上差别明显, 组成结构存在显著差异。
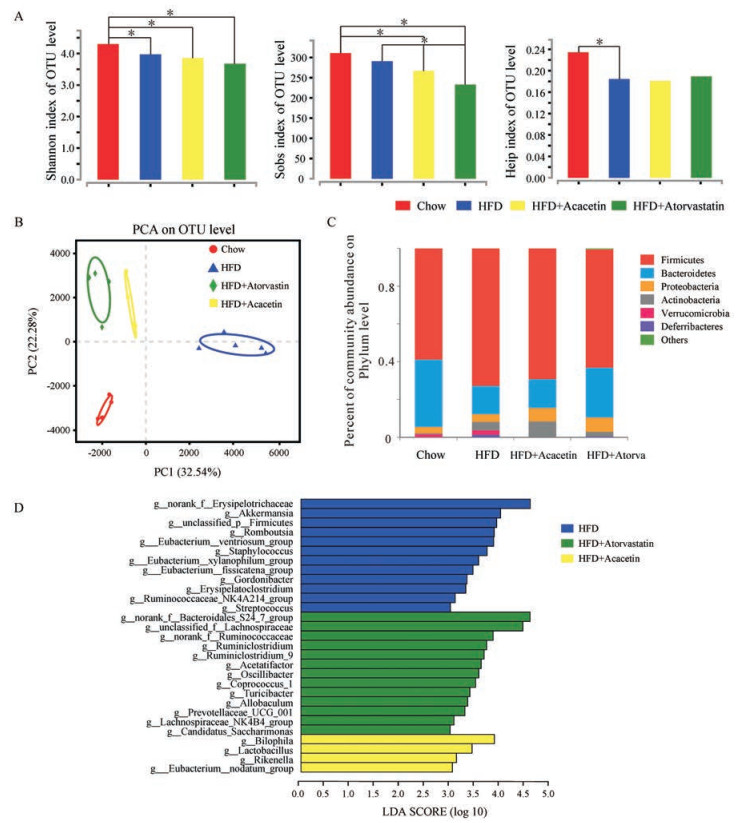
|
Figure 4 Effect of acacetin on intestinal flora of ApoE KO mice. A: Comparisons of microbial diversity, estimated by Shannon Index, Sobs Index, and Heip Index; B: Principal component analysis (PCA) of fecal microbiota based on operational taxonomic units (OTU) level; C: Composition analysis of gut microbiota at phylum level in the four groups; D: Linear discriminant analysis (LDA) score showing the most differentially significant abundant genera enriched in microbiota from three groups. n = 4-5; *P < 0.05 |
降低LDL-C是目前临床治疗动脉粥样硬化性心血管病的主要干预靶点, 他汀类药物就是反馈上调细胞表面LDLR, 使血浆胆固醇水平降低。在前期研究中, 本课题组发现田蓟苷作用动脉粥样硬化模型大鼠12周后, 血清中TC、TG及LDL-C水平较模型组均显著降低[15]。金合欢素是田蓟苷的天然苷元, 也是田蓟苷的体内代谢产物之一。本研究发现金合欢素显著降低C57BL/6J小鼠血清中LDL-C和TC水平, 同时在体内和细胞水平确认其增加LDLR mRNA及蛋白的表达水平。LDLR的启动子区内存在SREBPs结合位点, 哺乳动物细胞中有3种SREBPs亚型, 分别为SREBP-1a、SREBP-1c和SREBP-2, 其中SREBP-2是LDLR的主要激活因子[4]。本研究发现, 金合欢素能够明显上调肝细胞和肝组织中转录因子SREBP-2的蛋白水平, 因此金合欢素降低血脂的机制可能是通过增加转录因子SREBP-2的表达, 进而上调LDLR的表达。
载脂蛋白ApoE主要在肝脏和大脑合成, 是除LDL以外的所有脂蛋白的组成蛋白。ApoE也是多个脂蛋白受体(如LDLR)的配体, 在脂蛋白的代谢中发挥着重要作用[16]。当ApoE敲除后小鼠的脂蛋白清除能力降低, 血液中胆固醇水平升高, 从而容易引起动脉粥样硬化斑块的形成[17], ApoE KO小鼠由于缺乏LDLR的配体, 因而当药物(例如他汀)作用靶点为LDLR时, 往往无法很好地显示降低血脂的作用[18]。本研究发现金合欢素在ApoE KO小鼠体内未能如C57BL/6小鼠中达到预期的降血脂效果, 很可能与ApoE蛋白缺失导致LDLR功能未能充分发挥有关。
Dong等[19]研究发现, 他汀类药物上调LDLR表达的另一条途径是抑制LDLR诱导降解蛋白(inducible degrader of the LDLR, Idol)的表达。金合欢素与阿托伐他汀对ApoE KO小鼠肝脏LDLR蛋白的不同影响可能还与该小鼠体内二者不同的作用机制有关。本研究中金合欢素表现出了一定的抑制斑块作用, 这可能与它所具有的抗炎、抗氧化作用存在关联。国外有学者[18]利用ApoE*3-Leiden小鼠评价他汀类药物的降血脂和抗动脉粥样硬化效果, 获得与临床观察相一致的结果。在后续的研究中, 课题组拟对实验条件及给药剂量进行优化, 利用高脂饮食处理的C57小鼠或选择更为适合的动脉粥样硬化动物模型, 深入解析金合欢素的抗动脉粥样硬化作用。
肠道菌群是影响机体健康的重要环境因素, 特定类型的饮食模式可能影响肠道菌群结构, 菌群结构失衡可进一步影响脂质代谢、炎症反应, 促进动脉粥样硬化等代谢性疾病的发展[20]。本研究中金合欢素组灌胃给药和高脂饮食组相比, 对于菌群多样性的影响并不显著, 主要变化体现在菌群的丰度差异方面, 如对厚壁菌门和拟杆菌门二者相对比例的影响, 提示其可以改善由于高脂饮食导致的肠道菌群组成结构变化, 金合欢素对肠道微生物的调节有可能对脂质代谢以及抑制炎症产生有利的影响, 但是尚待进一步证实。
综上, 本研究结果表明, 金合欢素可能通过上调转录因子SREBP-2的表达而增强LDLR的表达, 从而降低血清中LDL-C水平, 调节小鼠的血脂代谢; 同时, 金合欢素对动脉粥样硬化模型小鼠的肠道菌群组成也会产生影响, 可能对其减缓动脉粥样硬化进程具有潜在作用。相信随着研究的深入, 对于金合欢素在动脉粥样硬化疾病防治方面的作用会有更加明确的认识。
| [1] | Smith SC Jr, Jackson R, Pearson TA, et al. Principles for national and regional guidelines on cardiovascular disease prevention:a scientific statement from the World Heart and Stroke Forum[J]. Circulation, 2004, 109: 3112–3121. DOI:10.1161/01.CIR.0000133427.35111.67 |
| [2] | Abdullah SM, Defina LF, Leonard D, et al. Long-term associa tion of low-density lipoprotein cholesterol with cardiovascular disease[J]. Circulation, 2018, 138: 2315–2325. DOI:10.1161/CIRCULATIONAHA.118.034273 |
| [3] | Brown MS, Goldstein JL. Familial hypercholesterolemia:defec tive binding of lipoproteins to cultured fibroblasts associated with impaired regulation of 3-hydroxy-3-methylglutaryl coenzyme A reductase activity[J]. Proc Natl Acad Sci U S A, 1974, 71: 788–792. DOI:10.1073/pnas.71.3.788 |
| [4] | Horton JD, Goldstein JL, Brown MS. SREBPs:activators of the complete program of cholesterol and fatty acid synthesis in the liver[J]. J Clin Invest, 2002, 109: 1125–1131. DOI:10.1172/JCI0215593 |
| [5] | Ma N, Li YJ, Fan JP. Research progress on pharmacological action of acacetin[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2018, 10: 1591–1595. |
| [6] | Kim SM, Park YJ, Shin MS, et al. Acacetin inhibits neuronal cell death induced by 6-hydroxydopamine in cellular Parkinson's disease model[J]. Bioorg Med Chem Lett, 2017, 27: 5207–5212. DOI:10.1016/j.bmcl.2017.10.048 |
| [7] | Chang W, Wu QQ, Xiao Y, et al. Acacetin protects against cardiac remodeling after myocardial infarction by mediating MAPK and PI3K/Akt signal pathway[J]. J Pharmacol Sci, 2017, 135: 156–163. DOI:10.1016/j.jphs.2017.11.009 |
| [8] | Akanda MR, Uddin MN, Kim IS, et al. The biological and pharmacological roles of polyphenol flavonoid tilianin[J]. Eur J Pharmacol, 2019, 842: 291–297. DOI:10.1016/j.ejphar.2018.10.044 |
| [9] | Hong JJ, Choi JH, Oh SR, et al. Inhibition of cytokine-induced vascular cell adhesion molecule-1 expression; possible mechanism for anti-atherogenic effect of Agastache rugosa[J]. FEBS Lett, 2001, 495: 142–147. DOI:10.1016/S0014-5793(01)02379-1 |
| [10] | Nam KW, Kim J, Hong JJ, et al. Inhibition of cytokine-induced ⅠκB kinase activation as a mechanism contributing to the antiatherogenic activity of tilianin in hyperlipidemic mice[J]. Ath erosclerosis, 2005, 180: 27–35. |
| [11] | Dai PM, Zhu LJ, Luo FF, et al. Triple recycling processes impact systemic and local bioavailability of orally administered flavonoids[J]. AAPS J, 2015, 17: 723–736. DOI:10.1208/s12248-015-9732-x |
| [12] | Jonsson AL, Bäckhed F. Role of gut microbiota in atherosclero sis[J]. Nat Rev Cardiol, 2017, 14: 79–87. DOI:10.1038/nrcardio.2016.183 |
| [13] | Wang Y, Jiang JD. A new research mode of drug PK-PD mediated by the gut microbiota:insights into the pharmacokinetics of berberine[J]. Acta Pharm Sin (药学学报), 2018, 53: 6–13. |
| [14] | Zhang SH, Reddick RL, Piedrahita JA, et al. Spontaneous hyper cholesterolemia and arterial lesions in mice lacking apolipopro tein E[J]. Science, 1992, 72: 3853–3869. |
| [15] | Cao WJ, Peng KJ, Yuan Y, et al. Effects of tilianin on the level of serum lipidsand inflammatory factors in rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 11: 164–167. |
| [16] | Huang Y, Mahley RW. Apolipoprotein E:structure and function in lipid metabolism, neurobiology, and Alzheimer's diseases[J]. Neurobiol Dis, 2014, 72 Pt A: 3–12. |
| [17] | Emini Veseli B, Perrotta P, De Meyer GRA, et al. Animal models of atherosclerosis[J]. Eur J Pharmacol, 2017, 816: 3–13. DOI:10.1016/j.ejphar.2017.05.010 |
| [18] | Zadelaar S, Kleemann R, Verschuren L, et al. Mouse models for atherosclerosis and pharmaceutical modifiers[J]. Arterioscler Thromb Vasc Biol, 2007, 27: 1706–1721. DOI:10.1161/ATVBAHA.107.142570 |
| [19] | Dong B, Wu M, Cao AQ, et al. Suppression of Idol expression is an additional mechanism underlying statin-induced up-regula tion of hepatic LDL receptor expression[J]. Int J Mol Med, 2011, 27: 103–113. |
| [20] | Lin Z, Zu XP, Xie HS, et al. Research progress in mechanism of intestinal microorganisms in human diseases[J]. Acta Pharma Sin (药学学报), 2016, 51: 843–852. |
 2019, Vol. 54
2019, Vol. 54


